Экспрессия pd l1 не выявлена что означает
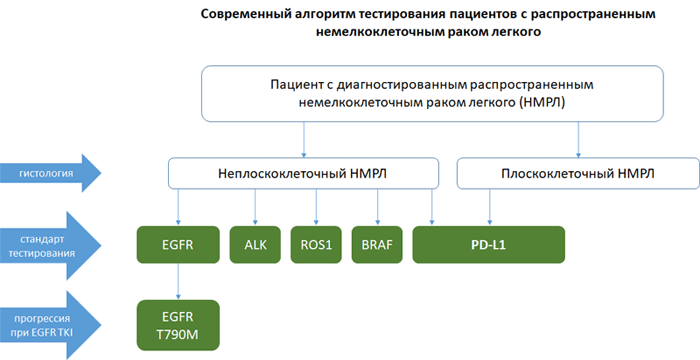
Диагностика экспрессии PD-L1
Что представляет собой лиганд программируемой клеточной гибели PD-L1?
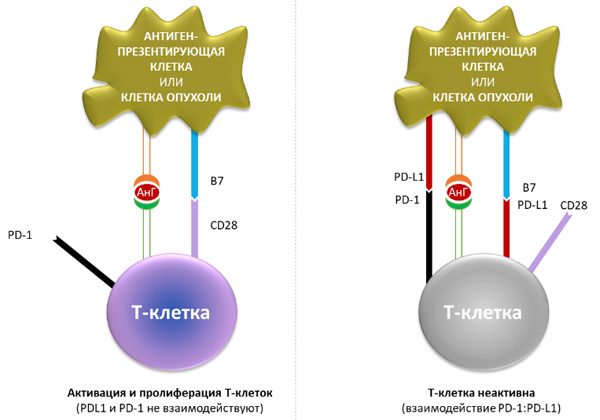
PD-L1 – лиганд рецептора программируемой клеточной гибели 1 (PD-1). Это трансмембранный белок с молекулярной массой 40 кДа, экспрессируемый на T- и B-лимфоцитах, NK-клетках, дендритных клетках, макрофагах, мезенхимальных стволовых клетках. PD-L1 способен связываться не только с рецептором PD-1, но и обладает сродством к CD80 (B 7.1) – белку, находящемуся на поверхности дендритных клеток, активированных B-клеток и моноцитов, который стимулирует активацию и выживаемость Т-лимфоцитов путем взаимодействия с CD28 на их поверхности. Лиганд PD-L1 способен угнетать этот процесс путем конкурентного связывания с CD80. На рисунке 1 представлены межклеточные взаимодействия (активирующие и ингибирующие сигналы) между Т-лимфоцитом и антигенпрезентирующей клеткой.
Рисунок 1. PD-1/PD-L1 сигнальный каскад в межклеточном взаимодействии иммунокомпетентных клеток. При связывании лиганда PD-L1 (лиганд рецептора программируемой клеточной смерти 1, также называемого PD-1) с рецепторами PD-1 и B7.1, находящимися на Т-лимфоцитах, происходит угнетение цитотоксической активности Т-лимфоцитов.
Роль PD-L1 в патогенезе злокачественных образований
Воздействие на сигнальный путь иммунной контрольной точки PD-1:PD-L1 лежит в основе иммунной терапии рака легкого, молочной железы, уротелиального рака и других злокачественных новообразований. Воздействие направлено на рецептор PD-1 и его лиганды PD-L1 и PD-L2. Наиболее важная роль в ускользании опухоли от иммунного ответа отводится взаимодействию рецептора PD-1 и лиганда PD-L1.
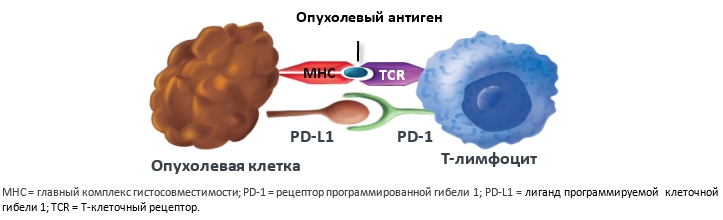
Длительная антигенная стимуляция, часто наблюдаемая при опухолевых заболеваниях, приводит к устойчивой экспрессии рецептора PD-1 на T-лимфоцитах и повышению экспрессии лигандов PD-L1 на опухолевых и иммунных клетках. Таким образом, опухоль вырабатывает механизм ускользания от иммунного ответа посредством гиперэкспрессии лиганда PD-L1, который, связываясь с рецептором PD-1 на T-лимфоцитах, нарушает их цитотоксическую активность (рис.2).
Рисунок 2. Сигнальный путь PD-1:PD-L1, инактивирующий действие Т-лимфоцитов.
Что нужно учитывать при выборе теста для оценки PD-L1 экспрессии?
Тест для определения экспрессии PD-L1 позволяет выделить группу пациентов с наибольшей вероятностью ответа на терапию ингибиторами иммунных контрольных точек. Важно учитывать, что для различных иммунных препаратов и показаний существуют отличия в методике проведения PD-L1 тестирования:
Вывод – перед проведением PD-L1 исследования необходимо удостовериться, что выбран правильный тест, на правильной культуре клеток и корректно интерпретировать полученные результаты.
Каким пациентам необходимо определение уровня PD-L1 экспрессии?
Анализ экспрессии PD-L1 в зависимости от планируемой к назначению терапии может быть рекомендован к назначению пациентам с:
НМРЛ: методы определения экспрессии PD-L1
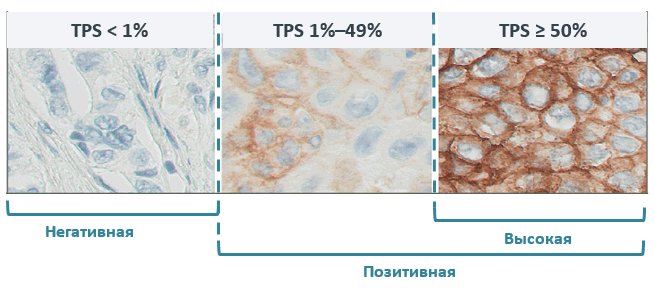
Экспрессия PD-L1 определяется методом иммуногистохимии. Оценка осуществляется путем подсчета соотношения опухолевых клеток с позитивным окрашиванием мембраны к общему количеству опухолевых клеток (TPS – tumor proportion score), результат выражается в процентах от 0 до 100.
В России зарегистрированы три диагностических набора для определения экспрессии PD-L1: производства Roche Diagnostics – PD-L1 sp142 и sp263, производства Dako – PD-L1 22C3. Тестирование проводится на платформах Ventana и Dako Autostainer Link 48 соответственно.
Экспрессия PD-L1 на опухолевых клетках
По уровню экспрессии PD-L1 выделяют следующие группы: отрицательная и позитивная экспрессия, в зависимости от количества окрашенных клеток.
Для тестирования может быть использован операционный или биопсийный материал первичной или метастатической опухоли, фиксированный в формалине и залитый в парафин. Обязательным требованием является наличие в исследуемом образце не менее 100 живых опухолевых клеток.
Определение уровня экспрессии PD-L1 и персонализированный подход к выбору терапии, основанный на результатах иммуногистохимического тестирования, позволяет сделать лечение пациентов с немелкоклеточным раком легкого более эффективным и безопасным в 1 линии терапии.
Алгоритм тестирования при распространенном НМРЛ
УРОТЕЛИАЛЬНЫЙ РАК: методы определения экспрессии PD-L1
Стандартом терапии 1 линии пациентов с раком уротелия продолжают быть химиотерапевтические режимы на основе цисплатина [4]. Однако по данным литературы до 50% больных не подходят для назначения данной терапии [5]. Ситуация с лечением изменилась с появлением иммунотерапевтических анти-PD-L1 препаратов [7]. Сейчас для назначения иммунотерапии в первой линии распространенного уротелиального рака пациентам, которые не могут перенести ципсплатин, рекомендовано проведение PD-L1 диагностики. Для остальных групп пациентов диагностика PD-L1 не требуется (при невозможности проведения любой платиносодержащей химиотерапии и у пациентов с прогрессированием заболевания в ходе или после окончания любой платиносодержащей химиотерапии или в течение 12 месяцев после неоадъювантной или адъювантной химиотерапии).
Какой метод используется для определения экспрессии PD-L1 у пациентов с уротелиальным раком?
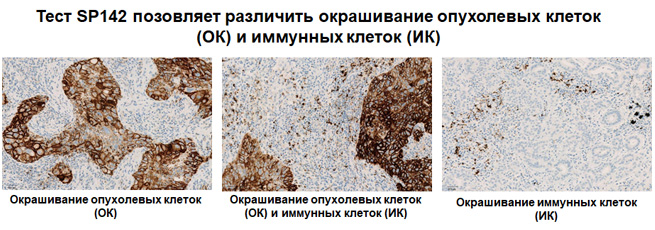
Экспрессия PD-L1 определяется методом иммуногистохимии. Для этих целей используется диагностический набор Ventana PD-L1 (SP142) Assay (Ventana Medical Systems, Inc.). Для тестирования используется ткань опухоли, фиксированная в формалине и залитая в парафиновый блок. PD-L1 статус у пациентов с уротелиальной карциномой определяется как часть площади опухоли, занятая PD-L1 экспрессирующими иммунными клетками, инфильтрирующими опухоль, любой интенсивности окрашивания.
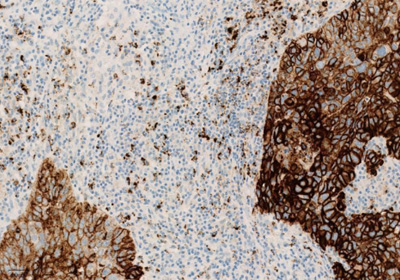
Рисунок 3. Окрашивание опухолевых и иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
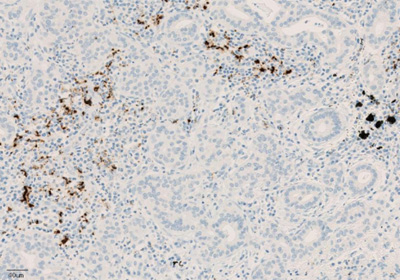
Рисунок 4. Окрашивание иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
Определение уровня экспрессии PD-L1 иммуногистохимическим методом позволяет выделить группу пациентов для назначения анти-PD-L1 терапии.
Какой уровень PD-L1 экспрессии является основанием для назначения иммуннотерапии при уротелиальном раке?
Наличие у пациентов экспрессии PD-L1 ≥5% на иммунокомпетентных клетках, инфильтрирующих ткань уротелиальной карциномы, по данным клинических исследований ассоциирована с увеличением частоты объективного ответа на иммунную терапию.
ТНРМЖ: методы определения экспрессии PD-L1
Тройной негативный рак молочной железы – самая агрессивная форма среди рака молочной железы [4]. Традиционно применяемая химиотерапия не позволяла достичь значимого увеличения продолжительности жизни свыше медианы в 18 месяцев. Появление анти-PD-L1 терапии, с одной стороны, позволило преодолеть медиану общей выживаемости в 2 года, а с другой стороны – для назначения терапии необходимо выделить группу PD-L1 позитивных пациентов. В отличие от уротелиального рака, назначение анти-PD-L1 терапии обязательно требует тестирования пациенток с тройным негативным раком молочной железы.
Какой метод используется для определения экспрессии PD-L1 у пациентов с ТНРМЖ?
При определении статуса PD-L1 для решения вопроса об иммунотерапии важно выбрать оптимальный метод. Тест VENTANA PD-L1 (SP142) позволяет идентифицировать пациентов с тройным негативным раком молочной железы (ТНРМЖ), которые могут получать анти-PD-L1 терпию.
Ткани пациентов с ТНРМЖ, окрашенные с использованием теста VENTANA PD-L1 (SP142), оценивают по окрашиванию инфильтрирующих опухоль иммунных клеток (IC). IC – это иммунные клетки, присутствующие в интратуморальной и прилегающей перитуморальной строме. В это понятие включены лимфоциты, макрофаги, дендритные клетки и полиморфноядерные лейкоциты. IC оценивают как долю области опухоли, которую занимают иммунные клетки с окрашиванием PD-L1 любой интенсивности.
Какой уровень PD-L1 экспрессии является основанием для назначения иммунной терапии при ТНРМЖ?
Наличие у пациентов экспрессии PD-L1 ≥1% на иммунокомпетентных клетках, инфильтрирующих ткань опухоли, по данным клинических исследований ассоциирована с увеличением общей выживаемости, выживаемости без прогрессирования и частоты объективного ответа на иммунную терапию.
О программе определения экспрессии PD-L1
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Исследование PD-L1
Для чего определяют PD-L1 и при каких опухолях?
Иммунотерапия является достаточно эффективным инструментом в борьбе с опухолями, особенно на поздних стадиях. Определять наличие PD-L1 в опухолевых клетках нужно заранее, чтобы узнать, будет ли работать терапия моноклональными антителами или нет.
Экспрессию PD-L1 определяют при:
В зависимости от уровня экспрессии PD-L1, результат может быть:
Что такое Т-лимфоциты и как они связаны с PD-L1?
Т-лимфоциты- это специальные клетки, которые уничтожают клетки-мишени (опухолевые, мутированые и др.), регулируют иммунный ответ. В том числе, они формируют иммунную память.
На поверхности Т-лимфоцитов есть белок PD1, который является рецептором.
На поверхности других клеток (как иммунных так и опухолевых) есть специальные молекулы (лиганды), в данном случае они называются PD-L1 и PD-L2. Эти структуры подходят друг к другу как “ключ и замок”.
Когда происходит их взаимодействие, “ключ вошел в замок”, Т-лимфоциты прекращают образовываться, снижается их активность и выживаемость. В ходе чего они перестают осуществлять свои основные функции защиты.
Поэтому этот путь PD1 — PD-L1 очень важен в противоопухолевом, трансплантационном иммунитете, аллергии и различный иммунопатологических состояниях.
Опухолевые клетки научились использовать этот механизм в свою пользу, чтобы обмануть иммунитет. Они “вооружаются” большим количеством PD-L1 и PD-L2, которые связываются с Т-лимфоцитами, тем самым активируют путь “обмана”. В ходе данной реакции иммунитет перестает видеть опухолевые клетки.
Иммунотерапия и PD-L1
В современной онкологии имеется понятие иммунотерапии рака.
В 2014 году были одобрены определенные препараты (моноклональные антитела), которые влияют на данный путь. Механизм иммунотерапии рака заключается в том, что препарат позволяет иммунитету «увидеть» опухоль и уничтожить её. Доказано, что антитела к белкам PD1 и PD-L1 борются с раком путем высвобождения Т-клеток организма. Исследователи Stanford University School of Medicine доказали, что эта терапия также борется с раковыми клетками совершенно другим способом, направляя иммунные клетки, называемые макрофагами, для поглощения и пожирания раковых клеток.
Как происходит исследование?
Нужно предоставить материал, который может быть биопсийным или операционным, в лабораторию UNIM. После чего он будет исследован методом иммуногистохимии.
Одним из обязательных условий является наличие достаточного материала (не менее 100 опухолевых клеток), чтобы адекватно оценить результат.
В ходе проведения исследования реакция будет оценена компетентным врачом-патоморфологом, после чего будет дан ответ.
Экспрессия pd l1 не выявлена что означает
PD-L1− это химическое вещество, лиганд, экспрессируемый опухолевыми клетками. На поверхности иммунокомпетентных клеток (Т-лимфоцитов) присутствует белок PD-1 (сокр. от Programmed cell Death-1). Когда Т-лимфоцит пытается прикрепиться к раковой клетке, чтобы разрушить ее, протеин PD-1 связывается с имеющимся на ее поверхности лигандом PD-L1. В результате функционирование иммунных клеток ингибируется: тормозится пролиферация, не происходит выделение цитокинов, губительных для злокачественных клеток. Таким образом, раковая опухоль отражает иммунную атаку и продолжает свой дальнейший рост. Оценка уровня экспрессии молекулы PD-L1 рассматривается как потенциальный биомаркер прогноза эффективности и продолжительности лечения злокачественных новообразований.
Лиганд PD-L1, лиганд рецептора программируемой клеточной смерти 1.
Какой биоматериал можно использовать для исследования?
Образец ткани (в парафиновом блоке).
Общая информация об исследовании
В онкологии иммуногистохимическое исследование помогает выявить молекулярные структуры опухолевых клеток, ассоциированные со степенью дифференцировки, способностью их к инвазии и метастазированию, чувствительностью к химиотерапии, иммунотерапии, с особенностями течения и прогнозом заболевания у конкретного пациента; определить источник метастазирования при невыясненном первичном очаге, прогноз опухолевого процесса на дооперационном этапе и коррекцию схемы лечения; выбрать адекватную патогенетическую и таргетную терапию, определить наличие в опухолевых клетках различные точки приложения.
Доказано, что антитела к белкам PD-1 и PD-L1 борются с раком путем высвобождения Т-клеток организма, особого типа иммунных клеток. Исследователи Stanford University School of Medicine доказали, что эта терапия также борется с раковыми клетками совершенно другим способом, направляя иммунные клетки, называемые макрофагами, для поглощения и пожирания раковых клеток.
Не так давно исследователи обнаружили, что раковые клетки научились использовать эту иммунную защиту для своих собственных целей. Опухолевые клетки разворачивают производство PD-L1-белков, которые распознаются PD-1-рецепторами, ингибируя атаку Т-клеток на опухоли. Больные раком лечатся антителами, блокирующими PD-1-рецепторы или фиксирующимися на обязательном партнере PD-L1, чтобы выключить «противоуничтожающий» сигнал и позволить Т-клеткам атаковать.
Также было обнаружено, что активация PD-1 ингибирует антираковую активность других иммунных клеток, макрофагов, и, когда PD-1 или PD-L1 рецепторы блокируются антителами, это заставляет эти макрофагиальные клетки атаковать рак.
В современной онкологии иммуногистохимическое исследование, в частности определение рецептора PD-L1 в ткани опухоли, играет важнейшую роль, так как при помощи этого онкологи определяют наличие тех или иных факторов в опухоли, которые позволяют грамотно и адекватно составить дальнейшее лечение пациента и говорить о прогнозах заболевания.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Заключение о позитивности/негативности опухоли по рецептору PD-L1.
Избыточная экспрессия PD-L1 выявляется в клетках более чем 50% опухолей человека, причем наиболее характерна для следующих новообразований:
— глиобластома и смешанная глиома (в 100% случаев),
— назофарингеальная карцинома (68-100%),
— множественная миелома (93%),
— опухоли мочевого пузыря (28-100%),
— немелкоклеточный рак легкого (35-95%),
— аденокарцинома кишечника (53%),
— гепатоцеллюлярная карцинома (45-93%),
— рак поджелудочной железы (39%),
— злокачественные опухоли желудка и пищевода (42%).
Повышенная экспрессия PD-L1 в опухоли ассоциирована с неблагоприятным прогнозом при различных типах рака, включая рак почки, рак мочевого пузыря, рак пищевода, рак желудка, рак поджелудочной железы, рак печени, рак яичников.
Кто назначает исследование?
Персонифицированная иммунотерапия рака и биомаркеры иммунного ответа

Последнее десятилетие действительно характеризуется явным прогрессом в иммунотерапии рака. Наиболее перспективными иммунными противоопухолевыми препаратами являются ингибиторы иммунных контрольных точек.
Сегодня зарегистрированы показания к назначению ингибиторов иммунных контрольных точек при немелкоклеточном раке легкого (НМРЛ), кожной меланоме и почечноклеточной карциноме.
Управление по контролю качества пищевых продуктов и лекарственных препаратов (FDA) США провело ускоренную регистрацию в отношении уротелиального и колоректального рака, карциномы из клеток Меркеля, а также разновидностей рака с микросателлитной нестабильностью (MSI) независимо от их анатомической локализации.
Продолжается регистрация показаний к иммунотерапии при гастроэзофагеальном раке, раке головы и шеи, гепатоцеллюлярной карциноме, мезотелиоме, мелкоклеточном раке легкого, раке яичника, лимфоме Ходжкина, глиобластоме и тройном негативном раке молочной железы (РМЖ).
В то же время накопленный опыт свидетельствует, что эффективность анти-CTLА‑4, анти-PD‑1, анти-PD-L1 препаратов и их комбинаций сильно различается при разных типах опухолей и у отдельных пациентов.
Если для проведения персонифицированной таргетной терапии необходимо знать один предиктивный онкомаркер, то для иммунотерапии рака подобная тактика себя не оправдывает.
Взаимоотношения между раковой клеткой и иммунной системой человека очень сложны и меняются во времени.
Это требует изучения и разработки надежных и доступных иммунологических онкомаркеров, особенно при лечении опухолей с низкой частотой иммунного ответа.
Иммунные онкомаркеры (тканевые и циркулирующие) должны быть основаны на анализе иммуногистохимических – ИГХ – характеристик (PD-L1, MSI, инфильтрация опухоли лимфоцитами – TIL), мутационной нагрузки опухоли, а также геномных, метаболомных и микробиомных нарушений.
Экспрессия PD-L1
PD‑1 рецепторы экспрессируются на поверхности активированных Т-клеток и их лигандов, PD-L1 и PD-L2 рецепторы экспрессируются на поверхности антигенпрезентирующих клеток, таких как макрофаги и дендритные клетки.
Значение уровня экспрессии белка PD-L1 на опухолевых клетках было изучено у пациентов с продвинутыми стадиями НМРЛ, меланомы, кастрационно-резистентного рака предстательной железы и при колоректальном раке. Хороший ответ на терапию был получен при PD-L1 положительных опухолях (≥5% окрашенных опухолевых клеток).
Однако последующие исследования показали противоречивые результаты.
Экспрессия PD-L1 при НМРЛ
Прогностическое и предиктивное значение экспрессии PD-L1 у пациентов с НМРЛ изучалось во многих исследованиях. В некоторых из них не было зарегистрировано увеличения общей выживаемости и выживаемости без прогрессирования в зависимости от уровня экспрессии PD-L1, в других исследованиях положительные корреляции были обнаружены.
В исследовании с использованием пембролизумаба более высокая частота ответа, более длительное время без прогрессирования и улучшение общей выживаемости наблюдались у пациентов с высокой экспрессией PD-L1 (≥50% клеток с мембранным окрашиванием) по сравнению с PD-L1-негативными пациентами. Исходя из положительных результатов этих исследований, FDA одобрило пембролизумаб для использования у ранее не леченных больных с метастатическим НМРЛ с экспрессией PD-L1 ≥50% в первой линии терапии.
Однако сегодня также известно, что значительное число пациентов НМРЛ с положительным статусом PD-L1 не реагируют на терапию ингибиторами иммунных контрольных точек. Количество таких больных предположительно составляет 40-50%.
И наоборот, приблизительно 15% PD-L1-негативных пациентов с НМРЛ отвечают на этот вид лечения.
В целом анализ проведенных исследований позволяет сделать вывод о важной роли экспрессии PD-L1 в качестве предиктивного биомаркера, преимущественно у больных НМРЛ.
Экспрессия PD-L1 при кожной меланоме
Результаты проведенных исследований подтверждают положительную роль экспрессии PD-L1 в качестве предиктивного биомаркера при иммунотерапии кожной меланомы. В то же время некоторые пациенты с PD-L1-отрицательной меланомой также демонстрируют стойкий клинический эффект от этого вида лечения.
Сегодня экспрессия PD-L1 сама по себе не используется для отбора пациентов с кожной меланомой в качестве кандидатов на иммунотерапию ингибиторами контрольных точек.
При раке других локализаций роль этого маркера является облигатной, и ее еще предстоит изучить.
Сложности при определении PD-L1
Сегодня для выявления экспрессии PD-L1 используются ИГХ-наборы антител различных производителей. По данным Blueprint PD-L1 IHC Assay Comparison Project, во время ИГХ-исследований отмечается плохая конкордантность при оценке экспрессии белка PD-L1 с различными коммерческими антителами. Использование анти-PD-L1 антител различных производителей затрудняет проведение сравнительного анализа клинических исследований и в будущем может оказаться преградой для обобщающих метаанализов.
С помощью метода количественной иммунофлюоресценции была установлена выраженная интратуморальная гетерогенность экспрессии PD-L1 в различных участках ткани опухоли у одного и того же пациента.
Это говорит о том, что образец опухолевой ткани, полученный с помощью игольной биопсии, может не отражать полного иммунного фенотипа опухоли.
Уровни экспрессии PD-L1 могут меняться со временем. Поэтому одним из недостатков проведенных исследований была оценка степени экспрессии PD-L1 не в свежем, а в архивном биопсийном материале. Очевидно, что архивный материал не может отражать иммунный статус опухоли на момент проведения терапии, поскольку эпитопы PD-L1 при длительной или неадекватной фиксации опухолевого материала являются потенциально нестабильными. Кроме того, иммунный статус опухоли будет меняться в результате различных терапевтических воздействий (химиотерапия, таргетная терапия, радиационное лечение).
Было показано также, что между первичной опухолью и отдаленным метастазом в характере экспрессии PD-L1 имелась очень слабая корреляция. Это говорит о том, что необходимо проводить исследование тканевых иммунных маркеров не только в первичной опухоли, но и в различных анатомических участках метастатической опухоли, что в принципе невозможно.
Наконец, следует учитывать, что могут возникнуть проблемы с подсчетом и интерпретацией ИГХ-исследований.
В некоторых случаях точно различить отдельные типы клеток затруднительно, так как и раковая клетка, и ассоциированный с опухолью макрофаг могут демонстрировать цитологический плейоморфизм.
Экспрессия PD-L1 может наблюдаться в разных клетках опухолевого микроокружения – опухоль-ассоциированных фибробластах, активированных лимфоцитах, ассоциированных с опухолью макрофагах, дендритных клетках.
Инфильтрация опухоли лимфоцитами
Ткань солидной опухоли представлена не только злокачественными клетками, но и клетками микроокружения. Лимфоциты, инфильтрирующие опухолевую ткань, играют важную роль в реализации иммунного ответа.
Для большинства пациентов, не отвечающих на иммунную терапию, во время прогрессирования заболевания характерна незначительная TIL («иммунологическое игнорирование»).
У других пациентов иммунные инфильтраты обнаруживаются не внутри, а вокруг внешнего края опухолевых клеток (внешний, так называемый исключенный, инфильтрат).
При плохом иммунном ответе могут выявляться обширные интратуморозные иммунные инфильтраты, но с минимальной экспрессией в этих лимфоцитах рецепторов PD-L1 (нефункциональный иммунный инфильтрат).
При истощенном PD‑1/CTLA‑4 фенотипе иммунного инфильтрата Т-клетки сохраняют способность продуцировать IFN-γ, но утрачивают способность продуцировать другие цитокины – TNF-α и IL‑2, что не позволяет им реализовать свой противоопухолевый потенциал. PD-L1-положительные опухоль-инфильтрирующие лимфоциты включают также миелоидные клетки (макрофаги и дендритные клетки). Иммунные В-клетки обычно являются PD-L1 отрицательными.
Ряд исследований показали, что увеличение числа опухоль-инфильтрирующих лимфоцитов, экспрессирующих CD8, PD‑1 или PD-L1 в инвазивной части опухоли, связано с лучшими результатами и более длительной выживаемостью у пациентов со злокачественными новообразованиями различных локализаций.
У пациентов с хорошим ответом на иммунотерапию опухолевая ткань после лечения обычно представлена плотным иммунным инфильтратом и обширным некрозом опухолевых клеток.
У пациентов с метастатической меланомой увеличение в опухоли доли CD8+ Т-клеток с высокой экспрессией как PD‑1, так и CTLA‑4 (PD‑1hi/CTLA‑4hi) сильно коррелировало с ответом на пембролизумаб или ниволумаб.
Пациенты с плотностью цитотоксических Т-лимфоцитов PD‑1hi/CTLA‑4hi >20% имели более высокую частоту ответа и более длительную продолжительность времени без прогрессирования.
Шкала Immunoscore как предиктивный маркер иммунного ответа
Иммунные клетки обнаруживаются как в глубине солидной опухоли, так и на периферии, в ее инвазивной части. Подсчет количества лимфоцитов, инфильтрирующих обе части опухоли, позволяет повысить точность отдаленного прогноза и предсказать ответ на иммунотерапию. Впервые такие исследования проведены у пациентов с колоректальной карциномой на ранней стадии.
Метод определения соотношения количества инфильтрирующих лимфоцитов в разных частях солидной опухоли был назван шкалой Immunoscore и предложен как инструмент для иммунной классификации опухолей, а также для прогнозирования ответа на терапию.
Immunoscore отражает плотность двух популяций лимфоцитов – CD8+ и CD45RO+ – в глубине и в инвазивных областях опухолей в поле зрения (мм 2 ).
Тип «0»: 0-14 лимфоцитов CD8+/HPF в поле зрения.
Тип «1»: 15-39 CD8+/HPF лимфоцитов, тип «2» – 40-69 CD8+/HPF лимфоцитов, тип «3» >70 CD8+/HPF лимфоцитов в поле зрения.
Многофакторный анализ, проведенный на основании изучения пациентов с колоректальным раком, показал преимущество шкалы Immunoscore перед общепринятыми системами классификации AJCC-UICC и TNM в отношении прогнозирования рецидива и выживаемости на ранних стадиях колоректального рака.
Исследования подтвердили, что высокая степень иммунной инфильтрации в разных участках опухоли напрямую коррелирует с лучшим исходом заболевания.
В настоящее время исследуется применение шкалы Immunoscore при кожной меланоме. Сделано предположение, что подсчет TIL может оказать влияние на принятие решения о проведении адъювантной терапии меланомы III стадии после удаления первичной опухоли и терапевтической лимфодиссекции.
Было показано, что высокая плотность PD-L1-положительных иммунных клеток в строме опухоли и PD‑1-положительных опухоль-ассоциированных лимфоцитов у больных НМРЛ I-IIIA стадий также связана с лучшей выживаемостью. Наоборот, низкая плотность PD-L1-положительных иммунных клеток в строме и низкая плотность PD‑1-позитивных опухоль-ассоциированых лимфоцитов связаны с плохой специфической выживаемостью на ранних стадиях заболевания.
Полезность шкалы Immunoscore для прогнозирования ответа на терапию при продвинутых стадиях НМРЛ остается предметом дальнейшего изучения.
Имеются противоречивые данные о ценности теста TIL у больных РМЖ.
Так, при тройном негативном фенотипе высокая TIL связана с повышением частоты pCR и улучшением выживаемости, поэтому является позитивным предиктивным и прогностическим маркером.
При люминальном фенотипе РМЖ повышенная TIL, наоборот, связана с более агрессивным течением и худшей выживаемостью.
Для широкого клинического использования данной шкалы необходимо преодолеть технические барьеры. Для эффективного применения теста требуются надежные программные решения автоматического обнаружения опухоль-инфильтрирующих лимфоцитов, эффективная и точная интерпретация большого количества данных о плотности иммунных клеток в тканях опухоли.
Учитывая связь между наличием CD8+ Т-клеток в инвазивном крае опухоли с уровнем экспрессии PD‑1 и PD-L1 в раковых клетках и лимфоцитах, значение шкалы Immunoscore как возможного маркера ответа на терапию в ближайшее время будет представлять большой интерес.
Мутационная нагрузка, неоантигены и микросателлитная нестабильность
Одним из новых биомаркеров для прогнозирования реакции на иммунотерапию рака является мутационная нагрузка опухоли, которая определяется количеством несинхронных мутаций в кодирующей области генома.
Опухолевые клетки с более высоким уровнем мутационной нагрузки могут лучше распознаваться иммунной системой и, следовательно, способствовать развитию более сильного иммунного ответа.
Многочисленные мутации в опухолевых клетках нередко приводят к генерации новых антигенов, называемых неоантигенами. Распознанные иммунной системой неоантигены повышают реактивность Т-лимфоцитов против клеток опухоли.
Возможно, этим объясняется высокая эффективность иммунотерапии при НМРЛ и кожной меланоме – опухолях, имеющих большее количество соматических мутаций, чем другие солидные опухоли.
Повышение мутационной нагрузки зависит не только от количества соматических мутаций в клетке, но и от степени нарушений в системе репарации поврежденной ДНК (система MMR).
Большое число мутаций в генах, отвечающих за репарацию ДНК, приводит к развитию феномена MSI. Микросателлитная нестабильность обратно коррелирует со способностью восстанавливать ошибки ДНК и, как было продемонстрировано, имеет сильную предиктивную связь с ответом на иммунотерапию рака.
Роль дефицита MMR в качестве маркера клинической пользы от иммунотерапии была изучена у больных с различными прогрессирующими солидными опухолями. Наличие молекулярных аномалий, ведущих к MSI, сегодня признано положительным предиктивным маркером при рассмотрении вопросов назначения иммунотерапии. В 2017 г. этот тест рекомендован FDA для клинического использования, независимо от анатомической локализации опухоли.
Рекомендации, основанные на выявлении мутационной нагрузки, MMR и MSI в качестве предиктивных маркеров иммунотерапии, являются многообещающими, однако все еще нуждаются в критической оценке.
Так, в исследования серии Keynote, послужившие основанием для рекомендаций FDA, были включены малые когорты онкологических пациентов, ранее получавших разные виды терапии. Кроме того, для анализа были использованы образцы тканей опухолей, полученные на разных этапах болезни.
Важно отметить, что в этих исследованиях были также группы пациентов с высокой мутационной нагрузкой, не реагирующие на иммунотерапию, и наоборот, пациенты с низкой мутационной нагрузкой, но хорошим ответом на анти-PD-L1 терапию.
Новые перспективы в выявлении предиктивных иммунных маркеров открываются при использовании полного комплексного геномного профилирования опухоли за счет технологий секвенирования нового поколения (NSG).
Секвенирование нового поколения
Применение технологии NSG позволило выяснить, почему некоторые опухоли с низкой мутационной нагрузкой хорошо реагировали на иммунотерапию. Такой, на первый взгляд, «парадоксальный» ответ наблюдали у пациентов с НМРЛ и наличием мутаций в генах BRAF или MET. Был сделан вывод, что эти редкие мутации, встречающиеся при НМРЛ с частотой не более 1,5-2,0%, позволяют выявлять тех больных, которые получат пользу не только от таргетной терапии, но и от анти-PD-L1 ингибиторов.
Также было обнаружено, что пациенты с высокой общей мутационной нагрузкой и мутациями в гене STK11 имеют низкие шансы ответа на иммунотерапию.
Мутации в генах STK11, BRAF и MET, по-видимому, определяют прогноз на иммунотерапию не только при НМРЛ, но и при других солидных опухолях.
Мутации в генах PTEN, PI3K, AKT, EGFR и MYC оказывают влияние на активность противоопухолевого иммунитета и резистентность к анти-PD-L1.
Активно изучаются другие молекулы, участвующие в инактивации Т-клеток: индоламиндиоксигеназа (IDO), молекула адгезии клеток РЭА1, TIM‑3, LAG‑3, VISTA, TIGIT, трансформирующий фактор роста-β, а также другие гены, участвующие в механизме мезенхимальной трансформации.
Все эти молекулярные события способствуют иммунной резистентности к анти-PD-L1 терапии.
Таким образом, результаты клинических исследований 2017 г. действительно показали важность неоантигенной нагрузки опухоли при прогнозировании реакции на иммунотерапию, однако эта зависимость оказалась нелинейной.
Для понимания сложности и системности иммунного ответа, прогнозирования чувствительности или резистентности клеток рака к терапии ингибиторами иммунных контрольных точек необходимо решить проблему использования в ежедневных клинических
условиях современных методов геномного анализа оценки целых экзомов – технологии секвенирования нового поколения.
Эндогенный интерферон-гамма
Интерферон-гамма (IFN-γ) представляет собой цитокин, который играет ключевую роль в иммунной регуляции и противоопухолевом иммунитете. IFN-γ продуцируется естественными клетками-киллерами при врожденном иммунном ответе или активированными Т-клетками во время формирования антигенспецифического (противоопухолевого) иммунитета.
IFN-γ увеличивает экспрессию молекул главного комплекса гистосовместимости и тем самым участвует в презентации антигенов.
Экспрессия рецептора PD-L1 на раковых клетках солидной опухоли также индуцируется IFN.
Частота ответа на терапию пациентов с солидными опухолями при высокой экспрессии рецепторов IFN-γ составляет 33%, а пациентов, отрицательных по экспрессии IFN-γ, только 8%.
Наибольшая частота противоопухолевого ответа (46%) зарегистрирована у пациентов, позитивных как по экспрессии рецепторов IFN-γ, так и по экспрессии PD-L1.
Такая закономерность четко прослеживалась у больных с кожной меланомой, но была слабой у больных НМРЛ и раком почки.
Есть доказательства, что IFN принимает участие в формировании эффекта приобретенной иммунной резистентности.
Было показано, что мутации в генах JAK1 и JAK2, которые кодируют ассоциированные с IFN тирозинкиназы, связаны с приобретенной резистентностью к терапии пембролизумабом. При прогрессировании таких опухолей обнаруживались усеченные мутации в генах JAK1 и JAK2.
Учитывая важную роль IFN-γ в развитии адаптивного иммунного ответа, необходимы дальнейшие исследования, чтобы определить, является ли сигнальный статус IFN надежным предиктивным биомаркером для ответа на иммунотерапию при различных типах рака.
Сывороточные маркеры иммунного ответа
Роль сывороточных иммунных маркеров во время иммунотерапии рака была изучена у пациентов с НМРЛ и кожной меланомой, получавших ипилимумаб и пембролизумаб. Оказалось, что сывороточная лактатдегидрогеназа (LDH) и количество иммунных клеток в крови могут быть полезными предикторами ответа на иммунотерапию.
О благоприятном прогнозе свидетельствовали стабильно высокие абсолютные количества лимфоцитов, низкие абсолютные количества моноцитов, а также увеличение количества лимфоцитов во время проводимой терапии.
С улучшением клинического ответа и повышением общей выживаемости во время иммунотерапии были также связаны исходные высокие количества эозинофилов в крови и раннее (от 18 суток до 7 недель) увеличение их количества после первой и двух последующих инфузий лекарственного препарата.
В исследованиях с участием пациентов с кожной меланомой выявлена положительная прогностическая ценность таких маркеров, как высокие относительные количества эозинофилов, высокие относительные количества лимфоцитов, низкие уровни LDH и отсутствие висцеральных метастазов.
Присутствие всех четырех факторов было связано с хорошим прогнозом, выживаемостью без прогрессирования (58,3%) и общей выживаемостью в течение 1 года (83,9%).
Сывороточные маркеры легко оценить в ежедневных тестах, которые рутинно используются в клинической практике. Они удобны для осуществления контроля в течение всего курса терапии.
PD-L1 позитивные циркулирующие опухолевые клетки
Циркулирующие в крови опухолевые клетки (ЦОК) представляют собой пул наиболее агрессивных злокачественных клеток, обладающих высоким метастатическим потенциалом и наиболее полно отражающих фенотип злокачественной опухоли.Mazel и соавт. впервые упомянули о возможности оценки PD-L1 в циркулирующих опухолевых клетках у больных РМЖ. Полученные данные свидетельствовали о возможности использования PD-L1 положительных ЦОК для оценки прогноза при метастатическом раке во время анти-PD-L1 терапии.
В докладе 2016 г. C. Nicolazzo и соавт. сообщили о возможности мониторинга PD-L1 позитивных ЦОК для идентификации тех групп пациентов с НМРЛ, которые лучшим образом ответят на иммунотерапию ингибиторами иммунных контрольных точек.Имеются также интересные данные о том, что наличие экспрессии PD-L1 в циркулирующих опухолевых клетках является чувствительным предиктивным маркером эффективности цитотоксической химиотерапии, отражая механизм уклонения клеток от лечения.
Наличие PD-L1 позитивных ЦОК к шестому месяцу терапии у больных метастатическим НМРЛ является свидетельством неэффективности лечения и плохого прогноза. PD-L1 отрицательные ЦОК не отражают такой зависимости.
Роль микробиоты в формировании иммунного ответа
Микробиоту называют забытым органом человеческого тела.
Наш организм состоит на 10% из человеческих и на 90% из бактериальных клеток. Более 70% этих бактерий не могут быть выделены в виде чистой культуры и не обнаруживаются обычными микробиологическими методами. Нам до сих пор известно не более 5% населяющих нас бактерий.
Функции микробиоты чрезвычайно разнообразны. Если микробиота толстого кишечника является большим «ферментативным органом», то микробиота тонкой кишки обладает собственным метагеномом (в 150 раз больше человеческого) и высокой метаболической активностью.
Микробиота человека активно влияет на иммунитет и принимает участие в формировании иммунного ответа.
Известно, что микробиота участвует в синтезе иммуноглобулинов и таким образом стимулирует гуморальный и клеточный иммунитет, является хранилищем микробных, плазмидных и хромосомных генов, способствует выведению эндо- и экзогенных токсинов, захватывает и выводит из организма вирусы, разрушает мутагены, синтезирует сигнальные молекулы (нейротрансмиттеры), повышает резистентность эпителиальных клеток к канцерогенам, может тормозить или стимулировать противоопухолевый иммунитет.
Известно, что такие бактерии, как Bifidobacter spp. и Bacteroides spp., повышают ответ на анти-PD-L1 противоопухолевую терапию.
Вероятно, что в скором будущем некоторые микробиомные маркеры будут рассматриваться в качестве предиктивных во время иммунотерапии рака.
Радиоиммунные маркеры опухолевого ответа
Очевидно, что биомаркеры, полученные из образцов опухолевой ткани в различные периоды опухолевого роста, не лишены недостатков.
Для прогнозирования результатов иммунотерапии клиницисты нуждаются в неинвазивных функциональных методах для визуализации и количественного определения клеток-мишеней in vivo.
Перспективным направлением, отвечающим этим требованиям, является иммуно-ПЭТ.
Так, для неинвазивного отслеживания цитотоксических Т-клеток во время иммунотерапии рака в экспериментальных мышиных моделях уже используется меченый 89 Zr-десферриоксамином анти-CD8-cys-диабод ( 89 Zr-malDFO‑169 cDb).
Радиоактивно меченый эктодомен рецептора PD-L1, высокоаффинный конкурент антагониста PD-L1, используется в качестве ПЭТ-визуализатора для обнаружения PD-L1-позитивных и PD-L1-негативных опухолей.
Дальнейшая разработка и применение радиоиммунных функциональных методов визуализации соответствующих мишеней in vivo позволит решить проблему гетерогенности опухолей и нивелировать недостатки биомаркеров, полученных из образцов опухолевой ткани.
Заключение
Иммунотерапия рака может изменить и уже меняет существующую стратегию лечения онкологических больных. Безусловный эффект от иммунотерапии был получен у многих больных при лечении иммунозависимых опухолей – НМРЛ, кожной меланомы и уротелиальной карциномы. Однако вскоре выяснилось, что эффективность ингибиторов иммунных контрольных точек сильно отличается у отдельных пациентов.
Исходя из главной парадигмы современной онкологии, новый вид лечения должен отвечать принципам персонифицированного подхода, основанного на тщательном анализе индивидуальных предиктивных онкомаркеров.
На сегодняшний день единственным маркером, позволяющим прогнозировать эффект иммунотерапии у больных НМРЛ, считается высокая (>50%) экспрессия PD-L1 в раковых клетках. Однако не все пациенты с высоким уровнем экспрессии отвечают на иммунотерапию. С другой стороны, пациенты без экспрессии PD-L1 иногда хорошо реагируют на этот вид лечения.
Эта неопределенность привела к тому, что появились статьи с ироничными названиями, например: «Исследование биомаркеров PD-L1 для немелкоклеточного рака легкого: правда или фикция?» (C. Grigg, N.A. Rizvi, Journal for ImmunoTherapy of Cancer, 16 August 2016).
Учитывая сложность биологии рака и еще более сложные взаимоотношения опухоли и иммунной системы человека, полностью предсказать иммунотерапевтический ответ при использовании ингибиторов иммунных контрольных точек пока невозможно.
Так или иначе по состоянию на 2017 г. роль прогностических и предиктивных биомаркеров во время проведения анти-PD‑1 и PD-L1 иммунотерапии все еще остается предметом активного изучения. Количество публикаций на эту тему продолжает увеличиваться.
Выявление индивидуальных ИГХ-маркеров, мутационной нагрузки опухоли, метаболомных, микробиомных и геномных нарушений, отвечающих за противоопухолевый иммунитет, будет предметом ближайших исследований.
Тематичний номер «Онкологія» № 2 (53), травень 2018 р.
СТАТТІ ЗА ТЕМОЮ Онкологія та гематологія
Із розвитком імуноцитологічних, імуногістохімічних та інших методів молекулярної діагностики значно розширилися терапевтичні можливості лікування онкологічної та онкогематологічної патології, у тому числі хронічної лімфоцитарної лейкемії (ХЛЛ). Визначення деяких факторів ризику дозволяє оптимізувати терапію та обрати ту терапевтичну опцію, яка матиме найбільшу користь для конкретного пацієнта.
Уже вдруге щорічний конгрес Європейського товариства медичної онкології (ESMO) відбувається у віртуальному просторі (формальним його господарем 21-25 вересня був Париж). Звичайно ж, через такий формат ці дуже важливі зустрічі онкологів багато втрачають, але всупереч складним умовам на конгресі ESMO-2021 оприлюднено результати низки важливих досліджень, які невдовзі змінять стандарти лікування. Традиційно про найголовніші досягнення повідомляється на президентських симпозіумах (їх було кілька). Особливо виділимо три повідомлення: про роль імунотерапії при занедбаному раку шийки матки, а також при ранній стадії меланоми і недрібноклітинного раку легені (НДРЛ).
4 вересня відбулася національна науково-практична конференція з міжнародною участю «Досягнення в клінічній онкології в 2021 році: прорив в терапії раку яєчників». На заході обговорювали сучасні підходи до діагностики раку яєчника (РЯ), застосування патоморфологічного та молекулярно-генетичного досліджень, BRCA-тестування, важливість хірургічного втручання з подальшою хіміотерапією (ХТ), а також необхідність індивідуалізованого підходу до ведення кожної хворої з застосуванням таргетної терапії при поширених формах епітеліального РЯ та його рецидивах.