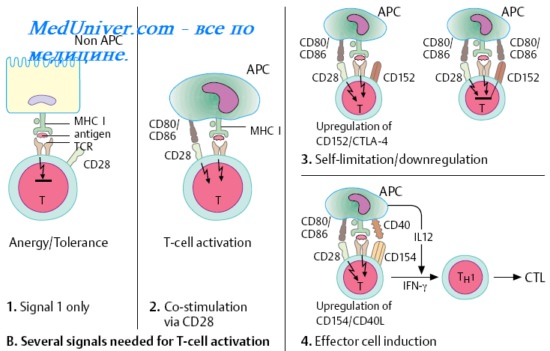
за что отвечают т супрессоры
За что отвечают т супрессоры
Т супрессоры.
Чужеродные Аг в неиммуногенной форме (гаптены) или иммуногенные Аг в очень высокой концентрации также способны индуцировать специфическую супрессорную активность клеток. После распознавания Аг зрелые лимфоциты препятствуют развитию иммунного ответа, действуя непосредственно на клетки или секретируя супрессорные факторы.
Цитотоксические Т-лимфоциты ( ЦТЛ ). Т-киллеры. Цитотоксический эффект Т-киллеров.
Цитотоксические Т-лимфоциты (ЦТЛ), или Т-киллеры [от англ. to kill, убивать] лизируют клетки-мишени, несущие чужеродные или видоизменённые аутоантигены (например, клетки опухолей, трансплантатов, инфицированные вирусами, клетки, несущие поверхностные вирусные Аг). В большинстве случаев функция ЦТЛ также МНС-рестригирована — цитотоксические Т-лимфоциты распознаёт чужеродный вирусный, опухолевый или трансплантационный Аг в комплексе с молекулой МНС I на мембране клетки-мишени. Индукция цитотоксических свойств клетки-предшественницы Т-киллера происходит под действием двух сигналов.
Первый сигнал включает взаимодействие между двумя комплексами: поверхностной молекулой CD8 лимфоцита и комплексом эпитоп-молекула МНС I на клетке-мишени. Второй сигнал — ИЛ, секретируемые близлежащими макрофагами и Т-клетками. Т-хелпер играет ключевую роль в стимуляции цитотоксических Т-лимфоцитов в качестве источника необходимых цитокинов, усиливающих их пролиферацию и созревание до функционально активных ЦТЛ.
Цитотоксический эффект Т-киллеров реализуется через образование в клетках-мишенях пор под действием особых белков — перфоринов. Нарушение осмотического баланса с внеклеточной средой приводит к гибели клетки.
Т-клетки памяти
Т-клетки памяти образуются при первичном иммунном ответе. Специфически распознают Аг и участвуют в иммунном ответе при вторичном попадании Аг. Большинство клеток памяти обладает функциями Т-клеток, экспрессируют CD4 и рестригированы по молекулам МНС II, то есть узнают Аг только на Аг-представляющих клетках в связи с молекулой МНС II.
ЗдоровьеКак Т-лимфоциты спасут нас от коронавируса и почему они лучше, чем антитела
В пандемию мы все научились немного больше заботиться о своём здоровье. И точно так же стали немного лучше разбираться в том, о чём раньше даже не подозревали: устройстве иммунной системы человека, взаимодействии её с вирусами разных типов и антителах. Последние особенно интересны в контексте приобретённого иммунитета, который позволяет переболевшим COVID-19 (кому-то больше, кому-то меньше) оставаться защищёнными от коронавируса.
Но вот в чём проблема: не у всех людей с симптомами коронавируса обнаруживаются антитела. Как такое возможно? Ответом на задачу со звёздочкой стали Т-лимфоциты. Учёные уже доказали, что сформированная ими защита может быть прочнее и совершеннее. Обо всём этом давайте немного подробнее.
ТЕКСТ: Марина Левичева
Иммунитет врождённый и адаптивный
Иммунная система представляет собой сложную сеть связанных между собой клеток, которая защищает организм от внутренних и внешних угроз. Сам иммунитет при этом бывает двух типов: врождённый (естественный) и адаптивный (приобретённый). В основном они отличаются друг от друга специфичностью и оперативностью реагирования на врага.
Врождённый иммунитет — наша первая линия защиты. Она может обнаружить многие патогены, как только они попадают в организм. Но, во-первых, она не всегда делает это достаточно быстро, чтобы мы успели не заболеть, во-вторых, она всё-таки не может распознать все потенциально опасные молекулы.
Если что-то идёт не так и врождённый иммунитет не справляется, система посылает сигналы, чтобы активировать адаптивную иммунную систему. Этот процесс называется презентацией антигена, потому что компоненты системы естественного иммунитета буквально представляют Т-лимфоцитам захваченный ими антиген (разве что без слов «Теперь это ваша проблема»).
Адаптивная иммунная система развивалась, чтобы обеспечить организму лучшую защиту. Но её полноценный запуск довольно медленный, так что может пройти несколько дней, прежде чем в игру вступят звёзды этой вечеринки — Т-клетки.
Т-клетки и что о них нужно знать
Из школьной программы многие помнят, что за иммунитет у нас ответственны лимфоциты. Существует два типа лимфоцитов: В-клетки, которые образуются и созревают в костном мозге, и Т-клетки, которые также образуются в костном мозге, но созревают в вилочковой железе (тимусе), расположенной в верхнем отделе грудной клетки. В организме они работают вместе, но Т-клетки всё равно круче.
Дело в том, что Т-клетки нацелены на выявление и устранение специфических инородных частиц. Вместо того, чтобы атаковать все антигены подряд (а это бактерии, вирусы, токсины и даже пыльца — всё, что заставляет организм вырабатывать антитела), Т-клетки циркулируют до тех пор, пока не столкнутся со «своим» антигеном. Они определяют его с помощью белков на поверхности, которые могут связываться с белками на поверхности антигенов. Существуют триллионы вариантов этих поверхностных белков, каждый из которых может распознать собственную мишень.
Роль Т-клеток немного меняется на протяжении жизни. В детстве с их помощью у нас формируется иммунитет к общим патогенам и создаётся запас Т-клеток памяти. Они буквально запоминают реакцию на те или другие антигены, поэтому, встречая их в будущем, реагируют быстрее и эффективнее (это называется вторичным иммунным ответом). Дальше
Т-клетки в основном занимаются иммунорегуляцией и работой с повторяющимися или постоянно присутствующими (при наличии хронических заболеваний) в организме антигенами. С возрастом их количество снижается, так что чем мы старше, тем слабее становится наш иммунитет.
Т-клетки тоже бывают разных типов. Т-хелперы, например, помогают активности других иммунных клеток, высвобождая информационные молекулы цитокины. Они стимулируют созревание В-клеток, которые уже начинают вырабатывать антитела для нейтрализации патогена. А
Т-киллеры (цитотоксические T-лимфоциты) самостоятельно убивают повреждённые или инфицированные клетки организма.
Хотя Т-клетки в основном наши друзья и защитники, иногда они могут стать причиной аутоиммунных заболеваний. Это происходит, когда путешествующие в поисках своего антигена клетки начинают атаковать собственные клеточные белки человека.
Что не так с антителами
Основная проблема антител в том, что они не очень долго сохраняются в организме. Есть данные, что уровень антител у людей, инфицированных SARS-CoV-2, снижается в течение 2–3 месяцев. Это справедливо, что так бывает не всегда, потому что срок жизни антител, по всей видимости, зависит от патогена.
Антитела к другим коронавирусам могут, постепенно уменьшаясь, сохраняться от 12 до 52 недель с момента заражения. Но в случае
с COVID-19 это может продолжаться до семи недель, а может и больше. Другое недавнее исследование показало, что при бессимптомном течении заболевания уровень антител значительно ниже и в 40 % случаев они полностью исчезают через восемь недель.
Получается, что с антителами пусть и всё так, но защита, которую они обеспечивают, не настолько продолжительная и мощная, как того хотелось бы.
Т-клетки и коронавирус
Так как большинство людей раньше не подвергались воздействию нового коронавируса (на то он и новый), у них нет Т-клеток памяти и, соответственно, защиты от инфекции. Хорошая новость в том, что инфицированные люди при этом могут генерировать COVID-специфические Т-клетки. Причём, как показало исследование шведских учёных, это происходит также у пациентов со слабыми симптомами или вообще без них. И даже в том случае, если в организме нет антител.
А ещё обнаружилось, что некоторые неинфицированные люди имеют
Т-клетки к COVID-19. Это, вероятнее всего, является перекрёстной реактивностью — совпадением с реакцией организма на предыдущие коронавирусные инфекции. Когда учёные посмотрели на образцы крови, взятые за несколько лет до начала пандемии, и обнаружили в них Т-клетки, приспособленные к обнаружению белков на поверхности COVID-19, теория подтвердилась.
Почему это всех так радует? Потому что Т-клеточные реакции могут быть довольно длительными. Когда учёные из Сингапура проанализировали показатели людей, перенёсших атипичную пневмонию в 2003 году, они увидели, что даже спустя семнадцать лет у них остались специфические
Т-клетки. Не говоря уже о том, что наличие Т-клеток более точно показывает, переболел человек коронавирусом или нет.
Что выяснили российские учёные
Совсем недавно в авторитетном научном журнале Immunity опубликовали исследование российских учёных на тему Т-клеток и коронавируса, в котором приняли участие 34 переболевших коронавирусом добровольца и две контрольные группы здоровых доноров.
«Действительно, не у всех переболевших коронавирусом обнаруживаются антитела. У части выздоровевших иммунный ответ обеспечивается только за счёт Т-клеток, чего, по всей видимости, оказывается достаточно», — объясняет Григорий Ефимов, заведующий лабораторией трансплантационной иммунологии Национального медицинского исследовательского центра (НМИЦ) гематологии Минздрава и один из авторов исследования.
Учёные также отметили, что ответ на фрагменты коронавируса есть не только у тех, кто им переболел, что может объясняться сезонными простудными заболеваниями в прошлом, которые были вызваны коронавирусами других типов. «При этом здоровые доноры, которых мы набирали во время пандемии, в среднем имели более высокий уровень ответа, чем те, образцы которых хранились в биобанке и были получены раньше. Скорее всего, это значит, что часть доноров имела контакт с вирусом, вызывающим COVID-19, не подозревая об этом», — добавляет Григорий Ефимов.
Одно из самых интересных открытий — обнаружение фрагментов вируса,
Т-клеточный ответ на которые у людей возникает особенно часто. По словам исследователей, прямо сейчас они заняты изучением этих фрагментов, так как лучшее их понимание даст информацию для разработки теста
на Т-клеточный иммунитет. Пока он используется только как научный инструмент, но если всё пойдёт хорошо, в ближайшее время может стать доступным и для диагностики тоже.
Т-лимфоциты: путешественники и домоседы
Об авторе
Софья Алексеевна Касацкая — младший научный сотрудник лаборатории геномики адаптивного иммунитета Института биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова РАН. Область научных интересов — Т-клеточный иммунитет, нейро- и онкоиммунология. Победитель конкурса «Био/мол/текст» 2015 г. в номинации «Лучшая статья по иммунологии».
Адекватная защитная реакция организма на вторжение вирусов, бактерий и других патогенов — уничтожить пораженные клетки, не допустив распространения инфекции и гибели большого числа собственных клеток. Если инфицированная вирусом клетка его заметила, запускаются процессы врожденного иммунитета: аутофагия (утилизация внутренних компонентов клетки с помощью ферментов лизосом) и апоптоз (запрограммированная гибель клеток). Однако патогенных вирусов и бактерий очень много, к тому же они постоянно меняются до неузнаваемости. Чтобы справиться с ними, подключается система адаптивного иммунитета и его главные участники — лимфоциты. Вершиной эволюции адаптивного иммунитета стал цитотоксический Т-лимфоцит, или Т-киллер. Для распознавания фрагмента вируса (антигена) на зараженной клетке он использует Т-клеточный рецептор (T cell receptor, TCR), случайно и независимо собирающийся на каждой Т-клетке в вилочковой железе (тимусе). Механизм сборки TCR уникален и присущ только иммунной системе позвоночных животных. Считается, что эти преимущества впервые получили примитивные рыбы около 500 млн лет назад, когда в результате ретровирусной инфекции в их гаметы внедрились гены, кодирующие особые белки (рекомбиназы), ответственные за рекомбинацию генов TCR.
Классическая иммунология человека построена на изучении иммунных клеток крови просто потому, что образец крови можно взять у любого пациента и исследовать в норме и в патологии. Именно на клетках крови была выстроена классификация Т-лимфоцитов — деление на Т-киллеры и Т-хелперы, которые проверяют антигенную специфичность Т-киллеров, выдают им «лицензию на убийство» и способны управлять всем ходом иммунного ответа через сигнальные растворимые молекулы, цитокины. Позднее из ветви Т-хелперов была выделена группа регуляторных Т-клеток, подавляющих избыточный адаптивный иммунитет.
Но, как нам напоминает реклама йогурта, значительная часть клеток иммунной системы сосредоточена вокруг слизистой оболочки пищеварительного тракта и в других тканях. В то время как в 5–6 л крови взрослого человека находится около 6–15 млрд T-лимфоцитов, в эпидермисе и коже — 20 млрд Т-клеток [1], в печени — еще 4 млрд [2]. Достаточно ли изучения образцов крови для полного описания функций Т-клеток, если в периферических органах Т-клеток больше, чем в кровотоке? И достаточно ли классических субпопуляций, чтобы описать все типы Т-клеток, находящихся в организме человека?
Жизненный цикл Т-лимфоцита
Каждая Т-клетка после сборки TCR проходит тестирование на функциональность случайно собранного рецептора (положительная селекция) и на отсутствие специфичности к собственным антигенам организма, т.е. на отсутствие очевидной аутоиммунной угрозы (отрицательная селекция). Этапы селекции происходят в вилочковой железе; при этом более 90% клеток-предшественников погибает, не сумев правильно собрать рецептор либо пройти селективный отбор. Выжившие Т-клетки пролиферируют и выходят из тимуса в кровоток — это наивные Т-лимфоциты, еще не встречавшиеся с антигеном. Наивная Т-клетка циркулирует в крови и периодически заходит в лимфоузлы, где в Т-клеточной зоне контактирует со специализированными клетками, которые представляют ей чужеродный антиген.
Миграция эффекторной Т-клетки в ткань при вирусной инфекции [3]. Сигналы воспаления от зараженных эпителиальных клеток при участии резидентных клеток передаются эндотелию сосудов, клетки которого привлекают эффекторные Т-клетки хемокинами CXCL9, CXCL10. Роллинг: при движении по посткапиллярной венуле в ткани эффекторная клетка замедляется, образуя временные контакты с Е-селектинами и P-селектинами на клетках эндотелия. Остановка: эффекторная клетка плотно прикрепляется к эндотелию при взаимодействии LFA-1 и других альфа-интегринов с ICAM-1 / VCAM-1 / MAdCAM-1 (на эндотелии). Трансмиграция: эффекторная Т-клетка связывает эндотелиальный JAM-1 молекулами PECAM, CD99, LFA-1 и проникает через клетки эндотелия в подслизистую
После встречи с антигеном в лимфоузле Т-клетка приобретает способность снова делиться — становится предшественницей Т-клеток памяти (Stem Cell Memory T cells, TSCM). Cреди ее потомков появляются клетки центральной памяти (Central Memory T cells, TCM) и эффекторные клетки-предшественники (Effector Memory T cells, TEM), которые при делении дают короткоживущие эффекторные клетки, осуществляющие иммунную реакцию (TEMRA-клетки) [3]. Все эти клетки выходят из лимфоузла и перемещаются по крови. Эффекторные клетки затем могут покинуть кровоток для осуществления иммунной реакции в периферической ткани органа, где находится патоген. Что потом — снова путешествие по крови и лимфоузлам?
Схема перехода потомков активированных Т-лимфоцитов между популяциями [4]. Пояснения в тексте
Клетки стромы, т.е. основы лимфоузла, выделяют сигнальные вещества (хемокины) для того, чтобы позвать Т-клетку в лимфоузел. Распознают хемокины лимфоузлов рецепторы хоминга CCR7 и CD62L. Но на эффекторных клетках оба рецептора отсутствуют. Из-за этого долгое время было загадкой, как эффекторные клетки могут попасть из периферической ткани обратно во вторичные лимфоидные органы — селезенку и лимфоузлы.

Сложный выбор эффекторной клетки. To home — процесс хоминга, или миграции Т-клеток, например, в наиболее привычное для наивных клеток место — лимфоузел. Альтернатива — не отправляться в путешествие по организму и превратиться в резидентную клетку ткани
В то же время стали накапливаться данные (о различиях в репертуарах TCR и профилях транскрипции между TEM в крови и в других тканях), которые никак не укладывались в концепцию постоянной миграции Т-клеток между тканями и кровью. Решено было выделить новую субпопуляцию — резидентные клетки памяти (Resident Memory T cells, TRM), которые населяют определенный орган и не рециркулируют [5].
Откуда впервые появляются резидентные клетки ткани? Это потомки эффекторных клеток, которые потеряли способность рециркулировать. Некоторые периферические для иммунной системы ткани, например слизистая тонкого кишечника и брюшная полость, позволяют эффекторным Т-лимфоцитам проникать внутрь свободно, другие — очень ограниченно. Большой поток эффекторных Т-клеток в эти ткани наблюдается только при реакции воспаления. К тканям второго типа относятся головной и спинной мозг, отделенные барьером от иммунной системы, а также многие другие ткани: периферические ганглии, слизистые половых органов и кишечника, легкие, эпидермис, глаза. Разница между двумя типами тканей — в экспрессии дополнительных молекул хоминга для эффекторных Т-клеток, например молекул адгезии MadCAM-1 для проникновения в эпителий [3].
Резидентные Т-клетки в старении тканей человека
Карта соотношений присутствия отдельных субпопуляций Т-клеток в разных органах человека, как ни странно, была составлена только в 2014 г. Команда Донны Фарбер из медицинского центра Колумбийского университета Нью-Йорка провела сравнение фенотипов Т-клеток, выделенных из крови и тканей доноров органов всех возрастных групп от 3 до 73 лет (всего 56 доноров) [6]. Анализ субпопуляций Т-клеток при помощи проточной цитофлуориметрии подтвердил многие данные, полученные методами с меньшим разрешением и меньшей статистикой, и некоторые черты описания иммунной системы, перенесенные с иммунологии мыши на человека, к примеру снижение содержания наивных Т-лимфоцитов во всех органах при старении организма.
Уменьшение числа наивных Т-клеток с возрастом связано с быстрым старением вилочковой железы, в которой будущие Т-клетки проходят этапы сборки TCR, проверку его работоспособности и селекцию на отсутствие аутоиммунного потенциала. Важно не только снижение абсолютной численности наивных Т-клеток, но и уменьшение разнообразия репертуара Т-клеточных рецепторов, а значит, и возможности сформировать адаптивный иммунный ответ на ранее незнакомую инфекцию [7]. Для наивных Т-киллеров подтвердилось прогрессирующее падение численности в крови и лимфоузлах, хотя для наивных Т-хелперов отрицательная корреляция численности с возрастом в данном исследовании оказалась значительной только для вторичных лимфоидных органов, но не для крови.
Пути циркуляции Т-лимфоцитов различных субпопуляций [8]. Наивные Т-клетки вместе с субпопуляцией TCM путешествуют по кровеносным сосудам и заходят в Т-клеточную зону различных лимфоузлов, в ткани не выходят, хотя в их капиллярах встречаются (красная траектория). Эффекторные ТEM-клетки перемещаются по лимфо- и кровотоку, могут попасть в лимфоузел, но в Т-клеточную зону не заходят (траектория лилового цвета). Резидентные ТRM-клетки (показаны зеленым в коже и различными цветами в слизистых) перемещаются только внутри ткани (траектория зеленого цвета)
Выделение Т-лимфоцитов памяти, эффекторных клеток памяти и короткоживущих эффекторных клеток из слизистых легких, тонкого и толстого кишечника, паховых и мезентериальных лимфоузлов доноров органов позволило впервые оценить динамику данных популяций в тканях человека при старении. Доля центральных клеток памяти ожидаемо растет с течением жизни, в соответствии с ростом числа инфекций, которые успели встретиться организму и попасть в библиотеку памяти иммунной системы. Эффекторные клетки памяти TEM стремительно заполняют нишу для Т-клеток в тканях ребенка, быстро, примерно к 12 годам, вытесняя наивные Т-клетки. Растет и количество терминально дифференцированных эффекторных Т-киллеров (TEMRA), но только в лимфоузлах и в селезенке; в нелимфоидных тканях численность TEMRA падает. Короткоживущие терминально дифференцированные Т-киллеры чаще всего встречаются в крови, селезенке и слизистых легких в любом возрасте, а вот среди Т-хелперов эта субпопуляция представлена исчезающе малым числом клеток. Аналогично мало центральных клеток памяти среди Т-киллеров, преимущественно они находятся в слизистых двух барьерных тканей: легких и кишечника.
Широкими мазками карту распределения Т-лимфоцитов человека можно обрисовать так: наивные Т-клетки путешествуют по крови и периодически заходят во вторичные лимфоидные органы, киллеры TEMRA находятся в крови, селезенке и легких. Для центральных клеток памяти, судя по всему, характерно более индивидуальное распределение по тканям, чем для других субпопуляций: во всяком случае, закономерностей динамики при старении разных тканей выявить не удалось. Эффекторные клетки памяти, включающие и TRM-субпопуляцию, доминируют среди Т-клеток слизистых барьерных тканей. В целом, при старении Т-клеточного иммунитета нелимфоидные ткани проявляют большую стабильность субпопуляций, лимфоидные ткани — большую возрастную динамику типов Т-клеток [6]. Стабильность тканевых клеток проще объяснить, если разобраться, какие из эффекторных клеток TEM остаются в ткани, становятся резидентными TRM и из каких событий состоит их жизнь после отказа от путешествий по организму.
Как отличить резидентные клетки тканей от примесей клеток крови?
Резидентные Т-клетки корректно, но неудобно каждый раз определять по способности индивидуальной клетки мигрировать в лимфоузлы, поэтому необходимо составить список характерных признаков, по которым можно выявить принадлежность к этой субпопуляции. Резидентные Т-лимфоциты в тканях — естественных барьерах организма (например в легких и слизистой тонкого кишечника) немного похожи на классические эффекторные клетки крови: экспрессируют маркер активированных клеток CD69, причем экспрессия стабильна в течение жизни при взрослении и старении и характерна для всех нелимфоидных тканей. Но вдобавок CD69 колокализуется с маркером CD103, который обозначает группу молекул адгезии — интегринов, способствующих прикреплению резидентной Т-клетки к эпителию и к фибробластам в подслизистой выбранного органа. Для эффекторных Т-клеток во вторичных лимфоидных органах экспрессия интегринов CD103 совершенно нехарактерна: TEM-клетки постоянно сохраняют подвижный фенотип.
У карты, составленной коллективом Донны Фарбер, есть крупный недочет: неясно, насколько чисто удается выделить Т-лимфоциты из органа, какую долю анализируемых клеток на самом деле составляют Т-лимфоциты крови из капилляров внутри органа.
Особенно остро вопрос загрязнения клетками крови стоит для легких — неслучайно субпопуляционный состав Т-клеток легких неожиданно похож на Т-клетки крови и лимфоузлов. Вопрос загрязнения клетками крови был изящно решен для Т-лимфоцитов мыши: подопытных животных заражали вирусом лимфоцитарного хориоменингита после пересадки трансгенного клона Т-клеток P14, специфичного к данному вирусу. В результате при инфекции большая часть циркулирующих клеток была представлена вирусоспецифичным клоном P14, а его присутствие в тканях можно было выявить с помощью флуоресцирующих антител к TCR P14. Мышам в кровь вводили антитело анти-CD8 к маркеру Т-киллерных клеток, оно быстро распространялось по кровотоку и связывалось со всеми Т-киллерами в крови (но не в тканях). При микроскопии срезов органов легко было отличить резидентные киллерные TRM от только недавно вышедших из крови в орган клеток, помеченных анти-CD8 антителом [9]. Численность резидентных клеток, подсчитанная этим методом, в 70 раз превышала количество, определенное методом проточной цитометрии; разница меньше чем в два раза наблюдалась только для резидентных клеток лимфоузлов и селезенки. Получается, стандартные методики выделения лимфоцитов из органов плохо подходят для анализа киллерных резидентных клеток и существенно занижают размеры популяции.
Работа резидентных Т-клеток: не стоит путать туризм с эмиграцией
Мышиные резидентные клетки тканей в нормальной ситуации почти не перемещаются внутри нелимфоидной ткани и достаточно прочно прикреплены молекулами адгезии к строме органа. Когда резидентные макрофаги той же ткани секрецией цитокинов инициируют реакцию воспаления, ТRM приобретают большую подвижность и патрулируют близлежащий эпителий в поисках зараженных клеток.
Если воспалительная реакция усиливается, то клетки понимают это как сигнал о подкреплении: к работе патрульных TRM подключаются вновь прибывающие из крови TCM— и TEM-клетки. Эти клетки крови куда более подвижны и лучше перемещаются в эпителии. Значит ли это, что именно в крови находятся готовые действовать Т-киллеры среди TEM, а CD8+ TRM выполняют в ткани хелперные и регуляторные функции?
С одной стороны, Т-хелперы по спектру Т-клеточных рецепторов более тканеспецифичны, т.е. пересечений между репертуарами TCR клеток, взятых из разных тканей, совсем мало, тогда как клетки одного клона Т-киллера встречаются в разных тканях среди TEM [6]. Спектр функций и репертуар антигенной специфичности TRM еще предстоит исследовать, но способности к уничтожению зараженных клеток тканей у TRM-киллеров точно есть. Более того, в модели мышиной инфекции полиомавирусом, протекающей в ткани головного мозга, аффинность вирусоспецифичных Т-клеточных рецепторов резидентных киллерных клеток выше, чем у вирусоспецифичных клеток центральной памяти [10].
Однако размер популяции Т-клеток зависит не только от специфичности TCR к инфекциям, которые раньше протекали в данном органе, но и от гомеостатической пролиферации Т-клеток — размножения более удачливых клеток для заполнения емкости органа по числу Т-лимфоцитов. По маркерам CD28 и CD127 на поверхности клеток можно отличить недавно и давно активированные через TCR клетки от тех, которые получили только гомеостатический сигнал к пролиферации от фактора роста IL-7. При старении ткани гомеостатическое размножение клеток начинает преобладать над пролиферацией активированных через TCR клеток.
Независимо от Т-клеточных рецепторов часто функционируют NKT-клетки, тип резидентных клеток печени, встречающихся и в других тканях. Они могут быть активированы NK-клеточными рецепторами через распознавание не индивидуальных антигенов, а общих молекулярных паттернов опасности и тканевого стресса. При активации CD8+ NKT-клетки выделяют цитотоксические гранулы и лизируют подозрительные клетки ткани, к примеру единичные опухолевые клетки и зараженные вирусами клетки, экспрессирующие и выставляющие на внешней мембране стрессорные молекулы. При старении тенденция TRM к активации без Т-клеточного рецептора, через NK-клеточные рецепторы или цитокиновые сигналы, может приводить к ошибочному лизису клеток ткани, недостаточному контролю над хронически зараженными или перерождающимися участками эпителия.
Патологические проявления, связанные с работой резидентных Т-клеток, включают органоспецифичные аутоиммунные синдромы и синдромы хронического воспаления в ткани. Примеры хронического воспаления, поддерживаемого резидентными Т-лимфоцитами, — контактный дерматит и псориаз, а механизмом служит выделение воспалительных факторов IL-17 резидентными Т-киллерами и IL-22 резидентными Т-хелперами дермы. CD8+ эффекторные Т-киллеры, находящиеся в головном мозге, похожи по совокупности мембранных молекул-маркеров на TRM кожи, кишечника и легких и способны подталкивать развитие перемежающегося рассеянного склероза при периодических выбросах воспалительных цитокинов. Неясно, однако, есть ли в норме в головном мозге популяция TRM или же это Т-лимфоциты, оставшиеся в ткани после нейротропной вирусной инфекции [8].
Функции резидентных клеток памяти в норме — при отсутствии инфекции или хронического воспаления — могут включать cross-talk (взаимную регуляцию преимущественно через секрецию цитокинов и костимуляторные молекулы) с неклассическими малоизученными лимфоидными клетками. Ими могут быть ассоциированные со слизистыми γ/δ Т-клетки, несущие альтернативный вариант сборки Т-клеточного рецептора, или лимфоидные клетки врожденного иммунитета (Innate Lymphoid Cells, ILC), которые делят с Т- и В-лимфоцитами общие черты эпигенетического ландшафта, но не имеют Т-/В- или NK-клеточных рецепторов [11, 12].
Предполагаемые функции резидентных Т-лимфоцитов тканей. Часть функций может выполняться во взаимодействии с резидентными макрофагами
TRM клетки контактируют с антигенпрезентирующими клетками тканей — дендритными клетками кожи и резидентными макрофагами тканей. Резидентные миелоидные клетки в разных тканях дифференцированы и слабо похожи друг на друга. К примеру, макрофаги маргинальной зоны селезенки, макрофаги печени и микроглия (макрофаги мозга) будут сильно отличаться и по морфологии, и по спектру функций. Кроме обнаружения антигенов в ткани, резидентные макрофаги заняты регуляцией процессов старения и самообновления тканей, в частности, выделяют факторы роста и цитокины, стимулирующие деление стволовых клеток тканей. В жировой ткани, к примеру, макрофаги стимулируют дифференцировку новых жировых клеток, но при переходе в активированное M1-состояние запускают воспаление и вместо дифференцировки заставляют увеличиваться и набухать имеющиеся жировые клетки. Сопутствующие изменения метаболизма жировой ткани приводят к накоплению жировой массы и в последние годы связываются с механизмами развития ожирения и диабета II типа. В коже цитокины, выделяемые макрофагами и резидентными γ/δ Т-клетками, стимулируют деление стволовых клеток при регенерации эпидермиса и стволовых клеток волосяных фолликулов [13, 14]. Можно предположить, что хелперные TRM-клетки при патрулировании эпителия и образовании контактов с тканевыми макрофагами могут модулировать спектр и объем выделяемых последними факторов роста для стволовых клеток, воспалительных цитокинов и факторов ремоделирования эпителия — и тем самым участвовать в обновлении тканей.
Что изучение TRM может дать медицине?
Понимание принципов работы резидентных Т-клеток абсолютно необходимо для борьбы с инфекциями, которые не поступают сразу в кровь, а проникают в организм через барьерные ткани, т.е. для подавляющего большинства инфекций. Рациональный дизайн вакцин для защиты от этой группы инфекций может быть направлен именно на усиление первого этапа защиты с помощью резидентных клеток. Ситуация, при которой оптимально активированные специфичные к антигену клетки элиминируют патоген в барьерной ткани, куда выгоднее, чем запуск острого воспаления для вызова Т-лимфоцитов из крови, поскольку меньше повреждается ткань.
Репертуар TCR, ассоциированных со слизистыми барьерных тканей, считается частично вырожденным и наиболее распространенным, т.е. идентичным для многих людей в популяции. Тем не менее искажения при выделении Т-клеток из органов, перекос данных в результате отбора в когорты только определенных европеоидных доноров и общее небольшое количество накопленных данных секвенирования не дают уверенности в публичности репертуаров Т-клеточных рецепторов TRM-клеток. Впрочем, это было бы удобно: дизайн вакцин мог бы сводиться к поиску и модификации наиболее аффинных и иммуногенных пептидов в патогене, взаимодействующих с одним из распространенных вариантов ТCR в барьерной для этого патогена ткани.
Конечно, представления о том, какие TCR несут на своей поверхности TRM-клетки, недостаточно для того, чтобы эффективно манипулировать иммунными реакциями в ткани. Предстоит детально изучить факторы, влияющие на заселение тканей определенными клонами Т-клеток, и разобраться в механизмах активации местного тканевого иммунитета и индукции толерантности TRM. Как заселяются ниши Т-лимфоцитов в слизистых у ребенка до встречи с большим числом патогенов и, соответственно, до формирования значительного пула эффекторных Т-клеток памяти — предшественников резидентных клеток и клеток центральной памяти? Почему и как вместо классической активации лимфоцитов формируется реакция толерантности к микробам непатогенной флоры слизистых? Эти вопросы стоят на повестке дня в изучении резидентных клеток иммунной системы.
Определение закономерностей хоминга Т-лимфоцитов в определенные ткани может дать преимущество в клеточной иммунотерапии опухолевых заболеваний. Теоретически киллерные Т-клетки нужной специфичности к опухолевому антигену, активированные in vitro, должны убивать опухолевые клетки пациента. На практике подобная иммунотерапия осложняется тем, что опухолевые клетки способны подавлять иммунные реакции и приводить в неактивное состояние приближающиеся к опухоли Т-киллеры. Зачастую в массе растущей опухоли и вокруг нее накапливаются анергичные Т-лимфоциты — в первую очередь TRM данной ткани. Из множества инъецированных пациенту активных опухолеспецифичных Т-клеток до цели дойдут немногие, и даже они могут оказаться практически бесполезными в иммуносупрессивном микроокружении опухоли.
Расшифровка механизмов, которые обеспечивают попадание конкретных клонов Т-клеток в определенные ткани, может позволить более эффективно направлять к опухоли сконструированные в лаборатории Т-лимфоциты и приблизить эру доступной персонализированной иммунотерапии.