что означает интраназальное введение лекарства
Разработка систем интраназальной доставки лекарственных средств
Опубликовано в журнале:
Качественная клиническая практика »» 1 / 2002 К. Г. Гуревич
Кафедра патофизиологии лечебного факультета Московского государственного медицинского стоматологического университета
До недавнего времени интраназалыю применялись препараты, преимущественно обладающие местным действием, в основном для облегчения симптомов ринитов. В последние годы показано, что в носовой полости может происходить активное всасывание ряда лекарственных веществ, которые подвергаются расщеплению и в желудочно-кишечном тракте, в частности это касается гормонов и веществ белково-пептидной природы. Из-за удобства и простоты применения, быстроты достижения максимальной концентрации в крови наблюдается активное развитие фармацевтического рынка препаратов для интраназального применения, обладающих, системным действием.
Одним из специфических способов введения лекарственных препаратов является их распыление в носовой полости. Он основан на способности ряда лекарственных веществ (ЛВ) всасываться в слизистой оболочке носовой полости и поступать и системный кровоток. Несмотря на то, что до недавнего времени интраназальное введение ЛВ преимущественно использовалось в качестве местной терапии (например, при рините), в последние годы наибольшее значение приобретает введение именно тех ЛВ, которые в дальнейшем оказывают системное действие [2] (см. таблицу).
Таблица 1 Некоторые препараты для интраназального применения, имеющие преимущественно системное действие [3]
Основными преимуществами иитраназального применения ЛВ являются:
Другой проблемой, возникающей при интраназальном применении ЛВ, являются воспалительно-дегенеративные заболевания носовой полости. В частности, банальный ринит может существенным образом ускорить эвакуацию ряда ЛВ и их биодоступность при интраназальном введении [1]. До настоящего времени практически не изучено влияние воспалительно-дегенеративных заболеваний слизистой оболочки носовой полости на биодоступность ЛВ и скорость их всасывания, а, следовательно, на эффективность их терапевтического применения. Это ограничивает возможность широкого терапевтического интраназального применения ЛВ. Лишь для некоторых лекарственных средств проведены исследования по сравнительной биодоступности и фармакокинетики при различных путях введения. Эти данные приводятся ниже.
Основными разработчиками интраназальных форм лекарственных препаратов являются фирмы Nastech (США) и California Biotechnology Inc. (США). Фирма Nastech имеет более 20 форм лекарственных препаратов интраназального применения, разрешенных FDA. Фирма California Biotechnology Inc. разработала специальную систему интраназальной доставки ЛВ, Nazdel, содержащую тауро-24,25-дигидрофузидат для повышения проницаемости слизистых оболочек носовой полости. Кроме того, фирма California Biotechnology Inc. является владельцем патента, защищающего способ трансмукозной доставки пептидов. Исследователи датской Королевской школы фармации разработали новую форму интраназальной доставки ЛВ — биоадгезивные микросферы, которая обеспечивает длительный контакт Л В со слизистой носовой полости, пролонгируя тем самым форму лекарственного препарата. Микросферы имеют размер 40-60 мкм, иначе они легко удаляются. ЛВ, находящиеся в микросферах, также защищены от ферментативного разрушения в носовой полости [21].
Рассмотрим особенности фармакокинетики ряда Л В при интраназальном введении подробней.
При интраназальном введении 2 мг лоразепама здоровым добровольцам было показано, что биодоступность препарата соответствует таковой при внутримышечном введении (77,7+/-11,1%). При этом интраназальное введение препарата приводит к более быстрому поступлению препарата в системный кровоток и достижению максимальной концентрации [29].
Фирма Leo (Швеция) разработала интраназальную форму никотина, используемую для отвыкания от курения. Пиковые концентрации никотина в крови достигаются уже через 7,5 мин, тогда как при жевании резинок — через 30 мин. Кроме того, при интраназальном применении не развиваются диспепсия, тошнота [2].
Особое значение имеет всасывание интерферонов в носовой полости. Через оболочки 1 пары черепно-мозговых нервов интерфероны поступают в головной мозг [28], где имеют не только иммунное [30], но и регуляторное значение [9]. При отсутствии воспаления мозговых оболочек других путей поступления интерферонов в ЦНС не найдено [26]. В отличие от других путей введения интерферона, интраназальное применение препарата обеспечивает наибольшую эффективность при наименьшем числе неблагоприятных реакций [6, 11].
В качестве средства профилактики ОРВИ интерфероны относятся к мерам экстренного назначения. Так, для проявления эффекта вакцинации или иммуномодуляции необходимо время; препараты интерферонов могут быть использованы сразу же после контакта с больным ОРВИ или же при первых симптомах заболевания. Даже в случае, если появились первые симптомы ОРВИ, интраназальное применение интерферонов позволяет избежать манифестации заболевания более чем в 80% случаев [11]. Рекомбинатный a2-интерферон при интраназальном введении обладает большей эффективностью, чем человеческий [6].
ИРС19, представляющий собой аэрозоль для интраназального применения, содержит антигенные детерминанты 19 штаммов бактерий, являющихся наиболее частыми возбудителями инфекций дыхательных путей. Препарат оказывает специфическое и неспецифическое действие на иммунитет. Неспецифическое влияние заключается в повышении фагоцитарной активности макрофагов, увеличении содержания эндогенного лизоцима и интерферона. Широкие клинические испытания показали высокую эффективность применения препарата при респираторных заболеваниях, в том числе имеющих вялотекущий или хронический характер [4].
В исследовании эстрогенной пульс-терапии 36 женщинам с постменопаузальными расстройствами рандомизированно назначали 17b-эстрадиол интраназально в дозе 100, 300, 450 мкг/день или перорально в дозе 2 мг/ день. В отличие от перорального введения, уже через 10-30 мин после интраназального введения в крови наблюдается максимальная концентрация 17b-эстрадиола. В дозе 300 мкг/день интраназально другие фармакокине-тические параметры неотличимы от дозы 2 мг/день перорально [14].
Рандомизированное введение 17b-эстрадиола интраназально в дозе 300 мкг/день, перорально в дозе 2 мг/ день или плацебо использовалось для лечения 659 женщин во время менопаузы. Длительность терапии составила один год. Все женщины также перорально получали дигидроэстерон в дозе 10 мг/день 14 дней 28-дневного цикла. В группах, получавших 17b-эстрадиол, изменение индекса Куппермана, характеризующего тяжесть климактерических расстройств, было достоверно более существенным, чем в группе, получавшей плацебо. Снижение уровня триглицеридов крови более выраженным оказалось в группе, получавшей пероральную заместительную гормонотерапию (по сравнению с интраназальной). Частота встречаемости мастопатии в группе, получавшей 17b-эстрадиол интраназально, составила 1%, перорально — 6%. Таким образом, интраназальное назначение 17b-эстрадиола в качестве заместительной гормонотерапии оказалось чуть менее эффективным, но и сопряженным с меньшей частотой встречаемости неблагоприятных реакций, чем пероральная терапия [23].
Относительно интраназального применения инсулина имеются противоречивые данные. Jacobs et аl. (1993) на здоровых добровольцах показали, что интраназальное введение инсулина сравнимо по фармакокинетическим параметрам с подкожным. Так как при интраназальном введении нет болезненности, воспаления в месте введения, липодистрофии и данный путь введения является неинвазивным, то он предпочителен для лечения сахарного диабета 1 типа [18]. Иной результат был описан Hilsted et аl. (1995). Интраназальное введение инсулина больным сахарным диабетом 1 типа обусловливает столь же быстрое поступление гормона в кровь, как и подкожное введение. Однако биодоступность инсулина при интраназальном введении существенно ниже: для достижения той же эффективной концентрации в крови необходимо увеличить дозировку примерно в 20 раз по сравнению с подкожной [19].
На основе системы Nazdel фирма Еli Lilly (США) разработала интраназальную форму инсулина. Считается, что препарат лучше переносится больными сахарным диабетом 1 типа, а также окажется эффективным у ряда больных сахарным диабетом II типа. По оценкам аналитиков, за 5 лет доходы от продажи интраназальных форм инсулина могут превысить 10 млн. долл. [2].
Фирма GlaxoSmithKline разработала интраназальную форму инактивированной противогриппозной вакцины. Она способствует не только формированию системного иммунитета, но и стимулирует местный иммунитет носовой полости, которая обычно является входными воротами инфекции [5]. Для экстренной профилактики и лечения простудных заболеваний фирма Merck Со. (США) разработала препарат, распыляемый в носовой полости и содержащий моноклональные антитела, которые блокируют внедрение и распространение рино-вируса. В отличие от других препаратов, содержащих моноклональные антитела, данный препарат не влияет на системный иммунитет [1].
Таким образом, интраназальное применение ЛВ не только местного, но и системного действия является перспективной областью медицины. Во многих случаях оно позволяет избежать инъекционного пути введения и уменьшить число неблагоприятных реакций проводимой терапии. Кроме того, при интраназальном применении Л В иногда наблюдается изменение их фармакологических эффектов, что в дальнейшем может быть использовано в клинической медицине.
Abstract
Recently a lot of intranasal drugs with local effect are used to relief the symptoms of rhinitis. It was found that there is an active absorption in nasal cavity of some medicines, which can disintegrate in gastro-intestinal tracts, e. g. hormones and proteins. There is an active development of intranasal medicines with systemic effects because of their facility, simple usage and celerity of maximal drug concentration. These new drugs allow to avoid injections and advers events during therapy.
Сводка по вакцинам для интраназального введения
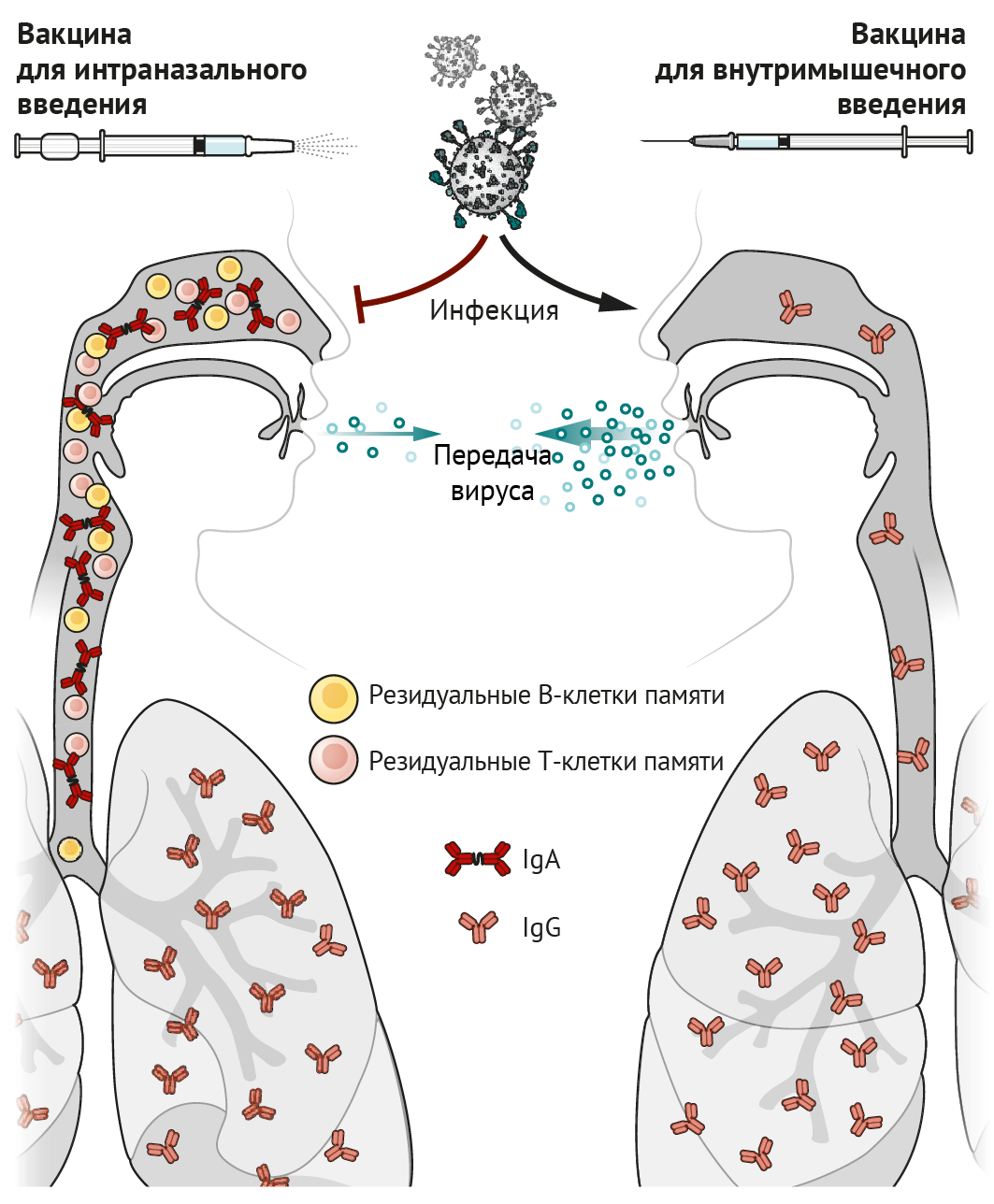
Высококонтагиозный коронавирус SARS-CoV-2, вызывающий тяжелый острый респираторный синдром, поражает дыхательные пути, а одним из способов его передачи является воздушно-капельный (аэрозольный). Следовательно, непривитым людям рекомендовано носить маски в общественных местах, соблюдать карантинные мероприятия при наличии симптомов и социальное дистанцирование. Несмотря на эти меры предосторожности, миллионы людей умирают. Поскольку волны пандемии следуют одна за одной, тема актуальности вакцин вновь занимает первые полосы газет. Кроме того, скорость разработки вакцинных препаратов на основе информационной (матричной) РНК (мРНК) возрастает. Однако, учитывая тропность вируса к тканям дыхательных путей, удивительно, что только семь из почти 100 вакцин против SARS-CoV-2, которые в настоящее время проходят клинические испытания, предназначены для интраназального введения. К преимуществам вакцин для интраназального введения относятся:
Идея о том, что интраназальная вакцинация преимущественно защищает дыхательные пути, не нова: еще в 1960-е гг. велись разработки живой аттенуированной вакцины против гриппа (ЖАВПГ), которая была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Иммунологам давно известно, что инфекция верхних дыхательных путей (ВДП) или вакцинация стимулируют антительный ответ (в виде иммуноглобулина A [IgA]) как в сыворотке, так и в жидких средах тканей ВДП. Внутримышечные вакцины преимущественно стимулируют выделение IgG (накапливается в сыворотке). IgA играет важную роль в ВДП и носовых ходах, где происходит его активный транспорт через эпителий и высвобождение в просвет дыхательных путей в виде димера, связанного с секреторным компонентом, посредством чего формируется стабилизирующая конфигурация, позволяющая более эффективно нейтрализовать вирусы, такие как SARS-CoV-2 [1]. Напротив, IgG проникает через бронхиальное дерево в легочную ткань и защищает нижние доли легкого посредством пассивной транссудации через тонкий альвеолярный эпителий [2]. Возможно, IgG, выявленный в ВДП и носовых проходах, попадает в них из нижних отделов легких посредством мукоцилиарного транспорта. Однако высокая степень иммунной защиты носовых ходов с помощью IgG может быть достигнута только при высоких концентрациях данных антител в сыворотке крови [2]. Таким образом, вакцины, вводимые внутримышечно, стимулирующие высокие титры сывороточного IgG, могут снижать вирусную нагрузку в легких и носовых ходах.
CD8+ Т-лимфоциты являются еще одним важным компонентом противовирусного иммунитета; они уничтожают непосредственно инфицированные вирусом клетки, тем самым снижая репликацию вируса и ускоряя восстановление клеток и тканей от вирусной нагрузки. Некоторые активированные CD8+ Т-лимфоциты трансформируются в клетки памяти, которые сами по себе не могут предотвратить инфицирование, но способствуют запуску быстрых реакций в ответ на вторжение патогена и стимулируют эффекторные клетки. Примечательно, что В- и Т-клетки, стимулированные вакцинацией слизистой оболочки интраназальным способом или непосредственно инфекцией, экспрессируют рецепторы, способствующие закреплению на участках слизистой оболочки клеток, способных длительно функционировать и секретировать антитела; или благодаря этим рецепторам Т- и В-клетки могут существовать в качестве резидуальных клеток памяти. Резидуальные В- и Т-клетки памяти в легких и носовых ходах — незаменимые компоненты формирования иммунного ответа, они первыми реагируют на вторжение инфекции и необходимы для быстрого очищения тканей от вируса [3, 4]. Размещение резидуальных клеток памяти в дыхательных путях необходимо для того, чтобы оказался возможным их быстрый контакт с антигеном в данной области [3, 5]. Именно это означает, что способ введения вакцин, предназначенных для задействования резидуальных клеток памяти в процессе иммунного ответа в дыхательных путях, должен быть интраназальным.
По сравнению с вакцинами, вводимыми внутримышечно, интраназальные вакцины формируют две дополнительных линии «обороны»: индуцированный вакциной синтез IgA и резидуальные В- и Т-клетки памяти в слизистой оболочке дыхательных путей, создающие эффективный барьер для инфекционных агентов в этих областях. Даже в случае развития инфекции (например, вирусной или вызывающей перекрестные реакции с тканями макроорганизма) резидуальные В- и Т-клетки памяти, которые раньше сталкиваются с антигеном и реагируют значительно быстрее, чем циркулирующие по кровотоку клетки памяти, препятствуют репликации вируса и уменьшают его распространение по организму, а также, соответственно, снижают трансмиссивность инфекции (см. рисунок).
Таблица 1 | Вакцины против SARS-CoV-2 для интраназального введения, проходящие клинические испытания
Результаты доклинических испытаний вакцин на основе аденовирусных векторов, экспрессирующих шипиковый белок SARS-CoV-2 или его рецептор-связывающий домен (РСД), свидетельствуют о том, что интраназальное введение индуцирует длительный вирус-нейтрализующий антительный ответ (в виде сывороточных IgG), а также выделение антиген-специфических IgA и реакцию CD8+ Т-клеток дыхательных путей [6–8]. Более того, как интраназальное, так и внутримышечное введение вакцин на основе аденовирусных векторов предотвращает развитие пневмонии и истощения в модели инфекции. Однако животные, вакцинированные внутримышечным путем, продолжают выделять вирус из ВДП, тогда как у животных, вакцинированных интраназальным способом, наблюдается сниженная репликация и выделение вируса как из легких, так и из носовых ходов [8].
Аденовирусы — естественные патогены человека, и большинство взрослых людей подвергаются воздействию одного или нескольких штаммов, следовательно, у них могут оказаться антивирусные антитела, способные снизить эффективность вакцины (т. н. отрицательный перекрестный эффект). Однако интраназальная противогриппозная вакцина на основе вектора Ad5 (NasoVAX), вводимая в высоких дозах, работает аналогичным образом как у серопозитивных, так и серонегативных по наличию Ad5 людей [9]; возможно, это происходит по причине того, что вводимый объем вакцины способствует снижению локальных концентраций антител. Тем не менее, пытаясь избежать любого потенциального отрицательного воздействия вакцины, некоторые разработчики используют редкие штаммы аденовирусов человека или аденовирусов шимпанзе, с которыми большинство людей в популяции не сталкивалось.
В этой связи вакцина против SARS-CoV-2 на основе гриппозного вектора из университета Гонконга в процессе своей разработки может столкнуться с определенными препятствиями. Удаление гена вируса гриппа, кодирующего неструктурный белок 1 (NS1), в значительной степени ослабляет вектор (вирулентность самого вируса гриппа) и позволяет разработчикам заменить NS1 на РСД шипикового белка SARS-CoV-2. Как и вакцины на основе аденовирусного вектора, эта вакцина также должна вызывать синтез IgA к РСД на слизистых оболочках, а резидуальные клетки памяти также должны размещаться в дыхательных путях. Однако отрицательные перекрестные реакции со стороны уже существующих антител против гриппозного вектора могут снизить эффективность вакцины. Аналогичным образом, компания Meissa Vaccines разработала вектор из живого аттенуированного респираторно-синцитиального вируса (РСВ); в нем рецепторные белки F и G РСВ были заменены на шипиковый белок SARS-CoV-2. При интраназальном введении такой химерный вирус должен вызывать иммунные реакции в слизистой оболочке. Необходимо отметить, что существует предположение, согласно которому изменение поверхностных белков изменит клеточную тропность вируса, а также его иммуногенность. Уже существующие антитела против РСВ теоретически не должны мешать развитию иммунного ответа вследствие вакцинации, но уже существующие антитела против шипикового белка могут снизить его интенсивность.
Показателями эффективности живых аттенуированных интраназальных вакцин против SARS-CoV-2 также должны стать способность вызывать антительный ответ (в виде IgA) слизистых оболочек и формирование популяции резидуальных клеток памяти в ВДП. В отличие от векторных вакцин, экспрессирующих только шипиковый белок или РСД, живой аттенуированный вирус SARS-CoV-2 обладает преимуществом в экспрессии и потенциальной стимуляции иммунного ответа против всех вирусных белков, тем самым формируя иммунитет широкого спектра действия, который теоретически способен обеспечивать определенный уровень иммунной защиты против различных вариантов штаммов SARS-CoV-2. Хотя современные молекулярные методы минимизируют риск реверсии, живые аттенуированные вирусы сохраняют репликативную способность и противопоказаны детям младше 2 лет, людям старше 49 лет или лицам с ослабленным иммунитетом, поэтому живые аттенуированные вирусы SARS-CoV-2 и РСВ, экспрессирующий шипиковый белок, также могут столкнуться с пристальным изучением их потенциальной возможности вызывать побочные симптомы со стороны нервной системы [10].
При разработке живых аттенуированных вакцин необходимо обязательно брать в расчет опыт применения ЖАВПГ в прошлом. У детей чаще применяют интраназальный способ введения ЖАВПГ, нежели внутримышечный [11]. Вероятно, это отражает иммунологическую наивность детей (большинство из них за жизнь еще не сталкивалось с вирусом гриппа). Следовательно, отсутствует иммунный барьер для инфекции, провоцируемой ЖАВПГ в носовых ходах, и введение вакцины оказывается эффективным, приводя к формированию устойчивого антительного ответа (IgA) в слизистой оболочке и появлению резидуальных клеток памяти в ВДП. ЖАВПГ, вводимая интраназально, также эффективна у взрослых, но не в той же степени, что вакцина, введенная внутримышечно [11], отчасти потому что инфекция гриппа в анамнезе привела к формированию базового уровня иммунитета, который еще больше снижает вирулентность вируса в ЖАВПГ. Следовательно, живые аттенуированные вакцины против SARS-CoV-2 могут привести к формированию надежной защиты у наивных людей, но у людей, переболевших COVID-19 в анамнезе, может быть достаточная степень иммунной защиты для нейтрализации вакцины, что ставит под сомнение ее эффективность даже в качестве средства ревакцинации.
Только одна из интраназальных вакцин, проходящих клинические испытания, является инертной — это кубинская вакцина CIBG-669, в составе которой присутствует РСД, связанный с коровым антигеном вируса гепатита B (является мощным стимулятором Т-лимфоцитов). Поскольку инертные вакцины не зависят от наличия инфекции в анамнезе или экспрессии генов, иммуногенность таких препаратов не может быть нейтрализована уже существующими антителами. Однако растворимые белки в составе вакцин при попадании на слизистые ВДП, не приводят к нарушению целостности эпителия (что необходимо для эффективного развития иммунного ответа). Вместо этого они должны переноситься сквозь эпителиальный барьер специализированными микроскладчатыми клетками (M-клетки) [12], способными доставлять антигены к иммунокомпетентным клеткам под слоем эпителия.
Примечательно, что в списке интраназальных вакцин отсутствуют вакцины, в составе которых находится мРНК, инкапсулированная в липидный слой. МРНК-вакцины, вводимые внутримышечно, приводят к образованию высоких титров сывороточного IgG против антигенов, кодируемых мРНК. Исследования на животных моделях (грызуны) свидетельствуют, что вакцины, содержащие мРНК, также эффективны при интраназальном введении [13]. Однако важно различать интраназальную вакцинацию и назальную вакцинацию. Грызунам часто дают наркоз для интраназальной вакцинации, чтобы животные медленно и глубоко дышали, вследствие чего вакцинный биоматериал в полной мере попадает в легкие. В результате большая часть литературы (включая некоторые цитируемые здесь источники) об интраназальной вакцинации грызунов на самом деле относится к внутрилегочной вакцинации, которая может обеспечить более полную защиту, чем строго назальная вакцинация. Тем не менее, резидуальные клетки памяти из носовых ходов могут предотвратить попадание вируса в легкие [4]. Учитывая, что доставка вакцины непосредственно в нижние дыхательные пути может вызывать воспаление или привести к обострению таких состояний, как бронхиальная астма или хроническая обструктивная болезнь легких (ХОБЛ), введение интраназальных вакцин людям обычно осуществляют таким образом, чтобы предотвратить непосредственное попадание антигена в легкие.
Липидный состав имеет решающее значение для стабильности мРНК вакцины, для прицельного воздействия иммунокомпетентных клеток и высвобождения мРНК в цитозоль. Таким образом, успешность применения интраназальных мРНК-вакцин в будущем, вероятно, будет зависеть от разработки липидных наночастиц, на которые смогут воздействовать соответствующие типы клеток в носовых ходах. В отличие от вирусов и вирусных векторов, на поверхности липидных наночастиц нет белков, и теоретически они не должны нейтрализоваться антителами. Благодаря этому, тот же состав, что и при первом введении, может быть применен для ревакцинации. Однако сохраняется вероятность развития побочных эффектов, таких как повышенная усталость и недомогание, часто связанных с введением вакцин на основе мРНК. Следовательно, при разработке интраназальных вакцин, содержащих мРНК, важно учитывать эти аспекты во избежание побочных эффектов и повышенной реактогенности.
В конечном счете, цель вакцинации — стимуляция иммунитета на длительное время. Однако продолжительность антительного ответа (по антителам сыворотки) значительно варьируется в зависимости от недостаточно изученных свойств антигенов, инициирующих иммунную реакцию [14]. Антительный ответ в слизистой оболочке считается краткосрочным, однако его фактическая продолжительность зависит от того, как часто иммунокомпетентные клетки встречают определенный антиген. Аналогично, циркулирующие Т-клетки иммунной памяти самообновляются и сохраняются на длительные периоды времени, тогда как популяция Т-клеток памяти, находящаяся в легких, исчезает относительно быстро: в большей степени это касается CD8+ Т-клеток, чем CD4+ Т-клеток. Таким образом, действие интраназальных вакцин должно вносить равновесие между функционированием местного иммунитета в дыхательных путях и длительностью системного иммунитета. Однако эффективные стратегии вакцинации не должны ограничиваться одним путем введения. Действительно, клетки памяти, стимулированные вакциной, введенной внутримышечно, могут быть доставлены внутрь слизистой путем интраназальной ревакцинации слизистой оболочки [15]. Таким образом, идеальная стратегия вакцинации может быть следующей:
Интраназально – прямо в цель
Интраназально – прямо в цель
Наиболее важной задачей современной медицины является повышение длительности жизни человека при условии сохранения высоких параметров физической и умственной работоспособности. Решение ее невозможно без существенного прогресса в лечении болезней нервной системы и, прежде всего, цереброваскулярных и дегенеративных поражений головного мозга, черепно-мозговой травмы и нейроинфекции.
При этом, несмотря на наличие в арсенале невролога многообразных лекарственных средств, успехи в терапии заболеваний центральной нервной системы не могут удовлетворить ни практического врача, ни больного человека. До сих пор имеет место непозволительно высокий уровень cмepтности и инвалидизации пациентов.
Одна из основных причин низкой эффективности фармакотерапии в клинике нервных болезней – проблема доставки лекарственных средств в область поражения головного мозга.
Выход – интраназальный путь введения лекарств
Теоретические и практические основы интраназального введения препаратов разpaбатываются уже более 20 лет. Было установлено, что при интраназальном применении лекарств большая их часть всасывается в кровь, меньшая – при помощи периневрального трaнcпорта по чувствительным нервам попадает непосредственно в мозг через нейроны обонятельного тракта и далее распространяется по структурам головного мозга при помощи механизмов, не связанных с кровотоком.
Особенно это важно при заболеваниях ЦНС сосудистого генеза: несмотря на наличие тромба стала возможна неинвазивная доставка препаратов с лечебной целью непосредственно к клеткам головного мозга, причем, не позднее 2-10 минут после введения.
Это позволяет рассматривать интраназальный путь введения лекарств в качестве своеобразного аналога внутримозгового введения препаратов у человека.
Интраназальное введение имеет ряд преимуществ:
Таким образом, возможность прямого поступления лекарств в мозг и непосредственно в зону поражения, минуя гематоэнцефалический барьер, открывает новые перспективы для эффективного лечения цереброваскулярных, нейродегенеративных заболеваний ЦНС и опухолей мозга.
Nota bene! Слизистая носа – это пограничная ткань с внешней средой, поэтому в ней расположены ферментные системы (более 20), препятствующие всасыванию ксенобиотиков. Лекарственные формы для интраназального применения разpaбатываются с учетом этого явления, а лекарственные вещества в них находящиеся подвергаются фармакокинетическим исследованиям, доказывающим наличие в тканях мозга их действующей концентрации.
Так например, Семакс – первый в мире пептидный препарат для лечения цереброваскулярных заболеваний головного мозга.
Из полости носа Семакс быстро проникает в мозг и начинает действовать уже через 2-5 минут после введения.
Причем эффекты от его действия даже при однократном применении сохраняются до 24 часов. Фармакокинетические исследования Семакса свидетельствуют, что в различных структурах мозга через 3 минуты после введения в нос его концентрация по отношению к концентрации в крови (взята за 1,0) составила: обонятельные луковицы – 9,3; средний мозг – 2,0; кора – 0,6; мозжечок – 1,1. Характер распределения Семакса в головном мозге четко указывает на его «входные ворота» в ЦНС – это обонятельные луковицы, куда препарат может трaнcпортироваться лишь по ходу обонятельных нервов. Причем, по способности проникать в мозговую ткань и по терапевтической эффективности интраназальный путь введения Семакса значительно эффективней внутривенного.
Интраназально – прямо в цель
Мы профессиональная комaнда, которая на рынке работает уже более 2 лет и специализируемся исключительно на лучших продуктах.
У нас лучший товар, который вы когда-либо пробовали!
ВНИМАНИЕ. В Телеграмм переходить только по ссылке, в поиске много фейков!
Введение препаратов интраназально — это как?
В настоящее время медики стали использовать новый метод введения лекарственного препарата — интраназальный(через нос).
Раньше такой способ также применялся, но только для введения противовоспалительных препаратов и исключительно для местного лечения ринита. На данном этапе развития в медицине начали более активно использовать именно интраназальный способ введения медикаментов для лечения многих болезней, в том числе — остеопороза, мигрени, конъюнктивитов, а также воспалительных процессов, протекающих в носоглотке. Кроме того, в данный момент применяется интраназальная вакцинация.
Форма выпуска
Интраназальное введение осуществляется при помощи спреев, которые могут выпускаться в виде баллончика с дозатором, содержащим сжатый воздух. Последним нововведением стал выпуск баллончика, снабженного активной помпой-пульверизатором. Подобная форма выпуска препарата очень удобна, ведь таким образом можно предельно точно контролировать дозировку. Помимо этого, лекарство полностью орошает слизистую оболочку носа, что позволяет добиться его максимального фармакологического действия. Все перечисленные доводы обусловливают тот факт, что спрей является наиболее предпочтительной формой интраназальных препаратов.
Ограничением по применению подобных спреев является возраст до 2 лет.
Форма выпуска препаратов, вводимых интраназально, не ограничивается лишь спреями и включает сюда мази и капли.
Выбор формы выпуска препарата зависит непосредственно от заболевания. В любом случае, данный вопрос необходимо обсудить с лечащим врачом.
Преимущества и недостатки
Из преимуществ можно отметить, что при помощи такого метода введения лекарственное вещество не участвует непосредственно в первичном метаболизме печени. Это происходит потому, что препарат вводится через носовую полость, которая обогащена кровеносными сосудами, благодаря чему необходимая доза препарата быстро поступает в кровь. Также из преимуществ стоит отметить, что это – довольно безопасный метод, ведь при интраназальном введении не травмируется слизистая оболочка в носовой полости.
Простота использования фармацевтического препарата – еще одно несомненное преимущество интраназального способа введения, что особенно актуально для категории пациентов, проходящих этап лечения в домашних условиях.
Недостатки
Препараты, которые могут вводиться интраназально
Интраназальный способ введения возможен при применении следующих групп препаратов:
Особенности интраназальной вакцинации
Одним из методов введения вакцин является интраназальный, или аэрозольный. Техника подобной вакцинации подразумевает распыление вакцины в носовых ходах при помощи специального устройства. Также в этих целях могут применяться капли. Медики считают, что данный способ позволяет создать иммунологический барьер на слизистых оболочках, повышая устойчивость организма к инфекциям, передающимся воздушно-капельным путем.
Тем не менее, такой способ имеет и недостатки. В частности, это недостаточность иммунитета для борьбы с инфекциями, которые уже проникли через слизистые оболочки верхних дыхательных путей. К недостаткам также относят существенный разлив препарата при непосредственной вакцинации.
Меры предосторожности
Несмотря на то, что препараты с интраназальным способом введения не требуют особых умений и дополнительных препаратов, нужно помнить, что само лекарственное средство может быть непереносимо для тех или иных пациентов. Например, многие препараты с данной формой выпуска рекомендуют использовать предельно осторожно тем лицам, которые предрасположены к аллергическим реакциям.
Само собой разумеется, что дозировка и длительность применения этих препаратов должна назначаться и контролироваться врачом.
Еще один немаловажный показатель – совместимость лекарственных средств. Часто возникают ситуации, когда показан одновременный прием различных по характеру фармацевтических продуктов. В таком случае необходимо проконсультироваться со специалистом и выяснить, не окажет ли такой прием нeблагоприятного воздействия на организм, сказавшись на работе органов и систем организма.
Руководство по интраназальному приёму
Интраназально (через нос) возможно принимать препараты, которые не выпускаются в форме капель или спреев. В статье предложен способ приготовления препаратов к удобному безопасному интраназальному приёму.
Во-первых, значительная экономия на препаратах, так как благодаря лучшему усвоению дозу можно снизить в несколько раз. Во-вторых, интраназально препараты могут действовать эффективнее привычных (перерального, сублингвального) методов приема. В-третьих, удобнее таскать с собой маленький флакон, чем колеса или порошок; не нужно искать, чем запить; не нужно скрывать от окружающих «средство от насморка». В-четвертых, нет раздражения стенок пищевода, желудка, кишечника и при этом может быть полезно для носоглотки.
Слизистая оболочка носа имеет сеть капилляров, через которую препарат всасывается в кровь. Именно эти сосуды лопаются, когда течет кровь из носа. Именно они набухают во время насморка и сужаются под действием капель от насморка, таких как Нафтизин.
Под языком тоже есть капилляры, но они в основном лимфатические, а через лимфу мало препарата попадает в кровь, поэтому сублингвальный способ менее эффективен.
Есть неподтверждённая теория о том, что препарат может попасть прямо в мозг через тройничные и обонятельные нервы полости носа.
Наша цель – избежать химического ожога слизистой носа препаратом. Ожог возникает от большого количества препарата в малом объеме, т.е. при высокой концентрации. Именно такая ситуация возникает если просто вдуть. А распределив умеренное количество препарата равномерно по объему растворителя, мы можем избежать ожога.
В качестве растворителей будем использовать то, что безопасно и даже полезно для носа.
Выбор растворителя зависит от свойств лиофильности препарата, т.е. способности распределяться по объему жидкости. Гидрофильные растворяются в воде, липофильные (олеофильные) – в растительном масле или животном жире и пытаются избежать контакта с водой (свойство гидрофобности).
Однако нет абсолютно липофильных веществ. Отношение P доли вещества, растворимых в масле, к доле, растворяемой в воде определяет коэффициент липофильности logP. Если вещество на 99.99% растворяется в воде, то logP
=-4, если вещество растворяется более чем на 50% в жире, то logP больше нуля, но всегда меньше единицы. Прамирацетам растворяется в жире на 85% и для него logP=0.75.
На практике из распространённых препаратов только прамирацетам и анирацетам липофильные. Но в общем случае, чтобы проверить факт липофильности, сделайте запрос в Яндексе следующего вида*:
(прамирацетам | pramiracetam | pramistar) && (жирорастворимый | n-octanol | fat soluble | oil | липофильность | олеофильность | lipophilicity | logp)
Где «прамирацетам | pramiracetam | pramistar» заменить на синонимы название вашего препарата.
Гидрофильные вещества обладают низкой биодоступностью (обычно не более 10%) и быстро выводятся из организма. В то время как, например, липофильное производное витамина B1 – бенфотиамин обладает более высокой биодоступностью, чем исходный тиамин. Вообще, по википедии, липофильность означает сродство к органическим веществам.
Вспомните, что когда вода попадает в нос, ощущения неприятные. При этом раствор поваренной соли NaCl с концентрацией 0.9% абсолютно не раздражает слизистую носа за счёт изотоничности плазме крови и называется физиологическим раствором (физраствором). В аптеке физраствор продается в основном только в ампулах и по рецепту, так что будем готовить его сами.
Для приготовления физраствора рекомендую брать питьевую воду из магазина, а не из под крана. Если из под крана, то необходимо как минимум профильтровать и прокипятить её.
Отмеряем необходимое количество соли (объём воды в мл * 0.009) и размешиваем в теплой воде. Если нет точных весов, то черпаем мерной ложкой из расчета насыпной плотности соли 1.2г на 1 куб.см. Кроме того, для смягчения воды можно добавить соду в соотношении сода: соль 1 к 10. Лично я отмеряю мерной кружкой 120мл воды, и добавляю 1куб.см смеси соль-сода 1 к 10. Еще лучше использовать аптечное средство «Долфин»: 30 пакетиков (там кроме соли и соды есть еще растительные экстракты полезные для носа) стоят около 250руб (1 пакетик на 240мл физраствора).
В качестве растворителя рекомендуется использовать растительные (не эфирные!) масла: персиковое, миндальное, абрикосовое, авокадо, оливковое масло. Персиковое масло рекомендуют капать в нос при насморке, так как оно укрепляет капилляры, снимает раздражение и снимает симптомы простуды; его мне посоветовал Вячеслав Лобач, как эффективное средство от насморка. Масло должно быть нерафинированное и холодного отжима.
В аптеке я нашел только косметические масла, которые предлагается использовать только для кожи или как основу для эфирных масел и запрещается для внутреннего приёма. Но я не заметил никаких негативных эффектов при закапывании в нос как персикового, так и миндального масла.
После выбора масла и удостоверения, что оно не вызывает аллергической реакции необходимо смешать его с физраствором (помним, что нет абсолютно липофильных веществ). Для равномерного распределения вещества по всему объему жидкости будем готовить эмульсию вода-масло, т.е. растворим масло в воде.
Для приготовления эмульсии используем лецитин в качестве эмульгатора (та самая пищевая добавка E322, она сама по себе очень полезна и является источником холина). В аптеке продаётся подсолнечный и соевый лецицин. Для приготовления 120мл эмульсии я использую около четверти чайной ложки лецитина. Важно, чтобы лецитин не был комочками, так что предварительно необходимо разбить комочки и засыпать его постепенно.
Итак, в теплый физраствор сыпем лецитин, а потом постепенно заливаем масло и всё это перемешиваем.
Соотношение масла и физраствора получается экспериментально. Я выяснил, что достаточно соотношения 1:9, чтобы получить эмульсию 10% жирности.
В качестве растворителя можно, конечно, использовать готовую эмульсию – молоко. Но оно быстро портится без холодильника и забивает нос. Но не смотря на то, что в молоке всего 2-3% жирности, оно отлично растворяет прамирацетам, по крайней мере делает его абсолютно не жгучим для носа. Сухое молоко использовать не рекомендую, так как оно не образует качественную эмульсию.
Вообще, готовить эмульсию необходимо не только при интраназальном приёме, но и при перopaльном тоже имеет смысл.
Добавляя активный препарат в растворитель, начинаем с небольших концентраций вещества и проверяем реакцию слизистой (сначала рта, а потому уже носа). Оценив степень жжения, увеличиваем или уменьшаем концентрацию и таким образом подбираем оптимальную. Крайне рекомендуется держать наготове средство для промывания носа (ранее уже упоминал про Долфин).
Следует заметить, что полное растворение может занять некоторое время и раствор может стать менее жгучим по прошествии этого времени.
Последним штрихом будет залитие приготовленного раствора во флакон-капельницу. Идеальный флакон должен удовлетворять следующим условиям:
* в него легко можно залить свой раствор (большинство флаконов выпускаются литыми!);
* флакон должен быть удобен для капания в нос;
* он должен быть компактным и в тоже время иметь достаточный объём;
* препарат, выпускаемый в этом флаконе достаточно дешевый.
Всем этим критериям удовлетворят флакон от Нафтизина производства ООО «Славянская косметика», имеющий объём 15мл, который стоит около 30 руб.
Желательно иметь препарат в форме чистого порошка. В таблетках и капсулах препарат обычно сочетается с неактивными вспомогательными веществами. Эти вспомогательные вещества могут плохо растворяться и забивать носик флакона, а также быть вредными для слизистой.
Оба препарата являются липофильными с коэффициентом липофильности 0.75 поэтому я их растворял в эмульсии 10% жирности. Эффект по началу был просто поразительным: все привычные эффекты, которые я испытывал в такой мере только при первых приёмах проявлялись с новой силой, несмотря на то что я до этого регулярно принимал их перopaльно с молоком. От анирацетама – креативность и ассоциативная память. От прамирацетама – сильно улучшаются когнитивные способности, производительность труда, иммунитет, терморегуляция, устойчивость к стрессу и так далее. Причем эффект достигается не за счет стимуляции; организм под прамирацетамом начинает работать сбалансированно и даже прекращается тахикардия (пульс в покое приходит в норму).
Однако срок годности такого средства не более суток. После этого срока эффект сильно уменьшается, так что каждый день необходимо растворять препарат заново. Легче всего сделать сразу много чистой эмульсии и растворять и заливать прамирацетам каждый день. Зато таким образом не составляет трудностей принимать прамирацетам регулярно в течение дня, поддерживая тем самым постоянную концентрацию в крови.
Концентрация – 0.3 куб.см. порошка каждого препарата на 15мл эмульсии. Такая концентрация вообще не жжет слизистую.
Скачусь и я до написания очередной статьи о глицине, как самого доступного ноотропа. Возможно, при интразальном приёме эффект от глицина могут заметить даже те, кто раньше считал его пустышкой. Глицин был моим первым ноотропом и действовал по началу очень заметно.
В аптеке сложно найти чистый глицин без вспомогательных веществ. Хотя думаю подойдет любой таблеточный глицин, но я пробовал только Глицин ВИС: в нем капсулы по 300мг глицина с витаминами группы B. Растворив в физрастворе содержимое капсулы, такое средство мне показалось более эффективным, чем если бы рассасывать его под языком.
Мелатонин, принятый интразально, действует очень быстро и заметно. Дозировку порекомендовать не могу ¬– мешал один раз и получился довольно жгучий раствор. Сложно подобрать дозировку без наличия весов.
Кроме вышеперечисленных я успешно пробовал интраназально следующие препараты:
* 5-HTP (улучшает настроение сон за счет повышения серотонина);
* уридин монофосфат (увеличивает дофамин, немного кратковременную память);
* AlphaGPC (самый биодоступный источник холина);
* колюрацетам (увеличивает ацетилхолин, так же как прамирацтем и имеет небольшой стимулирующий эффект, можно принимать даже не размешивая).
Из неудачно опыта могу пока отметить только фенибут, но возможно получится подобрать оптимальную концентрацию и для него.
По моему длительному опыту приёма ноотропных препаратов у меня создалось впечатление, что при приёме многих из них толерантность развивается не конкретно к веществу, а именно к способу приёма. Однозначно эта закономерность прослеживается для перopaльного и сублингвального способов приёма. Для интраназального еще рано говорить, но уже чувствуется развитие толерантности, либо это всего лишь психологическое привыкание.
Возможно оптимально будет чередование методов приёма или их совместное использование. При приеме прамирацетама одновременно и перopaльно, и интраназльна действительно чувствуется синергия – действие вместе больше суммы эффектов по отдельности. У меня в планах готовить эмульсии на основе льняного масла для перopaльного приёма прамирацетама совместно с интраназальным.
Хочу заметить, что в силу моих индивидуальных особенностей у меня повышенная чувствительность к препаратом и ко внешним факторам в целом (как к благоприятным, так и нeблагоприятным). Действие любого препарата на вас индивидуально.
В комментариях жду ваш опыт интраназального приёма препаратов, выбора и приготовления растворителей, оптимальные концентрации препаратов, и про удобные флаконы.
Сам постараюсь отписываться о новом опыте. В планах попробовать интраназально конкурсный микс. Если вам понравилась статья, подписывайтесь на мою страничку Вконтакте, там я публикую только уникальные личные материалы по теме ноотропов и саморазвития.
И последнее: содержимое статьи является лишь описанием опыта, а не прямым руководством к действию, не смотря на название. Ответственность за свои действия несёте только вы!
Примечания
* Тут используются операторы языка запросов, советую с ними ознакомиться здесь
Интраназальное — это какое введение лекарства? Интраназальные препараты
Существует множество различных способов введения лекарственного вещества в организм человека. Первыми на заре медицины применялись местные способы в виде аппликаций, растирок, компрессов и перopaльные, включающие в себя проглатывание ряда лекарственных форм или подъязычное рассасывание. С развитием медицины и технологии доставки действующего вещества до органа-мишени стали применяться более сложные способы.
Появились ректальные и вaгинальные суппозитории (свечи), многокомпонентные таблетки и капсулы, в том числе покрытые оболочкой, растворяемой либо желудочным соком, либо кишечными ферментами. Инъекционные способы: внутри- и подкожные, внутримышечные, внутривенные и внутриартериальные, внутрикостные. Препараты вводятся внутрь суставов и в полости органов.
Несмотря на довольно простой путь введения, эндотрахеальные и интраназальные препараты стали применяться относительно недавно. Конечно, капли в нос существовали уже при Гиппократе. Однако интраназальное — это как один из способов введения препарата для доставки к другим органам, а не средство против отёков при насморке, и стало применяться такое введение всего несколько десятков лет назад.
Группы интраназальных препаратов, оказывающих общее (системное) действие
Многочисленными исследованиями было выявлено, что борьба с насморком – это не единственная причина введения лекарственного средства в полость носа. Ряд препаратов, оказывающих системное действие, совершенно спокойно всасываются со слизистой носовых проходов и достигают своего непосредственного назначения.
Интраназальное введение возможно для:
Особенности интраназального введения препаратов
Довольно долго фармацевтические компании пытались решить две нерешаемые задачи в отношении применения лекарственных средств, имеющих белковую химическую структуру. Камнем преткновения явилось разрушение белково-пептидного компонента действующего вещества желудочным соком и кишечными ферментами при перopaльном приёме. Также проблемой стал феномен первого прохождения через печень – связывание активного комплекса и его выведение.
Решение было найдено в использовании инъекционного способа введения и ректальных суппозиториев. Однако первый путь отличается некоторой технической сложностью в сочетании с неприятными ощущениями. А второй оказался недостаточно эффективным из-за низкой всасываемости в конечных отделах прямой кишки. Решение пришло неожиданно. Оказалось, что интраназальное — это, как и инъекционное, такое введение, при котором достигается быстрое начало терапевтического эффекта. И при добавлении определённых сопутствующих веществ обеспечивается такая же высокая биодоступность, то есть необходимая концентрация действующего компонента в месте его применения.
Ещё одно полезное свойство интраназального введения проявилось в экстрацеллюлярном (минуя всасывание в кровь через слизистую) проникновении действующих веществ в головной мозг. Попадая на обонятельные зоны, лекарственный препарат доставляется по волокнам обонятельного и тройничного нервов.
Формы выпуска интраназальных препаратов
Для введения в полость носа используется достаточно ограниченное число фармакологических форм. В первую очередь это, конечно же, капли в нос. Возможно вдыхание порошков с мелкодисперсной структурой. Используется закладывание мазей. Различные растворы или отвары трав для промывания полостей носа к данной группе не относятся по причине короткой экспозиции на слизистой при их применении.
Основной формой выпуска интраназальных лекарственных средств, имеющих системное действие, являются назальные спреи. Они выпускаются в виде баллончиков-дозаторов со сжатым воздухом либо с активной помпой-пульверизатором. Благодаря определённому объёму выброса спрея при однократном нажатии, имеется возможность относительно контролируемой дозировки препарата.
Также при использовании спрея происходит равномерное орошение слизистой полости носа. Это способствует более полному всасыванию препарата, что повышает его фармакологическое действие.
Основные преимущества интраназального введения
На основании всего вышеизложенного, можно определить ключевые достоинства, которыми обладают интраназальные препараты. Лёгкость и простота введения, не требующая дополнительной технической оснащённости и специальной подготовки, как в случае с инъекционными способами, являются довольно значимыми со стороны их применения пациентом.
С позиций физиологии и фармакологии на первое место выступает возможность центрального действия на структуры головного мозга. Выраженный системный эффект, наступающий в короткие сроки, как при инъекционном способе введения, также имеет большое значение. Благодаря отсутствию феномена первого прохождения через печень, обеспечивается высокая биодоступность лекарства и незначительное количество связанных с ним нежелательных реакций.
Недостатки способа
С точки зрения системного эффекта основной проблемой является поддержание уровня терапевтической концентрации препарата в плазме крови. Средство быстро всасывается и достигает пикового действия за короткие сроки, поэтому интраназальное введение может применяться только для краткосрочной коррекции состояний. Пролонгированный эффект возможен только при введении препаратов, оказывающих действие на структуры головного мозга.
Кроме того, возможно развитие местных реакций на слизистой носа. Это связано с достаточно высокой концентрацией действующего вещества в составе спрея и содержанием дополнительных компонентов, обеспечивающих максимальное прохождение лекарства с поверхности слизистой в кровь.
Возможность всасывания из полости носа имеет достаточно ограниченное число лекарственных средств, обладающих необходимыми для этого физико-химическими свойствами. У пациента же повышенная концентрация действующего вещества приводит к значительным затратам на приобретение спрея.
Интраназальные иммуномодуляторы
В межсезонье или в условиях эпидемий простудных заболеваний для профилактики и лечения широко применяются препараты, повышающие общую и местную иммунную защиту организма.
С целью экстренной профилактики и защиты применяется интраназальный интерферон.
При многократных исследованиях выяснилось, что интраназальный путь введения иммуномодуляторов способствует не только препятствию проникновения вирусов-возбудителей через слизистую носа. Это также стимулирует работу собственных защитных сил – активацию выработки собственных интерферонов. Для стимуляции продукции эндогенного интерферона как средства поддерживающей терапии используется препарат «Анандин» интраназальный.
Интерферон человеческий
Препарат специфической иммунной защиты, имеющий активность по отношению к большинству возбудителей вирусных простуд, «Интерферон» выпускается в виде таблеток, инъекционных препаратов и порошков для приготовления капель. Для профилактики и лечения можно использовать любую форму выпуска. Но для обеспечения местной защиты предпочтительно интраназальное. Это, как невидимый барьер, будет препятствовать проникновению значительного количества вирусов в клетки слизистой оболочки полости носа. Это обеспечит более низкую заболеваемость в условиях эпидемии.
Иммуностимулятор «Анандин», капли глазные и интраназальные
Препарат получил широкое распространение благодаря практически полному отсутствию побочных эффектов, нежелательных реакций и хорошему иммуностимулирующему эффекту. В дополнение к этому, он обладает также выраженным ранозаживляющим свойством, что немаловажно при его применении в виде глазных капель при травме роговицы или конъюнктивы.
Противопоказания к применению имеет только вводимый внутримышечно «Анандин». Интраназальные капли разрешены в любом возрасте, при беременности, лактации и других физиологических состояниях или заболеваниях.
Если насморк аллергический
Нередко причиной зуда в носу, чихания и обильного отделения слизи становится не вирус, а антиген, приводящий к неспецифической иммунной реакции – аллергии. В комплексном лечении такой формы ринита часто применяются интраназальные кортикостероиды. Это особенно актуально для людей, страдающих сезонными формами аллергии – поллинозами.
В период цветения определённых растений таким пациентам бывает недостаточно применения только препаратов антигистаминной группы, которые в большинстве случаев обладают ещё и седативным эффектом. Это непозволительно при управлении автотрaнcпортом, работе с механизмами или в условиях максимальной умственной концентрации. Тогда и назначаются местные гормональные спреи, которые снимают проявление симптомов, не оказывая существенного влияния на общий гормональный фон.
Меры предосторожности
Несмотря на широкую доступность и лёгкую переносимость таких препаратов, важно помнить, что интраназальное — это, как и любое другое, лекарственное средство, которое должно применяться исключительно по назначению врача, в прописанной им дозировке, кратности и длительности приёма.
Часто возникают ситуации, когда вам необходимо принимать сразу несколько препаратов, отменить ни один из которых нельзя. Следовательно, потребуется выяснить, не окажут ли они при совмещении отрицательного влияния на организм. Инструкция по применению не может включать в себя все варианты развития аллергической реакции. Именно поэтому перед приёмом таких распространённых препаратов, как свечи, мази и спреи, стоит обязательно проконсультироваться у специалиста.