что означает линия ликвидус на диаграмме фазового равновесия двойных сплавов
Диаграммы состояния двойных сплавов. Диаграмма состояния –графическое изображение фазового состояния сплава в зависимости от температуры и концентрации компонентовв условиях равновесия.
Диаграмма состояния –графическое изображение фазового состояния сплава в зависимости от температуры и концентрации компонентовв условиях равновесия.
Закономерности сосуществования устойчивых фаз выражаются правилом фаз или законом Гибсса:
С = k – f + 2
где C— число степеней свободы системы, k – число компонентов в системе, f– число фаз в системе.
С = k – f + 1
Для случая кристаллизации чистого металла, когда металл находится в жидком состоянии, f=1 (одна фаза – жидкость), а число степеней свободы равно 1 (С =k – f + 1=1-1+1=1). В момент кристаллизацииf=2 (две фазы – твердая и жидкая), а С=k-f+1=1-2+1=0. Это означает, что две фазы находятся в равновесии при строго определенной температуре (температуре плавления), и она не может быть изменена до тех пор, пока не исчезнет одна из фаз.
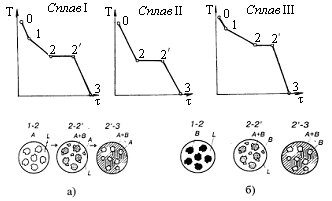
Для построения диаграммы состояния используют кривые охлаждения чистых компонентов (в общем случае А и В), и их сплавов различного состава, полученные методом термического анализа (рис.1.13). По кривым охлаждения определяют температуры фазовых превращений (перехода их жидкого состояния в жидкое с твердым, и потом в твердое состояние) – критические точки. На кривых охлаждения I и V чистых компонентов А и В имеется только по одной критической точке, т.к кристаллизация чистых металлов происходит при постоянной температуре.
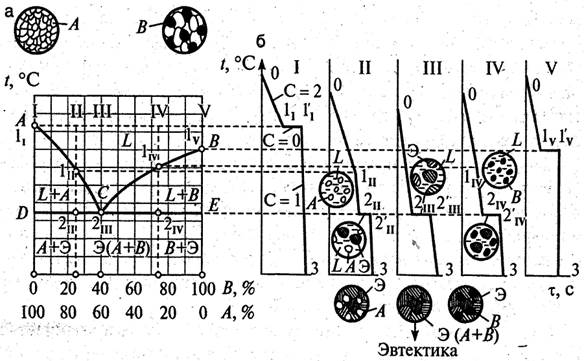
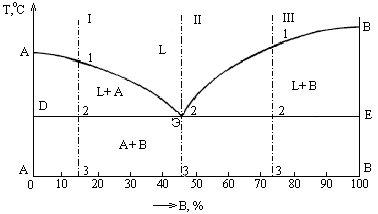
Рис.1.13. Диаграмма состояния I рода (а), кривые охлаждения сплавов I…V и схемы их структур (б): АСВ – ликвидус; DCE – солидус.
Такая диаграмма состояния (рис.1.13, а) называется диаграммой состояния I родаи соответствует сплавам которые нерастворимы в твердом состоянии, т.е. механическим смесям(рис.1.14, а).
Рис.1.14. Микроструктура механической смеси компонентов А и В.
Диаграммы состояния двойных сплавов
В процессе охлаждения (нагревания) или при изменении концентрации какого-либо компонента в сплавах происходят фазовые и структурные изменения. Эти изменения можно проследить с помощью диаграмм состояния, представляющих графическое изображение состояния сплавов в зависимости от температуры и концентрации. Фазовые диаграммы строятся для равновесного состояния с минимумом свободной энергии системы, которое достигается при достаточно медленном охлаждении (или нагревании), что на практике трудно реализовать. При быстром охлаждении (нагреве) система может остановиться на промежуточном (метастабильном) уровне. Структура неустойчива и при соответствующих условиях может вернуться в равновесное состояние. Диаграммы состояния позволяют прогнозировать фазовые и структурные изменения в сплавах и в метастабильном состоянии. Закономерности сосуществования равновесных фаз определяются правилом фаз:
где k – число компонентов, f – число фаз, c – число степеней свободы (вариантность системы), т. е. число внутренних и внешних факторов (температура, давление, концентрация), которые можно изменять без изменения количества фаз в системе. При c = 1 возможно изменение одного из факторов в некоторых пределах, без изменения числа фаз. При c = 0 внешние факторы нельзя изменить без изменения числа фаз. Если превращения происходят при постоянном давлении, то число переменных уменьшается, (единица учитывает изменение температуры):
Изменяя соотношение компонентов, получают сплавы, имеющие свою структуру и свойства, температуру плавления и затвердения.
Диаграмма состояния сплавов с полной нерастворимостью компонентов в твердом состоянии (диаграмма I рода)
Сначала получают термические кривые охлаждения сплавов. Соединив точки начала и конца кристаллизации сплавов (рис. 2.3), получают диаграмму состояния (рис. 2.4). Линия на диаграмме, выше которой сплавы находятся только в жидком состоянии, называется ликвидус – геометрическое место точек температур начала кристаллизации (Тн). Линия солидус – геометрическое место точек температур конца кристаллизации (Тк). Ниже сплавы находятся только в твердом состоянии. Строение сплавов механической смеси компонентов показано на рис. 2.5.



Чистые компоненты и эвтектический сплав Э кристаллизуются при постоянной температуре (точки О, P и C на диаграмме). Эвтектический сплав соответствует концентрации компонентов А и B в точке C. Механическая смесь двух кристаллов, одновременно кристаллизующихся из жидкости при самой низкой и постоянной температуре, называется эвтектикой: Э = А + B (рис. 2.5,б). Линия, на которой в сплавах образуется эвтектика, – линия эвтектического превращения.

Число фаз и их концентрацию в любой точке двухфазной области диаграммы можно определить, используя правило отрезков.
При охлаждении сплава I на линии CP (рис. 2.4) образуются кристаллы компонента В. Состав жидкости изменяется (обогащается компонентом А), достигая эвтектической концентрации на линии CN.
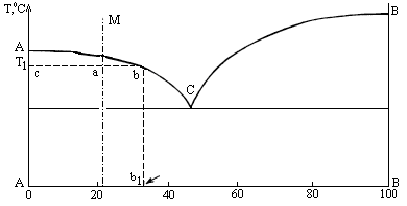
1. Чтобы определить процентное соотношение компонентов A и B в сплаве I в точке Е (рис. 2.4), необходимо через эту точку опустить перпендикуляр на основную ось концентраций. Проекция точки Е – точка Е1. Отрезок АВ определяет общее количество сплава (100 %), отрезок АЕ1 – количество компонента В (85 %), отрезок Е1В – количество компонента А (15 %). Сплав I в точке Е имеет двухфазную структуру: жидкая фаза Ж и кристаллы чистого компонента В.
2. Чтобы определить количество фаз в точке Е, необходимо через эту точку провести изотермическую линию (коноду). Первые точки пересечения конноды с линиями диаграммы (D и F) определяют присутствующие фазы. Количественная масса фаз обратно пропорциональна отрезкам проведенной конноды.
Общее количество сплава Q = Qж + Qтв определяется отрезком DF (принимается за 100 %). Количество твердой фазы Qтв 

Для проверки количественного соотношения фаз необходимо понизить температуру сплава. Точка Е опускается до точки Е ¢. Соотношение отрезков изменяется. Количество всего сплава определяет отрезок D¢F¢ (принимается за 100 %), количество твердой фазы – отрезок D¢Е¢ (55 %), жидкой – отрезок ЕF (45 %). В процессе кристаллизации количество твердой фазы увеличивается, жидкой – уменьшается.
3. Для определения состава фаз при температуре, соответствующей точке Е, из точек пересечения коноды с линиями диаграммы D и F опускаются перпендикуляры на основную ось концентраций.
Проекция точки D точка D1 покажет состав жидкой фазы Ж. Отрезок АВ – 100 %, отрезок АD1 – 70 % компонента В, отрезок D1B – 30 % компонента А. Состав жидкости: Ж = 70 % В + 30 % А.
Проекция точки F точка F1 покажет состав твердой фазы. Точка F1 на диаграмме совпадает с точкой В, которая соответствует чистому компоненту В – 100 %, при этом количество компонента А – 0 %. Состав твердой фазы сплава: 100 % В + 0 % А.
Для сплавов механических смесей компонентов характерна ликвация (химическая неоднородность). При медленном процессе кристаллизации в нижней части слитка преобладают кристаллы с большим удельным весом. Чтобы предотвратить ликвацию применяют ускоренное охлаждение слитка, механическое перемешивание, вибрацию и т. д. Примеры сплавов с полной нерастворимостью компонентов – Al–Si, Pb–Sb.
Диаграмма состояния сплавов с полной растворимостью компонентов в твердом состоянии (диаграммаII рода)
Количество компонентов k = 2 (химические элементы А, В). Число фаз f = 2 (кристаллы a-твердого раствора, жидкая фаза). Линия АаВ – ликвидус, АбВ – солидус.


Число фаз и их соотношение. Через выбранную точку (m) проводят изотерму (коноду) до пересечения с линиями диаграммы ликвидус и солидус. Состав жидкой (твердой) фаз определяется проекциями точек пересечения изотермы с линией ликвидус (солидус) на ось концентрации. Состав жидкой фазы изменяется по линии ликвидуса, твердой – по линии солидуса. С понижением температуры состав фаз изменяется в сторону уменьшения содержания компонента В и увеличения содержания компонента А.
Соотношение жидкой и твердой фаз. Количественная масса фаз обратно пропорциональна отрезкам проведенной коноды. Количество всего сплава (Q) определяет отрезок (pq),твердой фазы (Qтв) – отрезок (mp), прилегающий к линии ликвидус, жидкой (Qж) – отрезок (mq), прилегающий к линии солидус:
Q тв 

Неравновесная кристаллизация. Линия (Вn’nq’б’) на рис. 2.6 – линия неравновесного солидуса. При неравновесной кристаллизации, при температуре соответствующей точке n’,будут выделяться кристаллы a-твердого раствора. Состав твердой фазы будет соответствовать точке n’, лежащей на линии равновесного солидуса. При температуре, соответствующей точке n,концентрациякристаллов a-твердого раствора отличается от равновесной. В сплаве содержится некоторое количество жидкой фазы: Q¢ж 

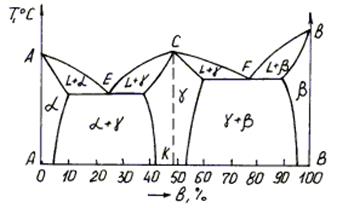
Диаграмма состояния сплавов с эвтектическим превращением встречается в составе сложных диаграмм распространенных промышленных сплавов (Fe–C, Al–Cu).
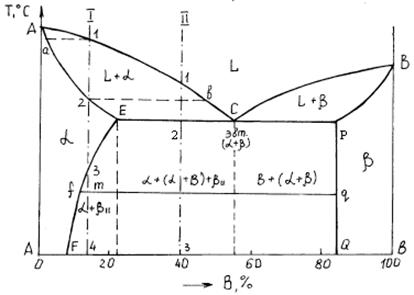
Количество компонентов k = 2 (А и B). Число фаз f = 3: жидкая фаза и кристаллы a- и b-твердых растворов. Линии и точки диаграммы. Линия ликвидус – GCH, солидус – GEDH. Точки E и N указывают предельную постоянную растворимость a-твердого раствора, точки D и F – предельную переменную растворимость b-раствора.
Сплавы системы
Компоненты А и B образуют твердые растворы слева от линии EN (a-раствор) и справа от линии DF (b-раствор). Процесс аналогичен тому, который происходит в сплавах с диаграммой состояния II рода.
Выше линии солидус в областях диаграммы GEC и CDH все сплавы имеют двухфазную структуру: (a+Ж) и (b+Ж).
Точка С – эвтектическая точка. Линия EСD – линия, в пределах которой протекает эвтектическое превращение аналогично тому, как это имеет место на диаграммах состояния I рода. Отличие в том, что в данном случае эвтектика состоит механической смеси a- и b-твердых растворов, а не механической смеси кристаллов А и B.
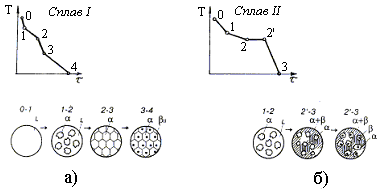
Кристаллизация доэвтектических сплавов (между точками С и Е) начинается с выделения кристаллов a-твердого раствора и заканчивается эвтектической реакцией: a+Ж®a+Э(a+b).

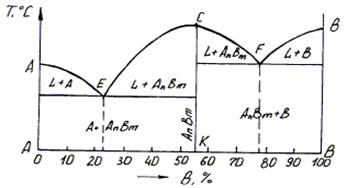
Диаграмма состояния сплавов с устойчивым химическим соединением компонентов (диаграмма IV рода).
Компоненты сплава при определенном соотношении вступают в реакцию и образуют химическое соединение типа АmBn с собственной кристаллической решеткой (рис. 2.9). На диаграмме появляется вертикальная линия. Точка С соответствует температуре плавления химического соединения. Если АmBn обозначить как компонент С, то вертикальная линия разбивает диаграмму на две части. Левая часть – диаграмма с полной нерастворимостью компонентов, правая – с ограниченной растворимостью компонента С в решетке В, в которой b-фаза является твердым раствором химического соединения в решетке компонента В.
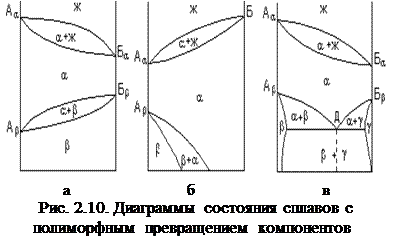
На рис. 2.10,а показана диаграмма состояния, когда оба компонента обладают полиморфизмом. Компонент А кристаллизуется с образованием a-решетки при температуре Аa, которая при температуре Аb меняется на b-решетку. Аналогичное превращение происходит с компонентом В. На рис. 2.10,б приведена диаграмма состояния для сплава, в которой только компонент А обладает полиморфизмом.
Низкотемпературные фазы на диаграммах выделяются из твердого раствора, но закономерности формирования структуры сплава те же, что и при кристаллизации из жидкости. Зародыши новой фазы образуются и растут до полного завершения фазового превращения. Механическая смесь, состоящая из одновременно выделяющихся из a-твердого раствора в точке Д кристаллов b- и g-твердых растворов (рис. 2.10,в), называется эвтектоидом.
Правила Курнакова Н.С. Если известны свойства чистых компонентов и вид диаграммы состояния для этой системы сплавов, то можно предсказать свойства любого сплава данной системы (см. рис. 2.11).
1. В твердых растворах с неограниченной растворимостью свойства сплавов изменяются по криволинейной зависимости. Механические и электрические свойства будут значительно отличаться от свойств чистых компонентов.








3. В твердых растворах с ограниченной растворимостью в интервале концентраций, отвечающих однофазным твердым растворам, свойства изменяются по криволинейному закону, в двухфазной области – по линейному закону. Крайние точки отражают свойства чистых фаз, предельно насыщенных твердых растворов, образующих данную смесь.
4. При образовании химических соединений точка концентрации компонентов соответствующих химическому соединению отвечает максимуму на кривой.
ДИАГРАММЫ ФАЗОВОГО РАВНОВЕСИЯ СПЛАВОВ



4.1. Правило фаз и общие сведения о построении
Свойства сплавов зависят от состава и концентрации компонентов, типа их соединений, а также от температуры, при которой находится данный сплав. Взаимосвязь этих факторов описывается с помощью диаграмм состояния сплавов или диаграмм фазового равновесия.
По диаграмме состояния сплавов можно представить полную картину формирования структуры любого сплава, определять пригодность того или иного сплава для изготовления деталей различными методами обработки, определять режим термообработки. Экспериментальное построение диаграмм состояния основано на изменении физико-химических свойств при любом фазовом превращении в сплавах.
Диаграмма состояния сплавов отображает устойчивые фазовые состояния, которым соответствуют минимальные значения свободной энергии. Поэтому диаграммы состояния называют диаграммами равновесия. Общие закономерности существования устойчивых фаз, отвечающих условиям равновесия, выражают в математической форме, называемой правилом фаз, или законом Гиббса
Под числом степеней свободы (вариантностью системы) понимают число внешних (температура, давление) и внутренних (концентрация фаз) факторов, которые можно изменять без изменения числа фаз в системе. Независимыми переменными в уравнении правила фаз являются концентрация сплава, температура, давление.
Давление мало влияет на фазовое равновесие сплавов в жидком и твердом состоянии, за исключением очень высокого. Поэтому диаграммы состояния сплавов строят обычно при постоянном атмосферном давлении, и правило фаз тогда принимает следующий вид
Если в двойной системе насчитывают более трех фаз, то это значит, что сплав не находится в равновесном состоянии или неправильно определено число фаз или компонентов.
Если в сплаве с определенным числом компонентов в условии равновесия находится максимальное число фаз, то число степеней свободы системы равно нулю (нонвариантная система). При нонвариантном равновесии определенное число фаз в сплаве может существовать только при строго определенных условиях: постоянная температура, постоянный состав всех фаз в сплаве.
Если число степеней свободы равно единице (моновариантная система), то это значит, что можно изменять один из факторов в некоторых пределах без изменения числа фаз в системе.
Диаграммы состояния показывают изменение фазового состояния сплава в зависимости от концентрации и температуры при постоянном давлении, т.к. последнее мало влияет на равновесие сплавов в жидком и твердом состоянии, за исключением очень высокого.
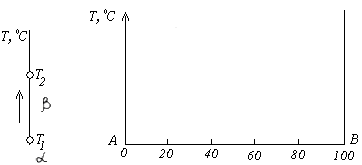
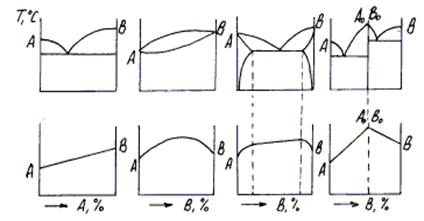
Если система однокомпонентна, то диаграмма имеет одно измерение по температуре, а определенные точки на прямой линии покажут изменение агрегатного состояния при равновесной температуре.
Если система двухкомпонентная, то по оси абсцисс откладывают концентрации компонентов А и В, а по оси ординат температуру. Крайние точки по оси абсцисс на диаграмме соответствуют чистым компонентам А и В, а общее содержание компонентов в любой точке составляет 100 % (рис. 4.1).
Диаграммы состояния сплавов с тремя и больше компонентами имеют более сложный пространственный вид, т.к. они должны иметь две и больше концентрационные зависимости.
Экспериментальное построение диаграмм основано на изменении физико-механических свойств сплавов (коэффициент термического (объемного) или линейного расширения, электросопротивление и др.) при фазовых превращениях. Переход сплава из жидкого состояния в твердое состояние связан со значительным выделением теплоты.
Для экспериментального построения двухкомпонентных диаграмм состояния изготовляют ряд образцов с различным содержанием компонентов А и В и для каждого сплава экспериментально определяют критические температуры точки фазовых превращений. Соединяя критические точки получают линии диаграммы состояния.
Рис. 4.1. Координаты для изображения состояния однокомпонентной (а) и двухкомпонентной системы (б)
На рис. 4.2 показана схема построения простейшей диаграммы состояния сплава с учетом кривых охлаждения сплава (а) во временной зависимости ( 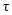
Рис. 4.2. Схема построения диаграммы состояния
4.2. Диаграмма состояния сплавов из компонентов,
образующих механическую смесь (I рода)
Общий вид диаграммы состояния изображен на рис. 4.3; кривая охлаждения при кристаллизации сплавов и схематическое изображение структур сплава при различном содержании компонентов А и В представлено на рис. 4.4.
Оба компонента в жидком состоянии неограниченно растворимы и образуют жидкую фазу. При охлаждении ниже линии АС из жидкости выпадают кристаллы А и смесь состоит из двух фаз L + А, ниже линии СВ из жидкости выпадают кристаллы В и сплав состоит из 2-х фаз (L + В).
На рис. 4.3 приведены три линии I, II, III, изображающих сплавы с различным содержанием компонентов А и В. Кривые охлаждения для этих сплавов будут иметь вид, изображенный на рис. 4.4 (I, II, III) соответственно. На этом рисунке участки 0-1 соответствуют охлаждению жидкого расплава; участки 1-2 соответствуют началу кристаллизации, в результате которой из жидкости непрерывно выделяются отдельно кристаллы А и В ( рис. 4.4 а, в) и кристаллизация протекает при переменной температуре. При этом оставшаяся жидкая фаза обогащается компонентами В и А (ниже кривой АС компонентом В, а ниже кривой СВ компонентом А).
Рис. 4.3. Диаграмма состояния сплавов, образующих механическую смесь (схема)
Рис. 4.4. Кривые охлаждения сплавов и структура сплавов: а) – доэвтектическог; б) – заэвтектического
При концентрации сплава, соответствующему линии II (рис. 4.4, б) происходит совместное одновременное выделение кристаллов из жидкого расплава, представляющих из себя механическую смесь кристаллов (компонентов А и В).
Механическая смесь различных видов кристаллов (двух и более), кристаллизующихся одновременно из жидкого расплава называется эвтектикой (т.е. легко плавящейся). Структура эвтектики зависит от вида компонентов, входящих в сплав и кристаллизация ее происходит при строго определенной концентрации компонентов и температуре. На рис. 4.3 температура сплава, соответствующая линии ДЕ носит название температуры эвтектики.
Для определения концентрации фаз и их количества в любой точке диаграммы, когда в сплаве существуют одновременно две фазы, применяют правило отрезков, или правило рычага (рис. 4.5).
Рис. 4.5. Диаграмма состояния, иллюстрирующая применение правила отрезков
Для определения массового или объемного количества твердой фазы (или жидкой) необходимо вычислить отношение длины отрезка, примыкающего к жидкой фазе (или твердой) к длине всей коноды. Отношение количества фаз, находящихся в равновесии, обратно пропорционально длине указанных отрезков коноды. Исходя из этого, абсолютное количество твердой Qтв.а и жидкой Qж.a фаз в точке а будет равно
Количественное соотношение масс в точке а будет равно
4.3. Диаграмма состояния сплавов, образующих неограниченные твердые растворы (ІІ рода)
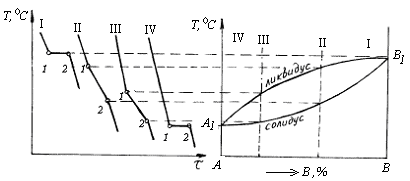
По этой диаграмме состояния кристаллизуются сплавы из компонентов А и В, обладающих полной взаимной растворимостью в жидком и твердом состоянии и не образующих химических соединений. На рис. 4.6 представлена диаграмма, кривые охлаждения и схематическое изображение структуры сплава в различном температурном интервале Полная взаимная растворимость в твердом состоянии возможна в том случае, когда компоненты А и В имеют одинаковые кристаллические решетки и атомные диаметры мало отличаются друг от друга.
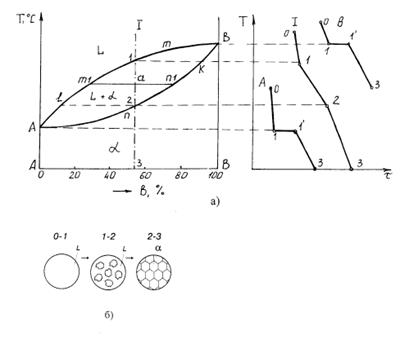
Диаграмма состояния состоит из 3-х областей: жидкости L, жидкости и твердого раствора L + a и твердого раствора a. Линия А m В является началом кристаллизации (линия ликвидуса), линия А n В-конец кристаллизации (линия солидуса) сплава.
После полной кристаллизации чистых компонентов А и В, тогда f = 1, температура будет равномерно понижаться (линия 1-3).
Рассмотрим процесс кристаллизации сплава, соответствующего составу I. При охлаждении сплава температура будет равномерно понижаться до точки 1, что соответствует линии 0-1 на кривой охлаждения сплава I ( рис. 4.6, б). При температуре, соответствующей т. 1 начинается процесс кристаллизации и на кривой охлаждения отмечается перегиб (линия 1-2), что связано с уменьшением скорости охлаждения сплава, обусловленного выделением скрытой теплоты кристаллизации. Между точками 1 и 2 сплав находится в двухфазном состоянии (L+a).
В процессе кристаллизации сплава при определенной концентрации компонентов А и В изменяется не только состав фаз, но и количественное соотношение жидкой и твердой фаз при любой температуре, лежащей между линиями ликвидус и солидус.
Во всем интервале кристаллизации из жидкого сплава при любой концентрации компонентов А и В при температуре, соответствующей началу кристаллизации, выделяются кристаллы обогащенные более тугоплавким компонентом В. Состав этих кристаллов определяется проекцией точки k. К концу кристаллизации(т. 2) состав жидкой фазы будет соответствовать проекции точки 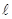
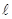
Если процесс кристаллизации протекает в условиях ускоренного охлаждения, что имеет место в реальных условиях получения литых деталей и слитков, то диффузионное выравнивание состава у кристаллов не успевает происходить, в результате чего наблюдается неодинаковый состав, не только у отдельных кристаллов, но и в каждом из них. Внутренние участки кристаллов будут обогащены боле тугоплавким компонентом В, а наружные компонентом А. Это явление неоднородности состава кристаллов называют внутрикристаллитной или дендритной ликвацией. Ликвация уменьшается в процессе диффузионного отжига. По рассмотренной диаграмме состояния кристаллизуются сплавы систем Cu-Ni, Cu-Ag, Ag-Au, Ni-Au, Fe-V и др.
4.4. Диаграмма состояния сплавов с ограниченной
растворимостью в твердом состоянии (III рода)
В зависимости от того, какая реакция протекает при одновременном существовании 3-х фаз, различают два типа диаграмм состояния: диаграмма с эвтектическим превращением и диаграмма с перитектическим превращением.
4.4.1. Диаграмма состояния с эвтектикой
Диаграмма состояния с эвтектическим превращением представлена на рис. 4.7.
Рассмотрим процесс кристаллизации сплава для двух характерных концентраций компонентов А и В, соответствующих прямым I и II. Кривые охлаждения и схемы структур при разных температурах и концентрациях изображены на рис. 4.8. При температуре, соответствующей точке 1 (концентрация сплава I), начинается процесс кристаллизации и из жидкости L выделяются кристаллы a, концентрация которых изменятся по кривой а-2, находящейся на линии солидус АE, а состав жидкой фазы по кривой 1-b, находящейся на линии ликвидус АС. В точке 2 процесс кристаллизации заканчивается, при этом концентрация a-раствора соответствует концентрации жидкой фазы L, находящейся выше точки 1.
Рис. 4.7. Диаграмма состояния с эвтектикой
На кривой охлаждения в т. 1 и 2 наблюдаются перегибы (рис. 4.7, а), идентичные перегибам при кристаллизации сплавов с неограниченной растворимостью (рис. 4.5, б). Кристаллы a-раствора не изменяют своего состава до температуры, соответствующей точке 3, лежащей на линии предельной растворимости EF. Ниже точки 3 a-твердый раствор является перенасыщенным, поэтому из него выпадают кристаллы b, выделяющиеся из твердого раствора.
a = mq/fq; b = fm/fq. (4.5)
Рис. 4.8. Кривые охлаждения и схемы структур
Кривые охлаждения сплава концентрации I и структура сплава, соответствующая различным температурам кристаллизации изображена на рис. 4.8, а.
При кристаллизации сплава концентрации II ниже точки 1 процесс образования твердой фазы a происходит в интервале температур, как и в предыдущем случае, так как система моновариантна (с = 2-2+1 = 1). Но при достижении температуры эвтектики, соответствующей линии ЕСР из жидкой фазы L одновременно выделяются твердые растворы aЕ и bP с образованием эвтектики
Кристаллизация сплавов, концентрации которых расположены правее точки С на диаграмме (заэвтектические сплавы), подобна процессу кристаллизации сплавов, расположенных левее точки С (доэвтектические сплавы). Для заэвтектических сплавов кристаллизация сопровождается выделением из жидкой фазы твердого раствора компонента А в В, т.е. b-растворов. При охлаждении сплавов ниже линии СР не будет наблюдаться выделение вторичных кристаллов из b-растворов, так как на диаграмме предельная растворимость компонента В в А, определяемая линией PQ, не изменяется. На рис. 4.7, а, б показаны структуры сплавов при различных температурах и составах. Но несмотря на многообразие структурных составляющих охлажденный сплав будет состоять из двух фаз: a и b. По рассмотренной диаграмме состояния кристаллизуются сплавы Pb-Sn, Mg-Cu, Al-Cu и др.
4.4.2. Диаграмма с перитектикой
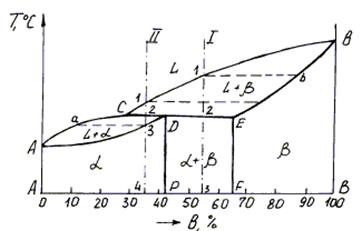
Диаграмма состояния сплавов, образующих ограниченные твердые растворы и перитектику изображена на рис. 4.9.
Рис. 4.9. Диаграмма состояния с перитектикой
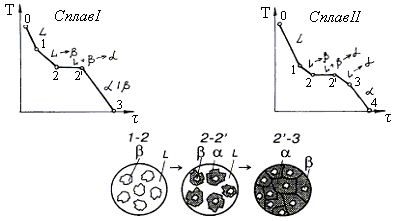
Рассмотрим процесс перитектического превращения сплавов, соответствующих концентрациям компонентов I и II. На рис. 4.10 представлены кривые охлаждения и структуры сплавов после окончания перитектической реакции. При охлаждении сплава I от точки 1 до точки 2 из жидкого сплава L выпадают кристаллы b-сплава.
Рис. 4.10. Кривые охлаждения и схема структуры сплава (I) после перитектического превращения
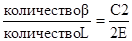
Чем ближе концентрация сплава I будет расположена к точке D, тем меньше в перитектической реакции остается избыточных b-кристаллов. После окончания процесса кристаллизации структура сплава состоит из перитектической смеси твердых растворов a и b, предельная концентрация которых соответствует точкам P и F (для простоты кривые предельной растворимости DP и ЕF даны вертикальными линиями относительно концентрации компонентов А и В).
Процесс кристаллизации сплава II начинается в точке 1 с выделения из жидкой фазы b-раствора. В этом сплаве при температуре перитектической реакции имеет место избыток жидкой фазы в отличие от сплава I, где наблюдается избыток твердой фазы b. Поэтому процесс кристаллизации этого сплава не заканчивается, так как наряду с вновь образовавшейся твердой фазой a сохраняется жидкая фаза L. В интервале 2′-3 из оставшейся жидкой фазы выделяются кристаллы a-фазы.
Концентрация жидкости изменяется по линии С-а, а концентрация кристаллов a-фазы по линии Д-3. Ниже линии DA сплав II состоит из кристаллов a-твердого раствора. Перитектическое превращение наблюдается в конструкционных сплавах на основе меди (Cu-Zn, Cu-Sn), железа (Fe-C) и др.
4.5. Диаграмма состояния сплавов, образующих
химические соединения (IV рода)
Химические соединения характеризуются определенным соотношением компонентов, входящих в сплав. Различают устойчивые химические соединения и неустойчивые. К устойчивым химическим соединениям относят сплавы, которые нагреваются до расплавления без разложения. К неустойчивым химическим соединениям относятся сплавы, которые при нагреве до температуры расплавления разлагаются. Возможно образование сплавов с одним устойчивым химическим соединением, а также сплавов с несколькими химическими соединениями между двумя компонентами.
На рис. 4.11 изображена диаграмма состояния сплава с одним устойчивым химическим соединением между компонентами А и В; чистые компоненты не образуют твердых растворов.
Линия СК на диаграмме обозначает концентрацию сплава, образующего устойчивое химическое соединение АnВm, при этом точка С соответствует температуре плавления этого химического соединения.
Рис. 4.11. Диаграмма состояния сплавов с одним устойчивым химическим соединением
Мы рассмотрели диаграмму состояния с устойчивым химическим соединением, когда компоненты А и В не образуют твердых растворов. Если компоненты с устойчивым химическим соединением образуют ограниченные твердые растворы и растворы на базе химического соединения, то диаграмма состояния будет состоять как бы из двух диаграмм, подобными сплавам с ограниченной растворимостью в твердом состоянии ( рис. 4.12) и образованием эвтектики.
Рис. 4.12. Диаграмма состояния с твердым раствором на базе химического соединения
Химические соединения наблюдаются в сплавах систем Mg-Cu, Fe-Zr, Fe-Nb, Al-Cu, при образовании карбидов, нитридов (WC, TiC, TaN).
4.6. Связь между диаграммами состояния и свойствами сплавов
При рассмотрении диаграмм состояния видно, что структура сплавов закономерно определяется характером взаимоотношений между компонентами и эта закономерность определяется фазовым составом. Свойства сплавов будут также зависеть от фазового состава, которые образуют компоненты. Академиком Н.С. Курнаковым был установлен важный принцип связи фазового состава и свойств: в каждой системе сплавов свойства изменяются закономерно с изменением состава, характер этой закономерности определяется структурой сплавов (видом фазовой диаграммы). На рис. 4.13 изображены рассмотренные нами четыре основные фазовые диаграммы и основные закономерности изменения различных свойств. В нижней части рисунка, показывающей зависимость свойств от состава, на ординатах откладывают или показатели свойств, или обратные им значения.
В сплавах, образующих механические смеси (рис. 4.13, а)), свойства изменяются по линейному закону (аддитивно) с изменением концентрации компонентов, так как зерна каждой фазы сохраняют в сплаве присущим им свойства. Сплавы обладают высокими литейными свойствами, лучшими в области эвтектики и хорошими антифрикционными свойствами, хорошо обрабатываются резанием. Сплавы могут обладать высокой прочностью, но имеют низкую пластичность. В этих сплавах нельзя получить промежуточные значения параметров, например удельное сопротивление, механическую прочность, более высоких или более низких, чем у исходных компонентов.
В сплавах с неограниченной растворимостью в твердом состоянии (рис. 4.13, б)) свойства изменяются по плавной кривой линии, что связано с искажениями кристаллической решетки растворителя. Промежуточные показатели свойств сплавов могут быть выше, чем свойства отдельных компонентов. Так, например, в системе Cu-Ni удельное сопротивление сплава может в 7 раз превышать удельное сопротивление никеля и в 30 раз удельное сопротивление меди. Однофазные твердые растворы имеют также более высокие значения прочности на разрыв и твердости, чем металлы, входящие в сплав, и сохраняют высокую пластичность. Поэтому сплавы хорошо обрабатываются давлением (штамповкой, ковкой, прокаткой), но плохо резанием из-за высокой вязкости и имеют низкие литейные свойства.
Рис. 4.13. Связь между диаграммами состояний сплавов и их свойствами
При образовании химического соединения свойства сплава изменяются по прямым линиям, пересекающимся в точке (сингулярная точка), соответствующей концентрации чисто химического соединения (рис. 4.13, г)). Характерной особенностью сплавов, образующих химические соединения, является большая твердость и прочность, высокое удельное электрическое сопротивление, но эти сплавы обладают повышенной хрупкостью, малой способностью к пластическому деформированию. По такой диаграмме кристаллизуются, например карбиды, нитриды (WC, TiC, TaN), которые обладают очень высокой твердостью, и нашли широкое применение при изготовлении металлокерамических твердых сплавов.
Вопросы для самопроверки
1. Напишите выражение правила фаз и определите, какие системы называются нонвариантными и какие моновариантными?
2. Что такое эвтектика? Опишите процесс кристаллизации в точке эвтектики.
3. Используя правило рычага, определите число фаз и фазовый состав сплавов, кристаллизующихся по фазовой диаграмме II рода.
4. Приведите фазовую диаграмму сплава Pb-Sn и опишите процесс кристаллизации сплавов.
5. В чем заключается перитектическое превращение при кристаллизации? Приведите примеры сплавов с перитектическим превращением.