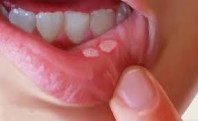
что означает выявление антител к неструктурным белкам вируса ящура
В ФГБУ «ВНИИЗЖ» разработана новая диагностическая тест-система – «Набор для обнаружения антител к неструктурным белкам вируса ящура иммуноферментным методом в сыворотках крови крупного и мелкого рогатого скота «Ящур НСП-ИФА»
В ФГБУ «ВНИИЗЖ» разработана новая диагностическая тест-система – «Набор для обнаружения антител к неструктурным белкам вируса ящура иммуноферментным методом в сыворотках крови крупного и мелкого рогатого скота «Ящур НСП-ИФА»
Сотрудниками референтной лаборатории по особо опасным болезням подведомственного Россельхознадзору «Федеральный центр охраны здоровья животных» разработана новая диагностическая тест-система – «Набор для обнаружения антител к неструктурным белкам вируса ящура иммуноферментным методом в сыворотках крови крупного и мелкого рогатого скота «Ящур НСП-ИФА».
Тестирование на наличие антител к неструктурным белкам вируса ящура позволяет дифференцировать вакцинированных и инфицированных животных (DIVA-тест), так как такие антитела образуются у всех особей, инфицированных вирусом, но не должны выявляться у вакцинированных животных (при условии соответствия вакцин требованиям МЭБ).
— усовершенствован протокол реакции с целью его максимального удобства для потребителя;
— подобраны условия, обеспечивающие сохранность всех компонентов набора при +40С в течение гарантийного срока;
— проведена валидация набора;
— оформлен комплект научно-технической документации на набор (инструкция по применению тест-системы, стандарт организации (СТО) на тест-систему и др.).
В ходе валидации набора было установлено, что его диагностическая специфичность составляет 99,4%, а чувствительность относительно импортного аналога PrioCHEK FMDV NS (ThermoFisher) равна 98,2%.
Набор рассчитан на исследование 192 образцов (включая контроли). Цена набора составляет 12000 рублей, включая НДС. Таким образом, стоимость исследования 1 пробы с применением набора ФГБУ «ВНИИЗЖ» в несколько раз меньше, чем при использовании импортных аналогов.
Набор «Ящур НСП-ИФА» дополняет линейку коммерческих тест-систем для диагностики ящура, разработанную в ФГБУ «ВНИИЗЖ».
Что такое ящур и чем он опасен.
По данным Международного эпизоотического бюро в последние годы отмечается ухудшение эпизоотической ситуации по ящуру в мире. Крупные вспышки ящура были зарегистрированы в Монголии, Северной и Южной Корее, Японии, Тайване, Афганистане, Индии, Китае, Киргизии, Таджикистане, Казахстане, Турции. Имеется тенденция к осложнению эпизоотической ситуации на территории Российской Федерации. Наиболее подвержены инфекции молодые парнокопытные сельскохозяйственные животные (крупный рогатый скот, свиньи, козы, овцы, олени). Животноводству ящур наносит большой экономический ущерб. За считанные часы от одного больного животного могут заразиться сотни. Больные животные подлежат уничтожению.
Я́щур (рыльно-копытная болезнь, афтозная лихорадка, эпизоотический стоматит) (Aphtae epizooticae)— острое вирусное высококонтагиозное заболевание из группы зоонозов (инфекционных болезней животных). Возбудитель ящура — фильтрующийся ультрамикроскопический вирус, относится к семейству Picornoviridae и является одним из наиболее мелких РНК-содержащих вирусов. Этот возбудитель инфекции характеризуется высокой изменчивостью и устойчивостью во внешней среде.
История изучения. Первое сообщение о заболевании животных ящуром сделано в Италии в 1546 году венецианским врачом Фракасторо. Впервые информация научного характера о ящуре у людей была опубликована в Норвегии в 1764 году Сагаром, который наблюдал более 1500 случаев ящура (афтозной ящурной лихорадки). В 1897 г. Ф. Леффлер и П. Фрош доказали вирусную природу возбудителя, они установили, что жидкость ящурных пузырьков проходит через бактериальные фильтры, сохраняя свою вирулентность.
Название болезни, по-видимому, русского происхождения, заимствованное из местного говора. Один из ведущих отечественных специалистов по ящуру профессор А.Л. Скоморохов в своей монографии «Ящур» (1952 г.) сообщает, что в отечественной литературе, начиная с первой половины XIX века, это заболевание описывается под названием «ящерокопытной» или «ящурокопытной» болезни скота. В Толковом словаре В.И. Даля (1882 г.) указывается: «Ящеръ — шероховатое воспаление языка у скота, трещины по языку». И далее: «Ящеръ — шероховатая кожа, кожа, обделанная сыпью». В переводе с английского название болезни звучит как «поражение конечностей и ротовой полости», с немецкого — как «поражение рта (морды) и копыт». В связи с этим в дореволюционной литературе нередко ящур назывался «рыльно-копытной болезнью».
Основным источником и резервуаром вируса являются домашние и дикие копытные животные. Выделение возбудителя больными животными происходит с мочой, слюной, испражнениями, молоком. А несоблюдение правил личной гигиены при контакте с заболевшими животными может явиться причиной заражения людей.
Большое значение в распространении вируса ящура имеет человек, так как он чаще всего соприкасается с животными и может перемещаться на большие расстояния. Механически переносится вирус ящура с транспортом, птицей и другими видами невосприимчивых животных (в том числе и дикими), а также насекомыми и клещами.
Основной путь передачи ящура контактно-бытовой, инфицирование человека происходит при попадании вируса на поврежденную кожу или слизистую оболочку. Заражение может произойти при контакте с фуражом и различными предметами ухода за животными, а также при употреблении в пищу сырого молока и плохо прожаренного мяса от больных животных.
Инфекция не передается от человека к человеку.
Профилактика. За счёт высокой контагиозности и устойчивости во внешней среде вирус не теряет своей актуальности и по сей день. Для предупреждения распространения ящура среди людей необходимо ликвидировать его среди животных, что достигается установлением строгих карантинных мероприятий (ограждения, дезинфекция транспорта, выезжающего за пределы очага, и т. д.). Лица, соприкасающиеся с больными животными, должны соблюдать ряд мер индивидуальной защиты: работать в спецодежде, не пить воду, не принимать пищу, не курить в очаге инфекции. Не допускаются к работе в неблагоприятных по ящуру хозяйствах беременные женщины, подростки и лица с микротравмами рук.
В России и некоторых других странах для профилактики ящура среди животных успешно используют инактивированные вакцины, которые через 2–3 недели после прививки создают иммунитет к заболеванию.
Памятка населению:
© Федеральное бюджетное учреждение здравоохранения
«Центр гигиены и эпидемиологии в Липецкой области», 2014-2021 гг.
Антитела класса IgG к S-белку коронавируса SARS-CoV-2, количественное определение, Abbott, США
| Исследуемый биоматериал | Кровь венозная (сыворотка) |
| Метод исследования | Иммунохемилюминесцентный анализ (ИХЛА), тест-система «SARS-CoV-2 IgG II Quant (LN 06S60, для использования с ARCHITECT), Abbott» |
| Cрок исполнения с момента поступления биоматериала в лабораторию | 1 к.д. |
Описание
Исследование предназначено для количественного определения иммуноглобулинов класса G (IgG), включая нейтрализующие антитела, к рецептор-связывающему домену (RBD) субъединицы S1 шиповидного белка SARS-CoV-2.
Геном SARSCoV-2 кодирует неструктурные белки, четыре структурных белка (спайковый [S], оболочечный [E], мембранный [M], нуклеокапсидный [N]), а также ряд предполагаемых вспомогательных белков. Внедрение SARS-CoV-2 в клетку хозяина требует связывания вирусного белка S с рецептором ангиотензинпревращающего фермента 2 (ACE-2) клетки-хозяина. Спайковый белок SARS-CoV-2, особенно его рецептор-связывающий домен (RBD), является критической мишенью для естественного и вакцинно-индуцированного иммунитета. Антитела к RBD шипа могут ингибировать связывание с рецептором ACE2, вызывая сильный ответ в виде нейтрализации вируса. Уровень антител IgG к вирусу SARS-CoV-2 коррелирует со степенью тяжести заболевания (чем сильнее болел человек, тем выше у него уровень антител). Для широкого ряда вакцин против COVID-19, применяются стратегии выработки иммунного ответа на шиповидный белок и домен RBD субъединицы S1.
Подготовка
Сдавать кровь рекомендуется не ранее чем через 3 часа после последнего приема пищи, допускается употребление негазированной воды.
Показания
1. Диагностика перенесенной коронавирусной инфекции
2. Дифференциальная диагностика ОРВИ заболеваний и инфекции COVID-19 в стадии выздоравливания
3. Оценка уровня нейтрализующих антител у пациентов с перенесенной коронавирусной инфекции в анамнезе
4. Контроль иммунитетом после вакцинации. Не подходит для контроля иммунитета за вакциной «ЭпиВакКорона», производства Вектор.
Статьи
Антителогенез у больных HCV-инфекцией
В.И. Лучшев, Т.Я. Чернобровкина, С.Н. Жаров
Кафедра инфекционных болезней, тропической медицины и эпидемиологии, ГОУ ВПО «РГМУ МЗ РФ» (зав. кафедрой – проф. В.И. Лучшев)
Из литературных источников известно, что геном вируса гепатита С (ВГС) кодирует три структурных белка: протеин С (core, ядерный), Е1 и Е2 (протеины оболочки) и четыре неструктурных белка: NS2, NS3, NS4 (A,B), NS5 (A,B). К каждому из белков в организме человека вырабатываются антитела, циркулирующие в крови. В настоящее время предлагается широкий спектр современных иммунологических и молекулярно-биологических диагностических тест-систем, а также гистологических исследований печени для выявления антительных, антигенных маркеров и RNA вируса гепатита С, различающихся своей чувствительностью и специфичностью [1, 2, 5, 8, 10]. Наиболее ранним маркером инфекции является обнаружение в сыворотке крови RNA-HCV через 1-3 недели от момента инфицирования. Однако, положительная RNA-HCV в сыворотке крови регистрируется только у 25% инфицированных ВГС на фоне нормальных уровней активности трансаминаз, поэтому чаще заболевание длительное время не диагностируется [2].
Обычно антитела к структурным белкам выявляются в сыворотке крови через 6-8 недель от инфицирования, причем они не обладают вируснейтрализующими свойствами, достаточными для элиминации вируса. Именно белки внешней оболочки (Е1 и Е2) ВГС имеют участки с высокой частотой аминокислотных замен, в результате которых образуются большое число генотипов и субтипов. Антитела к неструктурным белкам определяются в сыворотке крови несколько позже (через 10 недель от начала болезни) [3, 4, 5, 6]. В литературе появляется все больше данных о предполагаемых функциях и прогностическом значение как антигенов так и антител к ВГС. Считают, что нуклеокапсидный белок активирует апоптоз инфицированных клеток, способствует увеличению числа рецепторов апоптоза на клеточной мембране гепатоцита и повышению чувствительности клетки к проапоптотическим стимулам. Так, за чувствительность к интерферону возможно отвечает NS5 (A,B) белок. Высокий титр антител к поверхностным (структурным) белкам в острой фазе заболевания характеризует благоприятное течение HCV-инфекции [3]. Отсутствие антител к NS5 белку у больных ОГС характерно для периода реконвалесценции [5]. Выявление анти-NS4 ассоциируется с поздними морфологическими стадиями болезни – циррозом печени [4, 7, 9]. Диагностическая интерпретация антител к NS3 неструктурному белку по данным литературы неоднозначна. Кроме того, данные о маркерах вируса С изучались в образцах сыворотки крови больных в основном при моно инфекции HCV. Однако, доказанная репликация ВГС не только в клетках печени, но и в клетках эпителия, кератиноцитах, лимфоидных клетках и даже клетках крови послужила основанием для исследования маркеров ВГС на эритроцитах крови больных [7, 11].
Поэтому целью нашей работы являлось усовершенствование дифференциальной диагностики НСV-инфекции на основании исследования антител к структурным и неструктурным белкам ВГС не только в сыворотке, но и на эритроцитах крови больных.
Материалы и методы
Изучение клинической картины, лабораторных показателей и антителогенеза проводилось у 57 больных, страдающих HCV-инфекцией и микст-инфекцией HCV + HBV. Первую группу пациентов получавших базисную терапию, составили 17 больных с острым гепатитом С (ОГС), вторую 15 с обострением хронического гепатита С (ХГС), третью 25 пациентов с микст-инфекцией HCV+HBV по типу супер-инфекции острый гепатит В на фоне хронического гепатита С (ОГВ+ХГС). Пациенты находились на стационарном лечении в Инфекционной клинической больнице №3 г. Москвы (главный врач – Лазуткина Л.И.).
Верификацию вирусных гепатитов проводили с использованием иммуноферментного анализа (ИФА) и полимеразной цепной реакции (ПЦР).
Определение спектра антител класса IgM и IgG к вирусу гепатита С в сыворотке и на эритроцитах крови проводилось методом иммуноферментного анализа (ИФА) с использованием тест-систем «ИФА-АНТИ-HCV-СПЕКТР» и «ИФА-АНТИ-HCV-СПЕКТР- GM» НПО «Диагностические системы» (г. Нижний Новгород). Исследование крови пациентов проводилось в день госпитализации, через 1 месяц. ИФА проводился строго по инструкции прилагаемой к каждой тест-системе с поэтапным добавлением в лунки планшета готовых реагентов. В основе метода лежит реакция рекомбинантных антигенов, сорбированных раздельно на стрипах полистиролового планшета с антителами в исследуемых сыворотках и на эритроцитах крови больных HCV-инфекцией. Венозную кровь брали из локтевой вены натощак и центрифугировали 5 минут с 1500 оборотов в минуту. Сыворотку крови отделяли, помещали в пластиковые контейнеры и хранили в морозильной камере. Верификацию вирусных гепатитов проводили с использованием иммуноферментного анализа (ИФА) и полимеразной цепной реакции (ПЦР). Оставшийся осадок так же помещали в морозильную камеру. Перед постановкой реакции, сыворотки крови пациентов размораживались, а осадок крови трижды центрифугировали с физиологическим раствором (0,9% NaCl) в течение 5 минут с частотой 1500 оборотов в минуту с целью приготовления отмытых разрушенных эритроцитов.
Учет результатов проводили спектрофотометрически при длине волны 450 нм. Рассчитывалась критическая оптическая плотность (ОП) каждого антигена по формуле:
ОП крит. core-Ag = среднее значение ОП К- (core) + 0,2
Реакция считалась положительной при превышении результата над показателем критической ОП не менее чем на 20%.
ИФА проводился в лаборатории кафедры инфекционных болезней, тропической медицины и эпидемиологии РГМУ на базе клинической инфекционной больницы №3.
Результаты и обсуждение
При исследовании спектра маркеров HCV-инфекции в сыворотке и на эритроцитах крови, в условиях динамического наблюдения за больными получены следующие результаты.
У всех больных с моно-HCV-инфекцией при госпитализации в стационар обнаруживаются антитела к ядерному белку ВГС (100%) и в несколько меньшем проценте (84%) у пациентов с микст-инфекцией ОГВ+ХГС. В динамике заболевания сохраняется 100% выявляемость этих антител во всех группах (табл. 1).
Таким образом, наличие антител к core-белку в сыворотке крови практически у всех больных при поступлении в стационар и после базисной терапии может свидетельствовать о наличии у пациента только HCV-инфекции, не указывая на длительность течения и период заболевания. Следовательно, характерный спектр антител к структурному core-белку в сыворотке крови больных будет недостаточным для дифференциальной диагностики HCV-инфекции.
Параллельное определение спектра антител на эритроцитах крови показало, что в них сохраняется наибольшая выявляемость антител к core-белку у всех больных в период разгара и в период реконвалесценции у пациентов с ХГС и микст-инфекцией, в противоположность ОГС (20%, р Задать вопрос Оставить отзыв
Антитела класса IgG к S-белку коронавируса SARS-CoV-2, количественное определение, Abbott, США
| Исследуемый биоматериал | Кровь венозная (сыворотка) |
| Метод исследования | Иммунохемилюминесцентный анализ (ИХЛА), тест-система «SARS-CoV-2 IgG II Quant (LN 06S60, для использования с ARCHITECT), Abbott» |
| Cрок исполнения с момента поступления биоматериала в лабораторию | 1 к.д. |
Описание
Исследование предназначено для количественного определения иммуноглобулинов класса G (IgG), включая нейтрализующие антитела, к рецептор-связывающему домену (RBD) субъединицы S1 шиповидного белка SARS-CoV-2.
Геном SARSCoV-2 кодирует неструктурные белки, четыре структурных белка (спайковый [S], оболочечный [E], мембранный [M], нуклеокапсидный [N]), а также ряд предполагаемых вспомогательных белков. Внедрение SARS-CoV-2 в клетку хозяина требует связывания вирусного белка S с рецептором ангиотензинпревращающего фермента 2 (ACE-2) клетки-хозяина. Спайковый белок SARS-CoV-2, особенно его рецептор-связывающий домен (RBD), является критической мишенью для естественного и вакцинно-индуцированного иммунитета. Антитела к RBD шипа могут ингибировать связывание с рецептором ACE2, вызывая сильный ответ в виде нейтрализации вируса. Уровень антител IgG к вирусу SARS-CoV-2 коррелирует со степенью тяжести заболевания (чем сильнее болел человек, тем выше у него уровень антител). Для широкого ряда вакцин против COVID-19, применяются стратегии выработки иммунного ответа на шиповидный белок и домен RBD субъединицы S1.
Подготовка
Сдавать кровь рекомендуется не ранее чем через 3 часа после последнего приема пищи, допускается употребление негазированной воды.
Показания
1. Диагностика перенесенной коронавирусной инфекции
2. Дифференциальная диагностика ОРВИ заболеваний и инфекции COVID-19 в стадии выздоравливания
3. Оценка уровня нейтрализующих антител у пациентов с перенесенной коронавирусной инфекции в анамнезе
4. Контроль иммунитетом после вакцинации. Не подходит для контроля иммунитета за вакциной «ЭпиВакКорона», производства Вектор.