Экмо аппарат для чего нужен
Метод последней надежды: Реаниматолог объяснил, как ЭКМО помогает защитить мозг пациента
Медик подчеркнул, что неправильно называть такой способ лечения искусственной комой.
Фото © ТАСС / Максим Киселёв
Около 30–45% пациентов выживают после подключения к аппарату ЭКМО (экстракорпоральной мембранной оксигенации), однако без этого метода они были бы обречены на летальный исход. О том, что происходит с организмом при таком лечении, которое называют методом последней надежды, в беседе с kp.ru рассказал врач-реаниматолог, кандидат медицинских наук Георгий Арболишвили.
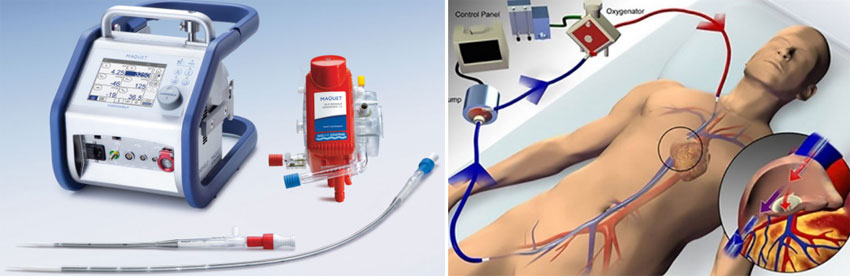
Аппарат экстракорпоральной мембранной оксигенации — это небольшое устройство, способное заменить функции сердца и лёгких человека на время их восстановления, например после коронавируса. Он состоит из двух компонентов, один из которых качает кровь из сосудов пациента, а другой — насыщает её кислородом, закачивая обратно в тело. ЭКМО является последним этапом интенсивной терапии, и именно к такому аппарату была подключена певица Максим.
Как рассказал Арболишвили, для большего комфорта пациента вводят в состояние медикаментозного сна, который ошибочно называют искусственной комой. Такой же способ используется и для людей, подключённых к аппарату искусственной вентиляции лёгких. В этом состоянии мозг защищён от кислородного голодания, и поэтому тяжёлые последствия от такого метода лечения исключены, подчеркнул врач.
«Речь идёт ни в коем случае не о коме. Правильно это называется медикаментозный сон. В кому человек впадает из-за тяжёлого поражения мозга — после инсульта, черепно-мозговых травм и т.д. Мы же при подключении к ИВЛ вводим пациента в медикаментозный сон именно для того, чтобы защитить мозг. Это называется нейропротекция», — рассказал медик.
Экстракорпоральная мембранная оксигенация (ЭКМО)
Презентация
Отчеты о выполненных перевозках
ВАЖНО: ООО “ТРАНСМЕДАВИА” — ЕДИНСТВЕННАЯ ИЗ НЕГОСУДАРСТВЕННЫХ КОМПАНИЙ, ОБЛАДАЮЩАЯ ВСЕЙ НЕОБХОДИМОЙ АППАРАТУРОЙ ДЛЯ ПРОВЕДЕНИЯ ЭКМО, А ТАКЖЕ ИМЕЮЩАЯ БОЛЬШОЙ ОПЫТ В ТРАНСПОРТИРОВКЕ ПАЦИЕНТОВ НА ЭКМО.
Несмотря на развитие интенсивной терапии и медицинских технологий, респираторный дистресс-синдром (РДС) по-прежнему остается одним из наиболее тяжелых и трудных для лечения реанимационных состояний. РДС приводит к утяжелению состояния пациента, удлинению искусственной вентиляции лёгких (ИВЛ) и времени пребывания пациента в реанимации и клинике, ухудшению исходов заболевания и удорожанию лечения. Применение миорелаксантов, позиции пациента на животе (прон-позиция) и протективной ИВЛ, заключающаяся в использовании низкого дыхательного объема (ДО), высокого положительного давления в конце выдоха (ПДКВ) и контроле давления в дыхательных путях, являются опциями лечения с доказанной эффективностью. Высокочастотная ИВЛ, оксид азота и сурфактант используются в тяжелых ситуациях, но эти опции не доказали свою эффективность в рандомизированных контролируемых исследованиях. В 10-15% наблюдений с РДС проводимая интенсивная терапия оказывается неэффективной, нарастает гипоксемия, гиперкапния, ацидоз, развивается полиорганная дисфункция. Наиболее часто такой клинический сценарий развивается у пациентов с атипичной пневмонией, политравмой с повреждением грудной клетки и при ожоговой болезни. Однако при любом РДС может развиться неуправляемая ситуация с резистентной к терапии гипоксемией и гиперкапнией. При таком варианте течения РДС единственной доступной и эффективной методикой органного замещения является экстракорпоральная мембранная оксигенация (ЭКМО).
ЭКМО используется в клинической практике уже более 40 лет. Долгие годы основной областью применения ЭКМО у взрослых была кардиохирургия и трансплантология, где эта методика использовалась в качестве моста для восстановления адекватной гемодинамики после интраоперационного искусственного кровообращения. Пандемия гриппа H1N1 кардинально изменила ситуацию. Только методика ЭКМО была способна спасать жизни пациентов с РДС, развившимся вследствие тяжёлой вирусной пневмонии. С тех пор применение ЭКМО в практике интенсивной терапии возрастает в геометрической прогрессии, создаются ЭКМО-центры, а также национальные и международные рекомендации и общества ЭКМО.
Важной проблемой является транспортировка пациентов с РДС, которым ЭКМО было начато в клинике первичной госпитализации или которым ЭКМО может понадобиться позднее, уже после их госпитализации в ЭКМО-центр.
При необходимости транспортировки пациентов с РДС, формируется команда специалистов, состоящая из сотрудников Центра ЭКМО и реаниматологов.
Оснащение команды: аппарат ЭКМО с кислородным баллоном; набор канюль различного диаметра и длины; хирургический инструментарий для проведения открытой канюляции бедренных сосудов и хирургической коррекции возможных осложнений канюляции; портативный аппарат УЗИ для оценки состояния внутренних органов и для канюляции сосудов; портативный аппарат ИВЛ с кислородным баллоном; портативный монитор с возможностью инвазивного измерения давления; не менее трёх перфузоров; реанимационная укладка с соответствующим запасом препаратов.
Для транспортировки таких пациентов используется автомобильный и/или авиационный транспорт. Основные принципы выбора метода транспортировки с использованием ЭКМО напрямую зависят от дистанции. При расстоянии до 500 км используется автомобильный транспорт, больше 500км — авиационный. Основным требованием к используемому транспорту является стабильно работающая электрическая сеть, которая должна обеспечить бесперебойную работу аппарата ЭКМО, ИВЛ и перфузоров. Кроме этого, всегда необходимо правильно рассчитать потребность в кислороде для аппарата ЭКМО и ИВЛ.
Рекомендации по применению ЭКМО при тяжелой легочной и/или сердечной недостаточности у пациентов с COVID-19
Российская межрегиональная общественная организация специалистов по экстракорпоральной мембранной оксигенации (РосЭКМО) подготовила этот документ для своевременного и безопасного применения ЭКМО у пациентов с COVID-19 в условиях пандемии на основе имеющихся на данный момент времени данных. Это согласованные рекомендации ведущих российских центров ЭКМО.
COVID-19 является новым заболеванием, вызванным новым вирусом SARS-CoV-2, появившемся в декабре 2019 года и вызвавшим всемирную пандемию. Поэтому эти рекомендации основаны на ограниченном опыте и будут обновляться по мере поступления новой информации. Актуальная информация размещена на сайте РосЭКМО.
Лишь у небольшой части пациентов с COVID-19 (по имеющимся оценкам из Китая и Италии – от 2 до 5%) развивается тяжелая дыхательная недостаточность и острый респираторный дистресс-синдром (ОРДС), требующие интенсивной терапии. Но при этом смертность у пациентов с потребностью в искусственной вентиляции легких очень высока. ЭКМО может быть средством спасения жизни у пациентов COVID-19 с тяжелыми формами ОРДС или рефрактерной сердечной недостаточностью. Первоначальный опыт работы с ЭКМО в Японии и Южной Корее (более 50 случаев), Европе (более 150 случаев) показывает возможность выживания таких пациентов. В обзоре в The Lancet Respiratory Medicine рассматривается роль ЭКМО и центров ЭКМО во время пандемии COVID-19 и рекомендуется использовать ЭКМО при наличии опытных центров, ресурсов и возможностей (1). В текущих рекомендациях ВОЗ применение вено-венозной (ВВ) ЭКМО показано пациентам с COVID-19 и тяжелым ОРДС в опытных центрах с достаточным количеством случаев для клинического опыта. Рекомендации ведущих мировых экспертов описывают общие требования к организации центра ЭКМО для лечения ОРДС (2). Общие рекомендации по показаниям и ведению пациентов на ЭКМО размещены на сайте международной организации экстракорпоральной поддержки жизни – ELSO (3). Society of Critical Care Medicine также опубликовало рекомендации по ведению пациентов с COVID-19 и рекомендует использовать ЭКМО в случае неэффективности обычного лечения (4). Потребность в ЭКМО при COVID-19 пока неясна, для справки при эпидемии гриппа H1N1 в Австралии и Новой Зеландии в 2009 году частота использования ЭКМО составляла 2,6 случая на миллион населения или 1% от общего количества госпитализированных, при MERS ЭКМО использовалась у 5,8% пациентов.
Рис. 1. Алгоритм лечения тяжелого острого респираторного дистресс-синдрома
PEEP – положительное давление в конце выдоха
PaO 2 / FiO 2 – отношение парциального давления кислорода в артериальной крови к фракциональной концентрации кислорода во вдыхаемой газовой смеси
PaCO 2 – парциальное давление углекислого газа в артериальной крови
ЭКМО – экстракорпоральная мембранная оксигенация
Следует учитывать, что использование ECMO для COVID-19 происходит во время пандемии, которая может перегрузить имеющиеся ресурсы больницы!
Решение о применении ЭКМО у пациентов с COVID-19 принимается на местном уровне, исходя из критериев клинической целесообразности и ресурсной обеспеченности учреждения здравоохранения. Это индивидуальное решение для каждого конкретного случая, которое следует принимать на основе общей нагрузки больницы пациентами, укомплектованности персоналом и другими ограниченными ресурсами, наличия технических возможностей, а также рекомендаций органов власти, регулирующих органов или руководства больницы. Если медицинскому учреждению требуется направить все ресурсы на других пациентов, ЭКМО не следует рассматривать до тех пор, пока ресурсы не стабилизируются. Если медицинское учреждение может осуществлять ЭКМО безопасно и без перегрузки персонала, то ее следует предлагать пациентам с хорошим прогнозом при использовании ЭКМО. Использование ЭКМО у пациентов с сочетанием пожилого возраста, множественных сопутствующих заболеваний или полиорганной недостаточности (большинство пациентов с тяжелым ОРДС при COVID-19) имеет плохой прогноз и должно проводиться в исключительных случаях.
Молодые пациенты с незначительными или отсутствующими сопутствующими заболеваниями имеют наивысший приоритет для использования ЭКМО во время пандемии COVID-19. Также приоритетом является медицинский персонал. Следует понимать, что это динамическая расстановка приоритетов. По мере изменения ресурсов приоритеты должны меняться в зависимости от того, что можно безопасно и успешно делать в условиях конкретной больницы.
Сердечная недостаточность у пациентов с COVID-19
У пациентов с COVID-19 возможно развитие тяжелой сердечной недостаточности (миокардит, гипоксическая кардиомиопатия и др). Сердечная недостаточность должна подтверждаться и оцениваться эхокардиографией. При невозможности поддержания адекватной гемодинамики обычной терапией (включая кардиотоники, вазопрессоры, инфузионную терапию) показана Вено-Артериальная (ВА) ЭКМО, предпочтительно в виде Вено-Артерио-Венозной (ВАВ) ЭКМО с учетом поражения легких и риска развития синдрома Арлекина. Своевременное эхокардиографическое обследование показано при наличии любого клинического подозрения на сердечную дисфункцию или признаки нарушения кровообращения.
Использование ЭКМО по другим показаниям во время пандемии возможно при наличии соответствующих ресурсов больницы (в первую очередь персонала).
Противопоказания для применения ЭКМО
Стандартные противопоказания остаются в силе: неизлечимое заболевание с плохим краткосрочным прогнозом (менее 6 месяцев), серьезное повреждение центральной нервной системы.
Защитные меры для персонала
Следует использовать стандартные меры предосторожности по COVID-19, рекомендованные ВОЗ и национальными организациями здравоохранения.
Из-за высокой контагиозности COVID-19 ЭКМО сопряжена с риском инфицирования персонала в связи с выделением пациентами инфицированных жидкостей и аэрозолей (мокрота из дыхательных путей, кровь и другое). Чтобы свести к минимуму риск перекрестного инфицирования медицинского персонала и уменьшить осложнения, связанные с ЭКМО, мы рекомендуем следующие меры предосторожности при проведении ЭКМО у пациентов с COVID-19:
Ведение пациентов с COVID-19 на ЭКМО
Для пациентов без кровотечения или высокого риска кровотечения (количество тромбоцитов >50×10 9 ) доза гепарина перед канюляцией составляет 50 Ед/кг, для пациентов с кровотечением или высоким риском кровотечения (тромбоцитопения 9 ) доза гепарина перед канюляцией следует уменьшить до 25 Ед/кг. После начала ВВ ЭКМО должна быть начата инфузия гепарина для поддержания уровня времени активированного свертывания (ВАС) 160-180 сек или активированного парциального тромбопластинового времени (АПТВ) 1,5 выше нормы (40-60 сек). Пациентов с активным кровотечением или тромбоцитопенией 9 рекомендуется вести без инфузии гепарина при поддержании скорости кровотока через контур ЭКМО не менее 3 л/мин.
После начала ЭКМО ИВЛ рекомендуется проводить в режиме «отдыха» легких: пиковое давление на вдохе не выше 20 см H2O, дыхательный объем 3-6 мл/кг, частота дыхания 10-15 в мин. Параметры объемной скорости кровотока и потока кислородо-воздушной смеси через контур ЭКМО рекомендуется подбирать для поддержания артериальной сатурации на уровне > 90%, pH>7,3, PaCO2 40-45 mm Hg (допустима гиперкапния до 60 mm Hg у пациентов с ХОБЛ).
Требуется больше информации о эффективном лечении пациентов с COVID-19 с использованием ЭКМО. Поэтому информация о применении ЭКМО при тяжелом течении COVID-19 должна собираться и анализироваться. Пожалуйста, внесите вашего пациента в Регистр РосЭКМО в тот момент, когда он будет подключен (и позже, когда выписан). Ранняя запись в Регистре позволит РосЭКМО предоставить оперативные и актуальные данные о результатах и осложнениях ЭКМО при COVID-19 в России!
Экмо аппарат для чего нужен
Вено-венозная экстракорпоральная мембранная оксигенация при COVID-19
Коронавирус-индуцированная болезнь 2019 (COVID-19) характеризуется широким спектром клинических вариантов течения, варьирующих от бессимптомной вирусной колонизации до острого респираторного дистресс-синдрома (ОРДС), требующего интубации и сложной стратегии искусственной вентиляции легких (ИВЛ). В случаях крайне тяжелой дыхательной недостаточности, не позволяющей обеспечивать адекватный газообмен, несмотря на оптимизацию ведения пациента и оптимальные параметры ИВЛ, вено-венозная экстракорпоральная мембранная оксигенация (ВВ ЭКМО) может стать дополнительной опцией поддерживающей терапии в ограниченном арсенале средств против COVID-19. Эту же роль ЭКМО уже играет в лечении других тяжелых вирусных респираторных инфекций, таких как грипп H1N1 и актуальные рекомендации поддерживают применение ЭКМО при COVID- 19.
Результаты аутопсии свидетельствуют о том, что патогенез дыхательной недостаточности при COVID-19 имеет сходство с патогенезом ОРДС. Отмечается диффузное повреждение альвеол с заполнением просвета альвеол жидкостью и образованием гиалиновых мембран, что приводит к снижению комплайнса легких и гипоксемии, которая может быть достаточно выраженной. ЭКМО может быть показано пациентам с тяжелыми расстройствами оксигенации (пороговое значение индекса P/F около 80–100) на фоне дыхательной недостаточности, которая характеризуется либо периодами длительной десатурации, либо повышением давления в дыхательных путях, несмотря на оптимизацию параметров вентиляции. ЭКМО не рассматривается до тех пор, пока не становится ясно, что дальнейшее проведение ИВЛ в безопасном режиме не представляется возможным, несмотря на оптимизацию параметров вентиляции и попытки переводить пациента в положение на животе. Имеется несколько вариантов абсолютных противопоказаний к подключению ЭКМО у пациентов с COVID-19: возраст более 60 лет, полиорганная недостаточность, активное злокачественное заболевание, существующее хроническое сердечное, легочное (не включая бронхиальную астму) заболевание или патология печени, неизвестный или неопределенный неврологический статус и тяжелая нейтропения. Индекс массы тела (ИМТ) >35 кг/м 2 рядом авторов рассматривается как относительное противопоказание, с учетом опасений за техническое обеспечение и достижение адекватных потоков вено-венозного ЭКМО в условиях выраженного ожирения. Другие относительные противопоказания по данным авторов: активное кровотечение, хроническая почечная дисфункция, иммуносупрессия и сопутствующая инфекция с мультирезистентной флорой.
Стратегия канюляции должна быть разработана с целью максимального повышения эффективности, чтобы исключить неоправданный расход ограниченных средств индивидуальной защиты (СИЗ), защищая при этом персонал от инфицирования, и минимизировать время пребывания пациентов в состоянии гипоксемии. Учитывая, что экстренные процедуры неизбежно сопровождаются более высоким риском ошибок и последующего контакта команды канюляции с COVID-19, имеет смысл организовать скрининг пациентов в ОРИТ для выявления кандидатов, которым может потребоваться сосудистый доступ для подключения ЭКМО. Таким пациентам превентивно катетеризируются правая внутренняя яремная и бедренная вена с установкой интродьюсеров (на фоне приближающегося этапа пронирования), что позволяет избежать критического этапа обеспечения сосудистого доступа в случае необходимости подключения ЭКМО. Количество медицинских работников в палате во время процедур канюляции должно быть минимально необходимым. Дополнительный персонал может находиться в ожидании, но за пределами палаты, готовым прийти на помощь в случае клинической необходимости. Важно, чтобы все потенциальные члены команды ЭКМО прошли соответствующие курсы, а также персональные тренинги по надлежащему применению СИЗ.
Основная задача вено-венозного ЭКМО состоит в том, чтобы обеспечить респираторную поддержку пациенту, пока его легкие восстанавливаются после клеточного цитотоксического повреждения, опосредованного SARS-CoV2, что позволяет использовать ультрапротективные режимы ИВЛ. При отсутствии проблем с кровоточивостью стандартно используется терапевтическая антикоагуляция. Пациенты в период функционирования ЭКМО, как правило, находятся в состоянии седации с обязательным мониторингом неврологического статуса. Проводится протективная ИВЛ. По мере восстановления функционирования легких пациента, попытке деканюляции предшествует пробная остановка подачи газа на аппарате ЭКМО. Если имеются признаки того, что поддержка больше не требуется, антикоагуляция прекращается и система ЭКМО удаляется с деканюляцией в палате. Гемостаз обеспечивается усиленными компрессирующими швами и мануальной компрессией. После деканюляции пациенты постепенно отлучаются от вентилятора.
Аппарат искусственного кровообращения
Схема принципа работы искусственного кровообращения
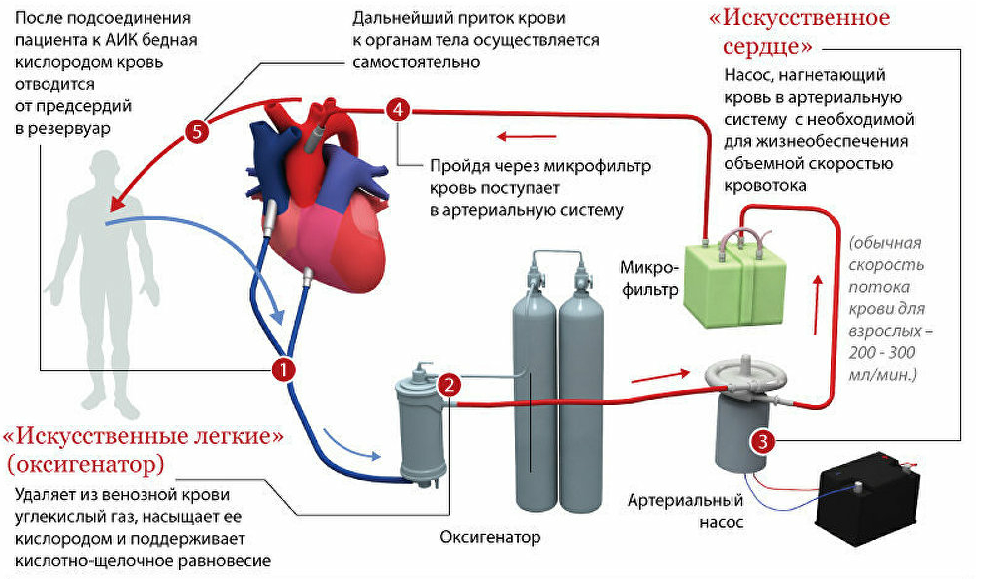
Аппарат искусственного кровообращения (АИК), или аппарат «искусственное сердце — лёгкие» — специальное медицинское оборудование, обеспечивающее жизнедеятельность человека при частичной или полной невозможности выполнения функций сердца и/или лёгких.
Принцип работы
Аппарат искусственного кровообращения временно замещает функцию сердца и легких. Поэтому он состоит из нескольких блоков, а именно:
1) Оксигенатор. Кровь попадает туда из катетеризированных вен правого предсердия самотеком. В оксигенаторе она насыщается кислородом и освобождается от углекислого газа. В некоторых оксигенаторах кровь соприкасается с газом (пузырьковые, пленочные), в других она насыщается кислородом через газопроницаемую мембрану.
2) Артериальный насос. По своей конструкции он может быть мембранный, камерный, роликовый, пальчиковый. Основная функция его состоит в нагнетании оксигенированной крови в артерию.
4) Теплообменник. Согревает или охлаждает кровь до определенной требуемой температуры. Так, чтобы избежать травматизации клеток крови во время перфузии, а это возможно при длительных оперативных вмешательствах, когда она проходит через циркуляторный контур многократно, используют гипотермию. Теплообменник может быть трубчатым или щелевым.
5) Фильтр-ловушка. Кровь, попадая в аппарат искусственного кровообращения, может образовать сгустки, содержать пузырьки газа, поэтому перед обратным поступлением в кровеносное русло больного ее фильтруют.
Где используется
В основном аппарат искусственного кровообращения (АИК) применяется в кардиохирургии, при операциях на открытом сердце. Во время оперативного вмешательства сердце не может выполнять свою функцию насоса и ее заменяют механическим перекачиванием оксигенированной крови. Есть и другое применение аппарата искусственного кровообращения – это регионарная перфузия.
Осложнения при искусственном кровообращении
Основные осложнения, которые могут возникнуть при использовании аппарата искусственного кровообращения это:
Кардиоплегия
Большое значение в предупреждении воздушной эмболии имеет искусственная остановка сердца (кардиоплегия). Кардиоплегию применяют не только для предупреждения воздушной эмболии, а в основном для предупреждения гипоксических изменений в миокарде в период, когда прекращено коронарное кровообращение, и для создания удобств оперирующему на открытых полостях сердца хирургу. Кроме того, вследствие кардиоплегии удается уменьшить кровопотерю из операционной раны сердца, если во внутрисердечном периоде операции не включено коронарное кровообращение.
Экстракорпоральная мембранная оксигенация (ЭКМО, ЭМО) — инвазивный экстракорпоральный метод насыщения крови кислородом (оксигенации) при развитии тяжёлой острой дыхательной недостаточности. Используется в кардиологии при острой сердечной недостаточности и для поддержания жизнедеятельности при проведении операции на открытом сердце совместно с аппаратом искусственного кровообращения.
История
Впервые метод экстракорпоральной оксигенации был применён в 1952 году в Великобритании у больного с дыхательной недостаточностью. В 1953 году впервые успешно проведена операция на открытом сердце с искусственной перфузией и оксигенацией крови. В 1965 году пузырьковый оксигенатор впервые использован у новорождённого, умирающего от дыхательной недостаточности. В 1969 году группой врачей под руководством T.G.Baffes впервые использован мембранный оксигенатор для искусственного кровообращения у детей. В 1970 году компания Avecor создала мембранный оксигенатор, ставший прообразом всех современных аппаратов ЭКМО.
Механизм
Для проведения ЭКМО к больному подсоединяют мембранный оксигенатор. Существует два способа подключения — вено-артериальная канюляция (ВАК) и вено-венозная канюляция (ВВК). При ВАК кровь забирается из венозного русла, очищается, насыщается кислородом и подаётся в артериальное русло. ВАК рекомендуется к применению у новорождённых, а также у взрослых с компенсированным инфарктом миокарда. При ВВК кровь забирается и возвращается в венозное русло. ВВК может применяться у взрослых с изолированным поражением лёгких. Для соблюдения физиологических механизмов забор и вливание крови осуществляется максимально близко к сердцу. ВАК предпочтительнее, так как при этом способе не происходит смешивание артериальной и венозной крови. ВВК требует вдвое большую поверхность мембран оксигенатора, поэтому на практике данный способ применяется реже.
При проведении процедуры новорождённым для компенсации объёма крови, циркулирующего в аппарате, используется донорская кровь.
ЭКМО является симптоматической терапией, не устраняющей фактор развития заболевания.
Возможные осложнения и недостатки
Использование донорской крови может вызвать аллергическую реакцию и привести к развитию шока. Кроме того, для исключения свёртывания крови в аппарате на протяжении всего времени использования ЭКМО пациенту вводят антикоагулянты, что может спровоцировать тромбоцитопению, кровоизлияния в головной мозг и в полости в месте канюляции, усиленный гемолиз. Недостаточность или неэффективность антикоагулянтов может привести к тромбообразованию и закупорке механизмов аппарата ЭКМО. Неисправность аппарата может вызвать воздушную эмболию сосудов, отказ аппарата фатален для пациента.
Главными недостатками метода являются необходимость наличия дорогостоящего оборудования, высококвалифицированного персонала и высокая стоимость процедуры.
Надежность. Превосходная работа и практическая функциональность.
Постоянный и равномерный уровень обмена газов крови является залогом максимальной безопасности наших пациентов. Немецкое качество. Модели оксигенаторов производятся со стандартными микропорами или с инновационными плазменными тонкими волокнами, используемых в оксигенаторах длительного использования. Все модели оксигенаторов MEDOS имеют следующие преимущества:
— Исключительный трансфер газа.
— Низкий обьем заполнения.
— Оптимизированный поток крови, газа и жидкости.
— Компактная, простая в сборке конструкция.
Купить оксигенатор Medos производства Германии Вы можете обратившись к менеджеру-консультанту Акжолу Марасулову (+996 555 710 885).