Экспрессия ск7 что это
Экспрессия цитокератина 7 и цитокератина 19 при высокой степени интраэпителиального поражения шейки матки и плоскоклеточной карциноме и их возможное участие в цервикальном канцерогенезе
Актуальность:
Вирус папилломы человека высокого риска (ВПЧ ВР) поражает клетки в переходной зоне (ПЗ) шейки матки, вызывая рак. Цитокератин (СК) 7 является маркером ПЗ и окрашивает клетки при цервикальной неоплазии. CK19 является обязательным «партнером» CK7 и экспрессируется при раке шейки матки. Несмотря на возможную связь между CK7/CK19 и раком шейки матки, не так много известно о механизме вовлечения CK7/CK19 при цервикальном канцерогенезе, опосредованном ВПЧ ВР.
Методы:
Был выполнен анализ экспрессии CK7, CK19, и р16 с помощью иммуногистохимического метода и ВПЧ-инфекции методом гибридизации in situ в 25 случаях высокой степени интраэпителиального поражения шейки матки (CIN3) и в 30 случаях плоскоклеточной карциномы (SCC).
Результаты:
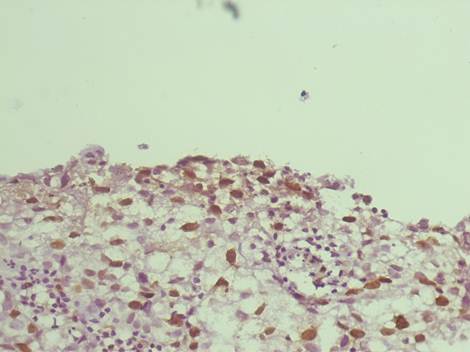
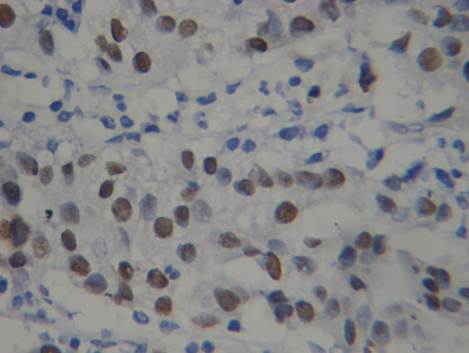
Экспрессия CK19, р16 и ВПЧ была положительной во всех случаях CIN 3 и SCC. Экспрессия CK7 была положительной во всех случаях CIN 3 и в 66% (n=20 из 30) SCC. Для каждого белка было характерно диффузное или очаговое окрашивание с топографическими различиями. Очаговое окрашивание CK7 и эписомальной ДНК ВПЧ совпадали в верхних слоях CIN3 и центральной части участка при SCC. В то время как очаговое окрашивание CK19 и комплексной ДНК ВПЧ обычно отмечалось в нижних слоях CIN 3 и по периферии участка SCC. Очаги окрашивания р16 совпадали с CK19 у пациенток с SCC.
Заключение:
Ключевые слова:
СК 19; СК 7; рак шейки матки; ВПЧ; зона перехода; р16
Cytokeratin7 and cytokeratin19 expression in high grade cervical intraepithelial neoplasm and squamous cell carcinoma and their possible association in cervical carcinogenesis.
Экспрессия ск7 что это
В Российской Федерации выявление больных с поверхностной формой рака (I стадия) составляет всего лишь 20-30 % наблюдений, в противоположность зарубежным данным, в соответствии с которыми I стадия рака мочевого пузыря диагностируется в 80 % случаев [2]. В нашей стране в 11,6-15,6 % наблюдений выявляется IV стадия рака мочевого пузыря.
Следует указать и тот факт, что при адекватной диагностике и своевременном лечении жизнь умерших от рака мочевого пузыря можно было бы продлить в среднем на 14 лет. Именно поэтому, своевременная диагностика опухолей мочевого пузыря остается одной из важнейших задач современной онкоморфологии.
В современной литературе имеется большой объем опубликованных работ по применению диагностических иммуногистохимических маркеров при раке мочевого пузыря [3,5,6]. Однако, в клинических рекомендациях, выпущенных по инициативе Российского общества онкоурологов с разрешения Европейской ассоциации по урологии, в 2009 году сведения по применению конкретных иммуногистохимических маркеров для диагностики рака мочевого пузыря отсутствуют. Нет их и в стандартах диагностики и лечения рака мочевого пузыря, как в России, так и в Европе. Все вышесказанное позволило нам сформулировать цель нашего исследования.
Разработать панель иммуногистохимических маркеров ранней диагностики, стадирования и прогноза рака мочевого пузыря.
Материалы и методы исследования
Материалом для исследования послужили операционный и биопсийный материал 106 пациентов с новообразованиями мочевого пузыря, проходивших лечение в НИИ «Фундаментальной и клинической уронефрологии» ГБОУ ВПО Саратовский ГМУ им. В.И.Разумовского Минздравсоцразвития России. С помощью обзорных методов окрашивания диагноз уротелиального рака был поставлен 94 пациентам. Остальные 12 пациентов составили группу сравнения. Операционный и биопсийный материалы были зафиксированы в 10 %-м растворе нейтрального формалина и залиты в парафин. Срезы толщиной 5-7 мкм, окрашенные гематоксилин-эозином, были подвергнуты обзорному морфологическому анализу, при котором стадию рака определяли в соответствии с классификацией TNM, а степень дифференцировки опухолевых клеток оценивали в соответствии с рекомендациями ВОЗ, 2004. Микроскопическое изучение препаратов было проведено с применением бинокулярного микроскопа «Micros MC100» при 400-кратном увеличении.
Иммуногистохимическое исследование 13 маркеров было проведено на биопсийном и операционном материале 66 пациентов. Все используемые моноклональные антитела были разделены на группы по функциональной значимости:
Формула подсчета следующая: histochemical score = ∑ P (i) х I,
Статистический анализ проводили с использованием пакета программ статистической обработки результатов SSPS 13.0 for Windows.
Результаты исследования
Рис. 1. Инвазивный уротелиальный рак. Умеренная и высокая экспрессия Кi-67 в ядрах уротелия
Равнозначные показатели получили при анализе экспрессии моноклонального антитела р53, являющегося белком-регулятором клеточного цикла и апоптоза. Отмечалось отсутствие окрашивания препаратов в группе сравнения, а интенсивность экспрессии и процент клеток с выраженной окраской имели четкую тенденцию к увеличению с возрастанием глубины инвазии опухоли. Раковые клетки с интенсивной иммуногистохимической реакцией маркера р53 появляются только в тех случаях, когда уротелиальная карцинома начинает прорастать в мышечный слой. Данные показатели позволяют использовать р53 как критерий прогноза заболевания, так и для определения глубины инвазии.
Рис. 2. Умеренная и выраженная экспрессия маркера Р53 в клетках инвазивной уротелиальной карциномы
Белок р63 также не дает экспрессии в группе сравнения. Однако достоверных различий частоты и интенсивности иммуногистохимической реакции в группах больных с различной стадией заболевания не выявлено.
При иммуногистохимической реакции на антигены, локализованные в цитоплазме, было установлено, что их экспрессия во всех исследованных группах больных является положительной. Достоверно значимых различий между группами больных по показателям иммуногистохимических реакций с цитокератинами (СК7, СК8, СК10/13, СК17, СК18, СК19) не установлено.
При исследовании полученных результатов иммуногистохимической реакции рецептора эпидермального фактора роста (EGFR) установлено, что его экспрессия отсутствует в группе сравнения и в группе больных с неинвазивными раками мочевого пузыря и нарастает с увеличением глубины инвазии. Таким образом, данное антитело не дает возможности на ранних этапах развития дифференцировать между собой доброкачественные процессы и злокачественные опухоли, поэтому данный маркер целесообразно использовать только для определения глубины инвазии опухоли.
Маркеры PCNA, Bcl2 не показали достоверной разницы в экспрессии ни в одной из изучаемых групп.
Выводы
Таким образом, проведенные исследования 13 моноклональных иммуногистохимических антител позволили разработать три основных направления в использовании данных маркеров:
Рецензенты:
Экспрессия ск7 что это
Нейроэндокринноклеточные опухоли (НЭО) – это разнородная группа новообразований, происходящих из нейроэндокринных клеток, способных к продукции гормонов и других веществ, обладающих биологически активными свойствами [1]. Научный интерес к проблеме нейроэндокринных новообразований возрастает с каждым годом. Эта тенденция во многом связана с увеличением частоты их обнаружения относительно опыта прошлых лет, что может быть обусловлено широким внедрением в практику современных методов диагностики, повышенной онкологической настороженностью, а также абсолютным стремительным ростом заболеваемости НЭО под влиянием изменяющихся факторов внешней среды в условиях урбанизации [2]. За последние 30 лет отмечается значительное увеличение числа новых зарегистрированных случаев заболеваемости НЭО всех локализаций [2; 3]. Так, на сегодняшний день заболеваемость НЭО составляет 5,25 случая НЭО на 1 миллион населения в год [4]. Хотя НЭО могут встречаться во всех органах, где есть нейроэндокринные клетки, большая часть из них приходится именно на желудочно-кишечный тракт (61%), и не менее 40% от этого количества составляют НЭО поджелудочной железы (ПЖ) [4; 5]. По данным литературы, последние выявляются с частотой 3-5 случаев на 1 млн населения в год [6]. Одна из главных проблем НЭО ПЖ в Российской Федерации сводится к отсутствию единого регистра этих опухолей, в связи с чем нет достоверных данных о заболеваемости ими в нашей стране [7].
Долгое время НЭО оставались предметом многочисленных дискуссий по поводу представлений об их истинной биологии. С 1907 года, после того как Oberndorfer ввел термин «карциноид», считалось, что НЭО имеют доброкачественную природу [8]. Однако благодаря развитию электронной микроскопии, иммуногистохимическим и молекулярно-биологическим методам исследования было установлено, что НЭО – это группа опухолей с неопределенным злокачественным потенциалом, способных в отдаленные сроки после операции рецидивировать и метастазировать [9]. Этот факт произвел настоящую революцию во взглядах ученых на проблему НЭО. Был сделан вывод, что, несмотря на сходные особенности в отношении морфологического строения, НЭО ЖКТ и ПЖ представляют собой гетерогенную группу, внутри которой существует множество различий как на клиническом уровне, так и на молекулярном. Данное обстоятельство определяет необходимость дифференцированного подхода к ведению пациентов с НЭО. Важное значение в диагностике НЭО ПЖ имеют морфологическое и иммуногистохимическое исследования, которые позволяют с высокой точностью установить потенциал злокачественности опухолей и на этом основании определить тактику лечения и сделать соответствующие прогнозы [9; 10].
Классификация НЭО ПЖ претерпела множество изменений, и в настоящее время рекомендовано использовать новую классификацию ВОЗ НЭО ПЖ от 2017 года, где основным фактором для определения злокачественности (Grade) также считается уровень индекса пролиферативной активности Ki-67 (Ki-67 ≤2 – G1, Ki-67 3–20% – G2, Ki-67 > 20% – G3), но новая концепция предполагает выделение высокодифференцированных НЭО ПЖ (G1, G2, G3), низкодифференцированных нейроэндокринных карцином (G3), в том числе их крупно- и мелкоклеточные варианты, смешанных карцином (MiNEN) [10]. Иммуногистохимический анализ, в свою очередь, позволяет подтвердить нейроэндокринную природу опухоли и уточнить ее гормональный статус.
Лечение НЭО ПЖ, как и их диагностика, требует мультидисциплинарного подхода. Это значит, что хирургическое лечение в иных случаях необходимо сочетать с химиотерапевтическими препаратами (особенно при низкодифференцированных карциномах) и препаратами из группы аналогов соматостатина. Применение последних является наиболее перспективным направлением в современной онкологии, но перед их назначением требуется иммуногистохимическое подтверждение экспрессии специфических рецепторов к соматостатину (SSTR2) на клетках опухоли [10]. В настоящее время нет достоверных данных о характере экспрессии данных рецепторов в различных органах и тканях, поэтому для изучения этого вопроса необходимы дальнейшие исследования с большими и репрезентативными выборками. Все вышеперечисленное обуславливает высокую актуальность проблемы НЭО ПЖ.
Цель исследования. Проанализировать иммунофенотипические особенности НЭО ПЖ, выраженность экспрессии диагностически значимых маркеров (Ki-67, синаптофизин, CD-56, NSE, Хромогранин А, CK-7, CK-18, CK-20, АЕ1/АЕ3) и оценить отдаленные результаты хирургического лечения.
Полученные результаты ИГХ-исследования экспрессии девяти маркеров представлены в таблице 1.
Характеристика экспрессии исследованных маркеров в образцах НЭО ПЖ
Медицинские интернет-конференции
Языки
Иммуногистохимические маркеры прогноза развития рецидива неинвазивных уротелиальных карцином
Цмокалюк Е.Н., Маслякова Г.Н.
Резюме
Проведенный анализ результатов иммуногистохимического исследования 13 моноклональных антител в биопсийном материале 34 больных с раком мочевого пузыря позволяет выявить наиболее значимые иммуногистохимические маркеры предрасположенности к рецидивированию у пациентов с поверхностной формой рака мочевого пузыря.
Ключевые слова
Статья
Несмотря на постоянное усовершенствование методов диагностики и лечения поверхностных форм уротелиальной карциномы к сожалению, не удается сколь нибудь значимо снизить процент рецидивов данных форм рака мочевого пузыря. По данным клинических рекомендаций Европейской ассоциации урологов (2010) прогрессирование опухоли при Та развивается в 6-20% случаев, при Т1 в 27- 48% при любой степени дифференцировки опухолевой ткани.
Большинство исследователей Американской и Европейской урологических ассоциаций, считают ТУР золотым стандартом лечения поверхностного рака мочевого пузыря [1, 9]. Однако, процент рецидивирования поверхностного РМП после выполнения только ТУР МП достаточно высок и составляет в среднем от 51% до 95% [27, Аль-Шукри С.Х. с соавт., 1997; Тарасов Н.И., 2000; Rajala P. et al., 1999; Tolley D.A. et al., 1996], при этом примерно 50% рецидивов возникают в течение 1-го года наблюдения.
Причинами частого рецидивирования поверхностных форм уротелиальной карциномы при органосохраняющей терапии большинство ученых считают следующие:
Западными исследователями было доказано, что высокодифференцированные неинвазивные папиллярные карциномы (рТа) обладают меньшим потенциалом прогрессирования, чем низкодифференцированные с инвазией в субэпителиальную мышечную ткань (рТ1). Вероятность мышечной инвазии в 2 раза меньше у рТа, чем у рТ1 опухолей и составляет 9% и 18% соответственно. Степень дифференцировки также является очень важной характеристикой опухоли. Доказано, что G1 опухоли прогрессируют в 6% случаев, в то время как у G2 опухолей потенциал прогрессирования больше в 5 раз и составляет 30% [22]. При наблюдении за больными в течение 20 лет риск прогрессирования для pTaG1 и pT1G3 был еще выше – 14% и 45% соответственно, при этом рецидивы выявлялись примерно в 50% случаев вне зависимости от степени злокачественности опухоли [19].
С данными результатами исследований согласны и отечественные ученые, которые также считают, что каждый последующий рецидив обладает большим потенциалом злокачественности, следовательно, имеет тенденцию к снижению дифференцировки и к инвазии в мышечный слой (Матвеев Б.П., 2001).
Хорошо известен тот факт, что течение заболевания, опухолевая прогрессия в виде возникновения рецидивов у пациентов с одной и той же клинической стадией и морфологической формой рака часто бывает различным. Поэтому, чтобы понять причины рецидивирования поверхностных форм уротелиального рака и с целью определения потенциала клеток, составляющих опухолевый рецидив, возникла необходимость в проведении дополнительного изучения с помощью иммуногистохимических маркеров.
В отечественной и зарубежной литературе существует много публикаций, в которых единодушно указывается, что уровень экспрессии генов-супрессоров, антигенов пролиферативной активности прямо коррелирует с опухолевой прогрессией и рецидивированием (7, 13). Однако, индексы экспрессии других групп маркеров в мышечнонеинвазивных формах рака (маркеры апоптоза, цитокератины и др.) среди исследователей имеют очень противоречивые результаты.(10)
Следует указать и тот факт, что своевременная молекулярная характеристика рецидивирующей опухоли позволяла бы отбирать больных не только для органосохранного лечения, но и проводить своевременную радикальную цистэктомию пациентам с высоким потенциалом рецидивирования, продлевая им тем самым жизнь.
Все вышесказанное определило цель нашего исследования.
Цель исследования: Выявить наиболее значимые иммуногистохимические маркеры предрасположенности к рецидивированию у пациентов с поверхностной формой рака мочевого пузыря.
Материалы и методы
Материалом для исследования послужили операционный и биопсийный материал 106 пациентов с новообразованиями мочевого пузыря, проходивших лечение в НИИ «Фундаментальной и клинической уронефрологии» ГБОУ ВПО Саратовский ГМУ им. В.И.Разумовского Минздрава России. С помощью обзорных методов окрашивания диагноз уротелиального рака был поставлен 94 пациентам. Остальные 12 пациентов составили группу сравнения. Операционный и биопсийный материал фиксировали в 10%-м растворе нейтрального формалина и заливали в парафин. Срезы толщиной 5-7 мкм, окрашенные гематоксилин-эозином, были подвергнуты обзорному морфологическому анализу, при котором стадию рака определяли в соответствии с классификацией TNM, а степень дифференцировки опухолевых клеток оценивали в соответствии с рекомендациями ВОЗ, 2004. Микроскопическое изучение препаратов было проведено с применением бинокулярного микроскопа «Micros MC100» при 400-кратном увеличении.
Иммуногистохимические реакции проводили на серийных парафиновых срезах (5мкм), используя стрептавидин-биотиновый метод. В качестве детекционной системы применяли систему LSAB2 System, HRP (K0675), Dako, в качестве хромогена – диаминобензидин (Dako).
Иммуногистохимическое исследование 13 маркеров было проведено на биопсийном и операционном материале. Все используемые моноклональные антитела были разделенны на группы по функциональной значимости:
Интенсивность реакций с антигенами, локализованными в цитоплазме (цитокератины 7,8,13,17,18,19) и на мембранах клеток (EGFR), оценивали полуколичественным способом по балльной шкале от 0 до 3, учитывая выраженность реакции и ее локализацию: 0 – отсутствие реакции, 1 – слабая реакция, 2 – умеренная реакция, 3 – сильная реакция.
Результаты реакций с антигенами, имеющими ядерную локализацию (PCNA, Ki67, p53, p63, bcl-2), оценивали по системе подсчета histochemical score. Система подсчета включает в себя интенсивность иммуногистохимической окраски по 3-балльной шкале и долю (%) окрашенных клеток и представляет собой сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски на балл, соответствующий интенсивности реакции. Интенсивность окраски 0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное окрашивание.
Формула подсчета следующая: histochemical score = ∑ P (i) х I, где i – интенсивность окрашивания, выраженная в баллах от 0 до 3; P (i) – процент клеток, окрашенных с разной интенсивностью. Максимальное значение гистосчета должно соответствовать 300.
Статистический анализ проводили с использованием пакета программ статистической обработки результатов SSPS 13.0 for Windows.
Результаты
Из 104 человек с диагнозом уротелиального рака были отобраны больные у которых РМП имел рецидивирующее течение – 34 человека.
При сравнительной характеристике клинических групп Та иТ1 необходимо отметить, что процент рецидивирующих опухолей резко возрастает с 34% в группе Та до 73% в группе Т1. Практически в половине процентов случаев (44%) рецидивы наблюдались у пациентов, первичная опухоль которых имела мультицентрический характер поражения слизистой мочевого пузыря.
В группе Та все 100% опухолей, которые рецидивировали в последующем, были высокодифференцированными (G1). Разнообразная картина наблюдается среди пациентов группы Т1: преобладали опухоли с высокой степенью злокачественности (G2,3), высокодифференцированные первичные опухоли (G1) наблюдались в 2,5 раза реже.
В группе пациентов Т1 среди больных с рецидивирующими опухолями отмечается существенный рост процента клеток с положительной экспрессией по сравнению с группой Та: среднее количество клеток с положительной экспрессией Ki67 в Та – 4%, в Т1 – 17,5%. Кроме того, необходимо отметить, что раковые клетки с интенсивной иммуногистохимической реакцией маркера Ki67 и р53 появляются только в тех случаях, когда уротелиальная карцинома имела в последующем рецидив. Аналогичная тенденция наблюдается в показателях положительной экспрессии и у остальных ядерных маркеров.
Рис. 1. Уротелиальный рак с инвазией в собственную пластинку слизистой оболочки мочевого пузыря. Умеренная и высокая экспрессия Кi-67 в ядрах уротелия.
Необходимо отметить особенности экспрессии Р53 среди пациентов группы Т1: позитивная экспрессия наблюдалась только у больных в первичной опухоли с рецидивами.
Рис. 2. Умеренная и выраженная экспрессия маркера Р53 в клетках уротелиальной карциномы с инвазией в собственную пластинку слизистой мочевого пузыря.
PCNA в обеих группах показал высокий процент экспрессии без существенных различий среди пациентов с рецидивами и без рецидивов.
При иммуногистохимической реакции на антигены, локализованные в цитоплазме, было установлено, что их экспрессия во всех исследованных группах больных является положительной. Достоверно значимых различий между группами больных по показателям иммуногистохимических реакций с цитокератинами (СК7, СК8, СК10/13, СК17, СК18, СК19) и рецептора эпидермального фактора роста (EGFR) не установлено.
Маркер Bcl2 не показал достоверной разницы в экспрессии ни в одной из изучаемых групп.
Выводы
Таким образом, проведенные исследования 13 моноклональных иммуногистохимических антител позволили сделать следующие выводы:
Экспрессия ск7 что это
Экспертное заключение – доктор медицинских наук, профессор кафедры патологической анатомии лечебного факультета РГМУ М.В. Самойлов
Учебное пособие выполнено в рамках инновационной образовательной программы Российского университета дружбы народов, направление «Комплекс экспортоориентированных инновационных образовательных программ по приоритетным направлениям науки и технологий»
ПРИКЛАДНЫЕ ВОПРОСЫ ИММУНОГИСТОХИМИИ Тема № 4. Значение клеточных белков в оценке гистогенеза опухолей Тема № 5. Рецепторные белки в неизмененных и опухолевых клетках Тема № 6. Белки – маркеры клеточного цикла Тема № 7. Факторы апоптоза и пролиферации
ПРАКТИЧЕСКИЕ ВОПРОСЫ ОНКОМОРФОЛОГИИ
В настоящее время иммуногистохимический метод исследования широко применяется для выявления неизвестной локализации первичной опухоли при наличии её метастазов. От 10 до 15% раковых опухолей характеризуются метастазами в различных органах, полостях и лимфатических узлах.
При морфологической диагностике метастатические опухоли, согласно рекомендациям Европейского общества медицинской онкологии (ESMO, 2004), целесообразно разделять на пять крупных категорий: аденокарцинома, плоскоклеточный рак, нейроэндокринный рак, недифференцированный рак, недифференцированная опухоль. Эти морфологические категории наряду с данными о распространённости процесса во многих случаях позволяют определить адекватный план обследования и лечения.
Частота случаев, когда заболевание сопровождалось развитием метастазов, а локализация первичной опухоли на момент морфологического исследования неизвестна, составляет 3-15% от всех онкологических заболеваний. При этом локализация первичного очага определяется при жизни в среднем у 30-40% пациентов, на аутопсии – у 60-70%.
Иммуногистохимическое исследование в зависимости от морфологического типа новообразования позволяет уточнить гистогенез опухоли и/или высказаться о вероятной локализации первичного очага. Большинство из этих опухолей представляют аденокарциномы молочной железы, толстого кишечника, легких, яичников, поджелудочной железы, предстательной железы и желудка.
В случае метастазов аденокарциномы задача иммуногистохимического исследования состоит в выявлении вероятного источника метастазирования.
Для этих целей в настоящее время используется целый ряд маркеров включая цитокератины 7 и 20, тиреоидный фактор транскрипции (TTF-1), CA125, CDX2, рецепторы к эстрогенам, GCDFP-15, лизоцим, мезотелин, простат-специфический антиген.
Цитокератин 7 (CK7) относится к семейству белков промежуточных филаментов, имеет молекулярную массу 54 кДа, выявляется в различных видах железистого эпителия. Антитела клона OV-TL (Dako) окрашивают цитоплазму различных видов клеток нормального и неопластического железистого эпителия, включая эпителий протоков. CK7 выявляется в клетках цилиндрического и железистого эпителия легких, шейки матки, молочной железы, желчевыводящих путей и собирательных трубочек почек. CK7 окрашивает переходный эпителий мочевого пузыря, эпителий яичников и легких. Иногда можно встретить положительное окрашивание эндотелия сосудов. В свою очередь, CK7 не экспрессируется в эпителиальных клетках желудочно-кишечного тракта, предстательной железы. Практически не выявляется CK7 в гепатоцитах, эпителии проксимальных и дистальных извитых канальцев почек, миоэпителиальных клетках, многослойном эпителии кожи, языка, пищевода и эктоцервикса. Моноклональные антитела OV-TL выявляют отдельные виды аденокарцином и могут быть использованы для проведения дифференциальной диагностики между CK7-позитивными тканями (такими как рак яичников и переходноклеточный рак) и CK7-негативными тканями (такими как аденокарциномы желудочно-кишечного тракта и рак предстательной железы).
Цитокератин 20 (CK20) является представителем кератина I типа, который непосредственно экспрессируется в эпителии желудка и тонкого кишечника, уротелии и клетках Меркеля кожи. Антитела (клон Ks 20.8, Dako) реагируют с соответствующим белком молекулярной массой 46 кДа. CK 20 – это основной белок зрелых энтероцитов и бокаловидных клеток; он специфически экспрессируется в эпителиальных клетках слизистой оболочки желудка и тонкого кишечника. Его также можно выявить в аденокарциномах толстого кишечника, желудка, поджелудочной железы, желчных капилляров, в муцинозных опухолях яичников, переходноклеточном раке мочевого пузыря и раке из клеток Меркеля. В свою очередь, в плоскоклеточных раках, аденокарциномах молочной железы, легких, эндометрия, не муцинозных опухолях яичников и мелкоклеточных карциномах легких CK 20 не экспрессируется.
Лизоцим катализирует гидролиз отдельных мукополисахаридов клеточной оболочки бактерий. Используется для выявления опухолей из гистиоцитов и лейкозных клеток миелоидного ряда. Он выявлен в клетках селезенки, легких, почек, лейкоцитах крови, плазматических клетках, слюне, молоке и слезной жидкости.
Мезотелин – клеточный гликопротеин (молекулярная масса 40 кДа), располагается на поверхности мезотелиальных клеток и связан с механизмами клеточной адгезии. Он также выявляется в мезотелиомах, эпителиальных раках яичников и некоторых плоскоклеточных раках. Клон 5В2 (Novocastra) окрашивает эпителиоидные мезотелиомы и аденокарциномы легких, яичников, опухоли брюшины, эндометрия, поджелудочной железы, желудка и толстого кишечника. Антитела не реагируют с тканью почек, печени, плаценты, кожи и щитовидной железы. Мезотелина много в обычных мезотелиальных клетках, из которых формируются злокачественные мезотелиомы и цистаденокарциномы яичников. Эти антитела вместе с антителами к калретинину могут быть использованы для выявления мезотелиом.
CDX2 – рекомбинантный белок прокариотов, соответствующий аминокислотному N-терминальному участку молекулы CDX2 человека. Является специфическим транскрипционным фактором клеток тонкого кишечника. Ген cdx2 кодирует интестинально-специфический транскрипционный фактор, его белок экспрессируется на ранних стадиях развития тонкого кишечника и может иметь значение в регулировании пролиферации и дифференцировки эпителиальных клеток тонкого кишечника. Играет важную роль в инициации дифференцировки клеток в зрелые энтероциты. Клон AMT28 (Novocastra) реагирует с 40кДа белком, расположенным в ядрах клеток. Он экспрессируется в ядрах эпителиальных клеток кишечника от двенадцатиперстной кишки до прямой кишки. Белок CDX2 экспрессируется также в первичных и метастатических опухолях толстого кишечника, а также выявляется при кишечной метаплазии желудка и кишечном типе рака желудка, в свою очередь, в нормальных эпителиальных клетках желудка он не встречается. Данный белок обнаруживается в ядрах только цилиндрического эпителия и раковых клетках колоректальных аденокарцином, таким образом с его помощью можно идентифицировать метастазы рака толстого кишечника.
CA125 – белок ракового антигена яичников. Моноклональные антитела (клон Ov185:1, Novocastra) распознают муциноподобный гликопротеин молекулярной массой около 200 кДа. Антитела окрашивают различные опухоли, такие как аденокарциномы толстого кишечника, аденокарциномы молочной железы, опухоли матки, бронхо-альвеолярные раки, эндометриоидные и серозные аденокарциномы яичников.
ER – рецепторы к эстрогенам. Клон 6F11 (Novocastra) взаимодействует с эстрогеновым рецептором альфа. Антитела окрашивают ядра с рецепторами к эстрогенам в эпителиальных и гладкомышечных клетках матки, а также ядра эпителия молочных желез. Выявление рецепторов к стероидным гормонам широко применяется при лечении гормонально-зависимых опухолей. Наличие рецепторов к эстрогенам является маркером рака молочной железы, а также может свидетельствовать о прогнозе заболевания и эффективности эндокринной терапии.
Простат-специфический антиген (ПСА) – представляет собой гликопротеин. Клон ER-PR8 (Dako) получен к белку молекулярной массой 35 кДа. ПСА биохимически и иммуногистохимически отличается от другого широко используемого маркера опухоли предстательной железы – кислой простатической фосфатазы. Он располагается в цитоплазме клеток ацинарного и протокового эпителия нормальной ткани, выявляется при доброкачественной гиперплазии предстательной железы и аденокарциноме. Эти антитела можно использовать для выявления метастазов рака предстательной железы, поскольку ПСА выделяется опухолевыми клетками простаты и определяется в плазме крови у больных с раком простаты.
GCDFP-15 – белок, который встречается при диффузной кистозной мастопатии, для которой характерны макро- и микрокисты, протоковая и дольковая гиперплазия и др. патология молочных желез. Кисты формируются за счет апокриновой секреции эпителиальными клетками. Жидкость кист содержит гликопротеины, включая уникальный 15 кДа мономер. В нормальной ткани подобный белок встречается в эпителии слезных, подъязычных и мелких слюнных желез, в клетках серозных оболочек, трахеальных и бронхиальных желез.
GCDFP-15 и PSA одновременно экспрессируются в опухолях молочных желез с положительной реакцией на рецепторы к андрогенам. Данный маркер может быть использован для выявления аденокарциномы молочной железы, протоковых раков слюнных желез и апокринового эпителия.
Часть маркеров, такие как ПСА для рака предстательной железы, TTF-1 для рака легких, работают моноспецифично. Другая часть маркеров этой панели характерна для нескольких опухолей: так, рецепторы к эстрогенам могут быть выявлены при раке молочной железы или яичников, CDX2 – при опухолях желудочно-кишечного тракта. Часть маркеров может характеризовать источник метастаза только комплексно: рецепторы к эстрогенам, мезотелин и CA125 характеризуют опухоли яичников.
Метастазы плоскоклеточного и нейроэндокринного рака без выявленного
первичного очага (Савелов Н.А., Петровичев Н.Н., 2006)
При метастазах плоскоклеточного рака проводить иммуногистохимическое исследование нецелесообразно, так как возможности метода не позволяют уточнить вероятный источник метастазирования. Это относится и к метастазам низкодифференцированного нейроэндокринного рака. Однако при метастазах высокодифференцированного нейроэндокринного рака (синоним – атипичный карциноид) коэкспрессия CK7 и TTF1 может свидетельствовать о локализации первичного очага в легком, а коэкспрессия CK20 и CDX2 – в органах ЖКТ.
Метастазы недифференцированного рака без выявленного первичного
очага (Савелов Н.А., Петровичев Н.Н., 2006)
У пациентов с метастазами без четких морфологических признаков железистой (аденогенной), нейроэндокринной или плоскоклеточной дифференцировки главной задачей дополнительных методов исследования является уточнение гистогенеза опухоли (точнее, установление направления дифференцировки опухолевых клеток). Для этого применяется следующая панель антител: р63, CК5, CK14 или CК5/CK6, CК18, СD56 (N-CAM).
Антитела к белку Р63 (клон 4А4, Dako). Белок Р63 принадлежит к семейству Р53 опухолевых супрессорных генов, которые также включают белок Р73. Эти белки регулируют процессы клеточной транскрипции и запускают процессы апоптоза в ответ на повреждение ДНК и развитие гипоксии. Р63 экспрессируется в ядрах базальных клеток различных видов эпителия. Белок Р63 выявляется в пролиферирующих клетках эпителия шейки матки, уротелия и предстательной железы. Он также экспрессируется в большинстве низкодифференцированных плоскоклеточных раков. Антитела к Р63 помогают дифференцировать доброкачественные и злокачественные опухоли предстательной железы.
Антитела к белку CD56 (клон МОС-1, Dako). Белок CD56 является антигеном клеток натуральных киллеров. Реагирует с CD4+ и CD8+, Т-клетками в периферической крови. CD56 можно выявить в нейробластоме и мелкоклеточном раке легких, а также некоторых других опухолях.
Цитокератины CK5/CK6 (клон D6/16 B4, Dako). Цитокератины относятся к семейству промежуточных филаментов и выявлены практически во всех клетках. Типы цитокератинов CK5/CK6 выявляются в мезотелиальных клетках и не встречаются в аденокарциномах. CK5/CK6 применяются как маркеры мезотелиомы и плоскоклеточного рака легких, болезни Боуэна (разновидности карциномы, поражающей чешуйчатые клетки эпидермиса кожи, но не распространяющейся на ее базальные слои). Они не встречаются в аденокарциномах легких, но окрашивают мезотелиому и базальные клетки желез простаты. Данные антитела не реагируют с тканями мезодермального происхождения, такими как мышцы и соединительная ткань. Цитокератины CK5/CK6 экспрессируются в низкодифференцированных аденокарциномах и выявляются в эпителиоидных мезотелиомах.
Цитокератин CK14 (клон LL002, BioGenex), молекулярная масса 50 кДа, – это кислый цитокератин первого типа, с помощью которого можно отличить многослойный плоский эпителий от простого эпителия. Цитокератин CK14 равномерно экспрессируется в цитоплазме всех клеток многослойного плоского ороговевающего эпителия. Моноклональные антитела к цитокератину CK14 помогают дифференцировать типы клеток в молочных железах при развитии аденокарциномы.
Цитокератин CK18 (клон DC10, Dako) – белок с молекулярной массой 45 кДа. Антитела реагируют с большинством видов простого эпителия, включая эпителий протоков и ацинусов желез. Данный белок экспрессируется в эпителии щитовидной железы, молочной железы, желудочно-кишечного тракта и дыхательной системы. Антитела используют для выявления аденокарцином легких, при этом они окрашивают цитоплазму опухолевых клеток из эпителия и не окрашивают опухолевые неэпителиальные клетки (глиомы, меланомы, остеосаркомы).