Экстранодальная инвазия что это
Особенности внутрикишечной опухолевой инвазии в проксимальном направлении при раке прямой кишки
И.А. Нечай, Г.И. Суханкина
Городская больница № 40
СПбГУ, медицинский факультет, кафедра хирургии
Аннотация. Представлены результаты гистологических исследований распространения «ракового поля» в проксимальном направлении при раке прямой кишки. Необходимость таких исследований обусловлена важностью сохранения дистальных отделов сигмовидной кишки, при выполнении передней резекции прямой кишки, с целью улучшения резервуарной и эвакуаторной функций. В результате определено минимальное расстояние от верхнего края опухоли, которое необходимо отступить при пересечении кишки, не нарушая онкологических принципов оперирования.
Клинические наблюдения о несомненной важности бережного отношения к дистальной части сигмовидной кишки при передних резекциях прямой кишки (ПК), побудили нас изучить распространенность ракового поля в проксимальном направлении от верхнего края раковой опухоли. Знания эти должны лечь в основу рекомендаций, насколько минимально допустимо отступать от верхнего края опухоли при резекции сигмовидной кишки, не нарушая онкологических принципов оперирования. Такая озабоченность связана с тем, что у больных, у которых при резекции ПК для анастомоза использовалась самая дистальная часть низводимой сигмовидной кишки, резервуарно-накопительная и эвакуаторная функции оказывались заметно лучше. Вместе с тем, заботясь об улучшении функциональных результатов операций, мы постоянно имели в виду важность соблюдения онкологических принципов оперирования, поскольку главным при лечении онкологических больных является, конечно, улучшение пятилетней выживаемости.
Распространение ракового процесса внутристеночно от края видимой опухоли ПК в дистальном направлении привлекало внимание ряда авторов. Такие исследования имеют чрезвычайно важное значение при оперативном лечении больных с низкой раковой опухолью ПК. При этой локализации злокачественной опухоли, с позиций функциональных результатов, важен каждый сантиметр сохраненной дистальной части кишки. Использование сшивающих аппаратов при резекции ПК позволяет в техническом плане проводить максимально низкие резекции кишки.
Распространенность инвазии в дистальном направлении при раке прямой кишки.
Распространенность раковой инвазии в дистальном направлении изучалась целенаправленными и тщательными морфологическими исследованиями. R.Willis приводит концепцию «опухолевого поля», в соответствии с которой новообразование развивается мультицентрически с формированием затем единого опухолевого узла. В.Ю.Клур с соавт. проводил серийные гистологические срезы не только в дистальном направлении, но и радиарно. Они установили, что контуры «опухолевого поля» имеют эксцентрическое распространение от основного узла с внутристеночной инвазией, которая в дистальном направлении составляет не менее 3,5-4,0 см при экзофитных опухолях, а при эндофитном росте увеличивается еще на 1,0-1,5 см. Г.И. Воробьев с соавт. исследовал 71 препарат прямой кишки, удаленный при брюшно-промежностной экстирпации. Они установили, что глубина опухолевой инвазии прогрессивно уменьшается в направлении от центра к периферии опухоли. Дистальный внутристеночный рост по подслизистому слою был зарегистрирован лишь в 2,2 % случаев и не превышал 15 мм. Глубина инвазии колоректального рака изучалась также с помощью компьютерного исследования, эндоректоэхографии. В результате была установлена незначительная по протяженности от опухолевого узла внутрикишечная инвазия опухолевого процесса в дистальном направлении. Практически это было претворено в жизнь, и на смену «правила 5 см» пришло «правило 2 см», т. е. достаточно отступить от нижнего края опухоли 2 см с тем, чтобы не нарушить основной онкологический принцип оперирования.
Распространенность опухолевой инвазии в проксимальном направлении в меньшей мере привлекала внимание специалистов. При пересечении кишки выше опухоли не возникает необходимости в строгой экономичности сохранения кишки, примыкающей к опухоли, так как всегда имеется достаточная часть остающегося участка левого фланга ободочной кишки. Вместе с тем наши специальные исследования с анализом длины сигмовидной кишки по дооперационным ирригограммам и размера резецированной части ее после передней резекции ПК показали несомненную важность максимально возможного сохранения для анастомоза дистальной части сигмовидной кишки. К подобному заключению нас подвело изучение функциональных результатов сфинктеросохраняющих резекций ПК. Все это побудило специально изучить распространенность ракового поля в проксимальном направлении от верхнего края видимой опухоли. Результаты таких исследований были нужны для определения минимального расстояния, которое необходимо отступать от верхнего края раковой опухоли при пересечении кишки для соблюдения онкологических принципов оперирования.
После фиксации препарата в проксимальном направлении от видимого верхнего края опухоли последовательно проводились пересечения кишечной стенки с интервалом 5мм (рис. 1).
Результаты исследования. Представляем наблюдение, характеризующее отсутствие опухолевой инвазии по кишечной стенке.
Мужчина 54 года, рак анального канала и ПК, выполнена брюшнопромежностная экстирпация ПК. Гистологическое исследование 31261−31272.
Макропрепарат: блюдцеобразно возвышающееся над поверхностью кишки новообразование диаметром 6 см, прорастает все стенки кишки. От края опухоли в проксимальном направлении макроскопически определяется инфильтрация стенки на протяжении 3,5 см.
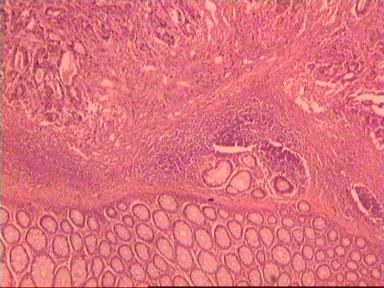
Микроскопическое исследование: высокодифференцированная слизеобразующая аденокарцинома ПК, прорастание всей толщи стенки кишки, врастание опухоли в жировую ткань. В опухоли очаги некроза, выраженная мононуклеарная реакция. От проксимального края видимой инвазии уже в 1 мм внутристеночного роста опухоли нет. (Рис. 2). Метастазов аденокарциномы в лимфатических узлах и жировой ткани не выявлено.
Рис. 2. Микропрепарат слизеобразующей аденокарциномы ПК
Такие данные были получены и при аденокарциноме, и при плоскоклеточном раке ПК. Приведем наблюдение, свидетельствующее о распространении опухолевого роста по кишке в проксимальном направлении. Мужчина 73 года, рак ПК, выполнена передняя резекция ПК. Гистологическое исследование № 869−870; 871−882. Макропрепарат: опухоль 5 см с кратером, циркулярно охватывающая просвет кишки, прорастание всех слоев кишки и прилежащей жировой ткани, участки абсцедирования.
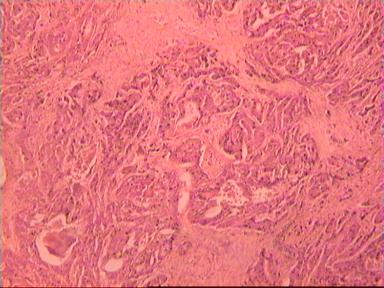
Микроскопическое исследование: аденокарцинома разной степени дифференцировки. В 5 мм вне видимой опухоли − аденокарцинома в подслизистом, мышечных слоях, в клетчатке, с абсцедированием (рис 3). На срезах через 10 мм от видимого края новообразования опухолевого роста нет.
 |  |
| А | Б |
Рис. 3. Микропрепарат аденокарциномы ПК разной степени дифференцировки
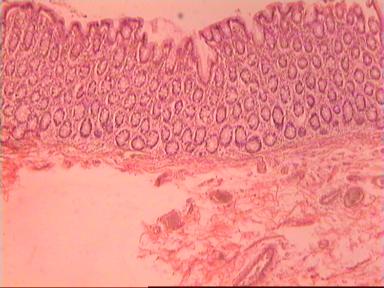
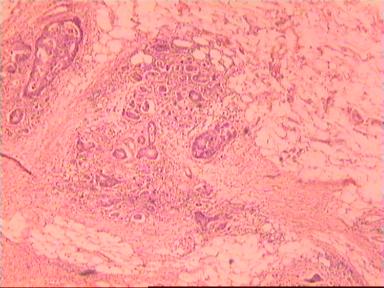
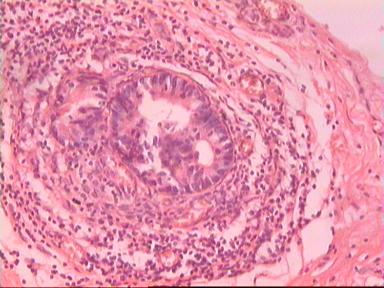
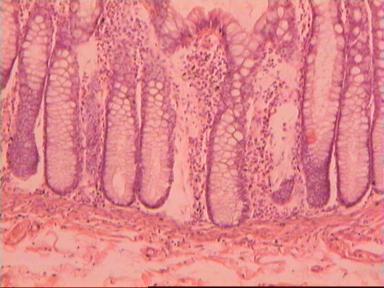
Приведем еще одно наблюдение, свидетельствующее о несомненном распространении опухолевого роста по кишке в проксимальном направлении. Женщина 73 года, рак ПК, выполнена резекция ПК по Гартману. Макропрепарат: экзофитная опухоль 5 х 5 см, прорастание всех слоев кишки, регионарные лимфоузлы не определяются.
 |  |  |
| А | Б | В |
Рис. 4. Микропрепарат аденокарциномы ПК разной степени дифференцировки
Рак прямой кишки. Инвазия опухоли. Обсуждение результатов исследования.
Данные исследования убедительно свидетельствуют, что раковая инвазия в проксимальном направлении от верхнего видимого края раковой опухоли ПК не имеет тенденции к значительному распространению, а в основном ограничена контурами макроскопического «ракового узла» или инвазией по кишечной стенке не более чем на 5мм от него. Лишь в 23,5 % случаев было установлено распространение ракового поля в проксимальном направлении, причем максимально зарегистрированная инвазия была в 20мм от видимого края опухоли ПК.
Вопреки ожиданиям не выявилось повышенной тенденции к внутристеночному росту при низкодифференцированной аденокарциноме, слизистых и плоскоклеточных формах рака ПК. Следовательно, отступление от верхнего края опухоли на 4−5 см в проксимальном направлении с онкологических позиций вполне оправдано и нет необходимости удалять здоровую и функционально полноценную часть кишки. Однако нужно учитывать, что уровень пересечения кишки выше опухоли во многом определяется высотой перевязки основного кровеносного сосуда, которым для этой зоны является нижняя брыжеечная артерия, особенностями кровоснабжения конкретного участка кишки и вовлеченностью в онкопроцесс лимфатического аппарата. Намечая линию пересечения сигмовидной или нисходящей части ободочной кишки, нужно учитывать эти обстоятельства и по возможности бережно, экономно относиться к удалению этого отдела толстой кишки, помня, что инвазия опухоли по стенке кишки незначительна.
Таким образом, внутрикишечная инвазия злокачественного роста в проксимальном направлении от видимого края опухоли ПК наблюдается в 23,5 % случаев и не превышает по протяженности 20 мм. В остальных случаях «раковое поле» ограничивается контурами основного видимого новообразования или распространяется не более чем на 5 мм от него.
Уровень пересечения кишки на 4−5 см выше проксимального края видимой раковой опухоли ПК онкологически оправдан, если учесть распространение «ракового поля» по кишечной стенке. Однако объем операции, конечно, зависит от особенностей кровоснабжения конкретного участка кишки, вовлеченностью в онкопроцесс лимфатических узлов и некоторых других факторов.
Особые показания к адъювантной лучевой терапии при раке молочной железы T2N1M0 после радикальной мастэктомии
В обзоре приведены данные исследований, демонстрирующие влияние различных факторов риска на выбор лучевой терапии при раке молочной железы T2N1M0. Следует рассмотреть возможность проведения лучевой терапии после радикальной мастэктомии при наличии как минимум двух из следующих факторов риска: возраст менее 40 лет, наличие позитивного или близкого (менее 1 мм) края резекции, экстранодальное распространение опухоли, низкая степень дифференцировки, лимфоваскулярная инвазия, люминальный В или трижды негативный подтип рака молочной железы.
В обзоре приведены данные исследований, демонстрирующие влияние различных факторов риска на выбор лучевой терапии при раке молочной железы T2N1M0. Следует рассмотреть возможность проведения лучевой терапии после радикальной мастэктомии при наличии как минимум двух из следующих факторов риска: возраст менее 40 лет, наличие позитивного или близкого (менее 1 мм) края резекции, экстранодальное распространение опухоли, низкая степень дифференцировки, лимфоваскулярная инвазия, люминальный В или трижды негативный подтип рака молочной железы.
От локального или локорегионарного рецидива рака молочной железы (РМЖ) не застрахованы ни радикально пролеченные больные с местнораспространенным процессом, прошедшие длительную комплексную терапию, ни пациентки с небольшими опухолями и достаточно благоприятным прогнозом. По данным разных авторов, частота развития изолированных рецидивов в области грудной стенки или сопровождающихся поражением зон регионарного лимфооттока у пациенток с инвазивным РМЖ стадий I–IIIA варьируется от 10 до 20% [1]. Такие больные заслуживают особого внимания, поскольку некоторым из них потребуется завершающая точка в виде послеоперационной лучевой терапии, направленной прежде всего на снижение риска рецидива и улучшение отдаленных результатов лечения. Несмотря на то что специалисты, занимающиеся данной проблемой, руководствуются рекомендациями крупных мировых сообществ, основанными на результатах большого количества исследований наивысшего уровня достоверности, в спорных ситуациях, к которым безусловно относится стадия T2N1M0 после радикальной мастэктомии, нередко звучат диаметрально противоположные мнения.
Показано ли облучение пациенткам с первичной опухолью размером менее 5 см и ограниченным количеством пораженных лимфоузлов (от одного до трех) после мастэктомии? Или такое лечение должны получать только больные с большим размером опухоли и более массивным метастатическим процессом в регионарных лимфоузлах? На какие факторы риска следует обращать более пристальное внимание при решении данного вопроса? Стоит ли в случае принятия положительного решения о лучевой терапии подвергать полномасштабному облучению все традиционно принятые зоны, или можно ограничиться отдельными? Специалисты достаточно часто задаются подобными вопросами.
Итак, РМЖ T2N1M0 после выполнения радикальной мастэктомии. 2007 г. стал переломным в плане отношения к адъювантному облучению для этой группы пациенток. Многие известные сообщества онкологов высказались в поддержку всестороннего рассмотрения возможности его назначения. С этим согласились и эксперты NCCN (National Comprehensive Cancer Network – Национальная всеобщая онкологическая сеть), проанализировав данные многочисленных рандомизированных исследований. Специалисты предложили при наличии от одного до трех пораженных лимфоузлов «серьезно рассмотреть проведение лучевой терапии на грудную стенку, надключичную и подключичную области» [2]. Как показал опубликованный в 2016 г. анализ L.L. Frasier и соавт. [3], основанный на данных SEER, за последующие четыре года ситуация действительно существенно изменилась. Авторы проанализировали почти 62,5 тысячи случаев РМЖ после мастэктомии. Все пациентки были разделены на три группы. В первую вошли больные с однозначным показанием к адъювантному облучению (опухоль ≥ 5 см, число пораженных лимфоузлов > 4), во вторую – пациентки без показаний (опухоль ≤ 5 см, отсутствие метастазов в лимфоузлах). Третью группу составили пациентки с опухолями ≤ 5 см и количеством выявленных метастатических лимфоузлов от одного до трех. Оказалось, что в этой когорте с 2007 по 2011 г. процент назначения послеоперационной лучевой терапии возрос с 26,9 до 40,5% (предположительно именно за счет больных со стадией T2N1M0). Ежегодный прирост составил от 2 до 9%. В двух других группах изменений не зафиксировано. Это говорит о том, что вопрос, не упускаем ли мы благополучную на первый взгляд группу пациенток после мастэктомии, вызывает обеспокоенность у специалистов во всем мире.
На какие же факторы риска следует обращать особое внимание, принимая решение о назначении адъювантной лучевой терапии для снижения риска рецидива в области грудной стенки? Такие факторы риска, как размер первичной опухоли менее 5 см, мультифокальность и наличие внутрипротокового компонента, не ассоциированы с повышенным риском локального рецидива, равно как и количество пораженных лимфоузлов (один, два или три). Однако последний фактор неразрывно связан с таким показателем, как количество исследованных лимфоузлов. R.V. Iyer и соавт. показали, что в соответствии со статистической моделью для достижения 90% вероятности аккуратности стадирования и подтверждения статуса N1 у больной с Т1 и пораженными одним, двумя или тремя лимфоузлами необходимо исследовать восемь, 15 или 20 лимфоузлов соответственно [4]. Если количество пораженных лимфоузлов менее восьми, то при обнаружении одного метастатического лимфоузла риск N2 составит 13%, двух – 55%, трех – до 93%. В подобных ситуациях следует задуматься об облучении подмышечной области. Как показали результаты недавних исследований, в отсутствие лимфодиссекции эффективность облучения подмышечной зоны сопоставима с эффективностью операции. Процент осложнений такой же или меньше [5].
О повышенном риске рецидива в области грудной стенки можно говорить при наличии следующих клинических, патоморфологических и иммуногистохимических факторов:
Маловероятно, что в случае HER2-позитивных опухолей лучевая терапия эффективно предотвратит рецидив в отсутствие таргетной терапии трастузумабом. По крайней мере при люминальном В подтипе (в сочетании с экспрессией HER2-neu или без нее) показано облучение грудной стенки, а при трижды негативном раке – возможно, всех зон регионарных лимфоузлов.
Итак, в случае T2N1M0 после радикальной мастэктомии при наличии как минимум двух из указанных выше факторов риска (возраст менее 40 лет, наличие позитивного или близкого (менее 1 мм) края резекции, экстранодального распространения опухоли, низкой степени ее дифференцировки и лимфоваскулярной инвазии, а также при обнаружении люминального В или трижды негативного молекулярного подтипа рака молочной железы) следует облучить хотя бы грудную стенку для снижения риска локального рецидива. Вероятно, в большинстве клинических ситуаций этой областью можно ограничиться.
Лучевая терапия на зоны регионарного лимфооттока чревата усугублением частоты и выраженности лимфостаза, развитием пневмофиброзов и сердечно-сосудистых осложнений. Подобный риск повышается при использовании 2-D-конвенционального облучения с более проблематичной стыковкой полей. Учитывая такую небезобидность лучевой терапии на регионарные зоны, при раннем раке подход к ее назначению должен быть максимально индивидуальным и взвешенным.
По мнению экспертов NCCN, если решение о лучевой терапии при Т1–2N1 принято, следует проводить облучение грудной стенки и надключичной области. С этим сложно не согласиться, особенно когда имеют место выявленная неадекватная подмышечная лимфодиссекция при количестве удаленных лимфоузлов менее восьми (необходимо рассмотреть возможность облучения подмышечной области), выраженная лимфоваскулярная инвазия, а также трижды негативный РМЖ.
Для подтверждения последнего предположения можно обратиться к результатам двух недавних работ. J. Wang и соавт. оценивали эффективность лечения 681 больной ранним тройным негативным РМЖ стадий I–II после радикальной мастэктомии и адъювантной химиотерапии в зависимости от добавления лучевой терапии в полном объеме (грудная стенка и зоны регионарного лимфооттока) либо без таковой. Причем основное внимание уделялось показателям пятилетней безрецидивной и пятилетней общей выживаемости. Средний период наблюдения при этом составил 86,5 месяца. Оказалось, что адъювантная лучевая терапия позволяет увеличить показатели безрецидивной выживаемости до 88,3% (против 74,6% в отсутствие таковой) и общей выживаемости до 90,4% (против 78,7%) без существенного увеличения токсичности [10].
T.J. Whelan и соавт. в подгруппе больных (как правило, с T1–2N1) после радикальной резекции с отрицательными рецепторами эстрогенов и прогестерона при облучении молочной железы и всех зон регионарных лимфоузлов установили тенденцию к лучшей общей выживаемости по сравнению с теми, у кого облучению подвергалась только молочная железа (81,3 против 73,9%) [11].
Вопрос о включении в облучаемые зоны парастернальной области остается одним из наиболее дискутабельных, несмотря на то что за последние три года появились результаты рандомизированных исследований, в частности EORTC 22922 и MA20, а также метаанализ 2013 г. Ни в одном из них не выявлено явных преимуществ добавления парастернального поля. Вероятно, поэтому рекомендации St. Gallen – 2015 не содержат прямых указаний на необходимость облучения данной зоны.
Наиболее подходящим для нашей клинической ситуации представляется исследование французских авторов [12]. Из 1334 больных после радикальной мастэктомии, включенных в исследование, почти 90% имели Т1–2. Больных с N1 насчитывалось более половины. Пациентки были рандомизированы на группы в соответствии с возрастом, рецепторным статусом и лекарственным лечением. В контрольной группе облучали грудную стенку и надподключичную зону. В экспериментальной группе лучевая терапия проводилась дополнительно на парастернальные лимфоузлы. Анализ десятилетней общей выживаемости продемонстрировал статистически недостоверное преимущество – 3,3%. Причина скорее всего в том, что изначально авторы предполагали более значительный выигрыш – 10%. При этом анализ по подгруппам в зависимости от локализации опухоли (медиальный/центральный или латеральный квадрант), наличия или отсутствия пораженных подмышечных лимфоузлов (N1 или N0), проведения адъювантной химиотерапии либо отказа от нее также не выявил достоверных преимуществ включения в зону облучения парастернального поля. Между тем при наличии медиальной или центральной локализации и N1 проведение парастернального облучения приводило к более существенной разнице в показателях выживаемости как среди тех, кто получал адъювантную химиотерапию, так и среди тех, кому она не проводилась.
Таким образом, расширение зон послеоперационного облучения с захватом надподключичной области в большей степени показано пациенткам с трижды негативным РМЖ, особенно при условии неадекватного исследования подмышечных лимфоузлов (когда необходимо облучение подмышечной зоны), а также больным с выраженной лимфоваскулярной инвазией, даже при стадии T3N0M0, как рекомендуют специалисты Американского колледжа радиологии (American College of Radiology). При локализации опухоли во внутреннем или центральном квадранте молочной железы и поражении подмышечных лимфоузлов, особенно в сочетании с другими факторами риска, необходимо рассмотреть возможность облучения парастернальной области.
Итак, больные РМЖ T2N1M0 после радикальной мастэктомии требуют индивидуального подхода. При наличии весомых факторов риска целесообразно облучение хотя бы грудной стенки, в ряде случаев надподключичных, а также парастернальных и подмышечных лимфоузлов. В некоторых ситуациях оставить данную категорию пациенток без облучения, не взвесив тщательно все аргументы «за» и «против», было бы опрометчиво.
Экстранодальная инвазия что это
Медицинский радиологический научный центр им. А.Ф. Цыба — филиал ГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Калужская область, Обнинск, Россия
Медицинский радиологический научный центр им. А.Ф. Цыба — ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, Обнинск, Россия
Медицинский радиологический научный центр им. А.Ф. Цыба — ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, Обнинск, Россия
Медицинский радиологический научный центр им. А.Ф. Цыба — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Обнинск, Россия
Медицинский радиологический научный центр им. А.Ф. Цыба — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Обнинск, Россия
Неинвазивная фоликуллярная опухоль щитовидной железы с ядрами папиллярного типа
Журнал: Онкология. Журнал им. П.А. Герцена. 2019;8(5): 358-361
Зибиров Р. Ф., Корецкая А. Е., Сидорин А. В., Шинкаркина А. П., Мозеров С. А. Неинвазивная фоликуллярная опухоль щитовидной железы с ядрами папиллярного типа. Онкология. Журнал им. П.А. Герцена. 2019;8(5):358-361.
Zibirov R F, Koretskaya A E, Sidorin A V, Shinkarkina A P, Mozerov S A. Noninvasive follicular thyroid tumor with papillary nuclei. P.A. Herzen Journal of Oncology. 2019;8(5):358-361.
https://doi.org/10.17116/onkolog20198051358
Медицинский радиологический научный центр им. А.Ф. Цыба — филиал ГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Калужская область, Обнинск, Россия
Приведено клиническое наблюдение неинвазивной фолликулярной опухоли щитовидной железы с ядрами папиллярного типа, рассмотрены особенности ее гистопатологической картины.
Медицинский радиологический научный центр им. А.Ф. Цыба — филиал ГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Калужская область, Обнинск, Россия
Медицинский радиологический научный центр им. А.Ф. Цыба — ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, Обнинск, Россия
Медицинский радиологический научный центр им. А.Ф. Цыба — ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, Обнинск, Россия
Медицинский радиологический научный центр им. А.Ф. Цыба — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Обнинск, Россия
Медицинский радиологический научный центр им. А.Ф. Цыба — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Обнинск, Россия
Вследствие высокой заболеваемости и смертности трудности в постановке диагноза и лечении опухолевых процессов являются одной из главных проблем в медицине, а правильная и своевременная их диагностика, проведенная в соответствии с современными системами классификации, позволяет избежать ряда тяжелых осложнений. Показано, что распространенность злокачественных новообразований щитовидной железы с 2006 по 2016 г. возросла с 66 до 105 на 100 000 населения, а к окончанию 2016 г. количество пациентов, состоящих на учете по данной патологии, составило 154 824 [1].
Согласно новой Международной классификации опухолей эндокринной системы, для инкапсулированных опухолей щитовидной железы с отсутствием капсулярной и/или сосудистой инвазии, а также изменением ядер опухолевых клеток, характерных для папиллярного рака щитовидной железы, введена классификационная категория «неинвазивная фолликулярная опухоль щитовидной железы с ядрами папиллярного типа» (НИФОЯПТ). Эта категория входит в группу «другие инкапсулированные опухоли щитовидной железы фолликулярного строения» [2]. Исследования показали медленное и благоприятное клиническое течение НИФОЯПТ, поэтому в данное время ее относят к доброкачественным новообразованиям щитовидной железы. Это свидетельствует о том, что лечение пациентов с НИФОЯПТ может быть сведено к минимальному, а именно к гемитиреоидэктомии, а тотальная тиреоидэктомия и радиойодтерапия не имеют при данной патологии никаких преимуществ. В дополнение к отсутствию психологической нагрузки от диагноза «рак» снижаются количество осложнений, которые могут возникнуть после тотальной тиреоидэктомии, а также риск возникновения вторичных опухолей после радиойодтерапии [3]. Такой подход повышает ответственность лечащего врача и врача-патологоанатома при постановке диагноза НИФОЯПТ и требует наличия комплекса четких морфологических критериев. Ниже представлено клиническое наблюдение, знакомство с которым считаем полезным для диагностики и определения тактики лечения данной патологии.
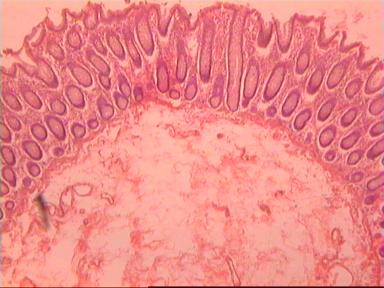
У женщины 36 лет выявлено узловое образование в левой доле щитовидной железы. При пальпации левой доли определялся узел размером 2×2×1 см с четкими контурами, мягкоэластической консистенции, подвижный при глотании. Лимфатические узлы шеи не увеличены. По результатам функциональных тестов и с помощью радиоиммунологического анализа выявлены следующие отклонения: повышенный уровень тиреотропного гормона — 6,6 мкМЕ/мл (при норме 0,27—4,0 мкМЕ/мл), сниженный уровень свободного Т4 — 0,71 нг/дл (при норме 0,8—2,1 нг/дл), повышенный уровень антител к тиреопероксидазе — 393,6 МЕ/мл (при норме 0—35 МЕ/мл). По данным ультразвукового исследования в левой доле железы, ближе к верхнему полюсу обнаружено неоднородное, окруженное капсулой, изоэхогенное образование размером 22×13×15 мм с выраженной васкуляризацией, участком гипоэхогенной структуры по периферии (рис. 1). 





Обсуждение
Диагноз НИФОЯПТ ставится при наличии определенных критериев. Опухоли преимущественно имеют фолликулярное строение, хотя в редких случаях могут иметь солидный, трабекулярный или инсулярный компоненты, однако такие участки не должны занимать более 30% [4]. Наличие высоких столбчатых клеток, криброзных, папиллярных структур, псаммомных телец, очагов некроза исключает диагноз НИФОЯПТ [5]. В клетках НИФОЯПТ характерно наличие не более 3 фигур митоза в 10 полях зрения при большом увеличении (×400) [6]. В строме НИФОЯПТ может присутствовать внутриопухолевый фиброз различной степени, а коллоид может быть как гиперэозинофильным при микрофолликулярном варианте, так и гипоэозинофильным при макрофолликулярном варианте. К критериям, исключающим НИФОЯПТ, относятся инвазия опухоли в собственную капсулу, паренхиму щитовидной железы, а также сосудистая и лимфатическая инвазия [7]. Согласно новой классификации ВОЗ опухолей эндокринной системы, к группе «другие инкапсулированные опухоли щитовидной железы фолликулярного строения» относят: 1) НИФОЯПТ, для которой характерны отсутствие капсулярной и/или сосудистой инвазии, а также изменения ядер опухолевых клеток как при папиллярном раке щитовидной железы; 2) фолликулярную опухоль неопределенного злокачественного потенциала (ФОНЗП), которая характеризуется сомнительной капсулярной и/или сосудистой инвазией и отсутствием изменений ядер опухолевых клеток, подобных таковым при папиллярном раке щитовидной железы; 3) высокодиффренцированную опухоль неопределенного злокачественного потенциала (ВОНЗП), характеризующуюся сомнительной капсулярной и/или сосудистой инвазией и наличием изменений ядер опухолевых клеток, характерных для папиллярного рака щитовидной железы [8, 9]. К достоверным признакам инвазии опухолью собственной капсулы относят случаи, когда опухоль полностью прорастает или распространяется за пределы собственной капсулы. Все остальные случаи очаговой инвазии опухоли в собственную капсулу относятся либо к сомнительной инвазии, либо инвазией не считаются. Для оценки сосудистой инвазии вовлеченные сосуды должны локализоваться внутри или снаружи фиброзной капсулы опухоли, а внутрисосудистая опухоль должна быть окружена эндотелием и только в одном случае эндотелий может отсутствовать, когда опухоль прикреплена к сосудистой стенке и этот процесс сопровождается тромбообразованием [10]. В случае наличия капсулярной и/или сосудистой инвазии опухоль необходимо отнести в категорию карцином: 1) при изменениях ядер опухолевых клеток, характерных для папиллярного рака, – инвазивный инкапсулированный фолликулярный вариант папиллярного рака; 2) при сомнительных изменениях ядер опухолевых клеток, характерных для папиллярного рака, – высокодифференцированная карцинома без дополнительных уточнений; 3) при отсутствии изменений ядер опухолевых клеток, подобных таковым при папиллярном раке, — фолликулярная карцинома. При отсутствии капсулярной и/или сосудистой инвазии и изменений ядер опухолевых клеток, подобных таковым при папиллярном раке, опухоль относится к фолликулярной аденоме.
В представленном наблюдении опухоль была инкапсулированной, в ткани опухоли обнаружены очаговые изменения ядер опухолевых клеток, характерные для папиллярного рака щитовидной железы, отсутствовала сосудистая и капсулярная инвазия опухоли, что дало нам основание классифицировать ее как НИФОЯПТ. До появления нового пересмотра Международной классификации опухолей щитовидной железы представленное наблюдение следовало бы отнести к пятому подтипу фолликулярного варианта папиллярного рака, характеризующегося наличием опухолевой капсулы без признаков ее инвазии, а также очаговыми изменениями ядер опухолевых клеток, подобными таковым при папиллярном раке щитовидной железы. Исследователи проводили попытки более детально классифицировать морфологически гетерогенную группу фолликулярного варианта папиллярного рака [11].
Молекулярно-генетический профиль ФОНЗП, ВОНЗП и НИФОЯПТ характеризуется присутствием точечных мутаций генов семейства RAS, редко наличием структурных перестроек хромосом, а также отсутствием мутации V600E гена BRAF, что объединяет эти опухоли с фолликулярными или имеющими фолликулярное (непапиллярное) строение новообразованиями [8]. В исследуемой опухоли не было обнаружено RAS мутаций, RET/PTC перестроек и мутаций гена BRAF.
В настоящее время информации по клинической оценке неинвазивной фолликулярной опухоли с ядрами папиллярного типа мало, но достаточно данных литературы, которая описывает благоприятное клиническое течение НИФВПР щитовидной железы [12, 13]. Так, показано, что у 31 пациента с НИФВПР через 11 лет после хирургического лечения в объеме гемитиреоидэктомии не обнаружено ни метастазов, ни рецидивов [14]. Y. Nikiforov и соавт. [3] у 109 пациентов с НИФВПР также не выявили признаков рецидива заболевания. В группе из 96 пациентов с НИФВПР, которым была произведена гемитиреоидэктомия, через 11 лет наблюдения проф. L. Thompson [15] не обнаружил признаков рецидива заболевания и метастазов в лимфатических узлах.
Данная работа проводилась в рамках выполнения тем государственного задания МРНЦ им. А.Ф. Цыба — филиала ФГБУ «НМИЦ радиологии» Минздрава России за 2015—2016 гг. и первой половине 2017 г., промежуточные итоги выполнения которых нашли отражение в обобщающей публикации [16].
Заключение
Правильная диагностика НИФОЯПТ важна для выбора последующего лечения пациента и возможна лишь с учетом всех имеющихся характеристик процесса, включая гистологические и иммуногистохимические методы исследования. В представленном случае инкапсулированная опухоль имела микрофолликулярное и нормофолликулярное строение и в ней определялись два компонента: первый из фолликулов, выстланных мономорфными тиреоцитами с гиперхромными ядрами, напоминающими строение фолликулярной аденомы щитовидной железы, второй из фолликулов, выстланных полиморфными тиреоцитами с ядерными признаками папиллярного рака щитовидной железы: напластование ядер клеток, внутриядерные включения, борозды, просветления. Признаков инвазии опухоли в собственную капсулу и ее сосуды не выявлено. При иммуногистохимическом исследовании в клетках опухоли определена экспрессия маркеров злокачественности — галектина-3, HBME-1, цитокератина-19. При молекулярно-генетическом исследовании не выявлено мутаций в анализируемых генах.
Таким образом, особенности клинического течения, терапии и морфологического строения НИФОЯПТ указывают на необходимость более внимательного исследования гистопатологической, иммуногистохимической и молекулярно-генетической картины данных новообразований.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.