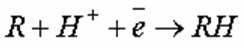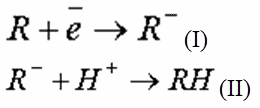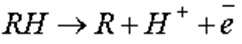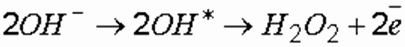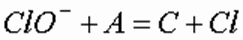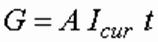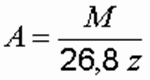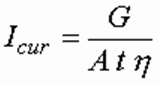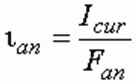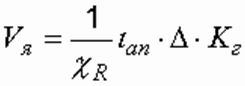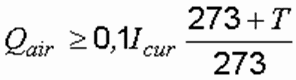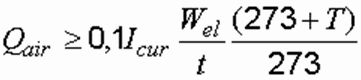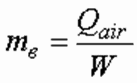Электролиз воды для чего
Электролиз воды

Всего получено оценок: 179.
Всего получено оценок: 179.
Процесс электролиза – это окислительно-восстановительная реакция, возможная только под действием электричества. Электролиз протекает в расплавах и растворах. В лабораториях для получения чистых газов – водорода и кислорода – проводят электролиз воды.
Что такое электролиз
Для осуществления процесса электролиза в раствор или в расплав помещают два электрода, подключённых к противоположным полюсам источника тока. В качестве электродов чаще всего используется металл или графит, так как эти материалы пропускают электрический ток.
Под действием электричества электрод, подключенный к отрицательному полюсу, становится катодом, а электрод, соединённый с положительным полюсом, превращается в анод. Катод и анод притягивают противоположные ионы: к катоду направляются положительно заряженные катионы, к аноду – отрицательно заряженные анионы.
Катод является окислителем, на нём происходит процесс восстановления катионов. На аноде протекает процесс окисления: анод восстанавливает анионы и окисляется.
Процесс электролиза можно разделить на два этапа. Сначала происходит диссоциация – распад электролита (раствора или расплава) на ионы. Затем протекают реакции на электродах.
Электролиз воды
Если пропустить через воду электрический ток, жидкость начнёт диссоциироваться на составляющие молекулу воды атомы. В результате процесса электролиза воды получают кислород и водород. Однако в зависимости от природы электродов можно получить озон и перекись водорода.
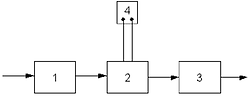
Схема электролиза воды:
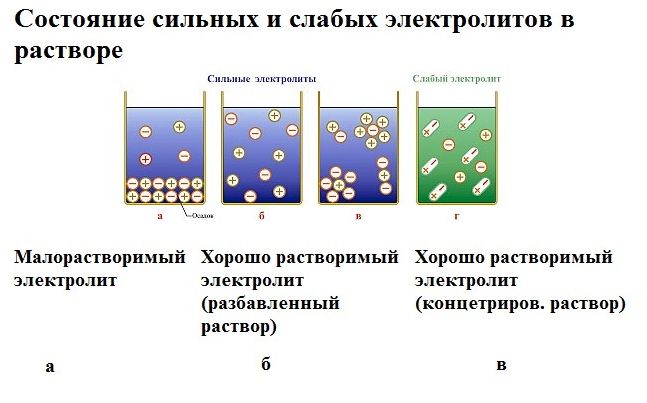
Вода – слабый электролит, поэтому электролиз чистой, дистиллированной воды протекает медленно или не идёт вовсе. Для ускорения процесса в воду добавляют сильный электролит, увеличивающий проводимость электрического тока.
Электролит выбирается так, чтобы исключить конкуренцию между катионами электролита и катионами воды (H + ). В противном случае водород не будет произведён. Чтобы исключить конкуренцию, необходимо подобрать электролит, катионы которого будут иметь меньший электродный потенциал, чем H + воды. На роль катиона электролита подходят:
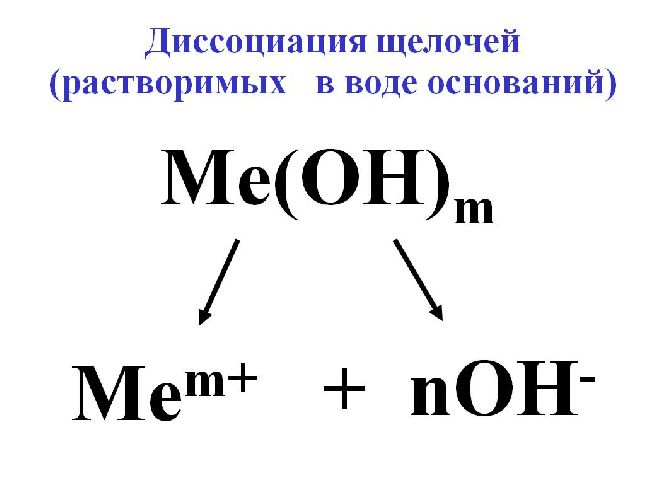
Для электролиза воды используются сильные щелочи: гидроксид калия (KOH) или натрия (NaOH). В некоторых случаях применяется сильная кислота, например, H2SO4.
Что мы узнали?
Электролиз – процесс образования и оседания на электродах ионов вещества под действием электрического тока. Вода разделяется на катионы водорода и анионы кислорода. Положительные катионы движутся к катоду, отрицательные анионы – к аноду. В некоторых случаях вода диссоциируется на озон и перекись водорода. Из-за низкой способности к диссоциации в воду добавляется сильный электролит, не мешающий образованию водорода и кислорода. Чаще всего добавляется щёлочь или сильная кислота.
Процедура электролиза воды, методики, для чего она, домашний эксперимент
электролиз воды это разложение воды на ее элементарные составляющие под действием электрического тока. При этом водород и молекулярный кислород образуются на двух инертных поверхностях, H2 и O2. Эти две поверхности более известны под названием электродов.
Теоретически, объем Н2 образуется должен быть в два раза больше объема O2. Почему? Поскольку молекула воды имеет отношение H / O, равное 2, то есть два H для каждого кислорода. Это соотношение проверяется непосредственно с помощью его химической формулы H2О. Однако многие экспериментальные факторы влияют на полученные объемы.
Если электролиз проводят внутри труб, погруженных в воду (верхнее изображение), столб воды меньшей высоты соответствует водороду, поскольку на поверхности жидкости присутствует большее количество газа, оказывающего давление. Пузырьки окружают электроды и в конечном итоге поднимаются после истечения давления пара воды.
Обратите внимание, что трубки отделены друг от друга таким образом, что существует низкая миграция газов от одного электрода к другому. В низких масштабах это не представляет неизбежного риска; но в промышленных масштабах газовая смесь Н2 и O2 Это очень опасно и взрывоопасно.
По этой причине электрохимические ячейки, в которых проводится электролиз воды, очень дороги; им нужны конструкция и элементы, которые гарантируют, что газы никогда не смешиваются, выгодная подача тока, высокая концентрация электролитов, специальные электроды (электрокатализаторы) и механизмы для хранения H.2 произведенный.
Электрокатализаторы представляют собой трение и в то же время крылья для прибыльности электролиза воды. Некоторые состоят из оксидов благородных металлов, таких как платина и иридий, цены на которые очень высоки. Именно в этот момент исследователи объединяют усилия для разработки эффективных, стабильных и дешевых электродов..
Причиной этих усилий является ускорение образования О2, который дается на более низких скоростях по сравнению с H2. Это замедляется электродом, где образуется О2 как общее следствие, применение потенциала намного больше, чем необходимо (перенапряжение); что то же самое, чтобы снизить производительность и более высокие расходы.
Реакция электролиза
Электролиз воды включает в себя много сложных аспектов. Однако в общих чертах его основа лежит в простой глобальной реакции:
Полуклеточные реакции
Вышеизложенное можно обобщить следующими химическими уравнениями для полуклеточных реакций:
Реакции полуэлемента изменяются в зависимости от значений рН, методов, а также имеют потенциальные потенциалы восстановления или окисления, которые определяют, какой ток необходимо подавать, чтобы электролитический процесс воды происходил самопроизвольно..
процесс
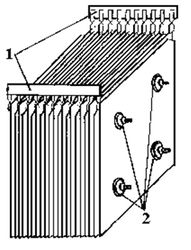
Два электрода обычно платиновые, хотя на изображении они были заменены угольными электродами. Оба связаны с батареей, с которой применена разность потенциалов (ΔV), которая способствует окислению воды (образование O).2).
В верхней части цилиндров есть несколько клавиш, позволяющих выпускать образующиеся газы. Вы можете тщательно проверить наличие H2 заставляя его реагировать с пламенем, сгорание которого дает газообразную воду.
методы
Методы электролиза воды варьируются в зависимости от количества Н2 и O2 что предлагается генерировать. Оба газа очень опасны, если их смешивать друг с другом, и поэтому электролизеры имеют сложную конструкцию, чтобы минимизировать увеличение газовых давлений и их диффузию через водную среду..
Кроме того, методы колеблются в зависимости от элемента, электролита, добавляемого в воду, и самих электродов. С другой стороны, некоторые подразумевают, что реакция проводится при более высоких температурах, уменьшая потребление электроэнергии, а другие используют огромные давления для поддержания H.2 хранится.
Среди всех методов можно упомянуть следующие три:
Электролиз щелочной водой
Электролиз проводят с основными растворами щелочных металлов (КОН или NaOH). С помощью этой техники происходят реакции:
Электролиз с полимерной электролитической мембраной
Полуклеточные реакции для этого случая:
Ионы Н + они мигрируют от анода к катоду, где они уменьшаются, чтобы стать H2.
Электролиз с твердыми оксидами
Какая польза от электролиза воды?
Электролиз воды дает H2 (г) и О2 (G). Приблизительно 5% газообразного водорода, производимого в мире, образуется в результате электролиза воды..
H2 это побочный продукт электролиза водных растворов NaCl. Присутствие соли облегчает электролиз за счет увеличения электропроводности воды.
Глобальная реакция, которая имеет место:
Чтобы понять огромную важность этой реакции, будут упомянуты некоторые виды использования газообразных продуктов; потому что, в конце концов, именно они стимулируют разработку новых методов для достижения электролиза воды более эффективным и экологичным способом..
Из всех них наиболее желательным является использование ячеек, которые энергетически заменяют использование сжигания ископаемого топлива..
Производство водорода и его использование
-Водород, получаемый при электролизе, может быть использован в химической промышленности, действующей в реакциях зависимости, в процессах гидрирования или в качестве восстановителя в процессах восстановления..
-Кроме того, это важно в некоторых действиях, имеющих коммерческое значение, таких как: производство соляной кислоты, перекиси водорода, гидроксиламинов и т. Д. Участвует в синтезе аммиака по каталитической реакции с азотом.
-В сочетании с кислородом он производит пламя с высокой калорийностью, с температурами в диапазоне от 3000 до 3500 К. Эти температуры могут использоваться для резки и сварных швов в металлургической промышленности, для роста синтетических кристаллов, производства кварца и т. Д..
-Обработка воды: слишком высокое содержание нитратов в воде может быть уменьшено путем их удаления в биореакторах, в которых бактерии используют водород в качестве источника энергии
-Водород вмешивается в синтез пластмасс, полиэстера и нейлона. Кроме того, он является частью производства стекла, увеличивая сгорание во время выпекания.
-Реагирует с оксидами и хлоридом многих металлов, в том числе серебра, меди, свинца, висмута и ртути с образованием чистых металлов.
-И, кроме того, он используется в качестве топлива в хроматографических анализах с детектором пламени..
Как метод отладки
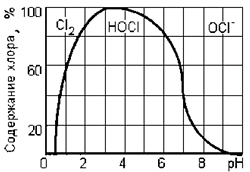
Электролиз растворов хлорида натрия используется для очистки воды бассейна. Во время электролиза водород образуется в катоде и хлоре (Cl2) на аноде. Говорят об электролизе в этом случае как хлоратор соли.
Хлор растворяется в воде с образованием хлорноватистой кислоты и гипохлорита натрия. Хлорноватистую кислоту и гипохлорит натрия стерилизуют водой.
В качестве источника кислорода
Электролиз воды также используется для генерации кислорода на Международной космической станции, которая служит для поддержания кислородной атмосферы на станции..
Водород можно использовать в топливном элементе, способе накопления энергии и использовать воду, которая генерируется в элементе для потребления астронавтами..
Домашний эксперимент
Эксперименты по электролизу воды проводились на лабораторных весах с помощью вольтметров Хоффмана или другой сборки, которая позволяет вместить все необходимые элементы электрохимической ячейки..
Из всех возможных сборок и оборудования самым простым может быть большой прозрачный контейнер для воды, который будет служить ячейкой. Кроме того, вы должны иметь под рукой любую металлическую или электропроводящую поверхность, которая будет выполнять функцию электродов; один для катода, а другой для анода.
Для этой цели могут быть полезны даже карандаши с острыми точками на обоих концах. И, наконец, небольшой аккумулятор и несколько кабелей, которые соединяют его с импровизированными электродами..
Если не сделать в прозрачном контейнере, образование пузырьков газа не может быть оценено.
Домашние переменные
Хотя электролиз воды является предметом, который содержит много интригующих и обнадеживающих аспектов для тех, кто ищет альтернативные источники энергии, домашний эксперимент может быть скучным для детей и других зрителей..
Следовательно, достаточное напряжение может быть приложено для формирования H-образования2 и O2 чередуя определенные переменные и отмечая изменения.
Кроме того, тот же эксперимент можно повторить с холодной и горячей водой. Таким образом, влияние температуры на реакцию будет затем рассматриваться.
Наконец, чтобы сделать сбор данных немного менее бесцветным, вы можете прибегнуть к очень разбавленному раствору сока фиолетовой капусты. Этот сок является основным кислотным индикатором природного происхождения..
Добавляя его в емкость с введенными электродами, можно заметить, что на аноде вода станет розовой (кислотной), а на катоде окраска будет желтой (основной).
СОДЕРЖАНИЕ
История
Принцип
Уравнения
Те же полуреакции также могут быть уравновешены основанием, указанным ниже. Не все полуреакции необходимо уравновешивать кислотой или основанием. Многие из них, например, окисление или восстановление воды, перечисленные здесь. Чтобы добавить половину реакции, обе они должны быть сбалансированы кислотой или основанием. Кислотно-сбалансированные реакции преобладают в кислых растворах (с низким pH), тогда как реакции со сбалансированным основанием преобладают в основных (с высоким pH) растворах.
Объединение любой пары половин реакции приводит к одинаковому общему разложению воды на кислород и водород:
Таким образом, количество образующихся молекул водорода в два раза превышает количество молекул кислорода. Если предположить, что температура и давление для обоих газов одинаковы, полученный газообразный водород, следовательно, в два раза превышает объем произведенного газообразного кислорода. Количество электронов, проталкиваемых через воду, в два раза превышает количество образованных молекул водорода и в четыре раза больше, чем количество образованных молекул кислорода.
Термодинамика
Разложение чистой воды на водород и кислород при стандартной температуре и давлении неблагоприятно с термодинамической точки зрения.
Выбор электролита
Электролит для электролиза воды
Сильные кислоты, такие как серная кислота (H 2 SO 4 ), и сильные основания, такие как гидроксид калия (KOH) и гидроксид натрия (NaOH), часто используются в качестве электролитов из-за их сильной проводящей способности.
Также можно использовать твердый полимерный электролит, такой как нафион, и при нанесении специального катализатора на каждую сторону мембраны может эффективно расщеплять молекулу воды всего лишь с 1,5 вольт. Несколько других систем с твердыми электролитами были испытаны и разработаны с несколькими системами электролиза, которые сейчас коммерчески доступны, в которых используются твердые электролиты.
Электролиз чистой воды
Методы
Фундаментальная демонстрация
Вольтаметр Гофмана
Промышленные
Высокое давление
Высокая температура
Алкалиновая вода
Изначально машины стали популярными в Японии и других странах Восточной Азии, а затем стали доступны в США и Европе.
Полимерная электролитная мембрана
Протонообменная мембрана, или мембрана полимер-электролит (PEM), представляет собой полупроницаемую мембрану, обычно сделанную из иономеров и предназначенную для проведения протонов, одновременно действуя как электронный изолятор и барьер для реагентов, например, для кислорода и газообразного водорода [1]. Это их основная функция при включении в узел мембранных электродов (MEA) топливного элемента с протонообменной мембраной или протонообменного мембранного электролизера: разделение реагентов и перенос протонов при блокировании прямого электронного пути через мембрану.
PEM могут быть изготовлены либо из чистых полимерных мембран, либо из композитных мембран, где другие материалы встроены в полимерную матрицу. Одним из наиболее распространенных и коммерчески доступных материалов PEM является фторполимер (PFSA) [2] Nafion, продукт DuPont. [3] Хотя нафион представляет собой иономер с перфторированной основной цепью, такой как тефлон, [4] существует множество других структурных мотивов, используемых для создания иономеров для протонообменных мембран. Многие используют полиароматические полимеры, в то время как другие используют частично фторированные полимеры.
Протонообменные мембраны в первую очередь характеризуются протонной проводимостью (σ), проницаемостью для метанола (P) и термической стабильностью [5].
Топливные элементы PEM используют твердую полимерную мембрану (тонкую пластиковую пленку), которая проницаема для протонов, когда она насыщена водой, но не проводит электроны.
Никель / железо
Электрохимические ячейки с нанозазором
В 2017 году исследователи сообщили об использовании электрохимических ячеек с наноразмерными промежутками для достижения высокоэффективного электролиза чистой воды без электролитов при комнатной температуре. В электрохимических ячейках с нанозазором два электрода расположены так близко друг к другу (даже меньше, чем длина Дебая в чистой воде), что скорость массопереноса может быть даже выше, чем скорость переноса электронов, что приводит к двум половинным реакциям, связанным вместе и ограничен шагом переноса электрона. Эксперименты показывают, что плотность электрического тока от электролиза чистой воды может быть даже больше, чем от 1 моль / л раствора гидроксида натрия. Механизм, «Механизм виртуального пробоя», полностью отличается от хорошо известной традиционной электрохимической теории из-за такого эффекта размера наноразмеров.
Приложения
Позже водород может быть использован в топливном элементе как способ хранения энергии и воды.
Эффективность
Промышленная продукция
Обычный щелочной электролиз имеет эффективность около 70%. С учетом принятого использования более высокой теплотворной способности (поскольку неэффективность из-за тепла может быть перенаправлена обратно в систему для создания пара, необходимого для катализатора), средняя рабочая эффективность электролиза PEM составляет около 80%. Ожидается, что к 2030 году этот показатель вырастет до 82–86%. Теоретическая эффективность электролизеров на основе ПЭМ прогнозируется до 94%.
Учитывая промышленное производство водорода и использование лучших в настоящее время процессов электролиза воды (PEM или щелочной электролиз), которые имеют эффективный электрический КПД 70–80%, производя 1 кг водорода (с удельной энергией 143 МДж / кг) требует 50–55 кВт⋅ч (180–200 МДж) электроэнергии. При стоимости электроэнергии 0,06 долл. США / кВт · ч, как указано в целях производства водорода Министерством энергетики США на 2015 г., стоимость водорода составляет 3 долл. США / кг. Учитывая диапазон цен на природный газ с 2016 года, как показано на графике ( Дорожная карта группы специалистов по производству водорода, ноябрь 2017 г. ), стоимость водорода, подвергнутого парометановому риформингу (SMR), составляет от 1,20 до 1,50 доллара США, то есть себестоимость водорода путем электролиза. все еще превышает вдвое целевые цены на водород DOE на 2015 год. Целевая цена Министерства энергетики США на водород в 2020 году составляет 2,30 доллара США / кг, при этом стоимость электроэнергии составляет 0,037 доллара США / кВт · ч, что является достижимым с учетом тендеров PPA 2018 года для ветровой и солнечной энергии во многих регионах. Это ставит целевую задачу по распределению H 2 в 4 доллара за галлон бензина в пределах досягаемости и приближает к несколько завышенным затратам на добычу природного газа для SMR.
В других частях света цена на водород SMR составляет в среднем 1–3 долл. США / кг. Это делает производство водорода посредством электролиза конкурентоспособным по стоимости уже во многих регионах, как указано Nel Hydrogen и другими, включая статью МЭА, в которой рассматриваются условия, которые могут привести к конкурентному преимуществу электролиза.
Перенапряжение
Настоящие водные электролизеры требуют более высокого напряжения для протекания реакции. Часть, которая превышает 1,23 В, называется перенапряжением или перенапряжением и представляет любые потери и неидеальность в электрохимическом процессе.
Термодинамика
Электролиз воды в стандартных условиях требует теоретического минимума 237 кДж подводимой электрической энергии для диссоциации каждого моля воды, что является стандартной свободной энергией Гиббса образования воды. Также требуется энергия, чтобы преодолеть изменение энтропии реакции. Следовательно, процесс не может протекать ниже 286 кДж на моль, если не добавляется внешнее тепло / энергия.
Однако, учитывая компонент энтропии (и другие потери), для протекания реакции при практических плотностях тока ( термонейтральное напряжение ) требуются напряжения более 1,48 В.
Физико-химические основы электрохимической обработки воды
Явление электрохимической активации воды (ЭХАВ) – совокупность электрохимического и электрофизического воздействия на воду в двойном электрическом слое (ДЭС) электродов (анода и катода) при неравновесном переносе заряда через ДЭС электронами и в условиях интенсивного диспергирования в жидкости образующихся газообразных продуктов электрохимических реакций.
В процессе ЭХАВ происходят четыре основных процесса:
1) Электролитическое разложение воды (электролиз) за счет окислительно-восстановительных реакций на электродах, обусловленных внешним постоянным электрическим полем;
2) Электрофорез – движение в электрическом поле положительно заряженных частиц и ионов к катоду, а отрицательно заряженных частиц и ионов к аноду;
3) Электрофлотация – образование газовых флокул и агрегатов, состоящих из мелкодисперстных пузырьков газа (водорода на катоде и кислорода на аноде) и грубодисперстных примесей воды;
В результате обработки воды постоянным электрическим током, при потенциалах равных или превышающих потенциал разложения воды (1,25 V) вода переходит в метастабильное состояние, характеризующееся аномальными значениями активности электронов и других физико-химических параметров (рН, Eh, ОВП, электропроводность) [1]. Прохождение постоянного электрического тока через объем воды сопровождается электрохимическими процессами, в результате которых происходят окислительно-восстановительные реакции, приводящие к деструкции (разрушению) водных загрязнений, коагуляции коллоидов, флокуляции грубодисперсных примесей и их последующей флотации.
Электрохимическая обработка применяется для осветления и обесцвечивания природных вод, их умягчения, очистки от тяжелых металлов (Cu, Co, Cd, Pb, Hg), хлора, фтора и их производных, для очистки сточных вод, содержащих нефтепродукты, органические и хлорорганические соединения, красители, СПАВ, фенол [2]. Достоинствами электрохимической очистки воды является то, что она позволяет корректировать значения водородного показателя рН и окислительно-восстановительного потенциала Еh, от которого зависит возможность протекания различных химических процессов в воде; повышает ферментивную активность активного ила в аэротенках; уменьшает удельное сопротивление и улучшает условия коагуляции и седиментации органических осадков [3].
В 1985 г ЭХАВ была официально признана в качестве нового класса физико-химических явлений. Поручением правительства РФ от 15 января 1998 г. № ВЧ-П12-01044 даны рекомендации министерствам и ведомствам использовать данную технологию в медицине, сельском хозяйстве, промышленности.
Электролиз воды
Основной стадией электрохимической обработки воды является электролиз воды. При пропускании постоянного электрического тока через воду, поступление в воду электронов у катода, так же как и удаление электронов из воды у анода, сопровождается серией окислительно-восстановительных реакций на поверхности катода и анода. В результате образуются новые вещества, изменяется система межмолекулярных взаимодействий, состав воды, в том числе структура воды [4].
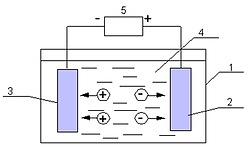
Типовая установка для электрохимической обработки воды состоит из блока подготовки воды (1), электролизера (2), блока обработки воды после электрохимической очистки (3) (рис. 1).
Рис. 1. Схема установки для электрохимической обработки воды: 1 – блок подготовки воды; 2 – электролизер; 3 – блок доочистки; 4 –выпрямитель электрического тока.
В некоторых установках электрохимической обработки воды предусматривается предварительная механическая очистка воды, уменьшающая опасность засорения электролитической ячейки грубодисперсными примесями с большим гидравлическим сопротивлением. Блок для механической очистки воды необходим, если в результате электрохимической обработки вода насыщается грубодисперсными примесями, например хлопьями гидрооксидов металлов (Al(OH)3, Fe(OH)3, Mg(OH)2) после электрокоагуляции. Основным элементом установки является – электролизер, состоящий из одной или нескольких электролизных ячеек (рис. 2).
Рис. 2. Схема электролизной ячейки: 1 – корпус; 2 – анод; 3 – катод; 4 – межэлектродное пространство; 5 – источник постоянного тока.
Рис. 3. Структура молекулы воды
Одновременно у анодов происходит выделение атомарного кислорода. В кислой среде этот процесс сопровождается разрушением молекул воды:
Нормальные окислительно-восстановительные потенциалы этих реакций: +1,23 V и +0,403 V, соответственно, но процесс протекает в условиях некоторого перенапряжения.
Электролизную ячейку можно рассматривать в качестве генератора вышеназванных продуктов, некоторые из которых, вступая в химическое взаимодействие между собой и с водными загрязнениями в межэлектродном пространстве, обеспечивают дополнительную химическую очистку воды (электрофлотация, электрокоагуляция) [5]. Эти вторичные процессы происходят не на поверхности электродов, а в объеме воды. Поэтому в отличие от электродных процессов они обозначаются объемными. Они инициируются повышением температуры воды в процессе электролиза и увеличением значения рН при катодном разрушении молекул воды.
Различают катодное и анодное окисление. При катодном окислении молекулы органических веществ, сорбируясь на катодах, акцептируют свободные электроны, восстанавливаются, трансформируясь в в соединения, не являющиеся загрязнениями. В одних случаях процесс восстановления проходит в один этап:
где R – органическое соединение; RH – гидратированная форма соединения, не являющаяся загрязнением.
В других случаях катодное восстановление проходит в два этапа: на первом этапе (I) органическая молекула превращается в анион, на втором (II) – анион гидратируется, взаимодействуя с протоном воды:
При анодном окислении молекулы органического вещества, адсорбируясь на аноде, отдают электроны с одновременной или с предшествующей гидратацией:
Анодное окисление органических соединений часто приводит к образованию свободных радикалов, дальнейшие превращения которых определяются их реакционной способностью. Процессы анодного окисления многостадийны и протекают с образованием промежуточных продуктов. Анодное окисление снижает химическую устойчивость органических соединений и облегчает их последующую деструкцию в ходе объемных процессов [6].
где ОН * – гидроксил-радикал.
Реакции взаимодействия органических веществ с окислителями протекают в течение определеного промежутка времени, длительность которого зависит от величины окислительно-восстановительного потенциала элемента и концентрации реагирующих веществ. По мере очистки и снижения концентрации загрязняющего вещества процесс окисления уменьшается.
Скорость процесса окисления при электрохимической обработке зависит от температуры обрабатываемой воды и от рН. В процессе окисления органических соединений образуются промежуточные продукты, отличающиеся от исходного как устойчивостью к дальнейшим превращениям, так и показателями токсичности.
где А – окисляемое вещество; С – продукт окисления.
Количество вещества, прореагировавшего на электродах при пропускании постоянного электрического тока по закону Фарадея, прямо пропорционально силе тока и времени обработки:
где А – электрохимический эквивалент элемента, г/А ч; Icur – сила тока, А; t – время обработки, ч.
Электрохимический эквивалент элемента определяется по формуле:
где М – атомная масса элемента, г; z – его валентность.
Значения электрохимических эквивалентов некоторых элементов приведены в табл. 1.
Таблица 1. Электрохимические эквиваленты некоторых элементов
Электрохимический эквивалент вещества А, г/А ч
Фактическое количество вещества, генерируемого при электролизе, меньше теоретического, рассчитанного по формуле (1), так как часть электроэнергии затрачивается на нагревание воды и электродов. Поэтому при расчетах учитывается коэффициент использования тока η 0 С (табл. 2).
Таблица 2. Электродные потенциалы некоторых элементов
Напряжения, генерируемые в электродной ячейке, должны быть достаточными для возникновения окислительно-восстановительных реакций на электродах. Значение напряжения зависит от ионного состава воды, наличия в воде примесей, например СПАВ, плотности тока (его сила отнесенная к единице площади электрода), материала электродов и др. При прочих равных условиях задача выбора электродного материала заключается в том, чтобы для прохождения окислительно-восстановительных реакций на электродах, требуемое напряжение было минимальным, поскольку это позволяет снизить затраты электроэнергии.
Расчет основных параметров процесса электролиза воды
К основным параметрам электролиза воды относятся сила и плотность тока, напряжение в пределах электродной ячейки, а так же скорость и продолжительность пребывания воды в межэлектродном пространстве.
Сила тока Icur – величина, определяемая в зависимости от требуемой производительности по генерируемому продукту, А, определяется по формуле:
Эта формула получена путем преобразования формулы (1) с учетом коэффициента использования тока η.
Плотность тока оказывает определяющее влияние на электролиз: с увеличением плотности тока интенсифицируются электродные процессы и уменьшается площадь поверхности электродов, но одновременно возрастают напряжение в электролизной ячейке и как следствие энергоемкость процесса [8]. Повышенное увеличение плотности тока интенсифицирует выделение электролизных газов, приводящее к бурлению и диспергированию нерастворимых продуктов электрообработки воды. При увеличении плотности тока также усиливается пассивация электродов, заключающаяся в блокировке поступающих электронов поверхностными отложениями анода и катода, что увеличивает электрические сопротивления в электродных ячейках и тормозит окислительно-восстановительные реакции, протекающие на электродах.
Аноды пассивируются в результате образования на их поверхностях тонких оксидных пленок, в результате сорбции на анодах кислорода и других компонентов, которые, в свою очередь, сорбируют частицы водных примесей. На катодах образуются, в основном, карбонатные отложения, особенно в случае обработки воды с повышенной жесткостью. В силу этих причин плотность тока при электролизе воды должна назначаться минимальной по условиям устойчивого протекания необходимых окислительно-восстановительных реакций в ходе технологического процесса.
Напряжение в электродной ячейке, В, определяется по формуле
Формула (5) не учитывает электрических сопротивлений электрода в связи с их низкими значениями, но при пассивации эти сопротивления оказываются значительными. Ширина межэлектродного канала принимается минимальной (3–20 мм) по условиям незасорения примесями.
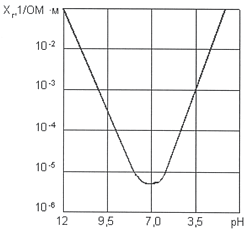
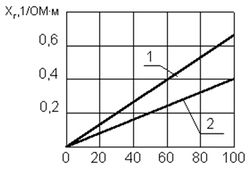
Рис. 5. Зависимость удельной электропроводности от рН воды при t = +5 0 C
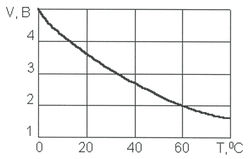
Удельная электропроводность воды χR зависит от ряда факторов, среди которых наиболее существенны температура, рН, ионный состав и концентрация ионов (рис. 5). С увеличением температуры электропроводность χR увеличивается, а напряжение уменьшается (рис. 6). Минимальное значение электропроводности соответствует значению рН = 7. Кроме этого, в процессе электролиза происходит повышение температуры и рН воды. Если рН >7, то можно ожидать уменьшения удельной электропроводности воды χR, а при значениях рН
Рис. 6. Зависимость напряжения на электродах от температуры воды.
Потребляемая мощность, Вт, электролизера определяется по зависимости (6):
где ηэ – коэффициент полезного действия электролизера, ηэ = 0,7–0,8; Icur – сила тока, A, Vэ – напряжение на электролизере, V.
Продолжительность пребывания воды в межэлектродном пространстве электролизера ограничивается временем, необходимым для генерации нужного количества продуктов электролиза, а также продолжительностью соответствующих объемных реакций, и определяется экспериментально.
Скорость движения воды в межэлектродом пространстве задается с учетом условий выноса из электролизера продуктов электролиза и других примесей; кроме того, от скорости движения воды зависит турбулентное перемешивание, что влияет на ход объемных реакций. Как и продолжительность пребывания воды, скорость воды выбирается на основании экспериментальных данных.
Конструкции электролизеров воды
Современные электролизеры представляют собой камеры различных конфигураций, в которых размещены электроды. Камеры выложены листовым винипластом или текстолитом для защиты от воздействия хлора, его кислородных соединений и других окислителей.
Электролиз воды сопровождается интенсивным пеновыделением, поэтому электролизер оборудуется специальными устройствами и пеногасителями для ее удаления. В целях защиты электродов и межэлектродного пространства от засорения пеной и нерастворимыми продуктами электролиза предусматриваются устройства для очистки межэлектродного пространства путем продувки сжатым воздухом или при помощи специальных диэлектрических щеток, которые предназначаются и для механической депассивации электродов. Электроды имеют форму пластин с центральным отверстием, через которое проходит вал с жестко закрепленными на нем скребками (щетками), заведенными в межэлектродные зазоры. При повороте вала происходит контакт щеток с электродами, что позволяет очищать их от твердых отложений.
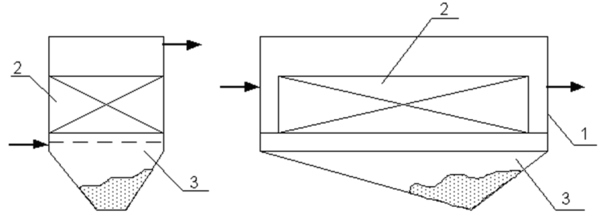
Если вода содержит грубодисперсные примеси с большим гидравлическим сопротивлением, предусматривается специальная иловая камера для накопления выпадающих осадков (рис. 8).
Рис. 8. Схемы электролизеров с осадконакопителями: 1 – корпус; 2 – блок электродов; 3 – осадконакопитель
В зависимости от направления движения воды электролизеры бывают горизонтального или вертикального типов (рис. 9). Вертикальная установка занимает меньшую площадь, но имеет большую высоту, что усложняет высотную схему сооружения.
Рис. 9. Схемы электродных камер: а – горизонтальная прямоугольная; б – вертикальная прямоугольная или круглая; в – то же с горизонтальным расположением электродов; 1 – корпус; 2 – электроды; 3 – распределительная решетка; 4 – блок электропитания; 5 – анод; 6 – катод в виде сетки.
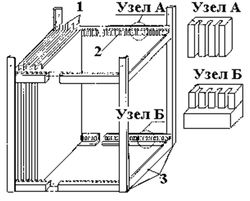
Электроды выполняются в виде стрежней, дисков, сеток и т.д., но чаще всего представляют собой металлические стальные пластины толщиной от 3 до 10 мм. Во избежание химической коррозии их размеры составляют 1,5–1,8 м. Пластины собираются в пакеты при помощи диэлектрических стягивающих зажимов либо устанавливаются в пазы специальных рам из диэлектриков (рис.10, рис. 11).
Рис. 10. Схема электродной системы пазного типа. 1 – электроды; 2 – контактные пазы; 3 – рама.
По условиям монтажа и ремонтопригодности вес пластин или пакетов пластин должен составлять не более 50–100 кг. Поэтому при необходимости в корпусе электролизера может размещаться несколько пакетов пластин.
Рис. 11. Схема электродной системы пакетного типа: 1 – токораспределительные пластины; 2 – стягивающие зажимы.
Электроды присоединяются к источнику электропитания по монополярной или по биполярной схеме. В последнем случае каждый электрод работает одной поверхностью как анод, а другой – как катод. Биполярная схема требует меньшего количества присоединений электродов к источнику питания, но при этом увеличивается напряжение на электродах. Если при монополярном присоединении оно равно напряжению в пределах одной электродной ячейки, т.е. Vэ = Vя, то при биполярной напряжение на электродах зависит от количества ячеек, n:
где n – количество ячеек, шт.
Материал электродов должен обладать рядом обязательных свойств:
1) химической устойчивостью и инертностью к среде, в которой производится электролиз;
2) оптимальными электрохимическими характеристиками по отношению к окислительно-восстановительным реакциям;
3) механической прочностью и химической устойчивостью.
Аноды (за исключением установок для электрокоагуляции) не должны растворяться при электролизе. Нерастворимые аноды изготавливаются титановыми с защитными покрытиями из платины, оксидов кобальта (ОКТА), диоксида марганца (ТДМА), оксидов рутения и титана (ОРТА) [12]. Возможно применение анодов из графита или графитизированного угля, но эти материалы недостаточно прочны и долговечны. В электрокоагуляторах аноды выполняются растворимыми из алюминия и его сплавов, а также из железа.
В процессе электролиза всегда генерируются газообразные водород и кислород. Смесь этих газов взрывоопасна, а смесь водорода с воздухом обладает взрывоопасностью при концентрации водорода более 4 об.%. Согласно условиям безопасности электролизеры оборудуются системами вытяжной вентиляции, обеспечивающими разбавление выделяющегося водорода воздухом до концентрации менее 0,4 об.%, т.е. в 10 раз ниже порога взрывоопасности.
Производительность вентиляционных установок для электролизеров непрерывного действия, м 3 /ч рассчитывается по формуле:
где t – температура обрабатываемой воды, 0 С.
Если электролизер периодического действия, то формула принимает вид:
где Wel – полезная вместимость электродной камеры, м 3 ; t – продолжительность обработки, ч.
В случаях, когда применяется открытый электролизер и генерируемый водород поступает непосредственно в помещение, кратность воздухообмена, 1/ч, расчитывается из формулы:
Электролиз воды всегда сопровождается выделением тепла и нагревом обрабатываемой воды, что может повлиять на условия ее последующего использования или выпуска в систему водоотведения.
Расход выделяющегося при электролизе воды тепла, кДж/ч, равен:
Температура обрабатываемой воды 0 C в электролизе определяется из формулы:
где С – объемная теплоемкость воды, кДж/(л град.); qw – расчетный расход воды, м 3 /ч.
Бытовые электрохимические реакторы
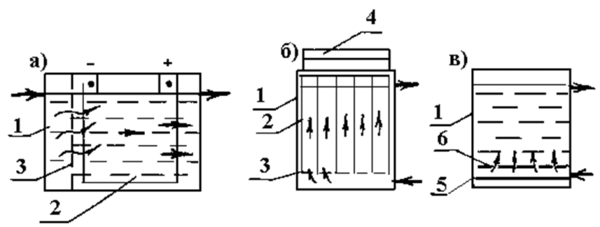
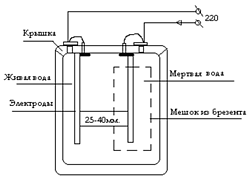
Рис. 12. Схема бытового электролизера для получения электроактивированных растворов воды.
Электрохимически активированные растворы католита, в зависимости от силы пропускаемого тока могут быть нескольких видов:
При анодной (анолит) электрохимической обработке кислотность воды увеличивается, ОВП возрастает, несколько уменьшается поверхностное натяжение воды, увеличивается электропроводность, возрастает количество растворённого в воде кислорода, хлора, уменьшается концентрация водорода, изменяется структура воды [17]. По внешним признакам анолит— коричневатая, кисловатая, с характерным запахом и вкусом жидкость с рН = 4-5 ед и ОВП = +500+1100 мВ. По параметрам токсичности анолит при введении в желудок и нанесении на кожу относится к 4 классу малоопасных веществ по ГОСТ 12.1.007-76 и обладает в данном классе минимальной токсичностью. При ингаляционном введении анолит с содержанием оксидантов 0,02% и общей минерализацией 0,25-0,35% не оказывает раздражающего действия на органы дыхания и слизистые оболочки глаз. При введении внутрь анолит не оказывает иммунотоксического действия и повышения уровня хромосомных аберраций в клетках костного мозга и других тканях и не обладает цитогенетической активностью. При нагревании до 50 С бактерицидная активность анолита увеличивается на 30-100% [18].
Электрохимически активированные растворы анолита подразделяются на четыре основных типа:
На основании материалов, опубликованных в сборника Второго и Третьего Международных симпозиумов «Электрохимическая активация в медицине, сельском хозяйстве, промышленности», монографии Прилуцкого В.И. и Бахира В.М. [19] приводятся следующие данные о некоторых свойствах и лечебном действии анолита и католита:
Анолит обладает антибактериальным, противовирусным, антимикозным, антиаллергическим, противовоспалительным, противоотёчным, противозудным и подсушивающим действием, может оказывать цитотоксическое и антиметаболическое действие, не причиняя вреда клеткам тканей человека. Биоцидные вещества в электрохимически активированном анолите, не являются токсичными для соматических клеток, поскольку представлены оксидантами, подобными тем, которые продуцируют клетки высших организмов.
Католит обладает антиоксидантными, иммуностимулирующими, детоксицирующими свойствами, нормализует ОВП, метаболические процессы (повышение синтеза АТФ, изменение активности ферментов), стимулирует регенерацию тканей, повышает синтез ДНК и стимулирует рост и деление клеток за счёт увеличения массопереноса ионов и молекул через мембраны, улучшает трофические процессы и кровообращение в тканях.
Растворы анолитов и католитов находят применение в медицине в качестве антисептиков с целью дезинфекции и стерилизации инструментов, помещений, аппаратуры, предметов ухода, кожи и слизистых и т.д., а также для лечения гнойных ран [20]. Использование смоченных в анолите салфеток позволяет за 3-5 дней очистить поверхность ран, флегмонов, абсцессов, трофических язв, гнойно-некротических поражениях подкожной клетчатки, а последующее наружное применение католита в течение 5-7 дней существенно ускоряет репаративные процессы в тканях. Имеются также данные о высокой лечебной эффективности электроактивированных растворов воды при гастритах, язвенной болезни желудка, уретритах, эрозии шейки матки, язвах роговицы, инфекционных заболеваниях кожи, при лечении стоматитов, парадонтитов, а также при сахарном диабете. Одним из положительных свойств электроактивированных растворов воды является их дешевизна (20 рублей за литр) и экологичность.
Электролиз воды находит все более широкое применение во многих отраслях промышленности и в быту, в том числе в водоподготовке и водоочистке. Отечественной промышленностью выпускаются бытовые установки для проведения электролиза воды “СТЭЛ”, “Эсперо-1”, “Гейзер”, “Биомед” и др. Электроактивированные растворы католитов и анолитов производятся в бутилированном виде и продаются в аптеках и магазинах. Однако, фармакологические исследования электроактивированных растворов воды, как лекарственных средств – их фармакологическое действие и токсичность изучены не достаточно. В РФ такие исследования проводятся, в основном, на кафедре фармакологии Воронежской медицинской академии.
Заключение
Электрохимическая обработка воды обладает рядом преимуществ по сравнению с альтернативными механическими, химическими и биологическими методами водообработки и водоочиски. Эти преимущества заключаются в эффективности, устойчивости, контролируемости и удобном автоматическом регулировании процессов, а также простоте конструкции аппаратуры. Установки для электрохимической очистки воды компактны, имеют высокий уровень безотказности, требуют простой эксплуатации и могут быть полностью автоматизированы. С другой стороны, при электрохимической обработке воды возрастает энергопотребление, а в случае применения растворимых анодов расходуется тонколистовая сталь. Поэтому электрохимическая обработка обычно оказывается более выгодной для установок малой производительности (до 10-20 м 3 /час). В многоступенчатых схемах улучшения качества воды электрохимическая обработка может удобно сочетаться с другими методами водоподготовки.
Литература
1.Бахир В.М., Лиакумович А.Г., Кирпичников П.А., Спектор Л.Е., Мамаджанов У.Д. “Физическая природа явлений активации веществ”, Изв. АН УзССР. Сер.техн. наук, 1, 60-64 (1983).
2. Кульский Л. А. Очистка воды электрокоагуляцией / Л.А. Кульский, П.П. Строкач, В.А. Слипченко и др., Будiвельник, Kiев (1978), 112 с.
3. Липовецкий Я.М. Электрохимические способы очистки питьевых и сточных вод / Я.М. Липовецкий, Я.Д. Рапопорт, ЦБНТИ Минжилкомхоза РСФСР, Москва (1985), 56 с.
4. Кирпичников П. А., Бахир В. М., Гамер П.У., Добреньков Г.А., Лиакумович А.Г., Фридман Б.С., Агаджанян С.И. “О природе электрохимической активации сред”, Докл. АН СССР, 286(3), 663-666 (1986).
5. Бахир В.М.,Задорожний Ю.Г. Электрохимические реакторы РПЭ, Гиперокс, Москва (1991), 35 c.
6. Яковлев С.В. Технология электрохимической очистки воды / С.В. Яковлев, И.Г. Краснобородько, В.М. Рогов. Л.О. Стройиздат, Ленинград (1987), 312 с.
7. Бахир В.М. Современные технические электрохимические системы для обеззараживания, очистки и активирования воды. ВНИИИМТ, Москва (1999), 84 с.
8. Бахир В.М., Задорожний Ю.Г., Леонов Б.И., Паничева С.А., Прилуцкий В.И. Электрохимическая активация: очистка воды и получение полезных растворов, ВНИИИМТ, Москва (2001), 176 с.
9. Кульский Л.А. Справочник по свойствам, методам анализа и очистке воды: В 2-х частях. Часть 1 / Л.А. Кульский, И.Т. Гороновский, А.М. Когановский и др., Наукова думка, Киев (1980), 680 с.
10. Медриш Г.Л. Обеззараживание природных и сточных вод с использованием электролиза / Г.Л. Медриш, А.А. Тайшева, Д.Л. Басин., Стройиздат, Москва (1982), 80 с.
11. Воловник Г.И. Теоретические основы очистки воды / Г.И. Воловник, Л.Д. Терехов. Часть 1., Издательство ДВГУПС, Хабаровск (2000), 167 с.
12. Бахир В. М. Электрохимическая активация, ВНИИИ мед. техники, 2 часть, Москва (1992), 657 c.
13. Бабцова Н.Ф., Комаров И.Ф. Опыт использования установки СТЭЛ в хирургическом отделении. Второй международный симпозиум. Электрохимическая активация. Тез. докладов и краткие сообщения. ч.1 (1999), с. 131-132.
14. Леонов Б.И., Прилуцкий В.И., Бахир В.М. Физико-химические аспекты биологического действия электрохимически активированной воды, ВНИИИМТ, Москва (1999), 244 с.
15. Бахир В.М. Теоретические аспекты электрохимической активации. / Второй международный симпозиум. Электрохимическая активация. Тез. докладов и краткие сообщения, ч.1 (1999), с.39-49.
16. Торопков В.В., Альтшуль Э.Б., Торопкова Е.В. Токсикологическая характеристика препарата католит / Третий Международный симпозиум «Электрохимическая активация»// Доклады и краткие сообщения, Москва (2001), с.57-62.
17. Леонов Б.И., Бахир В.М., Вторенко В.И. Электрохимическая активация в практической медицине / Второй Международный симпозиум «Электрохимическая активация»// Тез. докл. и краткие сообщения, ч.1, Москва (1999), с.15-23.
18. Торопков В.В.Альтшуль Э.Б., Пересыпкин О.И. Фармакологическая эффективность действия анолитов АН и АНК на слизистые оболочки ротовой полости / Второй Международный симпозиум «Электрохимическая активация»// Тез. докл. и краткие сообщения, ч.1, Москва (1999), с. 93-95.
19. Прилуцкий В.И., Бахир В.М. Электрохимически активированная вода: аномальные свойства, механизм биологического действия, ВНИИИМТ, Москва (1997), 228 с.
20. Паничева С.А. Новые технологии дезинфекции и стерилизации сложных изделий медицинского назначения, ВНИИИМТ, Москва (1998), 122 с.