Энатол что это такое
Влияние алкоголя на организм
Алкоголизм и его последствия
Влияние на печень
Влияние алкоголя на мозг
Описанные процессы приводят к повреждению частей мозга отвечающих за вестибулярный аппарат, поведение человека, а также память и внимание. При регулярном злоупотреблении алкоголем происходит изменение мыслительных и психических процессов – дегенерация.
Влияние на психику и нервную систему
Влияние на сердечно-сосудистую систему
Влияние на органы мочевыделительной системы
При длительном употреблении алкоголя в моче образуется белковый осадок. Вымытые этанолом минеральные вещества оседают и накапливаются в почках, образуя камни – развивается мочекаменная болезнь.
При нарушении метаболизма под воздействием алкоголя повреждается структура почек, накапливаются вредные вещества и токсины развивается дистрофия почек. При отсутствии лечения и дальнейшем употреблении алкоголя из перечисленных заболеваний развивается почечная недостаточность.
Влияние на органы пищеварения
Алкоголь, попадая в ротовую полость, нарушает работу слюнных желез в ротовой полости и вызывает вязкость слюны, что снижает ее защитные способности. Этанол начинает разрушать стенки пищевода. Позже у хронических алкоголиков нарушается глотание.
Также алкоголь способствует выработке желудочного сока и соляной кислоты, которые разъедают стенки органов пищеварения и вызывают язвы, которые со временем могут стать причиной онкологии ЖКТ. Кроме этого, алкоголь закупоривает капилляры и тем самым нарушается всасывание витаминов, что губительно для организма человека.
Селезенка очищает организм от мертвых кровяных тел. При отравлении алкоголем организма нарушается работа селезенки и способность к очищению организма. Нарушения в работе селезенки вызываются также воздействием алкоголя на печень, поджелудочную железу и кровеносную систему и нарушением их работы.
В результате злоупотребления алкоголем нарушается приток крови к селезенке, результатом является инфаркт тканей и нагноение капсулы селезенки – абсцесс селезенки.
Воздействие на иммунитет
Воздействие на опорно-двигательный аппарат
Известно, что этанол приводит обезвоживанию организма. Вода необходима для обеспечения работы клеток. Недостаток жидкости приводит к нарушению метаболизма. В результате продукты распада и вредные соединения скапливаются в мышечных тканях, вызывая дискомфорт. Алкоголизм приводит к нарушениям работы эндокринной системы – подавляется выработка тестостерона и гликогена. Их недостаток приводит к деградации мышечной ткани.
Влияние алкоголя на суставы
Влияние на внешний вид
Влияние на эндокринную систему
Влияние на легкие
Алкоголь выводится из организма не только через органы пищеварения и выделительной системы. В этом процессе активное участие принимают легкие. Органы дыхательной системы не приспособлены к такой нагрузке, поэтому легочная ткань постепенно твердеет и расширяется. Возникает фиброз соединительной ткани. На легких начинает скапливаться слизь и мокрота. Это становится причиной пневмонии и других заболеваний нижних органов дыхательной системы.
Алкоголь приводит также к обезвоживанию слизистых оболочек, и нарушаются защитные механизмы, человек чаще подвергается вирусным и инфекционным заболеваниям. У алкоголиков часто обнаруживается туберкулез. Закупорка кровеносных сосудов приводит к недостатку кислорода.
Заброс желчи в желудок — симптомы, лечение, советы гастроэнтеролога
В норме в желудок не попадает желчь. Этому препятствует мышечное кольцо между желудком и двенадцатиперстной кишкой — пилорический сфинктер, который также называют привратником желудка. Желчь, которая образуется в печени, накапливается в желчном пузыре и поступает в двенадцатиперстную кишку. Ее задача — обеспечение процесса переваривания пищи. Если желчь попадает из двенадцатиперстной кишки в желудок, это указывает на определенные проблемы в работе желудочно-кишечного тракта. Такое явление называют дуоденогастральным рефлюксом или билиарным рефлюксом.
Если содержимое двенадцатиперстной кишки забрасывается не только в желудок, но и в пищевод, такое явление называют дуоденогастроэзофагеальным рефлюксом.
Особенности состояния. Причины развития
Заброс желчи в желудок — одно из наиболее распространенных нарушений в работе пищеварительной системы. Чаще всего такое состояние указывает на наличие заболеваний ЖКТ и очень редко является изолированным нарушением. В норме желчь идет только в одном направлении: от печени к двенадцатиперстной кишке.
Билиарный рефлюкс развивается из-за:
Перечисленные состояния могут быть вызваны:
В группе риска находятся пациенты:
При холецистите, непроходимости желчных путей и панкреатите также возможно появление симптоматики билиарного рефлюкса.
Клиническая картина
При забросе желчи в желудок возникают такие симптомы:
При дуоденогастральном рефлюксе нарушаются процессы пищеварения, и питательные вещества не усваиваются в полной мере. В результате снижается масса тела, появляются покраснения в уголках рта, ухудшается состояние кожи, ногтей и волос.
Степени билиарного рефлюкса
Различают 3 степени дуоденогастрального рефлюкса:
Осложнения
Существующий в течение длительного времени дуоденогастральный рефлюкс может привести к рефлюкс-гастриту. Это заболевание, которое выражается в повреждении слизистой оболочки желудка из-за постоянной травматизации.
К другим возможным последствиям заброса желчи в желудок относятся язвенная болезнь, стеноз просвета пищевода и связанное с этим затруднение в продвижении пищи, перерождение эпителия желудка, образование доброкачественных и злокачественных опухолей желудка.
Диагностика
Диагностикой и лечением явления, при котором в желудок выбрасывается желчь, занимается врач-гастроэнтеролог. Для подтверждения диагноза проводят такие манипуляции:
При подозрении на заброс желчи в желудок проводят дифференциальную диагностику с кислым рефлюксом и пептическими язвами желудка.
Лечение
Лечение дуоденогастрального рефлюкса может быть консервативным или хирургическим.
Консервативная терапия направлена на подавление агрессивного воздействия желчи на слизистую оболочку желудка и пищевод, а также на нормализацию процесса передвижения содержимого кишечника и осуществления акта дефекации.
Пациентам назначают такие препараты:
Оперативное вмешательство при забросе желчи в желудок проводят, если консервативная терапия не дает улучшений, а также в случаях обнаружения предраковых изменений ЖКТ. Цель операции — укрепить пилорический клапан и уменьшить объем желчи, забрасываемой в желудок.
При дуоденогастральном рефлюксе важно соблюдать диету. Нужно избегать переедания, исключить из рациона продукты с повышенным содержанием жира, а также острую пищу. Также необходимо отказаться от употребления алкоголя и газированных напитков, кофе.
Профилактика
Чтобы предупредить заброс желчи в желудок, нужно:
При своевременной диагностике, адекватном лечении и соблюдении рекомендаций гастроэнтеролога прогноз гастродуоденального рефлюкса благоприятный.
Что такое гепатопротекторы
Сегодня поражения печени широко распространены среди населения. Они могут как возникать самостоятельно, так и сопутствовать системным патологиям. Участившиеся случаи заболеваний печени связаны с сохраняющимся ростом токсических, лекарственных, вирусных и аутоиммунных воздействий на этот орган, высокой распространенностью нарушений обмена веществ на фоне сахарного диабета и ожирения. 1,2 Одной из широких групп лекарств, применяемых в рамках комплексной терапии на разных стадиях поражения печени, являются гепатопротекторы. Это средства, которые препятствуют разрушению мембран функциональных клеток органа (гепатоцитов) и стимулируют их регенерацию.
Использование гепатопротекторов в клинической практике
Классификация гепатопротекторов
Общепринятой классификации таких препаратов на сегодняшний день не существует. Гепатопротекторное лекарственное средство может относиться к той или иной группе в зависимости от состава, происхождения и механизма действия.
1. Средства растительного происхождения
1.1. Средства, содержащие извлечения из расторопши. Действующим веществом таких лекарств является флавоноид силимарин. Препараты-гепатопротекторы из данной группы применяются преимущественно в комплексном лечении алкогольной и неалкогольной жировой болезни печени.
1.2. Средства, содержащие извлечения из солодки. Такие лекарства содержат глицирризиновую кислоту, обладающую антифибротической, антиоксидантной, антистеатозной и противовоспалительной активностью. Средства могут применяться при жировой дегенерации печени (гепатозе), ее токсическом, алкогольном и лекарственном поражении. К данной группе относится препарат-гепатопротектор Фосфоглив®.
1.3. Средства, содержащие извлечения из других растений. Активным компонентом таких лекарств может быть экстракт листьев артишока и др. Препараты обладают плейотропными (множественными) свойствами. Врач может назначить гепатопротектор из этой группы в случае, когда поражению печени сопутствует дискинезия желчевыводящих путей.
2. Средства животного происхождения
Для изготовления таких гепатопротекторных препаратов используется гидролизат печени свиней и крупного рогатого скота. Данные средства применяются сравнительно редко из-за недостаточной доказательной базы.
3. Препараты, содержащие эссенциальные фосфолипиды (ЭФЛ)
Такие гепатопротекторы производятся из соевых бобов. Их активным компонентом служит фосфатидилхолин, который является структурным элементом мембран функциональных клеток печени. Фосфолипиды способствуют восстановлению гепатоцитов, препятствуют их разрушению. Любой гепатопротекторный препарат для печени из этой группы для достижения эффекта должен применяться курсом в адекватно высоких дозах.
4. Средства с детоксицирующим действием
Такие препараты, прежде всего, снижают связанное с поражением печени отравляющее воздействие на организм.
4.1. С прямым детоксицирующим действием
Данные средства стимулируют обмен аммиака в головном мозге и в печени, за счет этого помогают уменьшить проявления печеночной энцефалопатии.
4.2. С непрямым детоксицирующим действием
Данные препараты снижают образование вредных продуктов метаболизма, стимулируют синтез веществ, которые оказывают детоксицирующее действие или ускоряют обмен опасных ядов.
5. Средства на основе желчных кислот
Такие препараты содержат урсодезоксихолевую кислоту или обетихолевую кислоту и обладают широким спектром действия. Применение таких лекарств-гепатопротекторов обеспечивает иммуномодулирующий, антифибротический, цитопротективный и другие эффекты.
6. Средства разных групп
К ним относятся препараты на основе альфа-липолиевой кислоты и тиотриазолина. Они применяются редко, поскольку их эффективность и безопасность при поражении печени недостаточно подтверждены клиническими исследованиями.
Фосфоглив® – современный гепатопротектор для лечения печени
Гепатопротекторное средство Фосфоглив® обладает уникальным 3 комплексным составом и может применяться на любой стадии 4 поражения печени. Активными компонентами препарата являются:
1. Olson J. C. Acute-on-chronic and decompensated chronic liver failure: definitions, epidemiology and prognostication // Crit Care Clin. 2016. Vol. 32, № 3. P. 301–309.
2. Sayiner M., Koenig A., Henry L., Younossi Z. M. Epidemiology of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis in the United States and the rest of the world // Clin Liver Dis. 2016. Vol. 20, № 2. P. 205–214.
3. По данным государственного реестра лекарственных средств, Фосфоглив® является единственным гепатопротектором, содержащим глицирризиновую кислоту.
4. В соответствии с инструкцией по медицинскому применению препарата Фосфоглив®.
Самое дорогостоящее лекарство в мире
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Не так давно, в мае 2019 года, произошло знаковое событие в сфере лечения генетических заболеваний: Управление по санитарному надзору за качеством продуктов и медикаментов США (FDA) одобрило препарат Zolgensma («Золгенсма», или онасемноген абепарвовек). Это лекарственное средство предназначено для генотерапевтического лечения спинально-мышечной атрофии (СМА). Сегодня «Золгенсма» является самым дорогим лекарственным препаратом в мире.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Что такое СМА?
Спинально-мышечной атрофией, или СМА, называют смертельно опасное нейродегенеративное заболевание, в процессе развития которого у пациента происходит постепенная атрофия скелетной мускулатуры. В результате человек теряет или так и не приобретает способности ходить, самостоятельно стоять, сидеть без поддержки. Со временем возникает сколиоз и другие ортопедические проблемы. Также СМА-пациенты, если они не получают должного ухода и лечения, постепенно утрачивают способность самостоятельно дышать, глотать, кашлять. Пациенты с первым, самым тяжелым, типом СМА еще несколько лет назад, как правило, не доживали и до двух лет [1].
СМА возникает из-за потери участка хромосомы или точечной мутации гена SMN1, расположенного в пятой хромосоме. В результате этого нарушается синтез SMN-белка, недостаток которого приводит к гибели моторных нейронов и атрофии скелетной мускулатуры [2].
Для того чтобы болезнь проявилась, носителем рецессивной мутации в гене SMN1 должны быть оба родителя. Примерно каждый 40-й житель Земли является таким носителем.
Подробнее о причинах возникновения, диагностике, течении спинально-мышечной атрофии читайте в статье «Надежда для СМАйликов» [3].
Терапия спинально-мышечной атрофии до появления «Золгенсмы»
До недавнего времени методы лечения СМА сводились к поддерживающей терапии. Больным рекомендовали специальное питание, витамины, умеренные физические нагрузки, при необходимости — хирургическое вмешательство, искусственная вентиляция легких. К сожалению, до сих пор значительная часть СМА-пациентов получает лишь такое лечение.
Рисунок 1. «Спинраза» — первый препарат, одобренный для лечения СМА
С 2016 года сначала в США, а затем и в Европе для лечения спинально-мышечной атрофии стали применять препарат «Спинраза» (нусинерсен) [4]. Он позволяет существенно увеличить продукцию полноценного SMN-белка, что ведет к сглаживанию симптомов заболевания. Терапия тем эффективнее, чем меньше возраст пациента.
Стоимость препарата составляет несколько сот тысяч долларов в год, поэтому его закупка осуществляется не за счет пациента. Одна за другой страны разных континентов одобрили препарат и стали применять для спасения жизней своих сограждан. В некоторых государствах этот процесс сильно затянулся из-за бюрократических проволочек и нехватки финансирования.
В РФ «Спинразу» Минздрав одобрил в начале 2019. В свою очередь компания «Биоген», производитель «Спинразы», в апреле 2019 г. объявила об открытии в России «Программы расширенного доступа» для лечения СМА нусинерсеном. Благодаря этой программе доступ к препарату получили 40 детей из России, страдающих СМА I типа [5].
В августе «Спинраза» была включена в Государственный реестр лекарственных средств РФ. Однако охват больных все еще слишком мал. В Российской Федерации зарегистрировано около 800 СМА-пациентов, и далеко не все они получают инъекции «Спинразы».
Отличия «Золгенсмы» от «Спинразы»
После появления на фармацевтическом рынке «Спинразы» все ждали выхода принципиально нового препарата для лечения СМА, основанного на генотерапевтическом подходе. Лидером в данной разработке оказалась компания «Новартис» (Novartis), которая в 2018 году купила компанию «Авексис» (AveXis) за 8,7 млрд долларов, а в 2019 вышла на рынок c препаратом «Золгенсма» (Zolgensma, он же AVXS-101, или онасемноген абепарвовек) [6].
Рисунок 2. Логотип препарата «Золгенсма»
Чем же «Золгенсма» принципиально отличается от препарата «Спинраза»? Самое важное различие заключается в механизме действия: «Спинраза» исправляет дефект сплайсинга матричной РНК гена SMN2, но она никак не затрагивает ген SMN1, мутации в котором и являются основной причиной развития спинально-мышечной атрофии.
Действие же препарата «Золгенсма» направлено именно на ген SMN1. Благодаря использованию этого лекарственного средства, мутировавший или отсутствующий ген SMN1 замещается функционально полноценным геном [1].
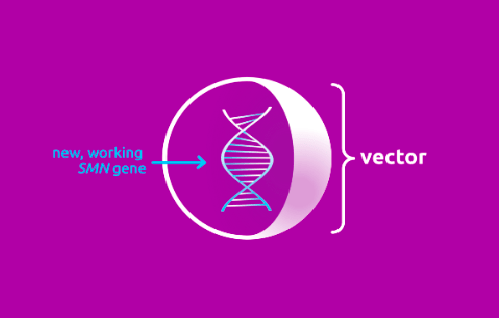
Происходит это следующим образом: препарат содержит функционально полноценный ген SMN1, который находится внутри вектора. Задача вектора — быстро доставить его в мотонейроны тела (рис. 3).
Рисунок 3. Условное изображение вектора, входящего в состав «Золгенсмы»
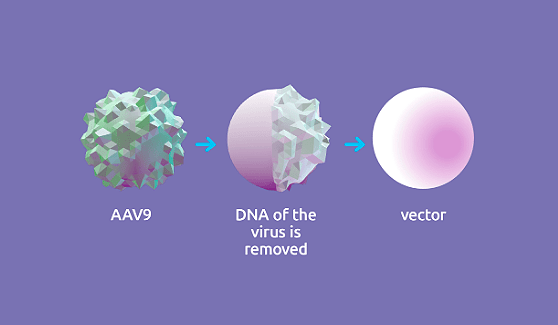
Для создания вектора использовали аденоассоциированный вирус (adeno-associative virus 9, или AAV9). Это представитель семейства парвовирусов, который способен инфицировать клетки человека и других приматов, но при этом не является патогенным. Все это делает AAV9 отличным генетическим вектором. Собственный генетический материал вируса удалили и вместо него поместили функционально полноценный ген SMN1 (рис. 4).
Рисунок 4. Условная схема механизма создания вектора
После того, как ген прибывает в нужную локацию, вектор разрушается и выводится из организма.
СМА-пациенту необходима всего одна инфузия препарата «Золгенсма» в течение жизни, в то время как лечение «Спинразой» требует нескольких доз в год. Отсюда и стоимость «Золгенсмы»: 2 125 000 долл. США. Такая ценовая политика компании-производителя делает данный препарат самым дорогим лекарственным средством на сегодняшний день. Для сравнения, стоимость все той же «Спинразы» составляет 125 тыс. долларов за одну дозу. При этом в первый год лечения нужно шесть инфузий, в последующие периоды — три инфузии ежегодно.
Насколько оправдана такая цена препарата и какова же его себестоимость? «Новартис» не афиширует информацию относительно себестоимости «Золгенсмы», поэтому эксперты оценивают стоимость препарата по двум показателям: качество жизни пациента с учетом прожитых лет (QALY) и добавленные годы жизни (LYG). По данным Института клинико-экономической экспертизы (Institute for Clinical and Economic Review, ICER), исходя из показателя QALY стоимость «Золгенсмы» должна быть в пределах 1,1–1,9 миллионов долл. США; исходя из показателя LYG — 1,2–2,1 миллиона долл. США. Таким образом, можно сказать, что стоимость «Золгенсмы» завышена по отношению к оценкам экспертов [7].
При формировании своей ценовой политики компания «Новартис» отталкивалась от стоимости препарата «Спинраза». По задумке производителя в течение десяти лет на лечение СМА-пациента «Спинразой» необходимо будет потратить более 4 млн долларов, в то время как одна инфузия «Золгенсмы» стоит 2 млн 125 тысяч. Таким образом, в долгосрочной перспективе второй вариант более выгоден [8], [9].
Компания «Новартис» ожидала, что «Золгенсма» станет «блокбастером», то есть принесет более 1 млрд долларов за первый год продаж. Однако скандал, который возник вокруг «Золгенсмы», может не дать осуществиться этим планам. Летом 2019 г. компания «Новартис» сама сообщила FDA о манипуляции с данными при проведении тестирования препарата на животных. Если бы эти данные были известны FDA в мае, то разрешение на использование препарата «Золгенсма» «Новартис» получила бы позже, но сейчас принято решение не отзывать препарат [10].
Сумму в два с лишним миллиона долларов не в состоянии заплатить большинство СМА-семей, поэтому предполагается, что пациенты будут обеспечиваться жизненно важным лечением благодаря государственной поддержке или за счет страховых компаний. Кроме того, производитель «Золгенсмы» предоставляет пятилетнюю рассрочку на оплату генной терапии и дает возможность пациенту не выплачивать оставшуюся сумму, если препарат перестанет действовать [8]. Сегодня препарат «Золгенсма» доступен только для жителей США, так как FDA — это единственная организация, которая его одобрила. Также есть ограничения по возрасту и тяжести заболевания: пока препарат применяется только для пациентов до двух лет с первым типом СМА. В дальнейшем производитель планирует использовать препарат и для других групп людей, страдающих спинально-мышечной атрофией.
Важно также отметить, что «Золгенсма» вводится внутривенно. «Спинраза» же должна попасть в спинномозговую жидкость пациента, что создает ряд дополнительных проблем и рисков.
Побочные эффекты «Золгенсмы»
Кроме высокой стоимости, у «Золгенсмы» есть и другие серьезные недостатки. Возможными побочными эффектами препарата являются:
Не рекомендуется использование «Золгенсмы» у недоношенных детей до достижения ими полного гестационного возраста.
По данным компании-производителя на момент регистрации «Золгенсма» в рамках клинических исследований была применена для терапии 44 детей в возрасте от 0,3 до 7,9 месяцев с массой тела от 3 до 8,4 кг. Такая небольшая выборка объясняется тем, что СМА является редким заболеванием, поэтому набрать большое количество пациентов за короткий период времени — не такая уж и простая задача.
С другой стороны, небольшая выборка означает, что количество побочных эффектов препарата может быть значительно выше, чем известно на данный момент. Так, производитель уведомляет, что один из СМА-пациентов, который участвовал в клинических исследованиях за пределами США, через 12 дней после инфузии препарата начал страдать от дыхательной недостаточности. Также у него были зафиксированы лейкоэнцефалопатия, приступы гипотензии и судорог примерно через месяц после начала лечения. Через 52 дня наступил летальный исход. Но пока сложно сказать, является ли подобное развитие событий реакцией на введение препарата или же эти симптомы появились бы у СМА-пациента и без использования «Золгенсмы».
Важно также отметить, что долгосрочное влияние препарата на организм человека пока неизвестно. Прежде всего, не ясно, будет ли экспрессия гена SMN1 в организме пациента поддерживаться постоянно или постепенно сойдет на нет. Чтобы ответить на этот вопрос, «Новартис» обязана постоянно собирать данные долговременного наблюдения. В разрезе стоимости это является ключевым риском для плательщиков. Компания-производитель пытается снизить эти риски, предлагая рассрочку на пять лет пациентам, с правом приостановить выплаты, если препарат не будет проявлять своего терапевтического действия. Однако если экспрессия гена прекратится после истечения пятилетнего срока, то никакой финансовой компенсации за это не предусмотрено.
Следующий шаг
Компания-производитель «Золгенсмы» планирует в будущем применять препарат для пациентов разных возрастов со СМА II и III типов. Также «Новартис» работает над регистрацией препарата за пределами США.
Рисунок 5. Рисдиплам — препарат для лечения спинально-мышечной атрофии, который находится на стадии клинических испытаний на людях
Появление «Золгенсмы» на фармакологическом рынке повлияло на продажи «Спинразы», поэтому компания «Биоген» уже проводит клинические исследования, направленные на усиление терапевтической активности «Спинразы» путем увеличения ее дозы [11].
Но «Спинраза» и «Золгенсма», возможно, недолго будут единственными препаратами для лечения спинально-мышечной атрофии. Компания «Рош» (Roche) уже достаточно давно ведет клинические испытания своего лекарственного средства (рисдиплама) и, по всей видимости, в ближайшие пару лет данный препарат также выйдет на фармацевтический рынок (рис. 5).
Рисдиплам, как и нусинерсен («Спинраза»), не влияет на ген SMN1, а модифицирует сплайсинг мРНК гена SMN2. Однако у рисдиплама есть существенное отличие: препарат принимается перорально и не требует введения в спинно-мозговую жидкость. Кроме того, рисдиплам подходит для всех типов СМА и в клинических испытаниях показывает более высокую эффективность, чем нусинерсен [12].
По прогнозам экспертов, цена препарата будет значительно ниже, чем «Спинразы» и «Золгенсмы», поэтому новое средство сможет составить серьезную конкуренцию уже существующим лекарствам [8].
Уже в конце 2019 года компания Roche планирует подать документы на одобрение препарата в FDA и EMA (Европейское медицинское агентство) [13].
Сегодня «Золгенсма» является одним из немногих одобренных генотерапевтических препаратов, и единственный — для лечения СМА. Данная технология является чрезвычайно перспективной и теоретически может подарить шанс СМА-пациентам на продолжительную жизнь высокого качества. Однако возможные побочные эффекты и высокая стоимость препарата пока не позволяют делать поспешных радужных выводов.