Эндогенный эритропоэтин что это
ИНСТРУКЦИЯ
по медицинскому применению лекарственного препарата
Торговое наименование препарата
Международное непатентованное наименование
Лекарственная форма
раствор для внутривенного и подкожного введения
Состав
1 мл раствора содержит:
Рекомбинантный эритропоэтин человека 500 ME или 2000 ME.
Описание
Прозрачная бесцветная жидкость
Фармакотерапевтическая группа
Код АТХ
Фармакодинамика:
Фармакокинетика:
При внутривенном введении Эритропоэтина у здоровых лиц и больных с уремией период полувыведения составляет 5-6 ч. При подкожном введении Эритропоэтина его концентрация в крови нарастает медленно и достигает максимума в период от 12 до 28 ч после введения период полувыведения составляет 13-28 ч. При внутривенном введении период полувыведения составляет 4-12 ч. Биодоступность Эритропоэтина при подкожном введении составляет 25-40 %.
Показания:
Лечение анемии почечного генеза у больных хронической почечной недостаточностью в т.ч. находящихся на диализе.
Профилактика и лечение анемии у взрослых больных с солидными опухолями получающих химиотерапию препаратами платины которые могут вызвать анемию (карбоплатин 75 мг/м2 на цикл карбоплатин 350 мг/м2 на цикл).
Лечение анемии у взрослых больных миеломной болезнью неходжкинскими лимфомами низкой степени злокачественности и хроническим лимфоцитарным лейкозом получающих противоопухолевую терапию при относительной недостаточности эндогенного эритропоэтина (она определяется как концентрация эритропоэтина в сыворотке непропорционально низкая относительно степени анемии).
Увеличение объема донорской крови предназначенной для последующей аутотрансфузии. При этом преимущества применения эпоэтина бета нужно соотнести с повышением риска тромбоэмболий при его применении. Больным с умеренной анемией (уровень гемоглобина 100-130 г/л или гематокрита 30-39 % без дефицита железа) препарат назначают только в том случае если получить достаточное количество консервированной крови не представляется возможным а плановое крупное оперативное вмешательство может потребовать большого объема крови (>4 единиц для женщин или >5 единиц для мужчин).
Профилактика анемии у недоношенных новорожденных родившихся с массой тела 750- 1500 г до 34 недели беременности.
Противопоказания:
Повышенная чувствительность к препарату или его компонентам парциальная красноклеточная аплазия после ранее проведенной терапии каким-либо эпоэтином бета неконтролируемая артериальная гипертензия невозможность проведения адекватной антикоагулянтной терапии инфаркт миокарда в течение месяца после события нестабильная стенокардия или повышенный риск тромбоза глубоких вен и тромбоэмболий в рамках преддепозитной программы сбора крови перед хирургическими операциями порфирия.
С осторожностью:
Беременность и лактация:
Так как достаточного опыта применения эритропоэтина при беременности и в период грудного вскармливания у человека нет Эритропоэтин следует назначать только в том случае если ожидаемые преимущества от его применения превышают возможный риск для плода и матери.
Способ применения и дозы:
Лечение анемии у больных с хронической почечной недостаточностью
Лечение Эритропоэтином проводится в 2 этапа:
Начальная терапия (стадия коррекции). При п/к введении начальная доза составляет 20 МЕ/кг массы тела 3 раза в неделю. При недостаточном повышении гематокрита (менее 05 % в неделю) дозу можно увеличивать ежемесячно на 20 МЕ/кг массы тела 3 раза в неделю. Суммарную недельную дозу можно делить также на ежедневные введения в меньших дозах или вводить за один прием.
Для поддержания гематокрита на уровне 30-35 % сначала дозу следует уменьшить наполовину от дозы в предыдущей инъекции. Впоследствии поддерживающую дозу подбирают индивидуально с интервалом в 1-2 нед. При п/к введении недельную дозу можно вводить однократно или за 3-7 введений в неделю.
У детей доза зависит от возраста (как правило чем меньше возраст ребенка тем более высокие дозы эпоэтина бета ему требуются). Однако поскольку предсказать индивидуальный ответ не представляется возможным начинать целесообразно с рекомендованного режима.
Лечение Эритропоэтином проводится как правило пожизненно. При необходимости его можно прервать в любое время.
Профилактика анемии у недоношенных новорожденных.
П/к в дозе 250 МЕ/кг массы тела 3 раза в неделю. Лечение эпоэтином бета должно начинаться как можно раньше предпочтительно с 3 дня жизни и продолжаться 6 нед.
Профилактика и лечение анемии у больных с солидными опухолями.
П/к разделяя недельную дозу на 3-7 введений.
Если во время первого цикла химиотерапии уровень гемоглобина несмотря на лечение эпоэтином бета снижается более чем на 10 г/л дальнейшее применение препарата может быть неэффективно.
Следует избегать повышения гемоглобина более чем на 20 г/л в месяц или до уровня выше 140 г/л. При возрастании гемоглобина более чем на 20 г/л в месяц дозу эпоэтина бета необходимо снизить на 50 %. Если уровень гемоглобина превышает 140 г/л препарат отменяют до тех пор пока он не снизится до уровня 90 80 33%) позволяет осуществить забор крови эпоэтин бета вводят в конце процедуры. На протяжении всего курса лечения гематокрит не должен превышать 48%.
Дозу препарата определяет врач-трансфузиолог и хирург индивидуально в зависимости от того какой объем крови будет взят у больного и от его эритроцитарного резерва. Объем крови который будет взят у больного зависит от предполагаемой кровопотери имеющихся в наличии методик консервации крови и общего состояния больного; он должен быть достаточным для того чтобы избежать переливания крови от другого донора. Объем крови который будет взят у больного выражается в единицах (одна единица эквивалентна 180 мл эритроцитов).
Возможность донорства зависит главным образом от объема крови у данного пациента и исходного гематокрита. Оба показателя определяют эндогенный эритроцитарный резерв который можно рассчитать по следующей формуле:
женщины: объем крови (мл) = 41 (мл/кг) х масса тела (кг) + 1200 (мл)
мужчины: объем крови (мл) = 44 (мл/кг) х масса тела (кг) + 1600 (мл) (при массе тела >45 кг).
Показание к применению Эритропоэтина и его разовая доза определяются по номограммам исходя из требуемого объема донорской крови и эндогенного эритроцитарного резерва.
Побочные эффекты:
Нежелательные реакции перечислены в соответствии со следующей градацией: часто (>1 % 01 % 001 %
Что такое эритропоэтин и чем опасен его дефицит?
Эритропоэтин помогает нашим клеткам получать достаточно кислорода, а еще позволяет добиться успехов в спорте. Разбираемся, как работает это вещество, чем опасен его дефицит, и при чем здесь генетика.
Содержание
Что такое эритропоэтин?
Эритропоэтин — это гормон, который помогает организму поддерживать оптимальный уровень кислорода. Для этого он стимулирует производство красных кровяных телец или эритроцитов.
Эритроциты обеспечивают наши ткани кислородом и выводят углекислый газ. Когда уровень кислорода падает, эритропоэтин помогает восполнить потери за счет усиленного производства эритроцитов и гемоглобина. Вот как это происходит:
В почках есть специализированные клетки, которые могут определить, что уровень кислорода в крови низкий. Если это так, почки вырабатывают больше эритропоэтина. Гормон запускает созревание гемопоэтических стволовых клеток в костном мозге. Это предшественники эритроцитов, которые с помощью эритропоэтина превращаются в полноценные клетки.
Чем опасен недостаток эритропоэтина?
Если выработка эритропоэтина снижена или нарушена, уровень кислорода в крови остается низким или будет падать дальше. Это опасно, потому что приводит к нескольким патологиям, включая анемию и гипоксию. При них ткани организма получают недостаточное количество кислорода и не могут нормально функционировать.
Симптомы анемии:
Недостаток эритропоэтина также снижает способность организма адаптироваться к перепадам высот и интенсивной физической нагрузке.
К пониженному уровню эритропоэтина могут приводить такие заболевания, как СПИД, воспалительные заболевания и некоторые виды рака. Недостаток кислорода может усугублять течение этих и других хронических заболеваний.
Легкие случаи анемии могут не требовать никакого лечения, особенно при отсутствии симптомов. Однако в более тяжелых случаях могут потребоваться добавки железа или стимулирующие выработку эритропоэтина препараты. Терапия эритропоэтином показала себя как эффективное лечение анемии у пациентов с хронической болезнью почек, а также у пациентов, страдающих онкологическими заболеваниями, ВИЧ и перенесших трансплантацию органов.
Что значит избыток эритропоэтина?
Повышение уровня эритропоэтина заставляет костный мозг производить больше красных кровяных телец. Постоянно повышенный уровень этого гормона сигнализирует о хронической нехватке кислорода в крови, например, из-за железодефицитной анемии. Также повышение уровня эритропоэтина может вызывать опухоль, выделяющая гормон. Например, почечно-клеточная карцинома.
В редких случаях слишком большое количество эритроцитов может вызвать состояние, известное как вторичная полицитемия. Она связана с рядом серьезных рисков для здоровья:
Стоит ли применять эритропоэтин в спорте?
В последние десятилетия профессиональные спортсмены обнаружили значительную пользу эритропоэтина. Этот гормон значительно повышает поглощение кислорода тканями, что может увеличить выносливость и работоспособность.

Как связаны спортивные достижения и генетика?
Эритропоэтин входит в группу допинговых препаратов крови, которые запрещены Медицинской комиссией Международного олимпийского комитета (МОК) и Всемирным допинговым агентством. Одной из причин запрета стал высокий риск для здоровья.
Использование эритропоэтина в качестве допинга приводит к аномально высокому количеству эритроцитов. Происходит сгущение крови и повышается риск серьезных побочных эффектов:
Что влияет на выработку эритропоэтина?
Вот что способствует снижению уровня кислорода в крови и усиленной выработке эритропоэтина:
Большая высота
На больших высотах давление воздуха ниже, что означает, что в каждом вдохе содержится меньше кислорода. Организм компенсирует это, увеличивая выработку эритропоэтина и эритроцитов для поддержания стабильного уровня кислорода в крови. Эта реакция помогает бороться с симптомами высотной болезни, вызванной снижением уровня кислорода.
☝️При адаптации к большим высотам у разных людей наблюдаются большие различия: одни быстро вырабатывают больше эритропоэтина, другие гораздо медленнее.
Реакция организма на большую высоту частично определяется генетикой. Население, традиционно проживавшее на большой высоте в течение тысяч лет, например, гималайские шерпы, вырабатывает больше эритропоэтина и имеет в среднем больше эритроцитов, чем люди, живущие на уровне моря.
Уровень эритропоэтина зависит от генетического склада человека. Ген EPO кодирует белок эритропоэтина. Когда уровень кислорода низкий, активность этого гена повышается, и выработка эритропоэтина увеличивается.

Что можно узнать из генетического теста
Исследование 2015 года показало, что вариант (rs7776054), расположенный возле гена MYB, связан с уровнем эритропоэтина. Ген MYB регулирует образование клеток крови, в том числе участвует в процессе созревания эритроцитов.
Генетический тест Атлас поможет выяснить, какой уровень эритропоэтина для вас нормален на основе генетики.
Эндогенный эритропоэтин что это
Эритропоэтин – гормон, синтезирующийся в почках. Он стимулирует образование эритроцитов в костном мозге.
Эпостим, эпоэтин, рекормон, регулятор эритропоэза.
мМЕ/мл (международная миллиединица на миллилитр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Эритропоэтин – гормон, в основном производящийся в почках. Он высвобождается в кровоток в ответ на кислородное голодание (гипоксию). Эритропоэтин попадает в костный мозг, где начинает стимулировать превращение стволовых клеток в эритроциты. Эритроциты содержат гемоглобин – белок, который способен переносить кислород от легких к органам и тканям. В норме срок жизни эритроцитов составляет около 120 дней, они имеют одинаковые размеры и форму.
Организм старается поддерживать примерно одинаковое число циркулирующих эритроцитов. При нарушении баланса между образованием и разрушением эритроцитов развивается анемия. Если в костном мозге образуется слишком мало эритроцитов либо слишком много теряется из-за кровопотери или разрушения (гемолиза), вызванного ненормальными размерами, формой, функцией эритроцитов или другими причинами, то количество переносимого к органам кислорода уменьшается. В ответ на это почкой вырабатывается эритропоэтин, который затем кровью доставляется в костный мозг, где стимулирует образование эритроцитов.
На производство эритроцитов влияет работа костного мозга, употребление достаточного количества железа, витамина B12 и фолиевой кислоты с пищей, а также образование эритропоэтина и способность костного мозга отвечать на соответствующие количества этого гормона.
Выработка эритропоэтина зависит от степени тяжести кислородного голодания и от способности почек производить гормон. Он активен в крови непродолжительное время, а затем выводится с мочой. Как только количество эритроцитов после дефицита повышается, почки начинают вырабатывать меньше эритропоэтина. Однако если они повреждены и/или не могут создавать достаточное количество эритропоэтина или если костный мозг не реагирует адекватно на достаточное количество эритропоэтина, то может развиться анемия.
При образовании доброкачественных или злокачественных опухолей почек (или других органов) производится чрезмерное количество эритропоэтина, из-за чего возникает слишком много эритроцитов – развивается полицитемия. Это приводит к увеличению циркулирующего объема крови, повышению ее вязкости и артериального давления.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Если уровень эритропоэтина у пациента повышен и в то же время количество эритроцитов снижено – он страдает анемией, вызванной, скорее всего, угнетением функции костного мозга. Если же при анемии уровень данного гормона снижен или в норме, то, очевидно, почки производят недостаточное количество этого гормона.
Повышенное количество эритроцитов и эритропоэтина с большой вероятностью указывает на производство избыточного количества эритропоэтина (почками или другим органом). Если количество эритроцитов увеличено, а эритропоэтин в норме или снижен, вероятно, что полицитемия не связана с выработкой эритропоэтина.
Причины повышения уровня эритропоэтина
Допустимое повышение эритропоэтина отмечается в следующих ситуациях:
Неадекватно высокий уровень эритропоэтина может быть вызван:
Причины понижения уровня эритропоэтина
Приемлемое снижение эритропоэтина происходит при:
Причины чрезмерно низкого уровня эритропоэтина:
Что может влиять на результат?
Кто назначает исследование?
Врач общей практики, терапевт, гематолог, нефролог, хирург.
Эритропоэтин (венозная кровь) в Москве
Лабораторное исследование для определения уровня эритропоэтина в сыворотке крови. Этот показатель относится к гормонам, которые регулируют образование красных клеток крови. Тест выполняется для выявления причин анемии, диагностики патологии костного мозга.
Приём и исследование биоматериала
Когда нужно сдавать анализ Эритропоэтин?
Подробное описание исследования
Основная функция эритроцитов, или красных клеток крови, в организме — доставка кислорода к тканям и органам. Это обеспечивает нормальное протекание всех физиологических процессов. Если по результатам лабораторного исследования в крови выявлено снижение количества эритроцитов, можно предположить развивающуюся анемию, которая требует обязательного выявления причины и подбора соответствующей терапии.
Эритроциты образуются в костном мозге. Для нормальной их продукции необходимо соблюдение многих факторов, например, достаточное содержание железа, витамина В12, фолиевой кислоты в рационе. Также важную роль играет достаточное обеспечение организма гормоном эритропоэтином, который стимулирует превращение стволовых клеток в красные клетки крови в костном мозге.
Эритропоэтин — гликопротеин, то есть вещество белково-углеводной природы, которое производится клетками почек и печени. Рецепторы к эритропоэтину расположены в клетках нервной ткани, на яичниках, яичках, в тканях молочной железы и других органах.
В норме его уровень в плазме крови низкий, но относительно стабильный. Почки начинают усиленно вырабатывать эритропоэтин, когда концентрация кислорода в тканях снижается — наступает гипоксия. Как только уровень кислорода стабилизируется, эритропоэтин прекращает вырабатываться.
От уровня этого гормона зависит не только образование и созревание красных кровяных телец, но и насыщение организма кислородом в целом. Эритропоэтин также влияет на функциональное состояние сердечно-сосудистой системы, на нервную и репродуктивную системы, на гемостаз, иммунный статус и мочевыделительную систему.
Заболевания почек могут стать причиной сниженного или, наоборот, увеличенного синтеза эритропоэтина. Дефицит гормона наблюдается при хронической почечной недостаточности и приводит к развитию анемии.
У больных с новообразованиями — доброкачественными или злокачественными — в почках может наблюдаться увеличенный синтез гормона, вследствие этого образуется слишком много эритроцитов. Такое состояние называют полицитемией. В результате этого увеличивается общий объем циркулирующей крови, повышается ее вязкость, увеличивается артериальное давление.
Исследование уровня эритропоэтина в сыворотке крови помогает определить причины развития анемии у людей, которые не страдают дефицитом железа или витамина В12. Анализ также важен для диагностики полицитемии и заболеваний костного мозга.
Эндогенный эритропоэтин что это
Анемия присутствует у 40% больных немиелоидными злокачественными опухолями: легкая степень – в 30%, умеренная – в 9% и тяжелая – в 1% случаев. Общая частота анемии во время противоопухолевого лечения (химиотерапии или лучевой терапии) составляет 54% (легкая форма – 39%, умеренная – 14%, тяжелая – 1%). Частота ее выше у больных раком легкого (71%) или злокачественными опухолями женской репродуктивной системы (65%) и возрастает с увеличением количества курсов химиотерапии [3]
Причины развития анемии при злокачественных опухолях могут быть разными и связаны как с состоянием здоровья больного (гемоглобинопатии, талассемия, нарушение питания с дефицитом необходимых элементов, метаболические нарушения, болезнь почек), так и с самим опухолевым процессом (кровотечение, опухолевая инфильтрация костного мозга, гиперспленизм, анемия хронического заболевания) или противоопухолевым лечением (обширное облучение, гематологическая или почечная токсичность цитостатиков, индуцированный лекарственными препаратами гемолиз).
Степень тяжести анемии, являющейся следствием противоопухолевого лечения, определяется согласно основной шкале токсичности Национального института рака – CTCAEv3:
Химиотерапия является одной из наиболее частых причин развития или усугубления анемии у онкологических больных. Анализ частоты гемотрансфузий у 2719 пациентов, проведенный в Великобритании, показал, что на фоне химиотерапии в 38% случаев наблюдалось падение концентрации Hb ниже 11 г/дл и в 33% потребовалась по крайней мере однократная гемотрансфузия.
В настоящее время для коррекции анемии в онкологии широкое распространение получили стимуляторы эритропоэза или непосредственно в переводе с английского языка (erythropoiesis-stimulating agents – ESAS) эритропоэзстимулирующие агенты (ЭСА), клиническая эффективность которых доказана в многочисленных клинических исследованиях. Известно, что при анемии у онкологических больных наблюдается абсолютное или относительное снижение продукции эндогенного эритропоэтина, дефицит которого может быть компенсирован путем введения экзогенных стимулятов эритропоэза: эпоэтина-а, эпоэтина-в, дарбэпоэтина-а.
Первый опыт успешного применения ЭСА у больных с терминальной стадией заболеваний почек, находящихся на гемодиализе, показал, что гемотрансфузии являются не единственным методом коррекции анемии и что анемия обратима. Этот факт послужил толчком для организации подобных исследований в онкологии для больных с анемией, индуцированной цитостатиками. Первое же рандомизированное исследование продемонстрировало эффективность рекомбинантного человеческого эритропоэтина в качестве корректора анемии у онкологических больных, получающих химиотерапию. [5]
Результаты 3 крупных открытых нерандомизированных исследований [6–8] подтвердили этот вывод: было показано, что применение ЭСА приводит к повышению уровня Hb, снижению потребности в гемотрансфузиях и улучшению качества жизни больных даже в случаях неэффективной химиотерапии. Одним из наиболее важных результатов этих исследований явилось установление оптимального уровня Hb (12 г/дл), при котором достигается максимальное улучшение качества жизни. Именно этот уровень Hb (12 г/дл) признан оптимальным всеми комитетами по выработке клинических рекомендаций и до настоящего времени является целевым при лечении ЭСА.
Однако в исследуемой популяции больных увеличение риска осложнений не сопровождалось увеличением смертности (относительный риск – HR 1,08; 95% доверительный интервал – 95% ДИ 0,99–1,18; 42 исследования, 8167 больных) [18]. Результаты ретроспективного анализа исследования об улучшении выживаемости больных, получавших эпоэтин-а.Это послужило основанием для организации проспективных исследований, которые пытались обосновать гипотезу улучшения выживаемости путем достижения в процессе лечения целевого уровня Hb, превышающего оптимальный, и расширения показаний для использования ЭСА, изучая их эффективность в качестве средства профилактики анемии, а также у онкологических больных, не получающих химиотерапию. Опубликованные результаты подобных клинических исследований [22–31] и метаанализа [32] свидетельствовали о негативном влиянии ЭСА на продолжительность жизни больных и/или на эффективность контроля роста опухоли.
Таблица 1. Рандомизированные, двойные слепые плацебо-контролируемые исследования по оценке эффективности дарбэпоэтина-a при анемии, индуцированной цитостатиками (n=2112)
| Автор | Тип опухоли, фаза исследования | N | Продолжительность терапии, нед | МНЛН | МВН, мес | Плацебо | Дарбэпоэтин-α | ||
|---|---|---|---|---|---|---|---|---|---|
| режим | n | доза, мкг/кг | n | ||||||
| D.Kotasek, 2003 г. | Солидные II | 249 | 12 | нет | 2,8 | 1 раз в 3 нед | 51 | 4,5 | 32 |
| 6,75 | 17 | ||||||||
| 9 | 46 | ||||||||
| 12 | 28 | ||||||||
| 13,5 | 35 | ||||||||
| 15 | 40 | ||||||||
| D.Kotasek, 2002 г. | Солидные II | 156 | 12 | нет | 2,8 | 1 раз в 4 нед | 31 | 9 | 31 |
| 12 | 31 | ||||||||
| 15 | 33 | ||||||||
| 18 | 30 | ||||||||
| M.Hedenus, 2002 г. | ЛФП II | 66 | 12 | нет | 3,5 | 1 раз в неделю | 11 | 1 | 11 |
| 2,25 | 22 | ||||||||
| 4,5 | 22 | ||||||||
| J.Vansteenkiste, 2002 г. | Рак легкого III | 314 | 12 | да | 7,5 | 1 раз в 1 нед | 158 | 2,25 | 156 |
| M.Hedenus, 2003 г. | ЛФП III | 344 | 12 | да | 29,4 | 1 раз в 1 нед | 170 | 2,25 | 174 |
| K.Taylor, 2005 г. | Немиелоидные III | 386 | 15 | нет | 4,2 | 1 раз в 3 нед | 193 | 300/3 нед | 193 |
| R.Pirker,2007 г. | МРЛ III | 597 | 18 | да | 8,6 | 1 раз в x4 нед, затем 1 раз в 3 нед | 298 | 300/нед x 4 нед, затем 300/3 нед | 299 |
Примечание. ЛФП – лимфопролиферативные злокачественные опухоли, МНЛН – многолетнее наблюдение, МВН – медиана времени наблюдения.
1. BEST [24] – профилактика анемии у больных диссеминированным раком молочной железы без анемии, получающих химиотерапию первой линии. Рандомизированное исследование по сравнению эффективности эпоэтина-а и плацебо, включившее 939 пациенток с концентрацией Hb не более 13 г/дл. Целевой уровень Hb – 12–14 г/дл. Получено снижение годичной выживаемости пациенток, получавших эритропоэтин (70% против 76%; HR 1,37; p=0,01), при отсутствии различий в частоте достижения объективного эффекта и времени до прогрессирования болезни. Наибольшее число смертельных исходов зарегистрировано в первые 4 мес лечения за счет более высокой частоты раннего прогрессирования опухоли (6% против 3%) и тромботических и сосудистых осложнений (1% против 0,2%) у больных из группы эритропоэтина. Однако ретроспективный анализ данных независимыми экспертами показал, что группа больных, получавших эпоэтин-а, была прогностически гораздо менее благоприятной, чем группа плацебо (более пожилой возраст, более тяжелое общее состояние и большая распространенность болезни на момент включения, большее число факторов риска развития тромбоэмболических и сосудистых осложнений).
2. ENHANCE [22] – профилактика анемии у больных раком области головы и шеи без анемии (n=351), получающих лучевую терапию. Рандомизированное исследование по сравнению эффективности эпоэтина-а и плацебо. Целевой уровень Hb – 14,5–15 г/дл. Отмечено снижение выживаемости без прогрессирования у больных, получавших эритропоэтин (HR 1,39). Однако этот вывод был сделан при анализе всей популяции включенных больных и в подгруппе пациентов гипофарингеальным раком: при сравнительном анализе пациентов, оцененных согласно протоколу, разницы не отмечено (p=0,11). Помимо того, при отдельном рассмотрении подгруппы больных, радикально прооперированных и получавших лучевую терапию в адъювантном режиме, различий во времени до прогрессирования болезни не выявлено (р=0,9). В подгруппе больных, которым были выполнены паллиативные операции, а также в подгруппе больных, которым операции не выполнялись, выявлено достоверное (р=0,001 и p=0,006 соответственно) уменьшение выживаемости без прогрессирования у больных, получавших эпоэтин. Исследовате- ли предположили, что данный феномен ускорения роста опухоли при стимуляции эпоэтином-а связан с активацией рецепторов эритропоэтина, расположенных на опухолевых клетках. В связи с этим авторы ретроспективно оценили экспрессию рецепторов к эритропоэтину в опухоли у 154 больных.
Экспрессия эритропоэтиновых рецепторов выявлена в 104 (68%) случаях и не определялась иммуногистохимически в 50 (32%) случаях. При рецепторположительных
опухолях получено статистически значимое уменьшение времени до прогрессирования болезни у больных, получавших эпоэтин-в (р=0,003). При рецепторотрицательных опухолях достоверных различий не выявлено (р=0,86).
Таким образом, данные о негативном влиянии ЭСА на продолжительность жизни больных и эффективность контроля роста опухоли получены в исследованиях, изучавших их вне рамок официальных показаний к применению.
H.Ludwig и соавт. [39] провели первый анализ совокупных индивидуальных данных онкологических больных – участников всех рандомизированных плацебо-контролируемых клинических исследований по изучению дарбэпоэтина-а с точки зрения современных показаний к назначению стимуляторов эритропоэза при анемии, вызванной цитостатиками. Анализ индивидуальных данных пациентов дает возможность стандартизировать главную цель исследования и уменьшить различия между исследованиями, выявить исходные параметры пациентов, которые могли бы предсказать конечный результат лечения. Помимо того, анализ большого числа больных позволяет выявить даже незначительные различия между группами, которые невозможно определить при анализе каждого, отдельно взятого исследования.
Авторами проведена оценка влияния дарбэпоэтина-а в сравнении с плацебо на безопасность лечения и потребность в гемотрансфузиях, а также взаимосвязи гемотрансфузий, исходной и достигнутой в процессе лечения концентрации Hb и безопасности терапии.
Главными параметрами безопасности, оценка которых проведена в ходе исследования, являлись общая выживаемость, выживаемость без прогрессирования, прогрессирование болезни в период лечения и в период длительного наблюдения, а также число смертей и число побочных явлений, определяемых на основе их известной или гипотетической связи с безопасностью лечения, связанных с препаратом.
Выборка побочных явлений осуществлялась вне зависимости от их тяжести и взаимосвязи с исследуемым препаратом. Учитывался каждый случай гемотрансфузии начиная с 5-й недели и до окончания периода лечения.
Большинство больных были белой расы. Средний возраст был одинаковым в обеих группах; женщин было больше в группе дарбэпоэтина-а. В группе плацебо по сравнению с группой дарбэпоэтина-а был выше процент больных, получавших химиотерапию, включавшую производные платины (табл. 2).
Таблица 2. Характеристика больных
| Характеристика | Дарбэпоэтин-a (n=1200) | Плацебо (n=912) | Общее количество (n=2112) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | ||||
| Пол | |||||||||
| мужской | 596 | 49,7 | 493 | 54,1 | 1089 | 51,6 | |||
| женский | 604 | 50,3 | 419 | 45,9 | 1023 | 48,4 | |||
| Раса | |||||||||
| европеоидная | 1129 | 94,1 | 866 | 95 | 1995 | 94,5 | |||
| негроидная | 30 | 2,5 | 22 | 2,4 | 52 | 2,5 | |||
| другие | 41 | 3,4 | 24 | 2,4 | 65 | 3,1 | |||
| Возраст, годы | |||||||||
| медиана | 61,9 | 62,0 | 61,9 | ||||||
| стандартное отклонение | 11,6 | 10,7 | 11,3 | ||||||
| моложе 65 | 659 | 54,9 | 522 | 57,2 | 1181 | 55,69 | |||
| 65 лет и старше | 541 | 45,1 | 390 | 42,7 | 931 | 44,1 | |||
| Платиносодержащая химиотерапия | 656 | 54,7 | 571 | 62,6 | 1127 | 58,1 | |||
| Тип опухоли | |||||||||
| легкое | 532 | 44 | 505 | 55 | 1037 | 49 | |||
| гематология | 255 | 21 | 217 | 24 | 427 | 22 | |||
| молочная железа | 144 | 12 | 62 | 7 | 206 | 10 | |||
| гастроинтестинальная | 106 | 9 | 56 | 6 | 162 | 8 | |||
| гинекологическая | 81 | 7 | 31 | 3 | 112 | 5 | |||
| мочеполовая | 41 | 3 | 10 | 1 | 51 | 2 | |||
| другие | 41 | 3 | 31 | 3 | 72 | 3 | |||
| Стадия заболевания | |||||||||
| II и ниже | 128 | 10,7 | 99 | 10,9 | 227 | 10,7 | |||
| III и выше | 1037 | 86,4 | 782 | 85,7 | 1819 | 86,1 | |||
| другие | 23 | 1,9 | 17 | 1,9 | 40 | 1,9 | |||
| неизвестно | 12 | 1,0 | 14 | 1,5 | 26 | 1,2 | |||
| ECOG | |||||||||
| 0 | 282 | 23,5 | 179 | 19,6 | 461 | 21,8 | |||
| 1 | 648 | 54,0 | 495 | 54,3 | 1143 | 54,1 | |||
| 2 | 162 | 13,5 | 150 | 16,4 | 312 | 14,8 | |||
| 3 | 10 | 0,8 | 7 | 0,8 | 17 | 0,8 | |||
| неизвестно | 98 | 8,2 | 81 | 8,9 | 179 | 8,5 | |||
| Исходный уровень Hb, г/дл | 1169 | 876 | 2045 | ||||||
| медиана | 10,5 | 10,5 | 10,5 | ||||||
| стандартное отклонение | 1,4 | 1,4 | 1,4 | ||||||
| Исходный уровень эндогенного эритропоэтина, МЕ/мл | 1137 | 859 | 1996 | ||||||
| медиана | 76,3 | 84,1 | 79,7 | ||||||
| стандартное отклонение | 134,5 | 209,5 | 170,9 | ||||||
Наиболее частыми видами злокачественных опухолей были рак легкого и гемобластозы. Данные типы опухолей диагностированы у 65% больных группы дарбэпоэтина-а и 79% больных группы плацебо. Большая часть больных имела распространенный процесс, определенный как III стадия и выше. Функциональный статус по шкале ECOG, исходная концентрация Hb и эритропоэтина представлены в табл. 2. Анализ выживаемости больных и прогрессирования болезни с учетом данных длительного наблюдения не выявил влияния дарбэпоэтина-а на эти показатели. Кривые общей выживаемости, выживаемости без прогрессирования и времени до прогрессирования болезни, построенные для больных, получивших дарбэпоэтин-а, и больных, получивших плацебо, практически полностью совпадали: для общей выживаемости HR составил 0,97 (95% ДИ 0,85–1,1), для выживаемости без прогрессирования HR составил 0,93 (95% ДИ 0,84–1,04), для времени до прогрессирования болезни – HR 0,92 (95% ДИ 0,82–1,03) (рис. 1). 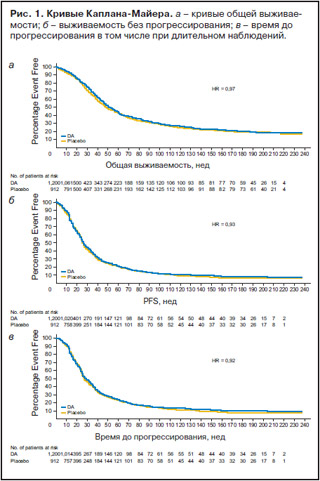
Побочные явления, зарегистрированные во время исследования, представлены в табл. 3.
Таблица 3. Побочные явления, зарегистрированные во время исследования
| Осложнение | Дарбэпоэтин-α (n=1200) | Плацебо (n=912) | HR | 95% ДИ | ||
|---|---|---|---|---|---|---|
| n | % | n | % | |||
| Сердечно-сосудистые и тромбоэмболические | 192 | 16,0 | 127 | 13,9 | 1,26 | 1,00-1,59 |
| Аритмия | 57 | 4,7 | 43 | 4,7 | 1,15 | 0,77-1,72 |
| Цереброваскулярные | 20 | 1,7 | 18 | 2,0 | 1,05 | 0,55–1,98 |
| Застойная сердечная недостаточность | 20 | 1,7 | 23 | 2,5 | 0,81 | 0,44–1,48 |
| ИМ или ИБС | 21 | 1,8 | 13 | 1,4 | 1,34 | 0,66–2,71 |
| Эмболия или тромбоз | 96 | 8,0 | 46 | 5,0 | 1,57 | 1,10–2,26 |
| Инсульт | 7 | 0,6 | 11 | 1,2 | 0,62 | 0,24–1,60 |
| Гипертензия | 47 | 3,9 | 31 | 3,4 | 1,33 | 0,84–2,10 |
Примечание. ИМ – инфаркт миокарда, ИБС – ишемическая болезнь сердца.
В период проведения исследования умерли 110 (9,2%) больных в группе дарбэпоэтина-а и 92 (10,1%) в группе плацебо. Отношение рисков смерти свидетельствует об отсутствии достоверных различий между двумя группами (HR 1,11; 95% ДИ 0,84–1,47).
Риск развития сердечно-сосудистых и тромбоэмболических осложнений был выше при применении дарбэпоэтина-а (HR 1,26; 95% ДИ 1,0–1,59) в первую очередь за счет более высокой частоты тромбоэмболических осложнений в этой группе (8% по сравнению с 5% в группе плацебо; HR 1,52; 95% ДИ 1,10–2,26). Частота развития инфаркта миокарда и болезни коронарных артерий также была выше при лечении дарбэпоэтином-а, однако процент больных был невелик, а 95% ДИ для HR был широким. Частота таких видов сердечно-сосудистых осложнений, как аритмии, цереброваскулярные нарушения и застойная сердечная недостаточность, была одинаковой в обеих группах.
Анализ влияния исходного уровня Hb на параметры безопасности показал, что независимо от исходной концентрации Hb дарбэпоэтин-а не увеличивал смертность и не влиял на выживаемость без прогрессирования (рис 2, а, б). Однако имелась тенденция к взаимосвязи между риском развития тромбоэмболических осложнений, ассоциированных с дарбэпоэтином-а, и уровнем исходного Hb (рис. 2, в). 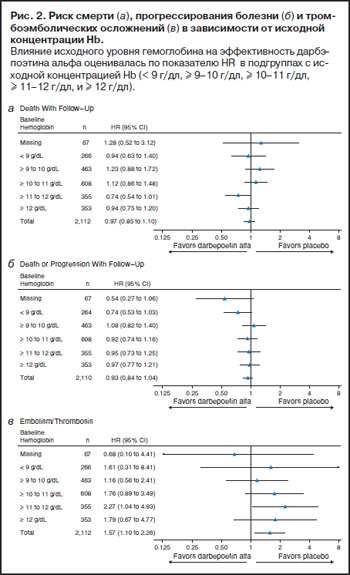
Не получено увеличения смертности или стимуляции опухолевого прогрессирования у пациентов, уровень Hb у которых в процессе лечения превысил 12 г/дл и 13 г/дл, а также у больных с повышением концентрации Hb на фоне дарбэпоэтина-а не менее 1 г/дл в течение первых 14 дней или не менее 2 г/дл в течение 28 дней без гемотрансфузий. Авторы предполагают, что способность к быстрому восстановлению уровня Hb может быть признаком более благоприятного биологического прогноза. В этом случае негативные результаты, полученные в исследованиях с высоким целевым уровнем Hb, могут быть отнесены к больным, нечувствительным к ЭСА. Подобное предположение нуждается в дополнительном исследовании с учетом эффективности проводимой химиотерапии.
Поскольку помимо дарбэпоэтина-а концентрация Hb может быть повышена и с помощью гемотрансфузий, проведено изучение влияния трансфузий на уровень достигнутого Hb. Гемотрансфузии лишь незначительно увеличили долю больных, у которых уровень Hb был более 12 г/дл: с 35,8% до 37,8% при лечении дарбэпоэтином-а и с 13,8% до 15,8% при использовании плацебо. Процент больных, уровень Hb которых превысил 13 г/дл с помощью или без помощи гемотрансфузий, тоже отличался незначительно: 62,4% против 57,6% для дарбэпоэтина-а и 40,8% против 33,7% для плацебо. Анализ выживаемости больных в зависимости от максимально достигнутого уровня Hb показал, что общая выживаемость и выживаемость без прогрессирования лучше у больных, уровень Hb у которых был выше 12 г/дл и 13 г/дл, чем у пациентов, у которых концентрация Hb была ниже. Четкой взаимосвязи между риском развития эмболий/тромбозов и достижением концентрации Hb, превышающей 12 или 13 г/дл, не отмечено.
Исследовали также влияние трансфузий на частоту увеличения концентрации Hb. При отсутствии трансфузий доля больных, повышение концентрации Hb у которых составило более 1 г/дл в течение 14 дней или более 2 г/дл в течение 28 дней, была равна 68,8% для дарбэпоэтина-а и 52,3% для плацебо или 39,1% для дарбэпоэтина-а и 19,2% для плацебо соответственно. Когда же в анализ были включены только пациенты, получившие трансфузии, процент больных, концентрация Hb у которых достигла указанного выше уровня, оказался одинаковым в обеих лечебных группах: 86,7% для дарбэпоэтина-а, 87,5% для плацебо или 77,6% для дарбэпоэтина-а, 75,3% для плацебо соответственно. Гемотрансфузии как единственная причина достижения желаемого уровня Hb ассоциировались с увеличением риска смерти и прогрессирования болезни (рис. 3, б, в). При анализе подгруппы больных, не получавших гемотрансфузии, подобной взаимосвязи не обнаружено (рис. 3, б, в). Не установлено четкой взаимосвязи между риском развития эмболий/тромбозов и частотой повышения концентрации Hb в зависимости от наличия или отсутствия гемотрансфузий (см. рис. 3). 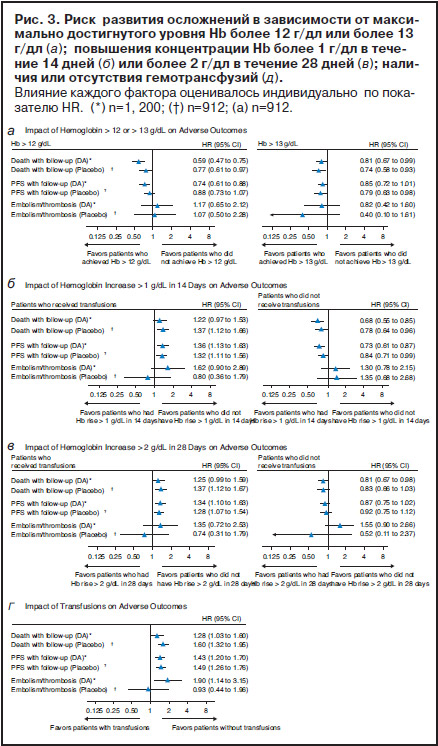
Наличие гемотрансфузий ассоциировалось с более высоким риском смерти и прогрессирования болезни как у пациентов, получавших дарбэпоэтин-а, так и у пациентов, получавших плацебо, а также с более высоким риском развития эмболий/тромбозов в группе дарбэпоэтина-а (рис. 3, г).
Известно, что потребность в гемотрансфузиях является признаком более тяжелого общего состояния пациента и менее благоприятного прогноза заболевания, что и могло, по мнению авторов, явиться причиной полученного негативного результата. Необходимы дальнейшие исследования в этой области.
По сравнению с плацебо дарбэпоэтин-а снижал необходимость гемотрансфузий, начиная с 5-й недели лечения и до его окончания, независимо от исходного уровня Hb (рис. 3, а). Как и ожидалось, больные (19%) с исходным уровнем Hb 10–11 г/дл нуждались в гемотрансфузиях в 2 раза реже, чем больные (41%) с исходным уровнем Hb менее 9 г/дл.
Таким образом, существует много исследований, посвященных изучению эффективности ЭСА при анемии, индуцированной цитостатиками, в которых не зарегистрировано негативное влияние на продолжительность жизни или течение опухолевого процесса и было показано улучшение общего состояния пациентов и снижение потребности в гемотрансфузиях. Еще одним доказательством являются результаты метаанализа H.Ludwig и соавт. Авторы понимают, что полученные данные не могут быть экстраполированы на всю популяцию онкологических больных и не могут отрицать негативные результаты других исследований. Но недостаточно ясное влияние стимуляторов эритропоэза на смертность больных и прогрессирование опухоли показывают, что необходима организация специальных исследований в этом направлении с учетом эффективности химиотерапии и стратификации сравниваемых групп пациентов в соответствии с факторами прогноза течения заболевания и риска развития тромботических осложнений.
В настоящее время при назначении стимуляторов эритропоэза онкологическим больным необходимо руководствоваться рекомендациями ESMO [4]: назначение ЭСА показано для лечения симптомной анемии, индуцированной химиотерапией у взрослых пациентов, страдающих немиелоидными злокачественными опухолями. Целью назначения является предупреждение гемотрансфузий, связанных с ними осложнений и возможность улучшения качества жизни за счет повышения уровня Hb.
1. Назначение ЭСА показано больным, получающим химиотерапию, при уровне Hb менее 10 г/дл в целях повышения его концентрации не более 12 г/дл или предупреждения дальнейшего его снижения.
2. Больным, получающим химиотерапию, уровень Hb которых составляет 10–12 г/дл, ЭСА могут быть назначены при наличии симптомов анемии или для предупреждения дальнейшего снижения концентрации Hb. Однако это выходит за рамки инструкций по использованию ЭСА.
3. Пациентам, не получающим химиотерапию, ЭСА не показаны ввиду возможного повышения риска смерти.
4. Больным, получающим лечение с целью излечения, ЭСА должны назначаться с осторожностью.
5. При повышении концентрации Hb по крайней мере на 1 г/дл по сравнению с исходной после 4 нед применения ЭСА вводимая доза может быть оставлена такой же или редуцирована на 25–50%.
6. При повышении концентрации Hb менее чем на 1 г/дл по сравнению с исходной после 4 нед применения ЭСА вводимая доза должна быть увеличена. Если после 4 нед применения ЭСА уровень Hb повышается не менее чем на 1 г/дл, вводимая доза может быть оставлена такой же или редуцирована на 25–50%.
7. В случае эффективного лечения ЭСА их применение должно быть прекращено через 4 нед после прекращения химиотерапии.
8. При повышении концентрации Hb менее чем на 1 г/дл по сравнению с исходным уровнем после 8–9 нед применения терапия ЭСА считается неэффективной и должна быть прекращена.
9. Если прирост Hb превышает 2 г/дл за 4 нед или уровень Hb превышает 12 г/дл, вводимая доза должна быть редуцирована на 25–50%.
10. Если уровень Hb превысил 12 г/дл, введение ЭСА необходимо прекратить, дождаться снижения уровня Hb ниже 12 г/дл, после чего следует возобновить введение ЭСА в дозе, сниженной на 25% по сравнению с предыдущей. Концентрация Hb не должна превышать 12 г/дл на фоне лечения ЭСА.
Автор: Н.С.Бесова
Отделение химиотерапии РОНЦ им. Н.Н.Блохина РАМН, Москва
Журнал «Современная онкология №4 2009 г.»
