Энтальпия что это такое простыми
Энтальпия
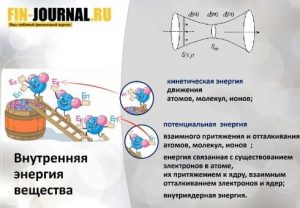
Энтальпия — это термодинамическое свойство вещества, которое указывает уровень энергии, сохраненной в его молекулярной структуре. Это значит, что, хотя вещество может обладать энергией на основании температуры и давления, не всю ее можно преобразовать в теплоту. Часть внутренней энергии всегда остается в веществе и поддерживает его молекулярную структуру. Часть кинетической энергии вещества недоступна, когда его температура приближается к температуре окружающей среды. Следовательно, энтальпия — это количество энергии, которая доступна для преобразования в теплоту при определенной температуре и давлении. Единицы энтальпии — британская тепловая единица или джоуль для энергии и Btu/lbm или Дж/кг для удельной энергии.
Количество энтальпии
Если температура вещества выше его данной температуры или изменяет состояние на газообразное при данной температуре, энтальпия выражается положительным числом. И наоборот при температуре ниже данной энтальпия вещества выражается отрицательным числом. Энтальпия используется в вычислениях для определения разницы уровней энергии между двумя состояниями. Это необходимо для настройки оборудования и определения коэффициента полезного действия процесса.
Энтальпию часто определяют как полную энергию вещества, так как она равна сумме его внутренней энергии (и) в данном состоянии наряду с его способностью проделать работу (pv). Но в действительности энтальпия не указывает полную энергию вещества при данной температуре выше абсолютного нуля (-273°С). Следовательно, вместо того, чтобы определять энтальпию как полную теплоту вещества, более точно определять ее как общее количество доступной энергии вещества, которое можно преобразовать в теплоту.
H = U + pV
Основы теплотехники
Что такое энтальпия?
Попробуем уяснить физический смысл и суть понятия энтальпия, которое широко используется при расчетах и прогнозировании различных процессов в теплотехнике.
Уравнение первого закона термодинамики, выражающее закон сохранения энергии в термодинамических процессах, можно преобразовать к следующему виду:
Слово энтальпия в переводе с греческого означает «нагреваю».
Энтальпия тоже является параметром состояния, поскольку составляющие u и pv имеют для каждого состояния вполне определенные значения. Тогда первый закон термодинамики можно записать в виде:
Выражение (cv + T) в соответствии с уравнением Майера можно выразить через cp :
Значение энтальпии различных веществ в разных состояниях приведены в справочниках.
Энтальпия используется в вычислениях для определения разницы уровней энергии между двумя состояниями термодинамической системы.
Это бывает необходимо для настройки оборудования и определения коэффициента полезного действия процесса.
Понятие энтропии
В переводе с греческого слово «энтропия» означает превращение.
Этот параметр не имеет физического смысла и введен формально на основании математических построений для облегчения решения многих теплотехнических задач применительно к идеальному газу.
Произведение энтропии на изменение температуры системы характеризует изменение энергии системы. При этом даже если энергия системы будет изменяться, энтропия этой системы может оставаться неизменной. Очевидно, что при изотермических процессах (температура системы неизменна) составляющая энергии системы в которую входит энтропия равна нулю.
В общем случае изменение энергии термодинамической системы не является обязательным условием изменения энтропии этой системы.
Скачать теоретические вопросы к экзаменационным билетам
по учебной дисциплине «Основы гидравлики и теплотехники»
(в формате Word, размер файла 68 кБ)
Скачать рабочую программу
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
Скачать календарно-тематический план
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
Энтальпия — что это такое простыми словами
Про энтальпию на простом языке
При работе с какими-либо расчётами, вычислениями и выполнении прогноза разнообразных явлений, связанных с теплотехникой, каждый сталкивается с понятием энтальпия. Но для людей, специальность которых не касается теплоэнергетики или которые лишь поверхностно сталкиваются с подобными терминами, слово «энтальпия» будет наводить страх и ужас. Итак, давайте разберёмся, действительно ли всё так страшно и непонятно?
Если попытаться сказать совсем просто, под термином энтальпия понимается энергия, которая доступна для преобразования в теплоту при некотором постоянном давлении. Понятие энтальпия в переводе с греческого значит «нагреваю». То есть формулу, содержащую элементарную сумму внутренней энергии и произведенную работу, называют энтальпией. Эта величина обозначается буквой i.
Если записать вышесказанное физическими величинами, преобразовать и вывести формулу, то получится i = u + pv (где u – внутренняя энергия; p, u – давление и удельный объем рабочего тела в том же состоянии, для которого взято значение внутренней энергии). Энтальпия — аддитивная функция, т. е. энтальпия всей системы равна сумме всех составляющих её частей.
Термин «энтальпия» сложен и многогранен.
Но если постараться в нём разобраться, то всё пойдёт очень просто и понятно.
Ну, что же, механизм работы понятен. Вам лишь нужно внимательно читать и вникать. С термином «Энтальпии» мы уже разобрались, также привели и его формулу. Но тут же возникает ещё один вопрос: откуда взялась эта формула и почему энтропия связана, к примеру, с внутренней энергией и давлением?
Суть и смысл
Для того, чтобы попытаться выяснить физический смысл понятия «энтальпия» нужно знать первый закон термодинамики:
энергия не исчезает в никуда и не возникает из ничего, а лишь переходит из одного вида в другой в одинаковых количествах. Таким примером может служить переход теплоты (тепловой энергии) в механическую энергию, и наоборот.
Уравнение первого закона термодинамики нам нужно преобразить в вид dq = du + pdv = du + pdv + vdp – vdp = d(u + pv) – vdp. Отсюда мы видим выражение (u + pv). Именно это выражение и называется энтальпией (полная формула приводилась выше).
Энтальпия также является величиной состояния, потому что составляющие u (напряжение) и p (давление), v (удельный объём) имеют для каждой величины определенные значения. Зная это, первый закон термодинамики возможно переписать в виде: dq = di – vdp.
В технической термодинамике используются значения энтальпии, которые высчитываются от условно принятого нуля. Все абсолютные значения этих величин весьма трудно определить, так как для этого необходимо учесть все составляющие внутренней энергии вещества при изменении его состояния от О к К.
Формулу и значения энтальпии привёл в 1909 г. учёный Г.Камерлинг-Оннесом.
В выражении i — удельная энтальпия, для всей массы тела полная энтальпия обозначается буквой I, по всемирной системе единиц энтальпия измеряется в Джоулях на килограмм и рассчитывается как:
Функции
Энтальпия («Э») является одной из вспомогательных функций, благодаря использованию которой можно значительно упростить термодинамический расчёт. Так например, огромное количество процессов подвода теплоты в теплоэнергетике (в паровых котлах или камере сгорания газовых турбин и реактивных двигателей, а также в теплообменных аппаратах) осуществляют при постоянном давлении. По этой причине в таблицах термодинамических свойств обычно приводят значения энтальпии.
Условие сохранения энтальпии лежит, в частности, в основе теории Джоуля — Томсона. Или эффекта, нашедшего важное практическое применение при сжижении газов. Таким образом, энтальпия есть полная энергия расширенной системы, представляющая сумму внутренней энергии и внешней – потенциальной энергии давления. Как любой параметр состояния, энтальпия может быть определена любой парой независимых параметров состояния.
Также, исходя из приведённых выше формул, можно сказать: «Э» химической реакции равна сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции.
В общем случае изменение энергии термодинамической системы не является необходимым условием для изменения энтропии этой системы.
Итак, вот мы и разобрали понятие «энтальпии». Стоит отметить, что «Э» неразрывно связана с энтропией, о которой вы также можете прочесть позже.
Что такое энтальпия? (и его 11 видов)
Содержание:
И из всех физических величин, с которыми справляется эта дисциплина, одним из самых важных, несомненно, является энтальпия. Изменение этого термодинамического свойства определяет, что химические реакции в системе являются экзотермическими (они выделяют тепло) или эндотермическими (они поглощают тепло), что очень важно во многих областях науки.
Но что такое энтальпия? Как рассчитывается? Какие бывают типы? Как это связано с энтропией? В сегодняшней статье мы ответим на эти и многие другие вопросы об этой энергии, которая, хотя мы ее и не видим, определяет природу всего, что нас окружает.
Что такое энтальпия?
Энтальпия, представленная как H, это количество энергии, которым термодинамическая система в условиях постоянного давления обменивается с окружающей средой.. Другими словами, это термодинамическое свойство, изменение которого определяет, выделяет ли рассматриваемая химическая реакция энергию в виде тепла или необходимо поглощать эту тепловую энергию.
Следовательно, энтальпию можно понимать как количество тепловой энергии, которую термодинамическая система (регулируемая потоками температуры и энергии) излучает или поглощает, когда она находится под постоянным давлением. А под термодинамической системой мы можем понимать, в основном, любой физический объект.
Это одно из самых фундаментальных термохимических свойств, поскольку мы анализируем, как реакционная среда обменивается теплом (поглощая или выделяя его) с окружающей средой. А поглотит он его или высвободит, будет определяться не самой энтальпией (H), а ее изменением (ΔH).. И исходя из этого химическая реакция может быть двух типов:
Экзотермический: Когда ΔH 0 (изменение энтальпии отрицательное), реакция выделяет энергию в виде тепла. Они не потребляют тепло, а излучают его. Все реакции, в которых конечный продукт молекулярно проще, чем исходный, будут экзотермическими.
Эндотермический: Когда ΔH> 0 (изменение энтальпии положительное), реакция потребляет энергию в виде тепла. Они не выделяют энергию, а должны ее поглощать и расходовать. Все реакции, в которых конечный продукт молекулярно более сложен, чем исходный, будут эндотермическими.
Как рассчитывается энтальпия?
Как мы видели, основа энтальпии очень проста. Если его изменение отрицательное, рассматриваемая химическая реакция будет выделять тепловую энергию в среду. И если его изменение положительное, он будет поглощать энергию в виде тепла. Как мы можем это вычислить? Тоже очень просто.
Формула для расчета энтальпии выглядит следующим образом:
H = E + PV
Тем не менее, как мы уже сказали, что действительно интересует нас для определения термического поведения реакции, так это изменение энтальпии. Таким образом, мы находим эту новую формулу:
ΔH = ΔE + PΔV
Таким образом, если результат добавления изменения энергии к произведению давления и изменения объема положительный, это означает, что энтальпия увеличивается и, следовательно, тепловая энергия поступает в систему (это эндотермический эффект). Если, наоборот, результат этой суммы отрицательный, это означает, что энтальпия уменьшается на протяжении реакции и, следовательно, тепловая энергия покидает систему (она экзотермична).
Какие бывают типы энтальпии?
Мы уже точно видели, что такое энтальпия и как она рассчитывается. Теперь пришло время посмотреть, как он классифицируется в соответствии с природой химических реакций, которые он определяет, и как он влияет на тепловую энергию в них.
1. Энтальпия образования
Энтальпия образования определяется как количество энергии, необходимое для образования одного моля соединения (единица, с помощью которой измеряется количество вещества и которая эквивалентна 6,023 x 10 ^ 23 атомов или молекул соединения) от элементов, которые составляют его при стандартных условиях температуры и давления, то есть 25 ° C и 1 атмосфера соответственно.
2. Энтальпия разложения
Энтальпия разложения определяется как количество тепловой энергии, поглощаемой или выделяемой при один моль вещества распадается в его составных элементах.
3. Энтальпия горения
Энтальпия горения связана с горением веществ в присутствии кислорода. В этом смысле речь идет о энергия, выделяемая при сгорании одного моля вещества. Рассматриваемое вещество горит, когда вступает в реакцию с кислородом, и это экзотермические реакции, поскольку всегда выделяются тепло и свет.
4. Энтальпия гидрирования.
Энтальпия гидрирования определяется как энергия, выделяемая или поглощаемая, когда вещество мы добавляем молекулу водорода, чтобы обычно образовывать углеводород.
5. Энтальпия нейтрализации.
Энтальпия нейтрализации определяется как энергия, выделяемая или поглощаемая при смешивании кислоты (pH ниже 7) и основания (pH выше 7), которые в конечном итоге нейтрализуются. Отсюда и его название. Так долго как смесь кислотных и основных веществ, будет энтальпия нейтрализации, связанная с реакцией.
6. Энтальпия фазового перехода
Под энтальпией фазового перехода мы подразумеваем любое выделение или поглощение энергии, когда один моль определенного вещества изменить его агрегатное состояние. Другими словами, это энергия, связанная с изменением состояния между жидкостью, твердым телом и газом.
7. Энтальпия растворения
Энтальпия раствора определяется как энергия, поглощаемая или выделяемая при химическое вещество растворяется в водном растворе. То есть это энергия, связанная со смесью растворенного вещества и растворителя, имеющая ретикулярную фазу (поглощает энергию) и фазу гидратации (выделяет энергию).
8. Энтальпия плавления.
9. Энтальпия испарения.
10. Энтальпия сублимации.
11. Энтальпия затвердевания.
Как энтальпия связана с энтропией?
С другой стороны, энтропия прямо противоположна. И хотя неправильно определять его как величину, которая измеряет степень беспорядка в системе, верно, что это связано с энергией, недоступной в реакции. Таким образом, это определенным образом связано с молекулярным хаосом.
В любом случае энтальпия и энтропия связаны. Но каким образом? Что ж, правда в том, что это довольно сложно, но мы могли бы резюмировать это в следовать обратно пропорциональной зависимости: чем выше энтальпия (больше энергообмена), тем ниже энтропия (меньше беспорядка); при этом чем ниже энтальпия (меньше энергообмена), тем выше энтропия (больше беспорядка).
Культура Панамы: традиции, обычаи, гастрономия, религия
Что такое энтальпия
Итак, что же такое энтальпия? Если говорить совсем упрощенно, энтальпия — это энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении. Когда я учился в университете, преподаватель помню, говорил нам, что энтальпию условно можно называть теплосодержанием, так как при постоянном давлении изменение энтальпии равно количеству теплоты, подведенной к системе.
И вообще, сам термин энтальпия составлен из древнегреческих слов — тепло и приставки — в. Это сочетание слов можно понимать как «нагревать». А впервые в термодинамику этот термин был введен ученым Д.Гиббсом. Ну это чтобы понятнее было, так как энтальпия, также кстати, как и энтропия, не может быть измерена непосредственно, как например давление или температура. Энтальпия определяется только расчетным путем. То есть, образно говоря, ее нельзя «потрогать», «пощупать».
Рассмотрим более подробно. Значение энтальпии вещества определяется из выражения:
где u – внутренняя энергия; p, u – давление и удельный объем рабочего тела в том же состоянии, для которого взято значение внутренней энергии.
То есть, можно сказать, что энтальпия любой термодинамической системы представляет собой сумму внутренней энергии системы и потенциальной энергии источника внешнего давления.
Энтальпия находится как сумма величин, которые определяются состоянием вещества, представляет собой функцию состояния и измеряется в Дж/кг. Чаще энтальпия во внесистемной системе измерений измеряется в ккал/кг. Энтальпия является одной из вспомогательных функций, использование которой позволяет значительно упрощать термодинамические расчеты. Так например, огромное количество процессов подвода теплоты в теплоэнергетике (в паровых котлах, камерах сгорания газовых турбин и реактивных двигателей, теплообменных аппаратах) осуществляется при постоянном давлении. По этой причине в таблицах термодинамических свойств обычно приводятся значения энтальпии.
В технической термодинамике пользуются значениями энтальпии, которые отсчитываются от условно принятого нуля. Абсолютные значения этих величин весьма трудно определить, так как для этого необходимо учесть все составляющие внутренней энергии вещества при изменении его состояния от 0 К. В таблицах и на диаграммах часто приводятся значения i и s, которые отсчитываются от 0 °С.
В заключение можно сказать, что энтальпия аналогично внутренней энергии и другим термодинамическим параметрам имеет вполне определенное значение для каждого состояния, то есть является функцией состояния рабочего тела.