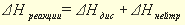Энтальпия отрицательная что значит
Энтальпия отрицательная что значит


Изменение свободной энергии (ΔG) химической реакции зависит от ряда факторов, в том числе от температуры и концентрации реагентов (см. с. 24). В этом разделе обсуждаются еще два параметра, которые связаны со структурными и энергетическими изменениями молекул.
У многих химических реакций ΔG и ΔН имеют близкие значения (см., например, Б1 ). Это обстоятельство позволяет определять энергетическую ценность пищевых продуктов. В живых организмах пища обычно окисляется кислородом до СО 2 и H 2 O (см. с. 114). Максимальную химическую работу, которую питательные вещества могут совершить в организме, т. е. ΔG реакции окисления компонентов пищи, определяют путем сжигания взятой навески соответствующего вещества в калориметре в атмосфере кислорода. Выделившееся тепло повышает температуру воды в калориметре. По разности температур рассчитывают теплоту реакции (энтальпию сгорания).
Энтропия системы тем выше, чем больше степень неупорядоченности (беспорядка) системы. Таким образом, если процесс идет в направлении увеличения неупорядоченности системы (а повседневный опыт показывает, что это наиболее вероятный процесс), ΔS — величина положительная. Для увеличения степени порядка в системе (ΔS > 0) необходимо затратить энергию. Оба этих положения вытекают из фундаментального закона природы — второго закона термодинамики. Количественно зависимость между изменениями энтальпии, энтропии и свободной энергии описывается уравнением Гиббса-Гельмгольца :
Поясним зависимость этих трех величин на двух примерах.
Энтальпия отрицательная что значит
Основы биохимии. Физическая химия
Энтальпия и энтропия

А.Теплота реакции и калориметрия
У многих химических реакций ΔG и ΔН имеют близкие значения (см., например, Б1 ). Это обстоятельство позволяет определять энергетическую ценность пищевых продуктов. В живых организмах пища обычно окисляется кислородом до СО 2 и H 2 O (см. с. 114). Максимальную химическую работу, которую питательные вещества могут совершить в организме, т. е. ΔG реакции окисления компонентов пищи, определяют путем сжигания взятой навески соответствующего вещества в калориметре в атмосфере кислорода. Выделившееся тепло повышает температуру воды в калориметре. По разности температур рассчитывают теплоту реакции (энтальпию сгорания).
Б. Энтальпия и энтропия
Энтропия системы тем выше, чем больше степень неупорядоченности (беспорядка) системы. Таким образом, если процесс идет в направлении увеличения неупорядоченности системы (а повседневный опыт показывает, что это наиболее вероятный процесс), ΔS — величина положительная. Для увеличения степени порядка в системе (ΔS > 0) необходимо затратить энергию. Оба этих положения вытекают из фундаментального закона природы — второго закона термодинамики. Количественно зависимость между изменениями энтальпии, энтропии и свободной энергии описывается уравнением Гиббса-Гельмгольца :
Поясним зависимость этих трех величин на двух примерах.
Что такое энтальпия? (и его 11 видов)
Содержание:
И из всех физических величин, с которыми справляется эта дисциплина, одним из самых важных, несомненно, является энтальпия. Изменение этого термодинамического свойства определяет, что химические реакции в системе являются экзотермическими (они выделяют тепло) или эндотермическими (они поглощают тепло), что очень важно во многих областях науки.
Но что такое энтальпия? Как рассчитывается? Какие бывают типы? Как это связано с энтропией? В сегодняшней статье мы ответим на эти и многие другие вопросы об этой энергии, которая, хотя мы ее и не видим, определяет природу всего, что нас окружает.
Что такое энтальпия?
Энтальпия, представленная как H, это количество энергии, которым термодинамическая система в условиях постоянного давления обменивается с окружающей средой.. Другими словами, это термодинамическое свойство, изменение которого определяет, выделяет ли рассматриваемая химическая реакция энергию в виде тепла или необходимо поглощать эту тепловую энергию.
Следовательно, энтальпию можно понимать как количество тепловой энергии, которую термодинамическая система (регулируемая потоками температуры и энергии) излучает или поглощает, когда она находится под постоянным давлением. А под термодинамической системой мы можем понимать, в основном, любой физический объект.
Это одно из самых фундаментальных термохимических свойств, поскольку мы анализируем, как реакционная среда обменивается теплом (поглощая или выделяя его) с окружающей средой. А поглотит он его или высвободит, будет определяться не самой энтальпией (H), а ее изменением (ΔH).. И исходя из этого химическая реакция может быть двух типов:
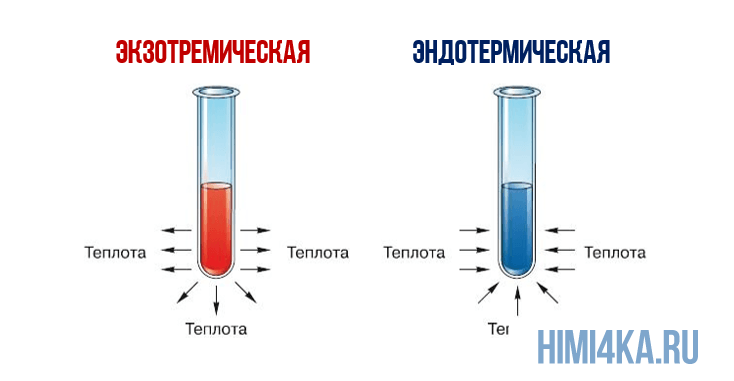
Экзотермический: Когда ΔH 0 (изменение энтальпии отрицательное), реакция выделяет энергию в виде тепла. Они не потребляют тепло, а излучают его. Все реакции, в которых конечный продукт молекулярно проще, чем исходный, будут экзотермическими.
Эндотермический: Когда ΔH> 0 (изменение энтальпии положительное), реакция потребляет энергию в виде тепла. Они не выделяют энергию, а должны ее поглощать и расходовать. Все реакции, в которых конечный продукт молекулярно более сложен, чем исходный, будут эндотермическими.
Как рассчитывается энтальпия?
Как мы видели, основа энтальпии очень проста. Если его изменение отрицательное, рассматриваемая химическая реакция будет выделять тепловую энергию в среду. И если его изменение положительное, он будет поглощать энергию в виде тепла. Как мы можем это вычислить? Тоже очень просто.
Формула для расчета энтальпии выглядит следующим образом:
H = E + PV
Тем не менее, как мы уже сказали, что действительно интересует нас для определения термического поведения реакции, так это изменение энтальпии. Таким образом, мы находим эту новую формулу:
ΔH = ΔE + PΔV
Таким образом, если результат добавления изменения энергии к произведению давления и изменения объема положительный, это означает, что энтальпия увеличивается и, следовательно, тепловая энергия поступает в систему (это эндотермический эффект). Если, наоборот, результат этой суммы отрицательный, это означает, что энтальпия уменьшается на протяжении реакции и, следовательно, тепловая энергия покидает систему (она экзотермична).
Какие бывают типы энтальпии?
Мы уже точно видели, что такое энтальпия и как она рассчитывается. Теперь пришло время посмотреть, как он классифицируется в соответствии с природой химических реакций, которые он определяет, и как он влияет на тепловую энергию в них.
1. Энтальпия образования
Энтальпия образования определяется как количество энергии, необходимое для образования одного моля соединения (единица, с помощью которой измеряется количество вещества и которая эквивалентна 6,023 x 10 ^ 23 атомов или молекул соединения) от элементов, которые составляют его при стандартных условиях температуры и давления, то есть 25 ° C и 1 атмосфера соответственно.
2. Энтальпия разложения
Энтальпия разложения определяется как количество тепловой энергии, поглощаемой или выделяемой при один моль вещества распадается в его составных элементах.
3. Энтальпия горения
Энтальпия горения связана с горением веществ в присутствии кислорода. В этом смысле речь идет о энергия, выделяемая при сгорании одного моля вещества. Рассматриваемое вещество горит, когда вступает в реакцию с кислородом, и это экзотермические реакции, поскольку всегда выделяются тепло и свет.
4. Энтальпия гидрирования.
Энтальпия гидрирования определяется как энергия, выделяемая или поглощаемая, когда вещество мы добавляем молекулу водорода, чтобы обычно образовывать углеводород.
5. Энтальпия нейтрализации.
Энтальпия нейтрализации определяется как энергия, выделяемая или поглощаемая при смешивании кислоты (pH ниже 7) и основания (pH выше 7), которые в конечном итоге нейтрализуются. Отсюда и его название. Так долго как смесь кислотных и основных веществ, будет энтальпия нейтрализации, связанная с реакцией.
6. Энтальпия фазового перехода
Под энтальпией фазового перехода мы подразумеваем любое выделение или поглощение энергии, когда один моль определенного вещества изменить его агрегатное состояние. Другими словами, это энергия, связанная с изменением состояния между жидкостью, твердым телом и газом.
7. Энтальпия растворения
Энтальпия раствора определяется как энергия, поглощаемая или выделяемая при химическое вещество растворяется в водном растворе. То есть это энергия, связанная со смесью растворенного вещества и растворителя, имеющая ретикулярную фазу (поглощает энергию) и фазу гидратации (выделяет энергию).
8. Энтальпия плавления.
9. Энтальпия испарения.
10. Энтальпия сублимации.
11. Энтальпия затвердевания.
Как энтальпия связана с энтропией?
С другой стороны, энтропия прямо противоположна. И хотя неправильно определять его как величину, которая измеряет степень беспорядка в системе, верно, что это связано с энергией, недоступной в реакции. Таким образом, это определенным образом связано с молекулярным хаосом.
В любом случае энтальпия и энтропия связаны. Но каким образом? Что ж, правда в том, что это довольно сложно, но мы могли бы резюмировать это в следовать обратно пропорциональной зависимости: чем выше энтальпия (больше энергообмена), тем ниже энтропия (меньше беспорядка); при этом чем ниже энтальпия (меньше энергообмена), тем выше энтропия (больше беспорядка).
Культура Панамы: традиции, обычаи, гастрономия, религия
Урок 19. Изменение энтальпии
В уроке 19 «Изменение энтальпии» из курса «Химия для чайников» рассмотрим понятие теплоты реакции и ее единицу измерения; выясним, что происходит при экзотермических и эндотермических реакциях, а также познакомимся с законом Гесса. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте о составлении химических реакций и формулировку законов сохранения массы и энергии, чтобы не возникало лишних вопросов.
Хоть данная глава и называется «Законы сохранения массы и энергии«, однако пока мы ничего не говорили о законе сохранения энергии. Для тех, кто забыл: закон сохранения энергии гласит, что теплОты реакций аддитивны и энергия процесса не зависит от того, проводится ли он в одну или несколько стадий.
Единица измерения теплоты
Так как это курс химии, а не физики, то совсем мельком напомню, что теплота и работа являются хоть и различными, но формами энергии, поэтому измеряются в одинаковых единицах (в Дж). Если вы совершаете работу над каким-либо телом или совокупностью тел, можно повысить энергию этой системы или нагреть ее в зависимости от того, каким образом совершается работа. К примеру, когда мы поднимает какой-либо предмет, работа превращается в потенциальную энергию, а если потереть этот предмет, то работа (трение) переходит в теплоту. И наоборот, при падении тяжелого предмета энергия превращается в теплоту, а при работе двигателя внутреннего сгорания выделяемая в нем теплота переходит в работу. Химиков, в отличии от физиков, занимает не работа, а теплота, которая может поглощаться и выделяться при протекании химической реакции.
Единицей измерения теплоты служит — Джоуль (Дж). 1 Джоуль можно определить как количество теплоты, необходимое для повышения температуры 1 г чистой воды на 1/4 градуса. В повседневной жизни 1 джоуль энергии требуется для поднятия небольшого яблока (102 г) строго вертикально на высоту один метр.
Теплота реакции
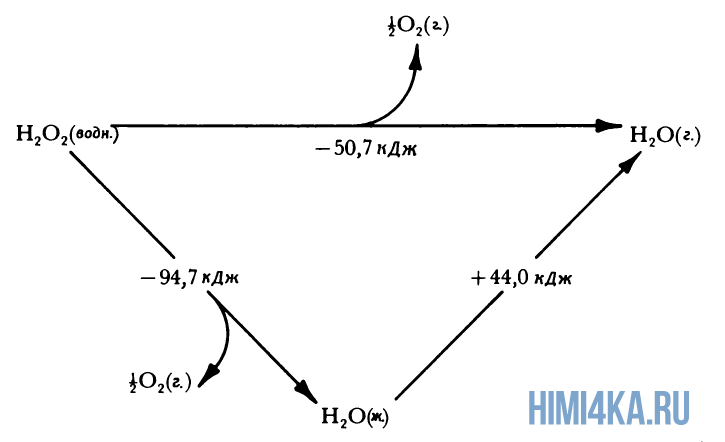
Представление о законе сохранения энергии можно получить на примере разложения пероксида водорода, H2O2. Когда водный раствор H2O2 реагирует с образованием газообразного кислорода и жидкой воды, происходит заметное выделение тепла: разложение 1 моля H2O2 при 25°С (комнатная температура) сопровождается выделением 94,7 кДж (94700 Дж) тепла.
Это количество теплоты, которое выделяется при разложении 1 моля пероксида водорода на 1 моль воды и 1/2 моля газообразного кислорода, т.е. в расчете на 1 моль реагента. Если удвоить все коэффициенты в уравнении реакции, то придется удвоить и теплоту реакции, поскольку она будет относиться теперь к вдвое большему количеству реагента:
Физическое состояние реагентов и продуктов также оказывает влияние на теплоту реакции (изменение энтальпии). Если H2O2 заставить разлагаться на газообразный кислород и водяной пар, а не жидкую воду, часть молярной теплоты разложения H2O2 (94,7 кДж) затратится на испарение H2O, которое описывается уравнением:
и поэтому при таком разложении пероксида водорода будет выделяться меньше теплоты:
Закон Гесса
Аддитивность теплот реакций вытекает непосредственно из первого закона термодинамики : изменение энергии или энтальпии между двумя состояниями системы зависит только от самих этих состояний, а не от того, каким образом осуществляется переход между ними. Следовательно, разность между энтальпиями реагентов и продуктов, т.е теплота реакции, должна зависеть только от исходного и конечного состояний, а не от того конкретного пути, по которому следует реакция. Это утверждение носит название закон аддитивности теплот реакций (закон Гесса).
Благодаря закону Гесса совсем не обязательно измерять изменение энтальпии каждой возможной химической реакции. Например, если известны теплота испарения жидкой воды (3), то совсем не обязательно измерять теплоту разложения пероксида водорода с образованием водяного пара; эту величину гораздо проще получить путем вычислений. Если какую-либо реакцию трудно провести в лабораторных условиях, можно попытаться подобрать последовательность легче осуществляемых реакций, сумма которых дает необходимую реакцию. После измерения изменений энтальпии для всех индивидуальных реакций в такой последовательности можно просуммировать соответствующие изменения энтальпии подобно самим химическим уравнениям и найти теплоту трудно проводимой реакции.
Урок 19 «Изменение энтальпии» бесспорно был сложным, но чрезвычайно важным. Скорее всего у вас сейчас каша в голове, но не пугайтесь, ведь в следующем уроке все встанет на свои места. Если у вас возникли вопросы по данному уроку, то пишите их в комментарии.
Энтальпия отрицательная что значит
Глава 2. ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ
2.1. Теоретическая часть
Раздел химии, изучающий тепловые эффекты химических реакций называется термохимией. Все химические процессы сопровождаются выделением или поглощением теплоты. Реакции, сопровождающиеся выделением теплоты из системы в окружающую среду, называются экзотермическими, сопровождающиеся поглощением теплоты из окружающей среды, называются эндотермическими. Тепловой эффект реакции, измеренный при постоянных температуре и давлении, называется теплотой реакции Qр, а противоположная ему по знаку величина, описывающая изменение состояния системы в результате протекания реакции энтальпией реакции 
В качестве основной единицы измерения теплоты в системе СИ установлен джоуль. В качестве единицы измерения теплоты встречается также калория, равная 4,184 Дж. В настоящее время она сохраняется как внесистемная единица для сравнения результатов современных работ с экспериментальными и справочными данными, накопленными за многие предыдущие годы.
Для описания тепловых явлений в химических реакциях принято пользоваться так называемыми термохимическими уравнениями. Термохимические уравнения записываются как обычные уравнения химических реакций, но с указанием величины и знака теплового эффекта реакции. В случае экзотермических реакций с правой стороны уравнения отмечают количество выделившейся теплоты со знаком «плюс», а в случае эндотермических реакций — количество поглощенной теплоты со знаком «минус». При этом у формулы каждого вещества индексом указывается его физическое состояние: газообразное (г), жидкое (ж), кристаллическое (к) или раствор (р-р).Существует термодинамический способ записи термохимических уравнений — когда в самом уравнении тепловой эффект не указывается, а изменение энтальпии реакции (
В данной реакции Q > 0, соответственно, 
Расчеты тепловых эффектов химических реакций основаны на применении закона Гесса (1836 г.): Тепловой эффект химической реакции при постоянном давлении и объеме, не зависит от способа ее проведения, а зависит лишь от начального и конечного состояния реагирующих веществ.
Например, растворение безводного сульфата меди:






Значения теплоты растворения безводной соли Q и кристаллогидрата Q2 известны и составляют 66,11 и –11,5 кДж соответственно. Тогда тепловой эффект реакции образования кристаллогидрата может быть рассчитан по формуле:
Q1 = Q – Q2 = 66,11 кДж – (–11,51 кДж) = 77,69 кДж, (2.5)
соответственно энтальпия равна 
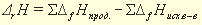
Например, значение энтальпии реакции между растворами сильной кислоты и сильного основания может быть получено по табличным данным энтальпий образования исходных веществ., если представить эту реакцию:, например
может быть получено по табулированным энтальпиям образования в виде реакций между ионами, поскольку эта реакция в действительности является реакцией между ионами H + и OH – :
Табличные значения энтальпий образования (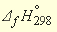




–285,84 – (–229,94) = –55,9 кДж/моль
При нейтрализации слабой кислоты сильным основанием или сильной кислоты слабым основанием тепловой эффект реакции будет зависеть от того, какая слабая кислота или слабое основание вступает в реакцию. (Другими словами от природы этих веществ). Это связано с тем, что слабые кислоты и основания существуют в растворах преимущественно в виде молекул. Например, при нейтрализации уксусной кислоты щелочью:
в действительности идет следующая реакция:
которой соответствует энтальпия 
В то же время реакцию (2.8) можно представить в виде суммы двух процессов:
1) диссоциации кислоты
CH3COOH = CH3COO + Н + 
2) и нейтрализации возникающих при этом ионов H + :
H + + ОН – = Н2О 
Тогда, по закону Гесса, энтальпия ее равна сумме энтальпий этих реакций:
Следовательно, если известныизмерить энтальпии реакций нейтрализации сильной кислоты сильным основанием и слабой кислоты сильным основанием, то по этим данным можно найти энтальпияю реакции диссоциации слабой кислоты может быть рассчитана по этим данным:
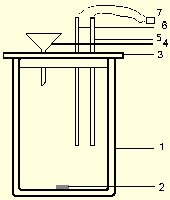
Общий вид используемой калориметрической установки
Рис.2.2 Схематическое изображение калориметрического стакана.
Если калориметрическая установка работает с компьютером, то сбор данных и построение графика осуществляется автоматически.
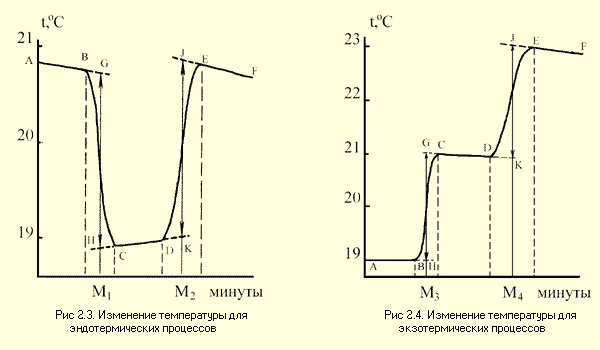
Примерные графики изменения температуры для экзотермических и эндотермических процессов представлены на рис.2.3 и 2.4.
Каждый калориметрический опыт начинают с определения температурного хода калориметрической системы. Для этого в течение нескольких минут измеряют температуру установки (участок АВ на рис. 2.3 и 2.4).
Участок ВС на графиках соответствует собственно реакции: экзндотермической на рис. 2.3 и экзотермической на рис.2.4. В результате реакции наблюдается значительное изменение температуры калориметра (
Наличие небольшого наклона на графике температурной зависимости в начальном (АВ) и конечном (СD) периодах, свидетельствует о том, что во время опыта имеет место некоторый теплообмен калориметра с окружающей средой. В расчетах теплообмен учитывается следующим образом. Прямая AB экстраполируется вправо, а прямая CD влево. Интервал времени от B до C делится пополам и через эту точку проводится перпендикуляр к оси абсцисс до пересечения его с экстраполированными участками прямых АВ и СД (точки H,G). Величина отрезка HG соответствует изменению температуры калориметрической системы 
Тепловой эффект химической реакции может быть рассчитан по формуле
Q = K
Количество тепловой энергии qэл,, сообщенное калориметрической системе при нагреве,, вычисляется по формуле Джоуля:
Тепловое значение калориметра:
K = qэл/
Подставив значение K в формулу (2.11), получаем значение теплового эффекта реакции.
Измеренный тепловой эффект следует отнести к 1 моль вещества, для чего необходимо разделить его на число молей (n ) того из участников реакции, который находится в недостатке, тогда:
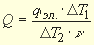
Увеличивается или уменьшается при этом энтальпия системы? Чему равно изменение энтальпии?
Получить практические навыки экспериментальной работы с простейшими калориметрическими приборами.. Экспериментально определить теплоты растворения кристаллогидрата CuSO4• 5H20O и безводной соли CuSO4. Оценить достоверность полученных результатов.
Дистиллированная вода, безводный CuSO4, CuSO4• 5H20O.
Калориметрическая установка, технические весы, мерные колбы на 100 и 50 мл, мерный цилиндр на 20 мл.
2.2.4. Порядок выполнения эксперимента
Опыт 1. Определение теплоты растворения кристаллогидрата CuSO4•5H2O.
Начинающим рекомендуется работать вдвоем. Один студент следит за показаниями температуры и времени на дисплее измерительного преобразователя «ЭКСПЕРТ-001-3» и диктует эти данные второму студенту, который заносит данные в таблицу 1 в рабочем журнале.)
Взвесьте с точностью до сотых 15 г CuSO4•5H2O.
В калориметрический стакан с помощью мерной колбы налейте 150 мл дистиллированной воды, температура которой должна быть близка к комнатной. Оставьте небольшое количество воды (
Опустите в калориметрический стакан сердечник магнитной мешалки и включите в розетку 220 В блок питания.
Нажмите кнопку включения на блоке питания (при этом на блоке питания должна загореться красная лампочка).
Нажмите и удерживайте в течение 2 сек. кнопку «ВКЛ» (рис.2 Приложения) на измерительном преобразователе «ЭКСПЕРТ-001-3» (при этом начнет светиться его жидкокристаллический дисплей). Первая надпись на ж/к дисплее измерительного преобразователя «ЭКСПЕРТ-001-3» показывает уровень зарядки собственных аккумуляторов преобразователя. При величине менее 30 % необходимо зарядить аккумуляторы при помощи сетевого адаптера.
Вращая ручку включения магнитной мешалки, добейтесь оптимальной скорости вращения сердечника магнитной мешалки.
Выберите время работы электрического нагревателя (с) при определении теплового значения калориметра. Для этого на клавиатуре измерительного преобразователе «ЭКСПЕРТ-001-3» нажмите кнопку «Ф2» и далее кнопку «ЧИСЛ». Цифровыми кнопками наберите время работы нагревателя, с. Рекомендуемое время 200 с. После установки времени нагрева два раза нажмите кнопку «ВВОД».
Кнопками «стрелка влево» или «стрелка вправо» выберите режим «ТЕРМОМЕТР».
Начните выполнение опыта, нажав кнопку «ИЗМ». На дисплее появятся данные работы секундомера, работающего в режиме прямого отсчета времени и значения температуры в калориметрическом стакане.
Определите тепловой ход калориметрической установки. (Участок АВ на рис. 2.3) При работе в ручном режиме записывайте в рабочий журнал в таблицу 1 показания температуры через каждые 30 с. в течение пяти минут. Если измерения показывают, что в течение 5 мин температурные изменения достаточно равномерны и невелики, начинайте эксперимент.
В определенный момент времени, отметив его в рабочем журнале, высыпьте в калориметрический стакан через сухую воронку приготовленную навеску кристаллогидрата сульфата меди CuSO4•5H2O. Оставшейся в мерной колбе водой смойте остатки соли с воронки.
| Время измерений, с | 30 | 60 | 90 | 120 | 150 | 180 | 210 | 240 | 270 | 300 |
| Температура измерений, о С |
За счет растворения соли происходит быстрое изменение температуры, поэтому, пока наблюдается рост температуры, фиксирутефиксируйте значения температуры через возможно малые промежутки времени (каждые 5–10 с).
После того, как растворение соли закончится, изменение температуры замедлится и температурный ход снова станет равномерным (участок СD на рис. 2.3), продолжайте измерения температуры через 30 с. еще в течение 5 мин.
После отключения тока нагревателя, рост температуры замедлится, а затем температура начнет медленно падать. Фиксируйте изменение температуры через каждые 30 с еще в течение 5мин..
Нажмите клавишу «ОТКЛ» на клавиатуре измерительного преобразователе «ЭКСПЕРТ-001-3».
Выполните команду «Стоп» на экране монитора компьютера.
При работе установки с компьютером измерения температуры в зависимости от времени в течении всего эксперимента будут фиксироваться автоматически. В результате на мониторе компьютера появиться график, соответствующий изменению температуры системы в течении всего эксперимента. После его окончания расечатайтераспечатайте полученный график на принтере.
Опыт 2. Определение теплоты растворения безводной соли CuSO4
Взвесьте с точностью до 0,01 г
Затем проведите опыт по определению теплоты растворения безводной соли CuSO4. Опыт выполняется так же, как и опыт 1.
Результаты температурных измерений представьте в виде графика.
Получить практические навыки экспериментальной работы с простейшими калориметрическими приборами. Экспериментально определить теплоты нейтрализации сильной кислоты сильным основанием и слабой кислоты сильным основанием. Оценить достоверность полученных результатов.
Дистиллированная вода, 0,4 М HCl, 0,4 M CH3COOH, 6 М KOH.
Калориметрическая установка, мерные колбы на 100 и 50 мл, мерный цилиндр на 20 мл
2.3.4. Порядок выполнения эксперимента
Опыт 3 Определение теплоты нейтрализации сильной кислоты сильным основанием
Определение теплоты нейтрализации сильной кислоты и сильного основания проводите в калориметрической установке, которая была описана выше.
С помощью мерной колбы налейте в калориметрический стакан 150 мл 0,4 М. раствора соляной кислоты. Оставшиеся в колбе следы соляной кислоты смойте в калориметр небольшим количеством дистиллированной воды.
В мерный цилиндр налейте 12 мл 6 М раствора КОН.
Опустите в калориметрический стакан сердечник магнитной мешалки, включите блок питания установки и, вращая ручку регулировки вращения магнитной мешалки, добейтесь оптимальной скорости ее вращения.
Выберите время работы электрического нагревателя, так как это описано в опыте 1. Кнопками «стрелка влево» или «стрелка вправо» выберите режим «ТЕРМОМЕТР» и начните выполнение опыта, нажав кнопку «ИЗМ».
Для того, чтобы результаты измерения фиксировались компьютером, одновременно выполните команду «СТАРТ» в меню программы«Expert001.exe» измерения данных на компьютере.
Определите тепловой ход калориметрической установки (участок АВ на рис. 2.4), записывая в таблицу 1 показания температуры через каждые 30 с. в течение 5 минут.
Влейте через воронку в калориметрический стакан 12 мл 6 М раствора КОН и с этого момента записывайте изменение температуры в калориметрической системе через возможно малые интервалы времени (5-10 с).
После того, как температура стабилизируется, в течение 5 минут фиксируйте изменение температуры через каждые 30 с.
Определите тепловое значение калориметрической установки как это описано в опыте 1 и закончите эксперимент нажатием клавиши «ОТКЛ». Выполните команду «Стоп» на экране монитора компьютера.
Постройте график зависимости температуры калориметрической системы в зависимости от времени или распечатайте его на компьютере.
Опыт 4. Определение теплоты нейтрализации слабой кислоты сильным основанием
Работу проводите так же, как и в опыте 3, только для реакции нейтрализации возьмите 150 мл 0,4 М раствора уксусной кислоты.
Рк +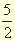
Чему равна энтальпия образования пентахлорида фосфора?