Энтерококкус фациалис у женщин в мазке что это
Все о фекальном энтерококке (Enterococcus Faecalis) в мазке у женщин: подробно и компетентно
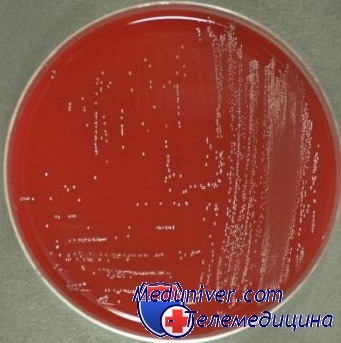
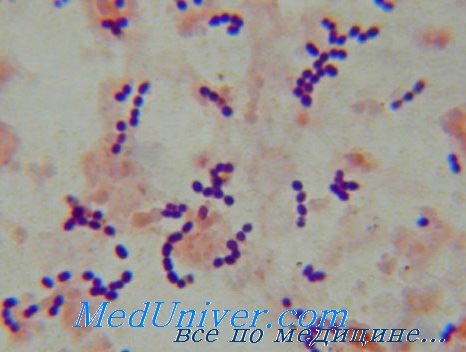
Бактерия под названием фекальный энтерококк относится к грамположительным микробам и является условно-патогенной микрофлорой.
В небольших количествах эта бактерия не вызывает проблем со здоровьем, но в случае активного размножения способна вызывать серьезные болезни мочеполовой системы.
Уровень опасности

Сам микроорганизм в определенных количествах обитает в кишечнике, особенно в тонкой кишке.
Выделяется с каловыми массами, которые содержат до 90 % этой бактерии, может долго сохраняться в воздухе.
При неблагоприятных факторах — от неправильного питания до несоблюдения элементарных правил личной гигиены — микроорганизм начинает активно размножаться, вытесняя нормальную микрофлору.
Попадая в женские половые органы, уретру, он вызывает патологии вплоть до развития пиелонефрита, уретрита, воспаления яичников и матки.
При несвоевременном обнаружении патологии могут прогрессировать, переходя в хронические формы, с трудом поддающиеся лечению.
А теперь подробно рассмотрим, как происходит лечение цистита у женщин: читайте об этом здесь в публикации.
Методы выявления и норма
Как обнаружить Enterococcus Faecalis в мазке у женщин, сколько их должно быть в норме?
Фекальный энтерококк можно обнаружить путем взятия мазка из влагалища. Забор материала осуществляется врачом-гинекологом, далее направляется в лабораторию для исследования под микроскопом.
По результатам анализа можно судить о том, на сколько превышено содержание условно-патогенной бактерии.
Если наличие бактерии превышает порог в 10-15%, воспалительный процесс есть. Концентрация в мазке более 30% говорит о сильно выраженной патологии, требующей адекватного лечения.
Причины обнаружения
Причины, по которым фекальный энтерококк может попасть в женские половые органы, немногочисленны.
Самый распространенный фактор, провоцирующий развитие энтерококковой инфекции — несоблюдение правил личной гигиены:
Передается бактерия и половым путем, через незащищенные контакты, поэтому женщины, не использующие барьерные средства контрацепции, не имеющие постоянного партнера, могут заразиться от мужчины.
Микроорганизм начинает активироваться в организме тех женщин, которые перенесли курсы антибиотикотерапии — в ослабленном организме энтерококк развивается активнее, чем у совершенно здорового человека с сильной иммунной системой.
Симптомы развивающейся болезни
Фекальный энтерококк может поражать как половые органы, так и мочевую систему, при серьезном течении — почки и мочевой пузырь. С момента активного размножения микроорганизма у женщин начинают появляться тревожные симптомы.
При поражении фекальным энтерококком больные чаще отмечают:
Выделения отмечаются практически у всех женщин.
При поражении влагалища и половых путей выделения обильные, по цвету — от сероватых до светло-коричневых, запах — неприятный. Выделения сопровождаются жжением, дискомфортом во влагалище.
Меняется характер мочеиспускания — оно становится учащенным, скудным. Могут возникать внезапные резкие позывы, процесс выделения мочи становится болезненным.
Ухудшается общее состояние больных:
Лечение
При обнаружении в анализах превышения допустимой концентрации фекального энтерококка — в мазках из влагалища, моче, кале — лечение важно начать сразу, так как микроорганизм быстро размножается, губительно влияя на весь организм.
Основные группы препаратов
Адекватная терапия против фекального энтерококка включает:
Антибиотики позволяют быстро остановить развитие инфекционно-воспалительного процесса. Важно подобрать антибиотик, к которому микроорганизм будет чувствителен.
Популярные и действенные антибиотики:
Назначают их чаще внутримышечно, в дозах, рассчитанных по весу, возрасту, тяжести болезни. Длительность курса — 7-10 дней, не дольше.
В последнее время в терапии против энтерококковой инфекции часто назначают бактериофаги — специальные препараты в жидкой форме, которые губительно влияют на условно-патогенные бактерии, вызывая минимум побочных эффектов.
Средства для наружного применения действуют местно, оказывая противомикробный и противовоспалительный эффект. К ним относятся вагинальные свечи, таблетки, гели.
Хорошо зарекомендовали себя:
Препараты для укрепления иммунной системы тоже важны — ослабленный организм не может полностью подавлять рост условно-патогенной флоры.
Для повышения защитных сил организма в комплексной терапии назначают:
Курс приема — не менее месяца, после него делают перерыв 14-30 дней, и прием витаминов и иммуномодуляторов повторяют.
Терапия для партнера

В мужском организме микроорганизм поражает кишечник и мочеполовую систему, приводя к развитию:
Лечение партнера включает антимикробные препараты, антибиотикотерапию и средства, укрепляющие иммунитет. После лечения сдаются контрольные анализы.
Заболевание при беременности
При обнаружении в моче или мазке из влагалища у беременных фекального энтерококка в завышенной концентрации лечение начинают сразу. Подобная проблема у женщин в положении — не редкость.
Последствия несвоевременного лечения могут быть нешуточными:

Обычно гинекологи назначают препараты для местного применения — Полижинакс или Тержинан во влагалище, Виферон для активизации иммунитета и пробиотики для приема внутрь — Линекс, Хилак-форте.
После проведенного курса необходимо провести контрольное обследование, чтобы установить, достигнута ли цель терапии.
Важно знать при планировании о том, какие самые первые признаки беременности до задержки: подробно о них — в данной статье.
Какие надо сдать анализы при планировании беременности, описано по этой ссылке: https://beautyladi.ru/analizy-pered-beremennostyu/.
Профилактические меры
Чтобы избежать заражения фекальным энтерококком, не допустить его размножения в кишечной и влагалищной флоре, следует придерживаться простых мер профилактики.
Обнаружение в анализах у женщин фекального энтерококка — неприятно и опасно. Симптомы болезни подрывают общее состояние, мешают полноценной жизни.
Но паниковать не стоит: при раннем выявлении и разумном лечении условно-патогенную флору можно победить полностью. А профилактика в будущем позволит избежать возвращения проблемы.
Энтерококкус фациалис у женщин в мазке что это
О патогенности энтерококков впервые упоминается в конце XIX в.: MacCallum и Hastings выделили этот микроорганизм из биоматериала больного острым эндокардитом и дали название Micrococcus zymogenes на основании его ферментативных свойств. Микроорганизм был устойчив к нагреванию до 60 °С, а также к различным антисептикам, включая карболовую кислоту и хлороформ. Также было установлено, что при внутрибрюшинном введении белым мышам этот микроб вызывал летальный исход, в экспериментальных условиях Micrococcus zymogenes был причиной эндокардита.
Спустя столетие энтерококки приобрели существенное значение и заняли 2-е место после Е. coli, составив более 12% всех возбудителей нозокомиальных инфекций (НКИ). В последние го/ты, по данным зарубежных авторов, энтерококки как причина НКИ в клиниках интенсивной терапии занимают 3-е место. Энтерококки по антигенному строению (группоспецифическая тейхоевая кислота) отнесены R. Lancefield в начале 1930-х годов к стрептококкам группы D. Четкие отличия энтерококков от стрептококков по ряду признаков указывают на необходимость выделить энтерококки в самостоятельный род.
Это было подтверждено в 1984 г. в сравнительных исследованиях по гибридизации нуклеиновых кислот, а также анализом иммунотипировапия белкового комплекса энтерококков, в котором не обнаружено родства со стрептококками других серологических групп.
Энтерококки окрашиваются по Граму положительно, представляют собой кокки, факультативные анаэробы. Enterococcus spp. это часть нормальной микрофлоры слизистых оболочек ЖКТ и половых путей женщин. Некоторые особенности этого микроорганизма обеспечивают ему длительное выживание в условиях окружающей среды. Энтерококки способны активно приспосабливаться к различным неблагоприятным факторам, передаваться в условиях стационара от человека к человеку через руки, инструменты. В литературе описаны случаи, когда источником НКИ оказались мобильные телефоны, стетоскопы, термометры и прочие объекты нозокомиальной среды.
Энтерококки способны вызывать у человека гнойно-воспалительные процессы различной локализации, которые протекают обычно вяло, хронически. Инфекции человека в основном обусловлены двумя видами энтерококков: E.faecalis (80-90%) и E.faecium (5-15%). Другие виды выделяют из различных патологических биоматериалов значительно реже. В основном сообщения об инфекционных осложнениях энтерококковой природы касаются следующих видов: Е. durans, E. avium, casseliflavus, E. gallinarum, Е. raffinosus и Е. hirae. Основным местом обитания Е. faecalis служит кишечник человека, E.faecium — кишечник свиней. Распространенность энтерококков в окружающей среде объясняется также их природной устойчивостью к различным классам антимикробных препаратов, включая амипогдикозиды, b-лактамы и хинолоны.
Например, резистентность энтерококков к аминогликозидам есть следствие их способности блокировать проникновение препаратов через клеточную стенку. Впрочем, применение аминогликозидов возможно, но в комбинации с препаратами, способными проникать через клеточную стенку микроорганизмов. Следует заметить, что в настоящее время отмечается быстрое распространение штаммов энтерококков с высоким уровнем устойчивости к аминогликозпдам (> 1000 мкг/мл для стрептомицина и >500 мкг/мл для гентамицина), по пока это явление не до конца изучено.
Колонизация слизистых оболочек основное условие развития энтерококковой инфекции. Энтерококки, как уже отмечалось, колонизируют слизистую оболочку ЖКТ у здоровых людей, входя в состав микрофлоры фекалий (103—108 колониеобразующих единиц [КОЕ] в 1 г). Между энтерококками и эпителиальными клетками организма хозяина существует тесная связь, которая препятствует выведению их вследствие естественной подвижности кишечника. Большинство известных микроорганизмов растет в узком диапазоне значений pH, близких к нейтральному. Энтерококки должны преодолеть кислую среду желудка, чтобы попасть в нижние отделы кишечника, что возможно благодаря устойчивости этих микробов к низким значениям pH среды их обитания (pH 3,2-4,8 в течение 15-30 мин).
Лечение антимикробными препаратами предрасполагает к развитию энтерококковых инфекций. Антибиотик-индуцированный усиленный рост Е. faecalis при соответствующих условиях (например, мукозит, энтеропатия) может привести к проникновению микроорганизма в кровь, что часто проявляется лихорадкой неясной этиологии. Механизм этот до конца не изучен.
Первый активный защитный барьер хозяина представляют различные типы клеток и гуморальных факторов иммунной системы, которые атакуют проникающие микроорганизмы. Фагоциты поглощают и лизируют патогенные микроорганизмы, очищая организм от них. Фагоцитированные микробные клетки оказываются внутри вакуоли (фагосомы), которая сливается с лизосомами и образует фаголизосому, внутри которой микробы подвергаются воздействию бактерицидных механизмов, зависящих и не зависящих от кислорода. В фаголизосоме образуются токсичные формы кислорода (супероксид-анион, пероксид водорода, синглетный кислород и гидроксил-радикал), которые вместе с другими антимикробными соединениями и оксидами азота вызывают гибель микроорганизмов.
Некоторые микробы способны избегать действия бактерицидных механизмов. Одно из предположений состоит в том, что фагоцитированные, но не лизированные тканевыми макрофагами энтерококки проникают через стенку кишки в лимфатическую систему, что приводит к системному распространению этого возбудителя.
E. faecalis отличаемся от Е. faecium мощной продукцией супероксид-аниона. Установлено, что основная часть штаммов Е. faecalis образует супероксид-анион, тогда как среди рода E. faecium такие штаммы встречаются менее часто. Покапано, что штаммы Е. faecalis, выделенные из крови больных, вырабатывают супероксид-анион на 60% больше, чем штаммы, выделенные из фекалий. Пока остается неясным, какую роль играет способность вырабатывать супероксид-анион в патогенезе энтерококковых инфекций. Возможно, штаммы энтерококков, отличающиеся мощной продукцией супероксид-аниона, способны лучше использовать среду своего обитания, лучше физиологически адаптированы к утилизации ограниченных ресурсов кишечника в условиях огромной конкуренции, что ведет к усилению их роста.
В 10-20% случаев энтерококки выделяются из биоматериалов, исследуемых по поводу интраабдоминальных абсцессов, причем считается, что энтерококки способствуют развитию абсцессов, как правило, только в сочетании с анаэробными микроорганизмами (например, Fusobacierium varium, Bacteroides fragilis). Такая особенность обязательно должна учитываться при выборе антимикробной терапии интраабдоминальных абсцессов.
Энтерококки составляют 8-14% послеоперационных раневых нозокомиальных инфекций (НКИ).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Enterococcus faecalis (энтерококк фекальный)

Фекальные энтерококки — самые часто встречающиеся в организме человека и домашней птицы энтероккоки. Фекальные энтерококки также колонизируют кишечник крупного рогатого скота, свиней, собак, лошадей, овец и коз.
Фекальный энтерококк может являться возбудителем различных инфекций: мочевыводящих путей, интраабдоминальных, органов малого таза, раневых, эндокардита. Фекальные энтерококки, наряду с энтерококками вида фэциум являются наиболее патогенными видами среди энтерококков, они составляют 80–90% от всех выделенных в клиническом материале человека энтерококков. Фекальные энтерококки часто бывают причиной внутрибольничных инфекций (Бондаренко В.М. Суворов А.Н. Симбиотические энтерококки и проблемы энтерококковой оппортунистической инфекции).
Enterococcus faecalis участвуют в реакции трансплантат против хозяина (Карпеева Ю.С. и др.).
В то же время, фекальные энтерококки входят в состав нормальной микрофлоры желудочно-кишечного тракта человека и многих позвоночных, играют важную роль в обеспечении колонизационной резистентности слизистой оболочки. Основное место обитания фекального энтерококка в организме — тонкая кишка, но он также встречается в толстой кишке, губчатой части мочеиспускательного канала, в половых органах, и, иногда, в полости рта. Фекальные энтерококки присутствуют в кале 90 % взрослых людей. Количество фекальных энтерококков во внешней среде является значимым санитарным и эпидемиологическим показателем ее фекальной загрязненности.
Фекальные энтерококки в пищевой промышленности
Инфекция мочевых путей и фекальные энтерококки
Бактериурия — наличие бактерий в моче может является признаком воспаления в мочевыводящих путях, мочевом пузыре, почках. При отсутствии каких-либо симптомов, истинная бактериурия (инфекция мочевых путей) диагностируется при наличии не менее 10 5 микробных тел в 1 мл свежевыпущенной мочи, иначе предполагается, что загрязнение мочи происходит при ее заборе. При наличии симптомов или при заборе мочи катетером диагностический порог может быть значительно уменьшен. Часто бактериурия не сопровождается какими-либо симптомами, тогда она называется бессимптомной или асимптоматическая бактериурией. В то же время, бактериурия нередко сочетается с симптомами цистита, пиелонефрита, простатита, уретрита, а также встречается у беременных. Бессимптомная бактериурия не всегда требует немедленного лечения.
Одним из возбудителей воспалений мочевыводящих путей (ВМП) является фекальный энтерококк, на долю которого приходится от 1 до 18 % (в зависимости от типа заболевания) всех выявленных при бактериурии патогенных микроорганизмов. Остальные виды энтерококков практически не встречаются среди возбудителей ВМП.
Активность антибиотиков в отношении Enterococcus faecalis
Антибактериальные средства (из имеющих описание в данном справочнике), активные в отношении Enterococcus faecalis: левофлоксацин, норфлоксацин, офлаксацин, рифаксимин, нифурател, доксициклин (не ко всем штаммам). Enterococcus faecalis умеренно чувствителен к ципрофлоксацину. 74 % штаммов Enterococcus faecalis не чувствительны к тетрациклину. Не активны в отношении Enterococcus faecalis линкомицин и клиндамицин. Чувствительные к ванкомицину и гентамицину штаммы Enterococcus faecalis чувствительны также к моксифлоксацину.
Для лечения острых неосложненных инфекций мочевыводящих путей, вызванных Enterococcus faecalis могут быть рекомендованы нитрофураны, цефалоспорины III поколения, гентамицин, фторхинолоны, последние — с оговоркой о неблагоприятных тенденциях к росту устойчивости. Следует отметить, что цефалоспорины лишены активности против энтерококков, а ранние фторхинолоны (ломефлоксацин, норфлоксацин, офлоксацин, пефлоксацин, ципрофлоксацин) обладают слабой активностью против Enterococcus faecalis.
Enterococcus faecalis в систематике бактерий
По современным представлениям вид Enterococcus faecalis относится к роду Enterococcus (энтерококки), который входит в семейство Enterococcaceae, порядок Lactobacillales, класс Bacilli, тип Firmicutes, Terrabacteria group, царство Бактерии.
По принятой ранее классификации энтерококки относились к стрептококкам серогруппы D и Enterococcus faecalis назвался Streptococcus faecalis. Традиционно он иногда называется фекальным стрептококком.
Вагиниты, вызванные условно-патогенной микрофлорой: рекомендации для практикующих врачей
Сведения об авторе:
Пустотина Ольга Анатольевна, доктор медицинских наук, профессор кафедры акушерства, гинекологии и репродуктивной медицины ФПК МР РУДН Адрес: 117198 Москва, ул. Миклухо-Маклая д. 6, телефон 8 (495) 787-38-27, email: rudn@rudn.ru Pustotina Olga Anatolievna, Doctor of Medicine, Professor of The department of Obstetrics, Gynecology and Reproductive Health, Peoples’ Friendship University of Russia. Address: 117198 Moscow, Mikluho-Maklaya str, 6. Phone 8(495)7873827
Нормальная микрофлора женских половых органов
Таким образом, во влагалище здоровых женщин репродуктивного возраста общая численность бактерий составляет 105-106 КОЕ/мл выделений, 95% которых представлены лактобактериями и только 5% формируется представителями других видов аэробных и анаэробных УПМ.
Вагиниты, вызванные УПМ
Вагиниты бывают воспалительного и невоспалительного характера. Воспалительные вагиниты в зависимости от вида возбудителя разделяют на неспецифические и специфические. К специфическим относятся трихомонадный, хламидийный, гонококковый и грибковый вагинит (вагинальный кандидоз), при обнаружении любых других УПМ вагинит является неспецифическим. Невоспалительный вагинит называется бактериальным вагинозом. Бактериальный ваги- ноз, неспецифический вагинит и вагинальный кандидоз объединяют вагиниты, вызванные УПМ.
Бактериальный вагиноз не относится к инфекциям, передаваемым половым путем (ИППП), но связан с сексуальной активностью женщины и может вызывать симптомы уретрита у мужчин. Происходящие во влагалищном биотопе изменения облегчают восходящее инфицирование ИППП: гонококками, хламидиями, трихо- монадами, ВИЧ-инфекцией и др. Кроме того, накапливаясь в большом количестве, УПМ проникают в полость матки, вызывая хроническую воспалительную реакцию, приводя к бесплодию, невынашиванию беременности и снижению эффективности программ ЭКО [7, 8].
Вагинальный кандидоз-это воспаление слизистой оболочки влагалища, вызванное дрожжевыми грибами рода СапсНс1а, которое встречается у 5-10% женщин репродуктивного периода. Развитие кандидоза в основном расценивают как вторичную эндогенную инфекцию, резервуаром которой является желудочно-кишечный тракт. Основными причинами, способствующими проникновению грибов из аногенитальной области во влагалище и их интенсивному размножению, является прием антибиотиков, глюкокортикоидов, потребление пищи с большим количеством углеводов. Предрасполагающими к заболеванию факторами служат ожирение, сахарный диабет и нарушение правил личной гигиены 10.
Факторы риска вагинитов, вызванных УПМ
Устойчивость экосистемы влагалища определяется факторами эндогенного и экзогенного происхождения. К развитию дисбиотических процессов в вагинальном микроценозе наиболее часто приводят: стресс, лечение антибиотиками, гормональная терапия, эндокринные и аллергические заболевания, снижение иммунной защиты организма, хронические запоры, инфекция мочевых путей. Уменьшение доли лактобацилл и повышение рН в содержимом влагалища происходит при повреждениях эпителиального покрова в результате полового акта, трещин, расчесов, при чрезмерной гигиене наружных половых органов. Нередко женщины при появлении неприятного запаха из половых путей прибегают к спринцеванию. Спринцевание не имеет ни гигиенического, ни профилактического, ни лечебного эффекта, а усугубляет дис- биоз и является фактором риска воспалительных заболеваний органов малого таза. Нарушение экосистемы влагалища может возникать после полового акта вследствие действия спермы с высоким уровнем рН, при частой смене половых партнеров, во время аногенитальных контактов, при использовании некоторых спермицидов. Длительное маточное кровотечение, инородные тела во влагалище (тампоны, пессарии, швы при истмико-цервикальной недостаточности) нередко также сопровождаются патологическими выделениями из половых путей [4, 6, 7, 9].
Клиника и диагностика вагинитов, вызванных УПМ
В основе вагинитов, вызванных УПМ, лежит уменьшение колоний лактобактерий, в результате которого изменяется рН вагинальной среды с кислой на щелочную и создаются условия для разрастания УПМ и их адгезии на освобождающийся эпителий слизистой оболочки влагалища.
Все происходящие изменения вагинального биотопа объединяются диагностическими критериями Амселя: появление специфических белей из половых путей, увеличение рН вагинального отделяемого, «рыбный» запах и наличие «ключевых клеток», представляющих собой эпителиальные клетки, порытые сплошным слоем различных микроорганизмов. По последним данным, даже наличие двух критериев из четырех позволяет установить нарушение вагинального микробиоценоза [5].
Кроме того, возбудители ИППП, такие как хламидии, трихомонады, гонококк и Мусор1а5та депйаПит, также могут колонизировать генитальный тракт, не нарушая нормальный рост лактобактерий и не изменяя рН влагалищного содержимого, в следствие чего до 90% случаев инфицирования ИППП протекают бессимптомно. Поэтому международные и отечественные эксперты 12 рекомендуют дополнительно к микроскопическому исследованию, обладающему низкими диагностическими возможностями в отношении облигатных патогенов, использовать метод полимеразной цепной реакции (ПЦР) для выявления антигенов хламидий, трихо- монад, гонококка и Мусор1а5та депИаИит в отделяемом половых путей.
Таким образом, окончательный диагноз вагинитов, вызванных УПМ, устанавливается при наличии у женщины жалоб на патологические вагинальных выделения и данных микроскопического исследования, и только после исключения ИППП методом ПЦР.
Лечение вагинитов, вызванных УПМ
Первый этап: Противомикробная терапия.
Препаратами выбора для лечения бактериального вагиноза являются производные нитроимидазола и линкозамиды, которые наиболее активно подавляют размножение анаэробной микрофлоры:
Исследования показали, что ни у одной из схем нет преимуществ в эффективности терапии [7], однако при местном использовании значительно реже возникают побочные эффекты [16].
Для лечения неспецифического вагинита рекомендуется использовать клин- дамицин (300 мг 2 р/сут 7 дней, вагинальный крем 2% 5г 7 дней, свечи 100 мг вагинально 3 дня). В сравнении с производными нитроимидазола (метронидазол, тинидазол, орнидазол), он имеет более широкий спектр действия, включающий не только анаэробные, но и аэробные грамположительные и грамотрицательные бактерии [3, 12, 13, 17, 18].
В последние годы опубликованы результаты крупных рандомизированных контролируемых исследований, показавших высокую эффективность лечения нарушений вагинального микробиоценоза еще двумя антибиотиками широкого спектра действия: рифаксимина (250 мг вагинально 5 сут) [19] и нифуратела (250 мг вагинально 10 сут) [20].
Следует отметить, что все выше представленные антибактериальные средства, обладая выраженной подавляющей активностью в отношении УПМ, не влияют на жизнедеятельность полезных молочно-кислых бактерий [15, 19, 20].
Терапия вагинального кандидоза проводится антимикотиками, среди которых препаратами первой линии являются азолы для интравагинального применения (имидазолы):
и азолы для приема внутрь (триазолы):
При остром неосложненном вагинальном кандидозе, вызванном СапсМс1а а1Ысап5, все препараты местного и системного действия одинаково эффективны.
В случаях рецидивирования процесса длительность и количество курсов увеличивается, при этом необходимо идентифицировать вид кандидозной инфекции и исключить возможные факторы риска [10,12-14].
Антисептики:
В настоящее время получено множество доказательств эффективности терапии вагинитов, вызванных УПМ, различными антисептическими средствами, такими как:
Все антисептики обладают широким неспецифическим спектром действия и подавляют рост аэробных и анаэробных микроорганизмов, а также грибов рода СапсМс1а, при этом не влияя на жизнедеятельность колонии лактобактерий [15].
Наибольшая доказательная база (уровень доказательности 1А) продемонстрирована для деквалиния хлорида (флуомизина). В крупномасштабных многоцентровых рандомизированных зарубежных [21 ] и отечественных исследованиях (БИОС-1/М) [18, 22, 24] с участием 321 и 640 пациенток, соответственно, деквалиния хлорид показал сопоставимую эффективность с действием клиндамицина при лечении вагинитов, вызванный УПМ, при значительно лучшей переносимости и меньшей частоте развития кандидоза. Кроме того, вагинальные таблетки деквалиния хлорида обладают хорошей всасываемостью и меньшей текучестью в сравнении с хлоргексидином, поэтому назначаются один раз в сутки, не вызывая аллергических и других побочных эффектов, характерных для повидон-йода, при этом более эффективно уменьшая количество «ключевых клеток» и ПЯЛ в вагинальном мазке [18, 22].
Второй этап: восстановление микробиоценоза
Одной из причин хронизации процесса являются бактериальные пленки, формирующие невосприимчивость микроорганизмов к действию антибактериальных и антисептических средств [23]. В результате уровень излеченности через 3 мес составляет 60-70% и еще ниже через 6 мес [6]. Значительное повышение эффективности терапии вагинитов происходит после проведения второго этапа, направленного на восстановление нормального микробиоценоза [22, 23, 25].
Наилучшие результаты продемонстрировало применение пробиотиков, содержащих живые лактобактерии. Они не только подавляют рост УПМ, ассоциированных с бактериальным вагинозом и неспецифическим вагинитом, за счет образования молочной кислоты, перекиси водорода и бактериоцинов, но и способны разрушать образованные ими биопленки, а также модулируют иммунный ответ и способствуют размножению колоний эндогенных лактобактерий [4, 12, 19, 24, 26, 27].
В качестве дополнительного фактора, улучшающего состояние вагинального микробиоценоза после антимикробной терапии, является применение вагинальных таблеток аскорбиновой кислоты. [28]. В то же время, применение исключительно пробиотиков и/или закисления вагинальной среды без предшествующей антимикробной терапии для лечения вагинитов, вызванных УПМ, недостаточно [7].
Лечение вагинитов, вызванных УПМ, у беременных
Нарушение вагинального микробиоценоза у беременных достоверно сопряжено с повышенным риском преждевременных родов, восходящего инфицирования плода и послеродовых гнойно-септических осложнений [1,8, 29-31 ].
Согласно зарубежным рекомендациям [12, 13] терапия бактериального вагино- за и неспецифического вагинита у беременных женщин не отличается от таковой у небеременных. Препаратом первой линии считается метронидазол для системного и местного применения. При осложненном течении беременности и высоком риске преждевременных родов более эффективным считается назначение клиндамицина, обладающего более широким спектром активности 34. При этом терапию нарушений биоценоза влагалища необходимо проводить с самых ранних сроков беременности [36].
В отечественных рекомендациях [14] антибиотики из группы нитроимидазола и линкозамидов противопоказаны в первом триместре, их применение возможно только местно после 12 нед беременности. Поэтому препаратами выбора для беременных являются вагинальные антисептики широкого спектра действия. Среди антисептических средств только у деквалиния хлорида безопасность применения на любом сроке беременности и в период грудного вскармливания подтверждена в масштабных многоцентровых исследованиях [18, 21, 22, 24]. Беременным с вагинальным кандидозом показано местное применение азолов (клотримазол, миконазол, терканозол и др.) 12. В случаях неэффективности терапии предусмотрено интравагинальное назначение полиенов (натамицин, нистатин) 14. В дальнейшем для профилактики рецидивов вагинальных выделений беременным назначаются пробиотики и средства, подкисляющие вагинальную среду [28, 36].
В заключение хочется отметить, что вагинальный микробиоценоз напрямую связан с состоянием здоровья женщины. Любые нарушения гомеостаза могут сопровождаться патологическими выделениями из половых путей, которые нередко бывают кратковременными, и после нормализации общего состояния самостоятельно проходят. В случаях рецидивирования процесса основной задачей врача является не поиск и идентификация возможных возбудителей, которых при вагинитах, вызванных УПМ, как правило множество, а выяснение причин, приведших к длительному течению заболевания. Для постановки правильного диагноза достаточно простой микроскопии вагинального мазка и метода ПЦР для исключения строгих патогенов. При рецидивирующих патологических вагинальных выделениях необходим также тщательный сбор анамнеза для выявления всех возможных факторов риска, только после устранения которых достигается полноценное восстановление вагинального микробиоценоза.
Список использованной литературы
1. Гуртовой Б.Л., Кулаков В.И., Воропаева С.Д. Применение антибиотиков в акушерстве и гинекологии. – М.: Триада-Х, 2004. – 176с.
2. Sweet RL, Gibbs RS. Infectious diseases of the female genital tract. – 5th ed. Lippincott Williams Wilkins, 2009. 469p.
4. Радзинский В.Е. Бактериальный вагиноз. В кн. Шейка матки, влагалище, вульва. Физиология, патология, кольпоскопия, эстетическая коррекция: руководство для практикующих врачей / Под ред. С.И. Роговской, Е.В. Липовой. – М.: Издат журнала StatusPraesens, 2014. – С.249-280.
5. Mittal V, Jain A, Pradeep Y. Development of modified diagnostic criteria for bacterial vaginosis at peripheral health centres in developing countries/ J Infect Dev Ctries. 2012; 6(5): 373-377.
6. Verstraelen H, Verhelst R. Bacterial vaginosis: an update on diagnosis and treatment/ Expert Rev Anti Infect Ther. 2009;7:1109–1124.
7. Donders GG, Zodzika J, Rezeberga D. Treatment of bacterial vaginosis: what we have and what we miss/ Expert Opin Pharmacother. 2014;15(5): 645-657.
8. Leitich H, Bodner-Adler B, Brunbauer M. et al. Bacterial vaginosis as a risk factor for preterm delivery: a meta-analysis/ Am J Obstet Gynecol. 2003;189: 139–147.
9. Filler SG. Insights from human studies into the host defense against candidiasis/ Cytokine. 2012; 58(1): 129-132.
10. Байрамова Г.Р. Рецидивирующий вульвовагинальный кандидоз: автореф. дис. докт.мед.наук.– М., 2013.
11. Роговская С.И., Липова Е.В., Яковлева А.Б. Вульвовагинальные микозы. В кн. Шейка матки, влагалище, вульва. Физиология, патология, кольпоскопия, эстетическая коррекция: руководство для практикующих врачей / Под ред. С.И. Роговской, Е.В. Липовой. – М.: Изд-во журнала StatusPraesens, 2014. – С.281-308.
12. CDC. Sexually Transmitted Diseases Treatment Guidelines 2010. http://www.cdc.gov/std/treatment/2010/pid.htm
13. Sherrard J, Donders G, White D. European (IUSTI/WHO) Guideline on the management of vaginal discharge in women reproductive age. 2011.
14. Клинические рекомендации РОАГ. Акушерство и гинекология. – 4-е изд./ под ред. В.Н. Серова, Г.Т. Сухих. – М.: ГЭОТАР-Медиа, 2014. – 1024с.
15. Профилактика, диагностика и лечение инфекций, передаваемых половым путем: рук-во для дерматовенерологов, акушеров-гинекологов, урологов и семейных врачей. – М.:Институт здоровья семьи, 2008.
16. Mikamo H, Kawazoe K, Izumi K, et al. Comparative study on vaginal or oral treatment of bacterial vaginosis / Chemotherapy. 1997; 43:60-68.
17. Практическое руководство по антиинфекционной химиотерапии// Под ред. Л.С. Страчунского, Ю.А. Белоусова, С.Н. Козлова. – М., 2007. – 462с.
18. Подзолкова Н.М., Никитина Т.И. Сравнительная оценка различных схем лечения больных с бактериальным вагинозом и неспецифическим вульвовагинитом // Рос вестник акуш гинекол, 2012.- №4. – С.75-81.
19. Donders GG, Guaschino S, Peters K, et al. A multicenter, double-blind, randomized, placebocontroled study of rifaximin for the treatment of bacterial vaginosis/ Int J Gynaecol Obstet. 2013; 120:131-136.
21. Weissenbacher ER, Donders G, Unzeitig V. et al. Fluomizin Study Group. A comparison of dequalinium chloride vaginal tablets (Fluomizin®) and clindamycin vaginal cream in the treatment of bacterial vaginosis: a single-blind, randomized clinical trial of efficacy and safety. Gynecol Obstet Invest.
2012; 73: 8–15.
23. Swidsinski A, Verstraelen H, Loening-Baucke V. et al. Presence of a polymicrobial endometrial biofilm in patients with bacterial vaginosis/ PLoS One. 2013;8:e53997.
25. McMillan A, et al. Disruption of urogenital biofilms by lactobacilli / Colloids Surf B Biointerfase,2011; 86(1): 58-64.
26. Larsson PG, Stray-Pedersen B, Ryttig KR, Larsen S. Human lactobacilli as supplementation of clindamycin to patients with bacterial vaginosis reduce the recurrence rate; a 6-month, double-blind, randomized, placebo-controlled study./ BMC Women Health, 2008;15(8):3.
27. Ya W, Reifer C, Miller L E. Efficacy of vaginal probiotic capsules for recurrent bacterial vaginosis: a double blind, randomized, placebo-controlled study. Am J Obstet Gynecol. 2010; 203:1200–1208.
28. Zodzika J, Rezerberga D, Donders G. et al. Impact of vaginal ascorbic acid on abnormal vaginal microflora / Arch Gynecol Obstet 2013; 288: 1039-1044.
29. Bothuyne-Queste E, et al. Is the bacterial vaginosis risk factor of prematurity? Study of a cohort of 1336 patients in the hospital of Arras/ J Gynecol Obstet Biol Reprod. 2012; 41(3): 262-270.
30. Pustotina OA, Bubnova NI, Yezhova LS. Pathogenesis of hydramnios and oligohydramnios in placental infection and neonatal prognosis /J mat-fetal&neonat med. 2008; 21(1): 267-271.
31. Pustotina OA. Urogenital infection in pregnant women: clinical signs and outcome /J Perinat Med, 2013; 41:135.
32. Simcox R, Sin WT, Seed PT, et al. Prophylactic antibiotics for the prevention of preterm birth in women at rick: a meta-analysis/ Aust N-Z J Obstet Gynaecol. 2007; 47: 368-377.
33. McDonald HM, Brocklehurst P, Gordon A. Antibiotics for treating bacterial vaginosis in pregnancy/Cochr Database Syst Rev. 2007. N1.P.CD000262.
34. Lamont RF, Duncan SLB, Mandal D, et al. Intravaginal clindamycin to reduce preterm birth in women with abnormal genital tract flora/ Obstet Gynecol. 2003;101:516–522.