Эрадикация что это значит
Антигеликобактерная эрадикационная терапия – выход из тупика или движение вглубь лабиринта?
К настоящему времени установлено, что эрадикация Helicobacter pylori может ускорить сроки рубцевания язвы, улучшить качество жизни пациента и уменьшить частоту рецидивов, но не позволяет ликвидировать заболевание. Это связано с тем, что Helicobacter pylori является не облигатно-патогенным, а условно-патогенным микробом. Соответствен но, стратегия эрадикационной терапии при заболеваниях, ассоциированных с условно-патогенной микрофлорой, в том числе с Helicobacter pylori, как минимум является ошибочной.
Уровень развития современной медицины, как и любого другого направления в науке, зависит от объема знаний и навыков, накопленных многими десятками предшествующих поколений. В то же время следует признать, что мы, как и современники Гиппократа, двигаемся вперед путем совершения проб и ошибок. Можно согласиться с тем, что число этих ошибок уменьшилось, но в целом оно еще очень велико. Достаточно упомянуть тот факт, что в нас тоящее время в каждом разделе медицины с периодичностью 3-5 лет происходит пересмотр рекомендаций по вопросам диагностики и лечения различных заболеваний. Ранее же ревизия сложившихся представлений занимала столетия и даже тысячелетия.
Открытие антибиотиков без преувеличения является одним из величайших достижений медицины, поскольку их использование позволило радикально сократить смертность от инфекционных заболеваний во всем мире. В конце ХХ века на слизистой оболочке желудка и двенадцатиперстной кишки пациентов с язвенной болезнью были выявлены грамотрицательные, неспорообразующие бак терии – Helicobacter pylori. Включение в программу лечения гастродуоденальных язв антибиотиков, обладающих антигеликобактерной активностью, в комбинации с блокаторами протонной помпы, позволило добиться максимального сокращения сроков рубцевания язвы, которое почти в 100% случаев сопровождалось эрадикацией бактерии. Данный факт послужил основанием для вывода о том, что H. pylori в сочетании с гиперхлоргидрией являются главными причинами язвенной болезни. Таким образом, о язвенной болезни стали говорить как об инфекционном заболевании. Однако лечением таких пациентов по-прежнему за ни маются не инфекционисты, а гастроэнтерологи. Поскольку выздоровлению пациентов инфекционных отделений всегда предшествует эрадикация инфекционного агента – виновника заболевания, данный подход был распространен и на пациентов с язвенной болезнью.
Длительное время существовало стойкое убеждение, что с эрадикацией H. pylori будет ликвидирована и язвенная болезнь. Прошло более 30 лет с момента открытия микроорганизма, в связи с чем появилась возможность подвести определенные итоги. Воздержимся пока от собственных оценок и обратимся к высказыванию И.В. Маева – одного из ревностных приверженцев версии о главной роли H. pylori в патогенезе язвенной болезни. «Несмотря на уже многолетнюю активную борьбу … с H. pylori-инфекцией, распространенность язвенной болезни как в нашей стране, так и в большинстве стран мира не снижается. Стабильно высокой (на уровне 10%) остается и частота ее грозных осложнений (перфорации, пенетрации, кровотечения и др.)» [1].
Приведенная фраза фактически является авторитетным признанием того, что утверждение о ведущей роли H. pylori в патогенезе язвенной болезни является ошибочным. Действи тельно, в значительной части случаев язвенная болезнь развивается без всякого участия H. pylori (H. pylori-негативные формы болезни). В США частота язвенной болезни, не ассоциированной с H. pylori, варьируется от 39 до 52%, а в Австралии достигает 45% [2,3]. Представленные данные наглядно демонстрируют, что роль H. pylori без достаточных оснований чрезмерно демонизирована.
Поскольку принципы лечения гастродуоденальных язв тесно увязаны с представлением о роли H. pylori, возникает вопрос, отразилось ли это на алгоритме антибактериальной терапии больных? На данный вопрос в целом можно ответить утвердительно. Корректировка схем лечения действительно осуществляется каждые несколько лет. Последние рекомендации сформулированы в Маастрихт-V-Флорентийском консенсусе [4]. Значительная часть всех пяти вариантов Мааст рихт ского консенсуса посвящена рассмотрению вопроса: что делать, если неэффективна та или иная схема терапии? Соответственно, в последнем варианте, как и в четырех предыдущих изданиях, преимущественно обсуждается тактика преодоления резистентности H. pylori к используемым антибиотикам. При этом стратегический вопрос о целесообразности обязательного достижения эрадикации H. pylori даже не возникает, он автоматически, в течение более 30 лет, переносится из одних рекомендаций в другие, хотя, как уже отмечалось, заболеваемость язвенной болезнью на планете за данный период не снижается. Более того, в новых рекомендациях без достаточных оснований расширяется круг заболеваний и синдромов, при которых рекомендуется проводить эрадикационную терапию.
Недавно, на страницах данного журнала Я.С. Цим мерман опубликовал дискуссионную статью, в которой привел целый ряд фактов, заставляющих усомниться в гипертрофированной роли H. pylori и в адекватности стратегии консервативной терапии гастродуоденальных язв. С учетом собственного опыта мы целиком разделяем точку зрения Я.С. Циммермана о том, что авторысоставители «Маастрихтских консенсусов» по существу монополизировали право определять показания к эрадикации H. pylori и методику проведения эрадикационной терапии, провозгласив стратегию на тотальную ликвидацию H. pylori (test and treat strategy: выявлять и уничтожать!), что научно бездоказательно и практически неосуществимо [5]. Твердо убеждены, что подобный подход является однобоким, ошибочным и требует учета альтернативных фактов. С учетом изложенного в предлагаемой статье мы постараемся более подробно остановиться на дискуссионных моментах, касающихся вопросов стратегии антигеликобактерной эрадикационной терапии.
В противовес утверждению о главной роли H. pylori в патогенезе гастродуоденальных язв считаем необходимым напомнить хорошо известный факт, установленный еще В.Х. Василенко (1970 г.) – «Язвы заживают при лечении, без лечения и вопреки лечению» [6]. С учетом того, что у значительной части больных возникновение заболевания возможно и при отсутствии H. py lori, данное наблюдение убедительно свидетельствует о существовании причин, которые играют более важную роль в патогенезе гастродуоденальных язв, чем наличие микроба. Считаем, что в патогенезе гастродуоденальных язв среди многочисленных факторов риска ведущими являются «немодифицируемые»: наследственность, пол и возраст человека. Непосредственная же реализация их роли осуществляется за счет имеющейся врожденной или приобретенной локальной гипоплазии сосудов в двенадцатиперстной кишке или желудке, которая также относится к категории немодифицируемых факторов [7]. Помимо немодифицируемых, в патогенезе гастродуоденальных язв важную вспомогательную роль играет огромное количество факторов, которые считаются «модифицируемыми»; к их числу относится и H. pylori. С учетом выраженного положительного ответа на антигеликобактерную терапию есть основание сделать вывод, что среди модифицируемых факторов H. pylori играет одну из главных ролей.
Опыт последних тридцати с лишним лет показал, что эрадикация геликобактера, сокращая сроки рубцевания язв, одновременно ведет к снижению соотношения гастродуоденальных язв, ассоциированных и не ассоциированных с H. pylori, но при этом, вопреки ожиданиям, не ведет к ликвидации язвенной болезни [8]. Большой интерес представляют наблюдения хирургов, установивших, что частота рецидивов после успешно выполненных органосберегающих операций (стволовой ваготомии с экономной резекцией язвы) составляет 0% в течение более 25 лет после вмешательства. При этом положительный H. pylori-статус у оперированных больных выявляют с той же частотой, что и в популяции [9,10]. Важно отметить рост смертности от осложнений длительно не рубцующихся гастродуоденальных язв, что дает повод провести переоценку показаний к проведению планового оперативного лечения при указанных состояниях. Приведенные примеры наглядно демонстрируют, что в значительном числе случаев успешное хирургическое устранение части стенки желудка или двенадцатиперстной кишки, включающей участок локальной гипоплазии сосудов, является гораздо более эффективной мерой, чем эрадикация H. pylori.
Негативный парадокс обсуждаемой проблемы заключается в том, что к настоящему времени данный микроб без достаточных оснований рассматривается в качестве главной причины возникновения уже целого ряда других заболеваний. Показания к их эрадикационной терапии были сформулированы еще консенсусом «Маастрихт II». В последующих согласительных документах дополнительно указывался ряд новых патологических состояний, при которых также рекомендовалось проведение эрадикационной терапии. К настоящему времени показаниями к диагностике и лечению H. pylori служат следующие [4,11]:
При этом игнорируется тот факт, что данный подход находится в противоречии с представлениями о патогенезе, особенностях течения, лечения и исходов классических облигатно- и условно-патогенных инфекций [12]. Известно, что биомасса микробов, заселяющих желудочно-кишечный тракт взрослого человека, составляет 2,5–3 кг и более и включает в себя до 450–500 видов. Около 90% данного микробиоценоза представлено облигатной (обязательной) нормальной микрофлорой, выполняющей множество жизненно важных функций [13]. Без преувеличения, значение данной микрофлоры сопоставимо с ролью такого важного органа, как печень. Остальная часть микробиоценоза представлена факультативной (возможной, необязательной) микрофлорой, часто встречающейся у здоровых людей и являющейся условно-патогенной [14]. Условно-патогенными считают микроорганизмы, представляющие собой большую группу грибов, бактерий, простейших и вирусов. Они являются нормальными обитателями кожи и слизистых оболочек, мирно сосуществующими с организмом человека, что свидетельствует о том, что иммунная система хозяина не воспринимает их как угрозу и ведет себя нейтрально. При этом они способны долгое время существовать в окружающей среде.
H. pylori относится к категории условно-патогенных инфекций. Особенностью микроорганизмов данного типа является то, что они многие годы и даже всю жизнь могут находиться в организме человека, не проявляя признаков какой-либо агрессии. Агрессивные свойства данные инфекционные агенты проявляют лишь в условиях пассивного проникновения во внутреннюю среду в больших количествах и (или) резкого снижения общего и местного иммунитета человека (нарушение целостности покровов, бактерицидной активности секретов, подавление фагоцитарной реакции, снижение числа микробов-антагонистов и др.). Это связано с тем, что условно-патогенные микробы, в отличие от облигатно-патогенных, не обладают факторами активного проникновения во внутреннюю среду, подавления защитных сил организма, не выделяют экзотоксины. Патогенное влияние на организм они оказывают с помощью эндотоксина и ферментов-токсинов [12].
Данные больные являются заразными, поэтому они нуждаются в изоляции от окружающих и соблюдении требований противоэпидемического режима и должны получать лечение в специализированных инфекционных отделениях. В подобных случаях убедительным и вполне обоснованным выглядит требование добиваться, в обязательном порядке, эрадикации инфекционных агентов, вызвавших данное заболевание.
Таким образом, в возникновении перечисленных патологических состояний H. pylori играет роль важного модифицируемого, но не главного фактора риска. В этой связи, утверждение, что при всех перечисленных состояниях антигеликобактерная терапия должна быть эрадикационной, вызывает большие сомнения. Накоп ленный мировой опыт допускает эмпирическое использование антибактериальных препаратов сразу после установления диагноза при заболеваниях, ассоциированных с условно-патогенной флорой (пневмонии, инфекции желчевыводящих, мочевыводящих путей и др.). При этом учитываются результаты предшествующих эпидемиологических исследований по региону, лечение пациентов данной категории осуществляется вне инфекционного стационара – в общетерапевтических, хирургических и других отделениях. Часто в результате лечения удается достичь и эрадикации агента, причастного к возникновению пневмонии или другого подобного заболевания, однако задача обязательного достижения подобной цели не стоит. Более того, прием антибиотиков прекращается задолго до того, как ликвидированы пневмоническая инфильтрация и основные лабораторные и клинические прояв ления. Таким образом, главной целью лечения заболеваний, ассоциированных с условно-патогенной флорой, является не эрадикация условно-патогенных бактерий, а достижение клинического выздоровления при острой болезни или ремиссии хронического заболевания. Принципиальным является тот факт, что после выздоровления не ставится задача контроля степени эрадикации возбудителя заболевания, более того, после успешного завершения лечения возбудитель часто так и остается неизвестным [17].
Отсутствие убедительных доказательств целесообразности эрадикации H. pylori при гастродуоденальных язвах делает еще менее обоснованным утверждение о необходимости добиваться той же цели при прочих перечисленных выше заболеваниях. Обсуждения заслуживают, прежде всего, хронический гастрит и функциональная диспепсия, ассоциированные с H. pylori, и рак желудка. Считается, что при естественном течении H. pylori-ассоциированнного хронического гастрита у 1-2% больных нарушается стройная система клеточного обновления слизистой оболочки желудка. Это ведет к атрофии и прогрессированию морфологических изменений в слизистой оболочке, что способствует формированию рака желудка («каскад Correa») [18].
Заболеваемость раком желудка характеризуется примерно 10-кратными географическими колебаниями, что может свидетельствовать о более важной роли этнической и наследственной предрасположенности. Рак желудка очень часто встречается в странах Восточной Азии (Японии и Корее), Южной Америке и Восточной Европе и значительно реже в Южной Азии, Северной Америке, Северной и Восточной Африке, Австралии, Новой Зеландии [19,20]. Особый интерес представляет тот факт, что в африканской популяции, где отмечается максимальная распространенность H. pylori (до 97%), рак желудка распространен в минимальной степени, а в Японии, где распространенность H. pylori составляет около 43%, заболеваемость раком этой локализации высокая. С учетом изложенного, трудно согласиться с утверждением, что инфекция H. pylori является канцерогеном 1 группы для человека [21]. Сомнение в обоснованности данного утверждения усиливается еще более, если обратиться к статистике распространенности рака желудка в России за период 2005-2015 гг. (рис. 1) [22].
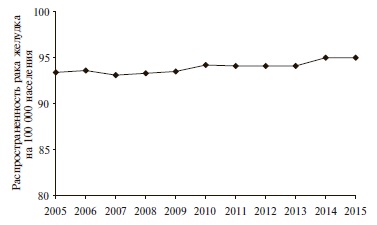
Приведенные данные наглядно свидетельствуют о том, что внедрение в практику эрадикационной стратегии не способствует снижению распространенности рака желудка в России. Более того, отмечается его статистически недостоверный, но неуклонный рост за период 2005-2010 гг., что делает сомнительным утверждение о целесообразности проведения эрадикационной терапии с целью профилактики возникновения данного вида онкопатологии.
Большой интерес представляет исследование, которое в течение около 7,5 лет проводилось в китайской провинции, где отмечается высокая заболеваемость раком желудка. Пациенты с сопоставимым риском возникновения рака желудка были распределены на две группы и получали плацебо (n=813) или эрадикационную терапию (n=817). В первые 5 лет кумулятивная заболеваемость раком желудка была выше в группе плацебо, однако к концу исследования частота его в сравниваемых группах достоверно не различалась [23]. Приведенные данные наглядно свидетельствуют о том, что эрадикационная терапия может на несколько лет замедлить скорость прогрессирования рака желудка, но не способна его предотвратить. В литературе приводятся данные о том, что эрадикационная терапия является эффективным элементом профилактики рака лишь в тех случаях, когда ее назначают до развития преднеопластических состояний. Установлено, что III и IV стадии атрофического гастрита по системе OLGA ассоциируются с повышенным риском развития рака желудка [24]. Эрадикационная терапия у пациентов с кишечной метаплазией не приводит к обратному развитию последней, она может лишь замедлить прогрессирование метаплазии до неоплазии.
Все схемы эрадикационной терапии, сформулированные в пяти Маастрихтских рекомендациях, предлагаются не в качестве рекомендаций, возможных к использованию, а вменяются в виде обязательств, непременных к исполнению. В этой связи представляет интерес наблюдение о распространенности язвенной болезни у лиц, занятых в производстве антибиотиков. При этом установлено, что средний возраст больных с дуоденальными язвами (39,8 лет), занятых в производстве антибиотиков, соответствовал таковому больных с язвами двенадцатиперстной кишки контрольной группы, работа которых не была связана с данным производством. В то же время, средний возраст пациентов с язвами желудка в основной группе (38,7 лет) был ниже возраста, характерного для лиц с язвами данной локализации (40-50 лет) в контроле. Это дает основание говорить о том, что продолжительный контакт человека с антибиотиком ведет к росту резистентности условнопатогенной флоры, что, в конечном счете, способствует более раннему возникновению язвы желудка у лиц, работа которых связана с производством антибиотиков [25].
Суммарная распространенность хронического гаст рита и функциональной диспепсии сопоставима с распространенностью H. pylori в популяции (не менееполовины населения). Известно, что при естественном течении хронического гастрита 1-2 из 100 человек могут умереть от рака желудка. При III и IV стадии атрофического гастрита эрадикационная терапия бесполезна. Требование о необходимости проведения эрадикации на более ранних стадиях означает, что в программу лечения следует включать не менее 50% населения планеты. В то же время, ранее приведенные примеры свидетельствуют о том, что, во-первых, эрадикационная терапия не остановит прогрессирования ни хронического гастрита, ни функциональной диспепсии. Во-вторых, у 1-2 из 100 человек с хроническим гастритом опухоль может развиться на несколько лет позже, чем при естественном течении заболевания, но умрут они, в любом случае, от рака желудка. Что касается остальных 98-99 пациентов, то они, фактически, превращаются в «живой термостат-инкубатор» для выращивания огромного количества новых штаммов бактерий, резистентных к новым антибиотикам.
Завершая обсуждение роли H. pylori в патогенезе и лечении H. pylori-ассоциированных заболеваний, можно сделать ряд выводов, которые дают основание усом ниться в достаточной обоснованности и целесообразности стратегии эрадикационной терапии при отмеченных заболеваниях. Если ориентироваться на распространенность H. pylori и ассоциированных с ним заболеваний, ситуацию в целом можно рассматривать как грозную пандемию, охватившую территорию всей планеты. Однако при более близком рассмотрении становится ясно, что сравнение с пандемией носит исключительно формальный характер. Как известно, классическим примером пандемии является «черная смерть», или эпидемия чумы, которая наблюдалась в Европе в XIV веке. Она почти одновременно буйствовала на территории Африки и Евразии. Последствия инфекции были ужасны: Европа опустела, потеряв по некоторым подсчетам до 40% населения, на территории Китая и Индии вымерли несколько сотен городов и деревень, количество мертвых в Африке и вовсе не подлежит подсчету. Таким образом, одной из главных особенностей пандемии является не только высокая распространенность инфекции в популяции, но и исключительно высокий риск смерти при заражении. При этом абсолютное большинство лиц с H. pylo riассоциированными заболеваниями представлено пациентами с хроническим гастритом, которые даже не знают о существовании у них ни гастрита, ни H. pylori. Сам же гастрит представляет угрозу для жизни лишь у 1-2 из 100 человек. С учетом представленных фактов термин пандемия для данной ситуации не подходит.
Следующая особенность состоит в том, что возбудители пандемических заболеваний все без исключения относятся к категории облигатно-патогенных, в то время как H. pylori является условно-патогенным. Важно подчеркнуть, что у выздоровевших после заразных болезней людей иммунная система вырабатывает барьер от определенного возбудителя: стойкий, нестойкий или пожизненный. При этом далеко не у всех переболевших классическим инфекционным заболеванием, вызванным облигатно-патогенным возбудителем, вырабатывается пожизненный иммунитет. Например, к числу болезней, после которых образуется стойкий иммунитет на всю жизнь, относят краснуху, эпидемический паротит, гепатит А, дифтерию, корь, полиомиелит, ветряную оспу. Нестойкий или кратковременный иммунитет формируется после таких заболеваний, как коклюш, гепатит В, грипп, туберкулез, брюшной тиф, дизентерия. К условно-патогенным возбудителям иммунная система относится нейтрально, поэтому нет оснований отрицать, что H. pylori после эрадикации может неоднократно возвращаться к одному и тому же человеку.
Эрадикация облигатно-патогенного возбудителя тож дественна полному выздоровлению инфекционного больного, эрадикация же H. pylori, как показало время, ведет лишь к сокращению сроков рубцевания язвы и к более продолжительной ремиссии, но не к ликвидации самого заболевания. Распространенность рака желудка, как отмечено ранее, не только не снижается, но продолжает расти. С учетом изложенного при остром возникновении или рецидиве гастродуоденальных язв проведение антигеликобактерной терапии следует признать целесообразным. При этом главным критерием эффективности лечения следует считать достижение ремиссии заболевания (купирование клинических проявлений, рубцевание язвы). Однако, поскольку эрадикация не является гарантией предотвращения рецидива заражения H. pylori и не сопровождается ликвидацией «H. рylori-ассоциированных заболеваний», лечебную стратегию, предписывающую обязательно добиваться эрадикации геликобактера, следует считать ошибочной.
Helicobacter pylori (хеликобактер пилори)

Заблуждения, связанные с Helicobacter pylori
Нередко, при обнаружении Helicobacter pylori, пациенты начинают беспокоиться об их эрадикации (уничтожении). Само наличие Helicobacter pylori в желудочно-кишечном тракте не является причиной для немедленной терапии с применением антибиотиков или других средств. В России количество носителей Helicobacter pylori достигает 70 % населения и подавляющее большинство из них не страдает какими-либо заболеваниями желудочно-кишечного тракта. Процедура эрадикации предполагает прием двух антибиотиков (например, кларитромицина и амоксициллина). У пациентов, имеющих повышенную чувствительность к антибиотикам, возможны аллергические реакции — от антибиотик-ассоциированной диареи (не тяжелое заболевание) до псевдомембранозного колита, вероятность возникновения которого мала, но процент летальных исходов большой. Кроме того, прием антибиотиков отрицательно воздействует на «дружественную» микрофлору кишечника, мочеполовых путей и способствует развитию резистентности к данному виду антибиотиков. Имеются данные, что после успешной эрадикации Helicobacter pylori в течение ближайших лет чаще всего наблюдается реинфекция слизистой желудка, которая уже через 3 года составляет 32±11 %, через 5 лет — 82–87%, а через 7 лет — 90,9% (Циммерман Я.С.).
Пока боль не проявилась, хеликобактериоз лечить не следует. Более того, у детей до восьмилетнего возраста вообще не рекомендуется проводить эрацикационную терапию, потому что у них иммунитет еще не сформирован, антитела к Helicobacter pylori не вырабатываются. Если у них провести эрадикацию до 8-летнего возраста, то через день, пообщавшись кратковременно с другими детьми, «схватят» эти бактерии (П.Л. Щербаков).
Helicobacter pylori однозначно требует эрадикации, если у больного имеется язва желудка или двенадцатиперстной кишки, МАLТома или если у него была резекция желудка по поводу рака. Многие авторитетные гастроэнтерологи (не все) в этот список включают также атрофический гастрит.
Эрадикация Helicobacter pylori может быть рекомендована для снижения риска развития рака желудка. Известно, что как минимум 90% случаев рака желука связаны с H. pylori-инфекцией (Старостин Б.Д.).
 |  |  |
| Helicobacter pylori от экспериментально моноинфицированных мышей (A), слизистой оболочки желудка человека (B) и культивированные на пластине агара (C). Как выделенных от экспериментально инфицированных мышей, так и при биопсии человека поверхность Helicobacter pylori является грубой, а жгутики имеют тенденцию склеиваться. За исключением коккоидной формы, морфология сравнительно хорошо сохраняется в культуре на агаре (С). Масштабные метки = 1 мкм. Источник: Stoffel M.H. et al. Distinction of Gastric Helicobacter spp. in Humans and Domestic Pets by Scanning Electron Microscopy / January 2001. DOI: 10.1046/j.1523-5378.2000.00036.x. Blackwell Science, 1083-4389/00/232–239. Inc. Volume 5 • Number 4 • 2000. | ||
Факторы вирулентности Helicobacter pylori
Язва двенадцатиперстной кишки, ассоциированная с Helicobacter pylori
Схемы эрадикации Helicobacter pylori
Всемирной организаций здравоохранения к активным препаратам в отношении Helicobacter pylori отнесены метронидазол, тинидазол, коллоидный субцитрат висмута, кларитромицин, амоксициллин и тетрациклин (Подгорбунских Е.И., Маев И.В., Исаков В.А.).

Эрадикация Helicobacter pylori не всегда достигает цели. Очень широкое и неправильное применение распространенных антибактериальных средств привело к повышению устойчивости к ним Helicobacter pylori. На рисунке справа (взято из статьи Белоусовой Ю.Б., Карпова О.И., Белоусова Д.Ю. и Бекетова А.С.) показана динамика резистентности к метронидазолу, кларитромицину и амоксициллину штаммов Helicobacter pylori, выделенных от взрослых (сверху) и от детей (снизу). Признано, что в разных странах мира (разных регионах) целесообразно применение разных схем. Ниже даны рекомендации по эрадикации Helicobacter pylori, изложенные в Стандартах диагностики и лечения кислотозависимых и ассоциированных с Helicobacter pylori заболеваний принятых Научным обществом гастроэнтерологов России в 2010 г. Выбор схемы эрадикации зависит от наличия индивидуальной непереносимости пациентами конкретных лекарств, а также чувствительности штаммов Helicobacter pylori к этим лекарствам. Применение кларитромицина в эрадикационных схемах возможно лишь в регионах, где резистентность к нему менее 15–20 %. В регионах с резистентностью выше 20 % его использование целесообразно только после определения чувствительности Helicobacter pylori к кларитромицину бактериологическим методом или методом полимеразной цепной реакции.
Антациды могут применяться в комплексной терапии в качестве симптоматического средства и в монотерапии — до проведения рН-метрии и диагностики Helicobacter pylori.
Первая линии антигеликобактерной терапии
Вариант 1. Один из ингибиторов протонной помпы (ИПП) в стандартной дозировке (омепразол 20 мг, лансопразол 30 мг, пантопразол 40 мг, эзомепразол 20 мг, рабепразол 20 мг) 2 раза в день и амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) в сочетании с кларитромицином (500 мг 2 раза в день), или джозамицином (1000 мг 2 раза в день), или нифурателем (400 мг 2 раза в день) в течение 10–14 дней.
Вариант 2. Лекарства, используемые при варианте 1 (один из ИПП в стандартной дозировке, амоксициллин в сочетании с кларитромицином, или джозамицином, или нифурателем) с добавлением четвертого компонента — висмута трикалия дицитрата 120 мг 4 раза в день или 240 мг 2 раза в день в течение 10–14 дней. 
Вариант 3 (при наличии атрофии слизистой оболочки желудка с ахлоргидрией, подтвержденной при рН-метрии). Амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) в сочетании с в сочетании с кларитромицином (500 мг 2 раза в день) или джозамицином (1000 мг 2 раза в день), или нифурателем (400 мг 2 раза в день), и висмута трикалия дицитрат (120 мг 4 раза в день или 240 мг 2 раза в день) в течение 10-14 дней.
Примечание. При сохранении язвенного дефекта по результатам контрольной эндоскопии на 10–14-й день от начала лечения рекомендовано продолжить терапию висмута трикалия дицитратом (120 мг 4 раза в день или 240 мг 2 раза в день) и/или ИПП в половинной дозе в течение 2–3 недель. Пролонгированная терапия висмута трикалия дицитратом показана также в целях улучшения качества послеязвенного рубца и скорейшей редукции воспалительного инфильтрата
Вариант 4 (рекомендуется только пожилым больным в ситуациях, при которых полноценная антигеликобактерная терапия невозможна):
а) ИПП в стандартной дозировке в сочетании с амоксициллином (500 мг 4 раза в день или 1000 мг 2 раза в день) и висмута трикалия дицитратом (120 мг 4 раза в день или 240 мг 2 раза в день) в течение 14 дней
б) висмута трикалия дицитрат по 120 мг 4 раза в день в течение 28 дней. При наличии болей — короткий курс ИПП.
Вариант 5 (при наличии поливалентной аллергии к антибиотикам или отказе больного от антибактериальной терапии). Один из ИПП в стандартной дозировке в сочетании с 30 %-ным водным раствором прополиса (100 мл 2 раза в день натощак) в течение 14 дней.
Вторая линия антигеликобактерной терапии
Выполняется при отсутствии эрадикации Helicobacter pylori после терапии первой линии.
Вариант 1. Один из ИПП в стандартной дозировке, висмута трикалия дицитрат по 120 мг 4 раза в день, метронидазол по 500 мг 3 раза в день, тетрациклин 500 мг 4 раза в день в течение 10–14 дней.
Вариант 2. Один из ИПП в стандартной дозировке, амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) в сочетании с нитрофурановым препаратом: нифурателем (400 мг 2 раза в день) или фуразолидоном (100 мг 4 раза в день) и висмута трикалия дицитрат (120 мг 4 раза в день или 240 мг 2 раза в день) в течение 10–14 дней.
Вариант 3. Один из ИПП в стандартной дозировке, амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день), рифаксимин (400 мг 2 раза в день), висмута трикалия дицитрат (120 мг 4 раза в день) в течение 14 дней.
Третья линия антигеликобактерной терапии
При отсутствии эрадикации Helicobacter pylori после лечения второй линии рекомендуется подбор терапии только после определения чувствительности Helicobacter pylori к антибиотикам.
В последнее десятилетие разработано большое число различных схем эрадикации Helicobacter pylori. Некоторые схемы на основе висмута трикалия дицитрата имеются в статье «Де-нол».
По мнению некоторых исследователей, сегодня перспективной является гибридная терапия. Она включает 7-дневный курс ИПП (стандартная доза) и амоксициллина (1 г 2 раза в день) с последующим 7-дневным курсом четырехкомпонентной схемы с применением ИПП (стандартная доза), амоксициллина (1 г 2 раза в день), кларитромицина (500 мг 2 раза в день) и метронидазола (500 мг 2 раза в день) (Парцваниа-Виноградова Е.В.).
Рекомендации «Маастрихт IV» в отношении схем эрадикации H. pylori
В 1987 г. была основана Европейская группа по изучению инфекции H. pylori — European helicobacter pylori study group (EHSG), целью которой явилось содействие междисциплинарным исследованиям патогенеза H. pylori-ассоциированных заболеваний. По месту проведения первой согласительной конференции все соглашения называются Маастрихтскими. Четвертая согласительная конференция прошла во Флоренции в ноябре 2010 года. Выработка Guidelines (рекомендаций) по результатам этой конференции продолжалась два года. Схемы эрадикационной терапии в соответствии с консенсусом Маастрихт IV представлены на рисунке ниже (Маев И.В. и др.):
Материалы для профессионалов здравоохранения, касающиеся заболеваний, ассоциированных с Helicobacter pylori
Статьи, методические рекомендации
Видео
Кадр из видео: Шурпо Е.М. Хронический гастрит
(лекция для студентов медицинского университета)
Кадр «Методы диагностики Hp-инфекции» из видеолекции Е.В. Гостищевой «Анатомо-физиологические особенности органов пищеварения у детей. Методика и методы исследования пищеварительной системы у детей» для студентов Медицинской академии имени С.И. Георгиевского Крымского федерального университета имени В.И. Вернадского
Кадр «Диагностика Helicobacter pylori» из видеолекции Бурсикова А.В. «Клинические и дополнительные методы исследования ЖКТ» для студентов 2-го курса Ивановской государственной медицинской академии (ИвГМА)
На сайте GastroScan.ru в разделе «Видео» имеются подраздел для пациентов «Популярная гастроэнтерология» и подраздел «Для врачей», содержащий видеозаписи докладов, лекций, вебинаров по различным направлениям гастроэнтерологии для профессионалов здравоохранения.
Проведение эрадикации Helicobacter pylori у беременных и кормящих матерей
Распространённость Helicobacter pylori в разных странах и в России
По данным Всемирной гастроэнтерологической организации (Helicobacter pylori в развивающихся странах, 2010, WGO) более половины населения Земли является носителями Helicobacter pylori), при этом частота инфицированности значительно варьируется между различными странами, а также внутри этих стран. В целом, инфицированность возрастает с возрастом. В развивающихся странах инфицированность Helicobacter pylori значительно более выражена у лиц молодого возраста, чем в развитых странах.
ВГО приводит следующие цифры:
| Страна (регион) | Возрастные группы | Частота инфицированности |
|---|---|---|
| Европа | ||
| Восточная Европа | взрослые | 70 % |
| Западная Европа | взрослые | 30-50 % |
| Албания | 16-64 | 70,7 % |
| Болгария | 1-17 | 61,7 % |
| Чехия | 5-100 | 42,1 % |
| Эстония | 25-50 | 69 % |
| Германия | 50-74 | 48,8 % |
| Исландия | 25-50 | 36 % |
| Нидерланды | 2-4 | 1,2 % |
| Сербия | 7-18 | 36,4 % |
| Швеция | 25-50 | 11 % |
| Северная Америка | ||
| Канада | 5-18 | 7,1 % |
| Канада | 50-80 | 23,1 % |
| США и Канада | взрослые | 30 % |
| Азия | ||
| Сибирь | 5 | 30 % |
| Сибирь | 15-20 | 63 % |
| Сибирь | взрослые | 85 % |
| Бангладеш | взрослые | > 90 % |
| Индия | 0-4 | 22 % |
| Индия | 10-19 | 87 % |
| Индия | взрослые | 88 % |
| Япония | взрослые | 55-70 % |
| Австралия и Океания | ||
| Австралия | взрослые | 20 % |
Причиной разной инфицированности может быть социоэкономическое различие между популяциями. Заражение Helicobacter pylori в основном происходит орально-оральным или фекально-оральным путями. Отсутствие санитарии, безопасной питьевой воды, базовых понятий о гигиене, а также ограниченная диета и большое скопление населения, могут играть роль в высокой распространенности инфекции.
Россия относится к странам с очень высокой распространенностью хеликобактерной инфекции. В некоторых регионах, например, в Восточной Сибири, эта цифра превышает 90% и в монголоидной, и в европеоидной популяции. В Москве инфицированность Helicobacter pylori ниже. По данным ЦНИИ Гастроэнтерологии около 60% жителей ВАО Москвы – носители хеликобактера. Хотя в отдельных группах населения хеликобактер более распространен. В частности, среди работников промышленных предприятий Москвы инфицированы Helicobacter pylori 88 % (Бордин Д.С.).
Helicobacter pylori в систематике бактерий
Helicobacter pylori у животных
Helicobacter pylori в МКБ-10
Helicobacter pylori упоминается в «Классе I. Некоторые инфекционные и паразитарные болезни (A00-B99)» Международной классификации болезней МКБ-10, бактерия включена в блок «B95-B98 Бактериальные, вирусные и другие инфекционные агенты» и имеет код рубрики «B98.0 Helicobacter pylori [H. pylori] как причина болезней, классифицированных в других рубриках». Данный код предназначен для использования в качестве дополнительного, когда целесообразно идентифицировать инфекционных агентов болезней, классифицированных в других рубриках.









