Этиленгликоль для чего применяют
Этиленгликоль, его характеристики и область применения
Этиленгликоль применяется в качестве хладоносителя в холодильных установках типа чиллер для кондиционирования воздуха. Однако область применения данного вещества на этом не ограничивается, оно используется и для других целей.
Главные особенности этиленгликоля
Применение этиленгликоля
Область применения данного вещества в народном хозяйстве действительно очень широка, поэтому спрос на него всегда велик. К основным сферам применения следует отнести в первую очередь:
• Производство теплоносителей и охлаждающих жидкостей, задачами которых является теплопередача и теплоотвод соответственно.
Радиаторы отопления, кондиционеры, чиллеры, фанкойлы – для работы этого и другого оборудования применяются растворы, в которых содержится этиленгликоль.
• Производство различных химических реагентов для изготовления синтетических смол, полимеров и других продуктов.
• Производство пластиковых бутылок.
Изготавливаются пластиковые бутылки из полиэтилентерефталата, который образуется при соединении таких веществ, как этиленгликоль, терефталевая кислота и катализатор.
• Производство синтетических волокон.
Из того же полиэтилентерефталата изготавливаются синтетические волокна для производства одежды, пленочных материалов. Получаемые синтетические волокна имеют множество превосходных характеристик: высокая прочность, эластичность, термостойкость, химическая стойкость.
• Производство гидравлических жидкостей.
Растворы, основой которых является этиленгликоль, применяются для смазывания приводов и других компонентов гидравлического оборудования – металлургических и металлорежущих машин, экскаваторов, комбайнов, автомобильной и авиационной техники.
• Изготовление лекарственных средств.
Этиленгликоль применяется для получения многих ценных химических продуктов, которые используются в составах лекарственных средств и медицинских препаратов.
Стоит отметить, что токсичность данного вещества несущественна, и при кратковременном вдыхании его паров нет высокой опасности для здоровья. Однако высокая концентрация паров может вызвать слабость, раздражение слизистой глаз и дыхательных путей, поэтому при работе с веществом нужно проявлять осторожность и аккуратность.
Этиленгликоль
| Этиленгликоль | |||
|---|---|---|---|
| |||
| Систематическое наименование | этандиол-1,2 | ||
| Традиционные названия | гликоль, этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол | ||
| Хим. формула | C2H6O2 | ||
| Рац. формула | C2H4(OH)2 | ||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 62,068 г/моль | ||
| Плотность | 1,113 г/см³ | ||
| Температура | |||
| • плавления | −12,9 °C | ||
| • кипения | 197,3 °C | ||
| • вспышки | 111 °C | ||
| Пределы взрываемости | 3,2 ± 0,1 об.% | ||
| Давление пара | 0,06 ± 0,01 мм рт.ст. | ||
| Константа диссоциации кислоты pKa | 15,1 ± 0,1 | ||
| Показатель преломления | 1,4318 | ||
| ГОСТ | ГОСТ 19710-83 | ||
| Рег. номер CAS | 107-21-1 | ||
| PubChem | 174 | ||
| Рег. номер EINECS | 203-473-3 | ||
| SMILES | |||
| RTECS | KW2975000 | ||
| ChEBI | 30742 | ||
| ChemSpider | 13835235 | ||
| Предельная концентрация | 5 мг/м 3 | ||
| ЛД50 | 4700 мг/кг (крысы, перорально) | ||
| Токсичность | ядовит | ||
| Пиктограммы СГС |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
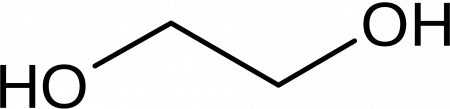
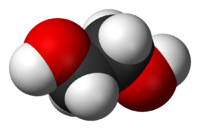
Этиленгликоль (гликоль, 1,2-диоксиэтан, этандиол-1,2), HO—CH2—CH2—OH — кислородсодержащее органическое соединение, двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу.
Содержание
История открытий и производства
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» (англ.). К 1929 году этиленгликоль использовался практически всеми производителями динамита.
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190‒200 °С или при 1 атм и 50‒100 °С в присутствии 0,1‒0,5% серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
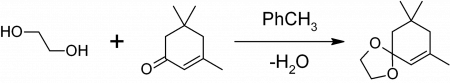
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана или комплекса диметилсульфат-ДМФА 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
Этиленгликоль также применяется:
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Меры безопасности
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Этиленгликоль умеренно токсичен. По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела). Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол.
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой.
Формула этиленгликоля: как это вещество изменило нашу жизнь
Утро многих людей начинается похоже: выпиваем бутылку воды, заводим машину, чтобы поехать на работу, сидим в офисе, задумчиво глядя на стену с календарем, где уже отмечены даты отпуска. Но мало кто знает, что ничего этого бы не было, если бы не этиленгликоль (моноэтиленгликоль, или МЭГ), благодаря которому появилась пластиковая тара, антифриз и даже краска для стены. Рассказываем о незаменимых свойствах этиленгликоля и сферах его применения.

Многопрофильное вещество
Этиленгликоль – один из наиболее популярных видов нефтехимического сырья и компонент для многих промышленных продуктов. Это двухатомный спирт, который в очищенном виде выглядит, как бесцветная жидкость без запаха. Вещество достаточно токсично и отнесено к третьему классу опасности по международной классификации.
Но полвека с момента его открытия этиленгликоль фактически «пролежал на полке».
От нефти к «зеленым» технологиям. История создания этиленгликоля
История производства этиленгликоля началась в середине 19 века. Впервые это вещество в 1859 году синтезировал французский химик Шарль Адольф Вюрц. Вначале — из диацетата этиленгликоля, а в год спустя – гидратацией этиленоксида. Но потом еще полвека этиленгликоль не получал широкого распространения.
Наиболее масштабное производство этиленгликоля начала компания Carbide в 1937 году, используя технологию газофазного окисления этилена и этиленоксида. Монополия на такой способ производства сохранялась до 1953 года.
За счет низкой себестоимости и более конкурентного набора свойств к середине 20 века этиленгликоль полностью вытеснил глицерин из промышленного производства динамита, а также из состава охлаждающей жидкости, спрос на которую стремительно рос с развитием машиностроения.
Сейчас этиленгликоль производится в основном путем гидратации (присоединение молекул воды) оксида этилена. В одном из вариантов это происходит при давлении в 10 атмосфер и температуре около 180 градусов в присутствии кислотного катализатора. На выходе получается жидкость, содержащая до 90% чистого этиленгликоля.
Побочные продукты – диэтиленгликоль и триэтиленгликоль – также используются в промышленности, например, в дезинфекторах, системах охлаждения воздуха и при производстве пластификаторов.
Другой вариант синтеза МЭГ – гидратация этилена с участием серной или ортофосфорной кислот при давлении в 1 атмосферу и температуре 50-100 градусов.
На фоне прогнозируемого сокращения добычи углеводородов повышается интерес к экологичным методам выпуска этиленгликоля. Американская компания IPCI нашла новый способ производства многоатомных спиртов из сахаров любого происхождения и уже запустила по этой технологии завод на 10 тыс. тонн продукции в год в Китае.
Запустить заводы по производству этиленгликоля из растительного сырья в середине 2020-ых годов планируется и в Европе.
После отвязки цены на МЭГ от нефтяных котировок, рынок станет прозрачнее, а сферы применения этиленгликоля могут расшириться за счет разработки новых продуктов.
Пластик, антифриз и краски. Где используется этиленгликоль?
Основная часть МЭГ идет на производство полиэтилентерефталата (ПЭТ). Это одна из разновидностей полимеров, продукт поликонденсации этиленгликоля с терефталевой кислотой. ПЭТ применяется для получения синтетических волокон, пленок и пластиковых бутылок.
Именно со сферой ПЭТ связаны позитивные перспективы роста объемов потребления этиленгликоля. Популярность полиэтилентерефталата гарантируют разнообразные потребительские качества: продукция из ПЭТ выдерживает температуры от — 40 градусов до + 70 градусов, ударопрочна и практически не впитывает запахи.
Эксперты уверены, что потребление ПЭТ, а, следовательно, и этиленгликоля будет расти в ближайшие годы, несмотря на запланированное ужесточение в ЕС и некоторых других странах норм использования продукции из полиэтилентерефталата. Тем более что сроки внедрения новых требований существенно сдвинулись вправо из-за ситуации с коронавирусом, которая повысила спрос на одноразовую пластиковую посуду и тару.
Алексей Костин, генеральный директор Центра отраслевых исследований
Хотя ПЭТ незаменим во многих областях, этот продукт из первичного сырья будет замещать его рециркулированная версия из вторсырья. Степень влияния будет зависеть от регулирования в странах потребления ПЭТ, которые могут ввести обязательный норматив на r-PET в волокне или взять на себя какие-либо обязательства в области текстильного бизнеса. Например, установить пошлину на ввоз пряжи, тканей или даже одежды в зависимости от содержания в этих продуктах r-PET.
Еще один крупный сектор применения этиленгликоля в качестве сырья – изготовление охлаждающих жидкостей. Добавленный в воду МЭГ мешает ей замерзнуть в ледяной монолит, что является угрозой для двигателя, и помогает сформировать отдельные ледяные кристаллы, которые не препятствуют запуску мотора.
Благодаря низкой температуре замерзания в смеси с водой, этиленгликоль используются в противообледенительных жидкостях для авиации, которыми самолеты покрывают перед взлетом.
В качестве компонента антифриза МЭГ впервые стали использоваться еще в 1926 году, а более масштабное применение началось незадолго до Второй мировой войны в основном в военной технике.
На тот момент мало кто обращал внимание на главную проблему охлаждающих жидкостей с использованием этиленгликолей – коррозию металла двигателя от соприкосновения с ним.
Во многом это объяснялось тем, что детали были чугунные, а радиаторы – латунные. Но с внедрением автопроизводителями в 1960-ых годах более легких сплавов, в частности, алюминия, пришлось искать ответ на вопрос агрессивного воздействия МЭГ на детали автомобилей. Проблему решили ингибиторы коррозии, которые замедляли окисление этиленгликоля, оберегая двигатель.
Этиленгликоль широко используется при производстве красок как растворитель. В текстильном секторе он применяется для формирования тканей и скручивания нитей, а также как один из главных составляющих красителей для кожи.
Многообещающая динамика
Объемы производства этиленгликоля, которые уже сейчас в мире приближаются к 30 млн. тонн, постоянно увеличиваются.
В Китае к 2020 году их выпуск за последние пять лет вырос на треть, превысив 10 млн. тонн. Еще около 6 млн. тонн производит второй по величине экспортер – Саудовская Аравия.
По прогнозам экспертов, как минимум до 2025 года динамика роста спроса на МЭГ составит 5-6% в год. Россия пока не занимает существенной доли в мировом производстве. В 2020 году внутренние производители (СИБУР, Казаньоргсинтез и Нижнекамскнефтехим) выпустили менее 400 тыс. тонн этиленгликолей, что связано с низкими темпами увеличения спроса внутри страны и высокой конкуренцией на экспорте.
Благодаря возможности разностороннего применения, этиленгликоль стал незаменимым компонентом для многих промышленных отраслей. При этом экономическая эффективность его применения и перспективы дальнейшего развития в качестве экологичного сырья гарантируют МЭГ стабильный спрос еще долгие годы.
Этиленгликоль
| Этиленгликоль | |
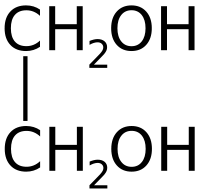 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | этан диол-1,2 |
| Традиционные названия | этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол |
| Химическая формула | C2H4(OH)2 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Молярная масса | 62,068 г/моль |
| Термические свойства | |
| Температура плавления | −12,9 °C |
| Температура кипения | 197,3 °C |
| Классификация | |
| Рег. номер CAS | 107-21-1 |
| SMILES | OCCO |
| Безопасность | |
| Токсичность | токсичен |
Содержание
История открытий и производства
Этиленгликоль впервые был получен в 1859 французским химиком Вюрцом из диацетата этиленгликоля омылением гидроксидом калия и в 1860 гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Южного Чарлстона (западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» К 1929 году этиленгликоль использовался практически всеми производителями динамита. В 1937 кампания Carbide начало первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190—200°С или при 1 атм и 50—100°С в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются этиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
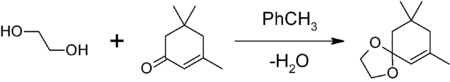
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана [2] или комплекса диметилсульфат-ДМФА [3] 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
Этиленгликоль также применяется:
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Меры безопасности
Понятие и свойства
Этиленгликоль (МЭГ, моноэтиленгликоль) – химический реактив, который 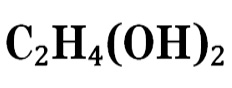
К списку свойств этиленгликоля можно отнести и свойства гликолей. Так, с такими химреактивами, как органические кислоты, образует сложные эфиры, щелочи и щелочные металлы – гликоляты. При окислении этиленгликоля возможно образование смесей гликолевого альдегида и щавелевой кислоты купить которую по доступной цене предлагает наш интернет магазин, а при окислении молекулярным кислородом – смесь муравьиной кислоты.
Данное химическое соединение выпускается двух марок: антифризный и волоконный, к последнему предъявляют очень серьезные требования к количественному содержанию примесей альдегидов.
Открытие этиленгликоля
Данный химический реактив впервые был получен химиком Вюрцом во Франции в середине XIX века. До начала Первой мировой войны он не имел широкого применения, позже в Германии во время военных действий его стали использовать как заменитель глицерина в процессе производства взрывчатых веществ. К 1930 году этиленгликоль стал активно использоваться многими известными производителями динамита.
Токсические и ядовитые действия этиленгликоля зависят от ряда факторов, среди которых следует выделить:
— количество;
— индивидуальную чувствительность организма;
— состояние нервной системы;
— степень наполнения желудка и другие.
Дозы, которые могут привести в организме к необратимым изменениям и вызвать смертельное отравление этиленгликолем, могут варьироваться от 100 до 700 мл. По данным ряда исследований для человека летальной дозой является 50-200 мл. При поражении этиленгликолем смертность очень высока и составляет примерно 60 % всех случаев отравления.
Применение
Области применения данного химического реактива весьма разнообразны. 
— в машиностроительной (в производстве тосола, тормозных жидкостях, антифриза);
— в текстильной (как растворитель красящих веществ);
— энергетической (как теплоноситель в отопительных системах);
— в химической (при производстве полимеров: целлофана, полиуретана, при синтезе высокотемпературных растворителей, для предотвращения процесса образования гидрата метана);
— электротехнической (в качестве вещества, защищающее объекты от замораживания, при производстве конденсаторов, как составляющий компонент в системе жидкостного охлаждения компьютеров);
— в военной (как исходное сырьё при производстве нитрогликоля – взрывоопасного вещества).
Меры безопасности, хранение
Хранить этиленгликоль необходимо в лабораторной посуде из стали, стойкой к коррозии, в закрытых неотапливаемых помещениях.
В связи с тем, что этиленгликоль ядовит, важно не допускать его попадания внутрь организма, так как это токсичное вещество влечет за собой необратимые изменения в работе внутренних органов и может привести к летальному исходу.
Этиленгликоль в соответствии с классификацией химвеществ причислен к третьему классу опасности: он взрывоопасен и горюч, поэтому при работе с ним следует придерживаться особых мер безопасности, используя защитные средства для органов дыхания – противогазы, респираторы, маски; для органов зрения – защитные очки; для кожных покровов – перчатки нитроловые, фартук, бахилы и другие резинотехнические изделия. Лабораторное оборудование и приборы должны быть использованы согласно требованиям инструкции по безопасности при работе с ядовитыми веществами.
Необходимо знать, что в случае отравления МЭГ первая доврачебная помощь должна быть проведена в срочном порядке. Это, прежде всего, промывание желудка плюс слабительные, вызывание рвоты, врачебная – назначение антидота.
Качественные химические реактивы по доступной цене
К выбору приобретения химических реактивов, а также любого другого лабораторного оборудования в Москве следует отнестись с особой ответственностью, так как от качества данной продукции зависят и результаты исследовательских процессов. Как кальций хлористый купить или молочную кислоту купить, так и этиленгликоль стоит в специализированных магазинах, где соблюдаются требования по хранению и отпуску товаров. Одним из таких является магазин химических реактивов Москва розница и оптовая торговля Prime Chemicals Group. Мы специализируемся только по продаже только сертифицированного лабораторного оборудования и химвеществ.
«ПраймКемикалсГрупп» – надежный помощник в оснащении Вашей лаборатории!