Фекальная микробиота что это
Опыт применения фекальной трансплантации микробиоты у пациентов с COVID-19
Фекальная трансплантация микробиоты нашла широкое применение в лечении тяжелого течения инфекции, вызванной C.difficile. И хотя механизм действия данного метода изучен недостаточно, фекальная трансплантация обладает большим потенциалом в терапии заболеваний, ассоциированных с нарушением состава кишечной микробиоты.
В последнее время большое внимание уделяется перспективам коррекции состава кишечной микробиоты для профилактики и лечения новой коронавирусной инфекции COVID-19. Приводятся данные об изменении состава микробиоты и об эффективности отдельных пробиотиков у таких больных. В июле 2021 года в журнале Gut были опубликованы 2 необычных клинических наблюдения исследователей из Медицинского Университета Варшавы (Польша), в которых описываются особенности течения коронавирусной инфекции COVID-19 у пациентов, перенесших фекальную трансплантацию микробиоты.
Таким образом, авторы продемонстрировали, что у пациентов, перенесших фекальную трансплантацию микробиоты, отмечалось более легкое течение COVID-19. При этом оба пациента имели факторы риска тяжелого течения заболевания: первый пациент пожилого возраста имел сопутствующие хронические заболевания, а второму пациенту проводилась иммуносупрессивная терапия. Оба наблюдения оставляют целый ряд вопросов, однако это первый представленный опыт применения фекальной трансплантации микробиоты у пациентов с COVID-19, который может лечь в основу надлежащих клинических исследований.
Источник : Biliński J, Winter K, Jasiński M, et al. Rapid resolution of COVID-19 after faecal microbiota transplantation. Gut; 06 July 2021. doi: 10.1136/gutjnl-2021-325010
Роль микробиоты кишечника в поддержании здоровья
Микрофлора представляет собой метаболически активную и сложную экосистему, состоящую из сотен тысяч микроорганизмов — бактерий, вирусов и некоторых эукариот. Подобно невидимому чулку, биоплёнка покрывает все слизистые нашего организма и кожу. Микробиота объединяет более чем 10 14 (сто биллионов) клеток микроорганизмов, что в 10 раз превышает число клеток самого организма. Микробиота находится в содружественных отношениях с организмом человека: организм хозяина предоставляет среду обитания и питательные вещества, микроорганизмы защищают организм от патогенных возбудителей, способствуют поддержанию нормальных иммунологических, метаболических и моторных функций. Выделяют несколько важных биотопов, которые отличаются плотностью распределения микроорганизмов и составом: кожные покровы, слизистые оболочки ЖКТ, дыхательных путей, урогенитального тракта и проч. Самой многочисленной считается микробиота кишечника, на её долю приходится 60% микроорганизмов, колонизирующих организм человека.
Микрофлора кишечника состоит из группы микроорганизмов, представленных более чем 1000 видами, 99% из которых приходится на 30–40 главных видов. В научных кругах кишечную микрофлору называют также дополнительным органом.
Состояние микробиоты кишечника определяет качество и продолжительность жизни. У каждого человека есть свой индивидуальный характер распределения и состава микробиоты. Частично он определяется генотипом хозяина и первоначальной колонизацией, которая происходит сразу после рождения. Различные факторы, такие как тип родов, кормление грудью, образ жизни, диетарные предпочтения, гигиенические условия и условия окружающей среды, использование антибиотиков и вакцинация, могут определять окончательные изменения в структуре микробиоты.
При изменении состава или функции микробиоты развивается дисбиоз. Дисбиотические состояния изменяют моторику кишечника и его проницаемость, а также искажают иммунный ответ, тем самым создавая предпосылки для развития провоспалительного состояния. Такие изменения, особенно в отношении иммунных и метаболических функций хозяина, могут вызывать или способствовать возникновению ряда заболеваний, например, сахарного диабета, ожирения, неврологических и аутоиммунных заболеваний. Недавние исследования показали, что микробиота участвует в этиопатогенезе многих гастроэнтерологических заболеваний, таких как синдром раздраженного кишечника, воспалительные заболевания кишечника, целиакия, неалкогольный стеатогепатит и новообразования желудочно-кишечного тракта.
Кишечная микрофлора и иммунитет
Кишечная микробиота имеет решающее значение для развития лимфоидных тканей, а также для поддержания и регуляции кишечного иммунитета.
В кишечнике происходит сенсибилизация иммуноцитов, которые затем заселяют другие слизистые оболочки и циркулируют между различными органами. Этот механизм обеспечивает формирование клонов лимфоцитов и образование специфических антител в участках слизистой оболочки, отдалённых от очага первичной сенсибилизации.
Иммунокомпетентные ткани пищеварительного тракта объединены в лимфоидную ткань. Лимфоидная ткань представлена лимфоцитами, расположенными между эпителиальными клетками кишечника, лимфоцитами собственного слоя, пейеровыми бляшками (скопления лимфоидной ткани в тонкой кишке) и лимфоидными фолликулами.
Попавшие в просвет кишечника или на слизистые оболочки антигены распознаются иммуноглобулинами памяти (IgG), после чего информация передаётся в иммунокомпетентные клетки слизистой оболочки, где из сенсибилизированных лимфоцитов клонируются плазматические клетки, ответственные за синтез IgА и IgМ. В результате защитной деятельности этих иммуноглобулинов включаются механизмы иммунореактивности или иммунотолерантности. Благодаря индукции иммунологической толерантности в кишечнике не возникают нежелательные воспалительные реакции против кишечной микробиоты и пищевых белков.
Кишечная микробиота и обмен веществ
Кишечная микробиота вносит непосредственный вклад в метаболизм питательных веществ и витаминов, необходимых для жизнедеятельности организма хозяина, при этом извлекая энергию из пищи. Эта энергия образуется путём реакции сбраживания не усваиваемых углеводов (клетчатки), в результате реакции образуются короткоцепочечные жирные кислоты, водород и углекислый газ.
Короткоцепочные жирные кислоты обеспечивают работу колоноцитов.
Короткоцепочные жирные кислоты считаются тонкими регуляторами иммунитета, энергетического обмена и метаболизма жировой ткани. Например, короткоцепочные жирные кислоты участвуют во взаимодействии бактерий и иммунитета, подавляя сигналы, которые могут привести к развитию аутоиммунных реакций. Пропионовая и масляная жирная кислота положительно влияют на метаболизм глюкозы. Наконец, короткоцепочные жирные кислоты обеспечивают подкисление просвета толстой кишки, предотвращая рост бактериальных патогенов.
Кишечная микробиота принимает непосредственное участие в метаболизме желчных кислот, источником которых является холестерин. В печени из холестерина синтезируются первичные желчные кислоты — холевая и хенодезоксихолевая, которые поступают в кишечник. Бактероиды и лактобациллы далее превращают первичные желчные кислоты во вторичные желчные кислоты — дезоксихолевую и литохолевую. Изменение нормального баланса кишечных бактерий приводит к неадекватному синтезу желчных кислот.
Микробиота и нервная система
Ещё более удивительные данные о взаимосвязи кишечной микробиоты и нервной системы. Микробиота кишечника тесно общается с центральной нервной системой. Микробиота кишечника производит такие нейроактивные молекулы, как ацетилхолин и серотонин, дофамин, которые являются главными медиаторами сигналов в ЦНС, а также регулируют работу мозга через активацию иммунных сигнальных путей. Дополнительно, блуждающий нерв активно участвует в двунаправленных взаимодействиях между кишечной микробиотой и мозгом для поддержания гомеостаза как в головном мозге, так и в кишечнике.
Недавние исследования показали, что микробиом влияет на свойства и функцию микроглии. Микроглия защищает мозг от различных патологических состояний через активацию иммунного ответа, фагоцитоза и продукцию цитокинов. Кроме того, микроглия ответственна за формирование нейронных цепей, которые участвуют в развитии мозга. Различные дисбиотические состояния, в том числе вызванные приёмом антибиотиков приводят к угнетению созревания клеток микроглии. Незрелая микроглия приводит к нарушению иммунной активации.
Астроциты — самая многочисленная клеточная популяция в ЦНС, и они почти в пять раз превосходят численность нейронов. Подобно микроглии, астроциты выполняют несколько важных функций по поддержанию целостности ЦНС, включая контроль кровообращения в головном мозге, поддержание стабильности гематоэнцефалического барьера. Астроциты регулируют баланса ионов и оказывают влияние на передачу сигналов между нейронами. Чрезмерная активация астроцитов является пусковым механизмом в развитии дисфункции ЦНС и неврологических расстройств. Чрезмерная активация происходит под действием метаболитов микрофлоры.
Целостность гематоэнцефалического барьера регулируется также метаболитами микробиоты, которые опосредуют передачу большего количества микробных сигналов между осью кишечник-мозг.
Дисбиоз микробных видов в кишечнике может вызывать атипичные иммунные сигналы, дисбаланс в гомеостазе организме-хозяина и привести к прогрессированию заболеваний ЦНС. Например, рассматривается роль микробиоты в патогенезе рассеянного склероза-заболевания, характеризующимся демиелинизацией аксонов нервных клеток. При болезни Паркинсона, которая проявляется моторными симптомами, включая тремор, мышечную ригидность, медлительность движений и аномалию походки наблюдается накопление α-синуклеина в нейронах. Избыточное отложение α-синуклеина в нервной системе инициируется кишечной микрофлорой до того, как возникают симптомы поражения ЦНС, что связано с некоторыми специфическими пищеварительными симптомами (запоры и нарушение двигательной функции толстой кишки). Бактериальный состав кишечника влияет на болезнь Паркинсона: тяжесть симптомов, в том числе постуральная нестабильность и нарушение походки, связана с изменениями численности некоторых видов Enterobacteriaceae, уменьшение количества Lachnospiraceae приводит к более серьёзному ухудшению моторных и немоторных симптомов у пациентов с болезнью Паркинсона. Болезнь Альцгеймера — ещё одно нейродегенеративное заболевание, которое приводит к серьёзным нарушениям функции ЦНС — обучению, памяти и поведенческим реакциям. Болезнь Альцгеймера характеризуется отложением пептида амилоид-β (Aβ) снаружи и вокруг нейронов, вместе с накоплением белка тау внутри корковых нейронов. Перегрузка амилоидом и агрегация тау нарушают синаптическую передачу. Изменение состава и разнообразия микробиоты вносит определённый вклад в патогенез болезни Альцгеймера. Активированная микроглия способствует развитию заболевания, увеличивая отложение амилоида.
Ожирение и состав микробиоты
При ожирении и сахарном диабете наблюдаются изменения в составе микробиоты кишечника, в частности, снижение популяционного уровня сахаролитических бактероидов, влияющих на интенсивность метаболических процессов, а также увеличение доли бактерий класса Firmicutes (Esherichia coli, Clostridium coccoides, Clostridium leptum). Снижение содержания сахаролитических бактерий уменьшает выработку коротко-цепочных жирных кислот, обеспечивающих трофику и деление эпителия кишечника, его созревание, оказывающих антимикробное действие и регуляторное действие в отношении ионов и липидов.
Дополнительно при ожирении отмечается хроническое системное воспаление, сопровождающееся секрецией провоспалительных цитокинов (интерлейкины — ИЛ, С-реактивный белок, α-фактор некроза опухоли — α-ФНО и др.) в висцеральной жировой ткани. Нарушения в составе кишечной микрофлоры приводят к усилению эффекта системного воспаления за счёт увеличения концентрации бактериальных липополисахаридов, стимулирующих выработку провоспалительных компонентов.
Диагностика состояния кишечной микробиоты
Существует два метода определения микробиоты — стандартный анализ на дисбактериоз и оценка состава микробиоты методом масс-спектрометрии по крови (ГХ-МС). В основе методики масс-спектрометрии лежит определение присутствия микроорганизмов по их клеточным компонентам (высшие жирные кислоты, альдегиды, спирты и стерины). Методика разработана профессором Осиповым Г.А. Метод ГХ-МС позволяет одновременно измерять более сотни микробных маркёров непосредственно в образце, позволяющих сделать заключение о некультивируемых и труднокультивируемых патологических возбудителях. Метод универсален также в отношении грибов и вирусов.
Фекальная микробиота что это
ФГБУ «Поликлиника №1» Управления делами Президента РФ
Межрегиональное общество специалистов доказательной медицины, Оренбург, Москва
Трансплантация фекальной микробиоты или пробиотики?
Журнал: Доказательная гастроэнтерология. 2017;6(3): 19-25
Никонов Е. Л., Аксенов В. А. Трансплантация фекальной микробиоты или пробиотики?. Доказательная гастроэнтерология. 2017;6(3):19-25.
Nikonov E L, Aksenov V A. Transplantation of fecal microbiota or probiotics?. Russian Journal of Evidence-Based Gastroenterology. 2017;6(3):19-25.
https://doi.org/10.17116/dokgastro20176319-25
ФГБУ «Поликлиника №1» Управления делами Президента РФ
В последнее десятилетие благодаря постоянно развивающимся молекулярно-генетическим методам оценки статуса микробиома появляется все больше доказательств значения бактерий-комменсалов для здоровья человека и роли кишечной микробиоты в патогенезе заболеваний желудочно-кишечного тракта. Большинство опубликованных к настоящему времени сообщений о применении трансплантации фекальной микробиоты (ТФМ) являются описаниями серий случаев и относятся к лечению инфекции Clostridium difficile (клостридиальная инфекция), воспалительных заболеваний кишечника и синдрома раздраженной кишки. Пробиотики имеют значительно более основательную доказательную базу, чем ТФМ и нашли более широкое применение в клинической практике для профилактики и лечения ряда заболеваний ЖКТ, преимущественно ассоциированных с инфекцией, а также патологических процессов, в патогенезе которых важная роль принадлежит иммунологическим расстройствам.
ФГБУ «Поликлиника №1» Управления делами Президента РФ
Межрегиональное общество специалистов доказательной медицины, Оренбург, Москва
В последнее десятилетие благодаря постоянно развивающимся молекулярно-генетическим методам оценки статуса микробиома появляется все больше доказательств значения бактерий-комменсалов для здоровья человека и роли кишечной микробиоты в патогенезе заболеваний желудочно-кишечного тракта.
Микробиота кишечника человека представляет собой сбалансированную и саморегулирующуюся микроэкологическую систему, в которой симбионтная микрофлора находится в динамическом равновесии, формирует микробные ассоциации и относится к важнейшим факторам, влияющим на здоровье человека [1].
К понятию «микробиота кишечника» относят всю совокупность бактерий, грибов, вирусов, одноклеточных и других микроорганизмов, населяющих все отделы кишечника, преимущественно толстой кишки [2].
Сложные и взаимовыгодные отношения человека с колонизирующими его желудочно-кишечный тракт (ЖКТ) микроорганизмами формировались в течение тысячелетий в процессе их совместной эволюции [3]. При этом состав микробиоты каждого человека уникален и рассматривается как генетически обусловленный признак [4].
Функции микробиоты пищеварительного тракта человека достаточно полно изучены (а их описание широко представлено в научно-медицинской литературе) — главным образом это защита кишечника от колонизации оппортунистическими и патогенными микроорганизмами, обеспечение трофики кишечного эпителия, участие в регуляции энергетического гомеостаза и обмене веществ, обеспечение синтеза витаминов, метаболизма пищевых компонентов, холестерина, желчных кислот, регуляция моторики кишечника и содействие формированию иммунитета [5—10].
Дисбиоз и методы коррекции кишечной микробиоты
Баланс кишечной микробиоты является динамичным процессом, постоянно подверженным факторам, которые изменяют количество, структуру и разнообразие его микроорганизмов. Множество исследований продемонстрировали, что к таким факторам относятся генетика, диета, патогенные микроорганизмы, гигиена, радиация, старение, стресс, алкоголь, лекарственные препараты, особенно антибиотики, и другие [11].
Микробиота кишечника относительно устойчива к изменениям, и способность здорового организма к саморегуляции обеспечивает быстрое восстановление после ее кратковременных нарушений. Однако более глубокие изменения при одновременном воздействии нескольких факторов могут продолжаться длительно и приводить к дисбиозу — нарушению качественного и/или количественного состава микробиоты кишечника с развитием микробиологического дисбаланса между ее представителями [12].
Результаты современных исследований показали наличие дисбиоза у пациентов с некоторыми патологическими состояниями, такими как воспалительные заболевания кишечника (ВЗК), синдром раздраженного кишечника (СРК), желудочно-кишечные инфекции, антибиотик-ассоциированная диарея, псевдомембранозный колит, целиакия, колоректальный рак, сахарный диабет 1-го и 2-го типов, ожирение, бронхиальная астма, ревматоидный артрит и некоторые неврологические заболевания. Однако пока неизвестно, вызывает ли дисбиоз все или часть этих заболеваний, или же нарушения кишечной микробиоты является их следствием [13].
В то же время, независимо от причинно-следственных отношений, восстановление состава и функциональной активности кишечной микробиоты является важной клинической задачей в лечении этих заболеваний. Средствами коррекции кишечной микробиоты при дисбиозе являются:
2) пробиотики — живые микроорганизмы, использование которых в необходимом количестве оказывает лечебно-профилактическое воздействие на организм человека [14];
3) пребиотики — специальные ингредиенты немикробного состава, которые избирательно стимулируют рост и развитие нормальной микрофлоры кишечника (инулин, лактулоза);
4) синбиотики — продукты, представляющие собой комбинацию пробиотиков и пребиотиков, которые оказывают взаимно усиливающее воздействие на функции желудочно-кишечного тракта и обмен веществ в организме человека [33];
5) трансплантация фекальной микробиоты (ТФМ) — введение фекальной суспензии, полученной от здорового человека, в ЖКТ другого человека с целью восстановления стабильной кишечной микробиоты [15].
В данном обзоре освещаются накопленные на сегодня научные доказательства, обосновывающие применение в гастроэнтерологии пребиотиков и ТФМ.
Трансплантация фекальной микробиоты
Применение фекалий в лечебных целях имеет давнюю историю. По сообщениям китайских исследователей [16], применение фекалий для лечения пищевых отравлений и тяжелой диареи практиковалось известным китайским врачом Ге Хонгом еще более 1500 лет назад. Позднее китайский врач и фармаколог XVI века Ли Шичжэнь применял различные препараты из фекалий для лечения диареи, запоров, болей в животе и рвоты. В XVII веке о применении фекальной трансплантации для лечения животных сообщал итальянский анатомом F. Acquapendente [17]. Потребление верблюжьих фекалий для лечения дизентерии было описано как немецкими солдатами во время Первой мировой войны, так и бедуинами [18].
В научной медицине первое сообщение о ТФМ появилось только в 1958 г., когда американский хирург B. Eiseman с соавт. описали успешное применение фекальных клизм в лечении четырех пациентов с тяжелым псевдомембранозным колитом [19]. Логическим обоснованием применения ТФМ было то, что большинство случаев псевдомембранозного колита развивались после лечения пероральными антибиотиками широкого спектра действия, что могло привести к избыточному росту в кишечнике устойчивых к антибиотикам патогенных бактерий.
К концу ХХ века были опубликованы исследования о применении ТФМ при целом ряде патологических состояний [20]. Большинство опубликованных к настоящему времени сообщений о применении ТФМ являются описаниями серий случаев и относятся к лечению инфекции Clostridium difficile (клостридиальная инфекция), ВЗК и СРК.
Инфекция Clostridium difficile
Инфекция C. difficile является наиболее распространенной инфекцией, связанной с оказанием медицинской помощи, т.к. обычно возникает на фоне применения антибиотиков из-за подавления ими кишечной микробиоты, приводя к развитию псевдомембранозного колита. В последние годы клостридиальная инфекция становится все более распространенной и все чаще приводит к серьезным последствиям. В США в 2011 г. зарегистрировано почти 500 тыс. случаев клостридиальной инфекции и примерно 29 тыс. связанных с ними случаев смерти. С появлением в начале 2000-х годов гипервирулентных штаммов клостридиальной инфекции она становится менее восприимчивой к стандартной терапии. Особенно опасна многократно рецидивирующая клостридиальная инфекция, развивающаяся примерно у четверти пациентов [21]. В этих обстоятельствах ТФМ все чаще используется для лечения многократно рецидивирующей клостридиальной инфекции.
В 2011 г. был опубликован систематический обзор E. Gough и соавт. [22], который включал информацию о 317 пациентах, получивших ТФМ по поводу рецидивирующей клостридиальной инфекции. У 92% пациентов произошло полное выздоровление (у 89% после однократной ТФМ и у 5% после повторной), а у 4% после ТФМ развился рецидив. В течение периода наблюдения зарегистрировано 13 (4%) летальных случаев, 3 (1%) из которых произошли по причине клостридиальной инфекции. Ни одно из исследований, включенных в этот систематический обзор, не являлось рандомизированным клиническим испытанием (РКИ).
Результаты первого РКИ эффективности ТФМ для лечения рецидивирующей клостридиальной инфекции были опубликованы E. van Nood и соавт. в 2013 г. [23]. В него включались пациенты как минимум с одним рецидивом клостридиальной инфекции, у которых сравнивалась эффективность дуоденальных инфузий донорских фекалий после лечения ванкомицином и промывания кишечника с лечением только ванкомицином или ванкомицином с промыванием кишечника. РКИ было методологически несовершенным, процедура «ослепления» не проводилась.
Излечение после ТФМ было достигнуто у 81% пациентов по сравнению с 31% (p
Современные взгляды на роль кишечной микробиоты в формировании патологии кишечника
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Связь между кишечной микробиотой и состоянием здоровья человека является общепризнанной. Появление молекулярных и генетических методов диагностики позволило сделать поистине революционные открытия в области изучения микробиома пищеварительного тракта. В обзоре описаны особенности колонизации пищеварительного тракта в зависимости от вида родоразрешения, особенностей вскармливания. Показана роль диеты в формировании количественного и качественного состава микробиоты кишечника. Представлены актуальные сведения о роли микробиоты в патогенезе функциональных и органических заболеваний кишечника (синдрома раздраженного кишечника, воспалительных заболеваний кишечника, колоректального рака). Особое внимание уделено влиянию кишечной микробиоты на риск развития и характер течения новой коронавирусной инфекции COVID-19, находящейся сегодня под пристальным вниманием исследователей всего мира. Отмечено, что дисбиотические изменения с увеличением относительной численности условно-патогенных микроорганизмов и патобионтов на фоне сокращения доли полезных представителей комменсальной микробиоты сохранялись даже после полного выздоровления пациентов. Также в статье представлены современные способы коррекции состава кишечной микробиоты с акцентом на применение пребиотиков.
Ключевые слова: кишечная микробиота, микробиом, синдром раздраженного кишечника, болезнь Крона, язвенный колит, колоректальный рак, COVID-19, пребиотик, пищевые волокна, ОптиФайбер.
Для цитирования: Гаус О.В., Беляков Д.Г. Современные взгляды на роль кишечной микробиоты в формировании патологии кишечника. РМЖ. 2021;4:10-16.
Modern views on the gut microbiota role in intestinal pathology
O.V. Gaus, D.G. Belyakov
Omsk State Medical University, Omsk
Association between the gut microbiota and human health is generally recognized. The emergence of molecular and genetic diagnostic methods has made it possible to make revolutionary discoveries in the field of studying the gastrointestinal tract microbiome. The article describes the characteristics of gastrointestinal tract colonization, depending on the type of delivery and feeding features. The article also shows the diet role in the formation of the quantitative and qualitative composition of the gut microbiota. Current information on the microbiota role in the pathogenesis of functional and organic intestinal diseases (irritable bowel syndrome, inflammatory bowel diseases, colorectal cancer) is presented. Special attention is paid to the gut microbiota impact on the risk of development and the nature of the COVID-19 course, which is currently under the close attention of researchers worldwide. It is noted that dysbiotic changes with an increase in the relative number of co nditionally pathogenic bacteria and pathobionts (during a decrease in the useful representatives proportion of the commensal microbiota) persisted even after complete recovery of patients. Modern methods concerning correcting the gut microbiota composition with an emphasis on the use of prebiotics are also presented.
Keywords: gut microbiota, microbiome, irritable bowel syndrome, Crohn’s disease, ulcerative colitis, colorectal cancer, COVID-19, prebiotic, dietary fibers, OptiFibre.
For citation: Gaus O.V., Belyakov D.G. Modern views on the gut microbiota role in intestinal pathology. RMJ. 2021;4:10–16.
Введение
Микробиота человека представляет собой совокупность бактерий, грибов, вирусов и простейших, населяющих наш организм. Самой многочисленной и, безусловно, одной из наиболее значимых является микробиота кишечника, которая содержит порядка 100 трлн микроорганизмов общей массой до 1,5–2 кг. Кишечная микробиота по праву признана самостоятельным метаболически активным органом, и ее функциональную роль сложно переоценить. Бактерии кишечника обеспечивают процессы ферментативного расщепления питательных веществ с образованием большого числа сигнальных молекул и метаболитов, участвуют в синтезе витаминов, модулируют серотонинергическую нейротрансмиссию в центральной нервной системе, регулируют развитие и дифференцировку иммунокомпетентных клеток кишечника. Кроме того, продукты бактериального переваривания стимулируют кишечную перистальтику и являются полноценным пластическим материалом, необходимым для поддержания гомеостаза в организме человека.
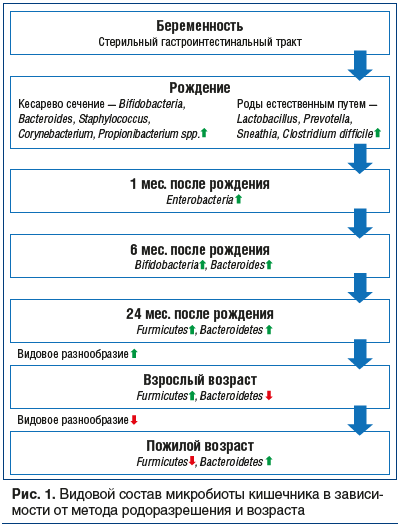
Колонизация пищеварительного тракта бактериями начинается сразу после родов. При естественном родоразрешении кишечник новорожденного заселяется типичными представителями микробиоты родовых путей — Lactobacillus и Prevotella, при кесаревом сечении — Streptococcus, Corynebacterium и Propionibacterium, находящимися на поверхности кожи матери. После первичной инокуляции кишечная микробиота младенца видоизменяется в зависимости от типа вскармливания и приобретает сходство с микробиотой взрослого человека лишь к 3 годам. В кишечнике детей, находящихся на грудном вскармливании, преобладают Bifidobacterium spp. и Lactobacillus spp., в то время как у детей на искусственном вскармливании — Enterobacter spp., Bacteroides spp., Clostridium spp., Streptococcus spp. Состав кишечной микробиоты человека продолжает претерпевать изменения и во взрослом возрасте (рис. 1). При этом важную роль играют внешние факторы, среди которых особое значение отводится диете, лекарственным препаратам, перенесенным инфекционным заболеваниям пищеварительного тракта, проведенным оперативным вмешательствам на органах брюшной полости [1].
В настоящее время связь между кишечной микробиотой и состоянием здоровья человека является общепризнанной. Появление молекулярных и генетических методов диагностики позволило сделать поистине революционные открытия в области изучения микробиома пищеварительного тракта. В данном обзоре представлены современные сведения о роли микробиоты в развитии функциональных и органических заболеваний кишечника.
Роль кишечной микробиоты в развитии функциональных заболеваний кишечника
Синдром раздраженного кишечника (СРК) — одно из наиболее распространенных функциональных расстройств пищеварительного тракта, которым страдает около 11% взрослого населения во всем мире. СРК характеризуется абдоминальной болью, связанной с изменениями формы кала и/или частоты стула. Точная этиология СРК остается неустановленной. В качестве пусковых рассматриваются многие факторы: наследственная предрасположенность, перенесенные инфекционные заболевания, пищевая непереносимость, прием антибактериальных препаратов, хронический стресс и травмирующие психосоциальные события [2]. Одним из ключевых звеньев патогенеза СРК является изменение кишечного микробиома под действием вышеуказанных факторов. Во многих исследованиях показано, что в развитии СРК большое значение имеют утрата микробного разнообразия и нарушение баланса между количеством комменсальных и патогенных бактерий [3]. Среди пациентов с СРК выявлено увеличение численности Proteobacteria, включая типы Veillonelli и Firmicutes, а также снижение активности отдельных штаммов Lactobacillus и Bifidobacteria [4].
Нарушение качественного и количественного состава бактерий ассоциировано с повышением проницаемости эпителиального кишечного барьера, что может приводить к активации иммунной системы и развитию воспаления в слизистой оболочке кишечника. Установлено, что выраженность воспалительного инфильтрата коррелирует со степенью висцеральной гиперчувствительности — основного механизма формирования абдоминальной боли при СРК [8]. В исследовании J. Tap et al. [6] показано влияние специфических изменений кишечной микробиоты на тяжесть течения СРК. Отмечена также взаимосвязь между интенсивностью абдоминальной боли и низким микробным разнообразием, а также изменением соотношения Methanobacteriales и Bacteroides в пользу последних [9].
Более того, у пациентов с СРК обнаружено сокращение количества Bifidobacterium порядка Clostridiales, Ruminococcaceae и Erysipelotrichaceae — основных продуцентов короткоцепочечных жирных кислот (КЦЖК), дефицит которых нарушает метаболизм колоноцитов, способствует повышению кишечной проницаемости и развитию воспаления [5].
Участие микробиоты в патогенезе СРК делает ее перспективной терапевтической мишенью. Эффективность пробиотиков при СРК продемонстрирована в целом ряде рандомизированных клинических исследований (РКИ), подтвердив роль микробиоты в патогенезе заболевания [10, 11]. В современных рекомендациях указывается, что пробиотики как класс лекарственных средств могут уменьшить выраженность клинических проявлений СРК, в первую очередь метеоризма [12, 13]. Целесообразным считается подбор конкретных штаммов с учетом варианта течения болезни. К примеру, штамм Bifidobacterium lactis DN-173 010 показал свою способность ускорять транзит по пищеварительному тракту и нормализовать частоту стула у пациентов с СРК-З. Пробиотический штамм Bifidobacterium infantis 35 624 способствует уменьшению абдоминальной боли, вздутия и регуляции кишечной моторики вне зависимости от типа ее нарушения [14].
Кишечная микробиота и органические заболевания кишечника
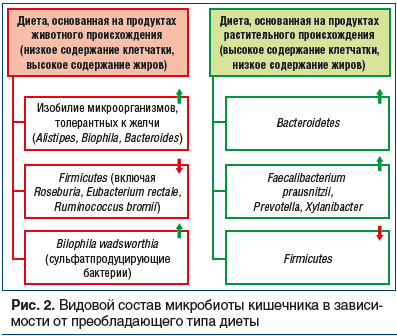
Под термином «воспалительные заболевания кишечника» (ВЗК), объединяющим такие нозологии, как болезнь Крона (БК) и язвенный колит (ЯК), понимают хронические прогрессирующие иммунологически опосредованные заболевания пищеварительного тракта. Несмотря на то, что ВЗК не входят в «топ» самых распространенных заболеваний гастроэнтерологического профиля, им нет равных по частоте развития осложнений, риску инвалидизации и повышенному уровню летальности. При БК в патологический процесс может вовлекаться любой отдел пищеварительного тракта — от полости рта до заднего прохода, тогда как для ЯК типичным является поражение толстой кишки [15, 16]. Заболеваемость ВЗК растет по всему миру. Наибольшее число больных с ВЗК зарегистрировано в Северной Америке (1,5 млн) и Европе (2,2 млн) [17]. Точные данные о распространенности ВЗК в России отсутствуют. В литературе имеются результаты отдельных эпидемиологических исследований, которые сложно экстраполировать на всю популяцию [16]. Этиология и патогенез ВЗК до сих пор являются предметом активного поиска у исследователей [18]. Учитывая, что распространенность ВЗК выше в развитых странах, было выдвинуто предположение, что определенную роль в развитии данных заболеваний может играть так называемая «западная» диета, богатая животными жирами и бедная растительными волокнами. Известно, что диета во многом определяет количественный и качественный состав микробиоты кишечника (рис. 2). Показано, что даже 4-дневное соблюдение диеты, основанной на продуктах животного происхождения, приводит к снижению численности Firmicutes на фоне увеличения количества бактерий родов Bacteroides, Proteobacteria и Acinetobacter [19]. Подобные изменения были обнаружены и среди больных ВЗК [20].
Связь между кишечной микробиотой и развитием ВЗК установлена еще до появления современных методов диагностики, когда было продемонстрировано, что введение гомогената фекальной микробиоты от пациентов с БК в кишечник экспериментальных особей приводит к развитию у них гранулематозного колита [21]. Технология секвенирования бактериальной РНК позволила выявить, что у лиц с БК снижено количество микроорганизмов видов Blautia faecis, Ruminococcus torques, Faecalibacterium prausnitzii, Clostridium lavalense и Roseburia inulinivorans. Интересными представляются данные о том, что риск рецидива БК после резекции кишечника повышается среди лиц с низким содержанием Faecalibacterium prausnitzii до операции [20]. На модели экспериментального колита было продемонстрировано, что F. prausnitzii проявляет свой противовоспалительный эффект за счет продукции бутирата, который поддерживает баланс между противовоспалительными (Th17) и иммунорегуляторными (Treg) Т-клетками посредством ингибирования гистондеацетилазы 1. Нарушение баланса между Th17 и Treg приводит к развитию аутоиммунного воспаления [22]. Известно также, что бутират отвечает за поддержание барьерной функции кишечного эпителия посредством регуляции экспрессии белка плотных контактов клаудина 2 [23]. Дисбиоз, приводящий к истощению бутиратпродуцирующих бактерий, значительно повышает биодоступность кислорода в толстой кишке, что приводит к гипероксигенации эпителия и значительному росту потенциально патогенных протеобактерий [24]. Кроме того, снижение синтеза масляной кислоты бактериями связано со значительным увеличением числа провоспалительных иммунных клеток в слизистой оболочке, что является важным фактором развития ВЗК. Взаимосвязь между воспалительными реакциями при ВЗК и снижением уровня бутирата в ближайшем
будущем может стать ключевым звеном в разработке терапевтических стратегий лечения и профилактики
ЯК и БК [17, 25].
В качестве потенциального возбудителя ВЗК рассматривается также адгезивно-инвазивная Escherichia coli (AIEC). Патогенные штаммы AIEC выявляются у 22% пациентов с БК [26]. Адгезия, колонизация и инвазия AIEC в слизистую оболочку кишечника приводят к нарушению целостности эпителиального кишечного барьера и повышению кишечной проницаемости.
Примечательно, что нарушение состава кишечной микробиоты может быть ассоциировано не только с повышенным риском развития ВЗК, но и с характером течения заболевания. Так, в образцах кала пациентов с тяжелым течением ЯК отмечается более высокое содержание Streptococcus и Proteobacteria, тогда как среди лиц с легкими формами заболевания — Akkermansia и Ruminococcus [27]. Дисбиотические изменения, которые характеризуются появлением или увеличением уровня энтеротоксических штаммов Bacteroides fragilis, AIEC и Fusobacterium nucleatum, повышают риск развития колоректального рака (КРР) у лиц с ВЗК [28, 29].
В течение нескольких десятилетий КРР твердо занимает лидирующие позиции в структуре онкологической заболеваемости и смертности во всем мире. К КРР относятся злокачественные опухоли из эпителиальной ткани, поражающие слепую, ободочную и/или прямую кишку, включая ее дистальный отдел [30]. В настоящее время ключевым патогенетическим фактором развития КРР признано влияние окружающей среды, а не конституциональные генетические отклонения, как это считалось ранее. Наследственный анамнез по КРР удается установить лишь в 5% случаев [28]. Прорывом в области изучения онкогенеза КРР стало обнаружение связи заболевания с диетой и микробиотой кишечника. Более того, сегодня очевидно, что некоторые бактерии способны не только провоцировать развитие и прогрессирование опухоли, но также определять эффективность и безопасность противоопухолевой терапии [29].
В ходе реализации проекта Human Microbiome установлено, что частота развития рака в толстой кишке выше в 12 раз по сравнению с тонкой. Этот факт можно объяснить более высокой бактериальной плотностью в толстой кишке (
10 12 клеток/мл) в сравнении с этим же показателем в тонкой кишке (
10 2 клеток/мл). Имеются также данные о том, что некоторые «толстокишечные» бактерии способны продуцировать высокотоксичные соединения, индуцирующие повреждение ДНК и стимулирующие рост опухолей [31]. Отмечена значительно более высокая концентрация Proteobacteria в образцах кала больных КРР [32]. Кроме того, A. Boleij et al. [33] обнаружили резкое увеличение числа колоний энтеротоксичных B. fragilis в биоптатах слизистой оболочки толстой кишки при КРР. При этом количество B. fragilis возрастало параллельно с увеличением возраста пациента и длительности заболевания. R.V. Purcell et al. [34] также подтвердили участие токсигенных штаммов B. fragilis в инициации изменений, приводящих к развитию дисплазии слизистой оболочки толстой кишки, трубчатой аденомы и в конечном итоге КРР. Как оказалось, B. fragilis способны стимулировать кишечный эпителий на усиленный синтез простагландина Е2, сфингозин-1-фосфата, необходимых для рекрутирования и пролиферации Th17-клеток. В свою очередь, Th17-клетки секретируют интерлейкин-17 и родственные ему цитокины, обладающие проканцерогенными эффектами [32]. В дополнение к этому токсин B. fragilis повышает активность сперминоксидазы (SMO) в эпителиальных клетках толстой кишки, что приводит к SMO-зависимой генерации активных форм кислорода и повреждению ДНК [35]. Регуляторные Т-клетки усиливают воспалительные реакции и, как правило, ингибируют канцерогенез, но в случае, когда процесс инициирован B. fragilis, они, напротив, способствуют развитию КРР [36].
Прямую генотоксическую роль Escherichia coli в возникновении КРР обусловливает геномный остров поликетидсинтазы (pks), который кодирует синтез бактерией колибактерина — метаболита, связывающего белок-супрессор опухолей р53, что приводит к апоптозу колоноцитов и усиленной пролиферации опухолевых клеток [37]. Инфицирование мышей E. coli, имеющих pks, вызывает повреждение ДНК в энтероцитах и запускает онкогенез [38]. I. Elatrech et al. [39] установили способность Enterococcus faecalis индуцировать выработку супероксида, который усиливает экспрессию циклооксигеназы-2 макрофагами и приводит к повреждению ДНК в эпителиальных клетках.
Интересными представляются данные о повышенной колонизации на поверхности опухолевых клеток потенциально пробиотических видов Collinsella, Slackia, Faecalibacterium и Roseburia, продуцирующих метаболически активный бутират и антиоксидант иквиол [40]. Существует мнение, что такая видоспецифическая колонизация опухолей бактериями-«пассажирами» может приводить к ингибированию ее роста [41]. В доклинических испытаниях продемонстрировано, что трансплантация фекальной микробиоты может снизить риск возникновения КРР, однако до сих пор остается неясным, способна ли она уменьшить развитие и прогрессирование опухоли у людей [42].
Дисбиотические изменения на фоне COVID-19
Новая коронавирусная инфекция (COVID-19) — острое инфекционное заболевание, вызываемое высокопатогенным (II класс патогенности) одноцепочечным РНК-содержащим вирусом SARS-CoV-2, имеющее воздушно-капельный (основной), воздушно-пылевой и контактный пути передачи, характеризующееся поражением респираторного тракта (особенно его нижних отделов) и ряда других органов и систем (пищеварительной, сердечно-сосудистой, нервной), осложнениями которого могут быть острая дыхательная недостаточность, острый респираторный дистресс-синдром, сепсис, инфекционно-токсический шок, тромбозы и тромбоэмболии. Известно, что для проникновения в организм хозяина SARS-CoV-2 использует рецепторы ангиотензинпревращающего фермента 2 (АПФ-2), которые в большом количестве содержатся в дыхательных путях и по ходу пищеварительного тракта [43].
Ранние сообщения из Ухани содержали информацию о том, что от 2% до 10% пациентов с COVID-19 предъявляют жалобы со стороны пищеварительного тракта [44].
Систематический обзор и метаанализ K.S. Cheung et al., объединивший результаты 60 исследований (n=4243), показал, что распространенность всех гастроинтестинальных симптомов достигает 17,6%. Наиболее частым симптомом при этом является диарея (7,8%) [45]. Обнаружено, что у пациентов с COVID-19 повышен уровень фекального кальпротектина — неспецифического маркера нейтрофильного воспаления в кишечнике [46]. В ходе дальнейших исследований вирус SARS-CoV-2 был выявлен в образцах кала у половины пациентов с COVID-19, на основании чего было выдвинуто предположение о том, что пищеварительный тракт может являться внелегочным местом репликации и размножения вируса [47].
Кроме того, среди больных COVID-19 отмечены значительные изменения микробиоценоза толстой кишки во время госпитализации и на протяжении всего периода лечения в стационаре. Дисбиотические изменения с увеличением относительной численности условно-патогенных микроорганизмов и патобионтов (Actinomyces viscous, Bacteroides nordii, Clostridium hathewayi) на фоне сокращения доли полезных представителей комменсальной микробиоты, преимущественно бутират- и пропионатпродуцирующих бактерий (Lachnospiraceae, Ruminococcus obeum, Faecalibacterium prausnitzii), сохранялись даже после полного выздоровления пациентов (исчезновение респираторных симптомов и отрицательные результаты полимеразной цепной реакции на коронавирус в мазках из зева). При этом численность Coprobacillus, Clostridium ramosum и C. hathewayi коррелировала с тяжестью течения COVID-19. Тогда как в отношении F. prausnitzii была выявлена обратная зависимость [44]. Группа исследователей во главе с T. Zuo установила, что у пациентов с тяжелым течением COVID-19 статистически значимо снижено количество Bacteroides dorei, Bacteroides thetaiotaomicron, Bacteroides massiliensis и Bacteroides ovatus в кишечнике. Данные бактерии способны снижать экспрессию АПФ-2 в пищеварительном тракте, а следовательно, влиять на тяжесть течения заболевания. В образцах кала с высокой инфицированностью SARS-CoV-2 содержалось большое количество микроорганизмов следующих видов: Collinsella aerofaciens, Collinsella tanakaei, Streptococcus infantis, Morganella morganii. Напротив, образцы кала с низкой инфицированностью SARS-CoV-2 или вовсе без нее имели более высокое содержание бактерий, продуцирующих КЦЖК: Parabacteroides merdae, Bacteroides stercoris, Alistipes onderdonkii и Lachnospiraceae bacterium [48].
Известно, что связь по оси «кишечник — легкие» является двунаправленной. Поэтому, с одной стороны, воспалительный процесс в легких воздействует на микробиоту кишечника, а с другой — изменение видового состава бактерий кишечника существенно влияет на течение вирусной пневмонии [49]. Кроме того, антибиотик-ассоциированный дисбиоз кишечника может также повышать восприимчивость организма к вирусу и снижать функциональную активность иммунных клеток легких, способствуя более тяжелому течению инфекции [48].
Несмотря на ограниченность данных о взаимодействии бактерий кишечника и вирусов, имеются сведения о том, что воздействие на кишечную микробиоту путем применения пробиотиков или фекальной трансплантации может усилить противовирусный иммунитет, снизить частоту и длительность инфекционного заболевания дыхательных путей. По результатам двух РКИ с участием 381 пациента, находящегося на искусственной вентиляции легких (ИВЛ), показано, что введение пробиотических штаммов Lactobacillus rhamnosus GG, Bacillus subtilis и E. faecalis значительно снижало риск развития ИВЛ-ассоциированной пневмонии по сравнению с группой плацебо [49]. Безусловно, эти результаты наталкивают на мысль о возможных перспективах данного подхода в качестве метода профилактики и лечения инфекции SARS-CoV-2.
Современные способы коррекции состава кишечной микробиоты
Учитывая наличие доказанной роли дисбиотических изменений микробиоты в развитии различных заболеваний кишечника, неудивительно, что коррекция состава микробиоты рассматривается в качестве одного из потенциальных методов их профилактики и лечения. С этой целью могут применяться диета, деконтаминация патогенных и условно-патогенных бактерий антибиотиками, кишечными антисептиками, энтеросорбентами, бактериофагами и др., а также про-, пре, син- и метабиотики. Согласно определению Всемирной гастроэнтерологической организации (ВГО), под пробиотиками понимаются живые микроорганизмы, которые при введении в адекватных количествах оказывают положительное влияние на организм хозяина [50]. В качестве пребиотиков рассматриваются диетарные вещества, которые не перевариваются в тонкой кишке, а подвергаются бактериальной ферментации микробитой толстой кишки с образованием активных метаболитов. Биологически активные добавки (БАД), имеющие в своем составе как пробиотики, так и пребиотики, получили название синбиотиков, а содержащие продукты метаболизма или структурные компоненты пробиотических микроорганизмов — метабиотиков. Необходимо отметить, что из огромного многообразия представленных на фармацевтическом рынке средств, потенциально влияющих на микробиоту, немногие из них имеют доказанную эффективность.
В настоящее время научно обоснованным и перспективным методом коррекции дисбиотических нарушений кишечной микробиоты представляется применение пребиотиков, селективно стимулирующих рост и метаболическую активность собственных комменсальных бактерий. Среди пребиотиков лидирующая роль по праву принадлежит пищевым волокнам, которые также добавляют пище объем, тем самым уменьшая энергетическую ценность рациона, являются хорошими регуляторами моторики пищеварительного тракта, способствуют нормализации уровня холестерина и глюкозы [51, 52]. При этом, по данным отдельных популяционных исследований, в настоящее время большая часть людей не употребляют рекомендованного ВГО количества пищевых волокон — 20–30 г/сут [53]. Образующиеся в процессе бактериальной ферментации пищевых волокон КЦЖК являются основным энергетическим субстратом для колоноцитов, стимулируют репаративные процессы в слизистой оболочке пищеварительного тракта и снижают повышенную кишечную проницаемость — это один из ключевых механизмов формирования как органических, так и функциональных заболеваний пищеварительного тракта [2, 3, 14, 51, 52]. Применение пищевых волокон при заболеваниях кишечника в реальной клинической практике ограничено их плохой переносимостью. Хорошо известно, что прием нерастворимых пищевых волокон зачастую приводит к усугублению абдоминальной боли и метеоризма. Однако, как оказалось, физиологический эффект и переносимость пищевых волокон определяются не только растворимостью, но и другими их свойствами, в частности молекулярной массой, ферментируемостью и вязкостью [53]. Суммируя данные многочисленных РКИ, можно так охарактеризовать «идеальный пребиотик»: он должен быть хорошо растворимым, медленно ферментируемым, иметь низкую молекулярную массу и вязкость. Всеми этими свойствами обладают частично гидролизованные пищевые волокна циамопсиса четырехкрыльникового (травянистое растение семейства бобовых), появившиеся на российском рынке относительно недавно под торговым названием «ОптиФайбер». БАД на 100% состоит из натуральных компонентов, не содержит сахара, лактозы, глютена, подсластителей, красителей, ароматизаторов и консервантов. Частичный гидролиз пищевых волокон циамопсиса четырехкрыльникового обеспечивает хорошую переносимость без вздутия и газообразования. ОптиФайбер рекомендован для восстановления регулярной работы кишечника и сбалансированного состава кишечной микробиоты. Кроме того, натуральный состав БАД и отсутствие привыкания обусловливают возможность ее длительного применения в качестве дополнительного обогащения рациона растительными волокнами, в т. ч. у беременных
женщин [54, 55].
Действующее вещество ОптиФайбер обладает достаточной доказательной базой клинических исследований, в т. ч. рандомизированных, двойных плацебо-контролируемых, с уровнем доказательности А. Показано, что частично гидролизованные пищевые волокна циамопсиса четырехкрыльникового не только регулируют работу кишечника, оказывая пребиотический эффект и увеличивая скорость кишечного транзита, но и способствуют уменьшению выраженности абдоминальной боли и вздутия живота при СРК [56, 57]. Кроме того, в опубликованных исследованиях японских ученых продемонстрирован положительный эффект частично гидролизованных пищевых волокон циамопсиса четырехкрыльникового, входящих в состав ОптиФайбер, в профилактике острых респираторных вирусных инфекций посредством повышения иммунитета [58, 59].
Заключение
В XXI в. понимание роли микробиома пищеварительного тракта претерпело революционные изменения. Микробиота кишечника удивительно разнообразна, а ее биологические эффекты, связанные со здоровьем человека, многочисленны. К сожалению, несмотря на стремительно появляющуюся новую информацию в этой области, остается очень много нерешенных вопросов. В настоящее время убедительно показана связь между дисбиотическими изменениями микробиоты и развитием различных заболеваний кишечника — от функциональных до органических. Как правило, эти нарушения характеризуются уменьшением количества «полезных» комменсалов и увеличением доли патогенных штаммов. При этом очевидно, что патогенетические механизмы реализации этой связи намного сложнее и требуют дальнейшего изучения. 2020 год навсегда войдет в историю как год начала пандемии новой коронавирусной инфекции, но даже в этих условиях микробиота кишечника продолжает находиться под пристальным вниманием исследователей всего мира. Дисбиотические нарушения кишечника сегодня могут быть корригированы изменением рациона питания, применением про-, пре-, син- и метабиотиков, проведением фекальной трансплантации. Однако не стоит забывать, что любые воздействия не должны нарушать гармонии между кишечными бактериями, ведь именно от нее зависит функционирование не только органов пищеварения, но и всего организма в целом. В настоящее время одним из наиболее научно обоснованных и перспективных методов стимуляции роста и метаболической активности кишечной микробиоты является применение пребиотиков, среди которых лидирующее место отводится пищевым волокнам. Высокой эффективностью и хорошей переносимостью обладают частично гидролизованные пищевые волокна циамопсиса четырехкрыльникового. Они подходят для длительного применения и имеют достаточную доказательную базу клинических исследований, в т. ч. рандомизированных двойных плацебо-контролируемых с уровнем доказательности А.
Редакция благодарит компанию Atrium Innovations за оказанную помощь в технической редактуре настоящей публикации.
Только для зарегистрированных пользователей