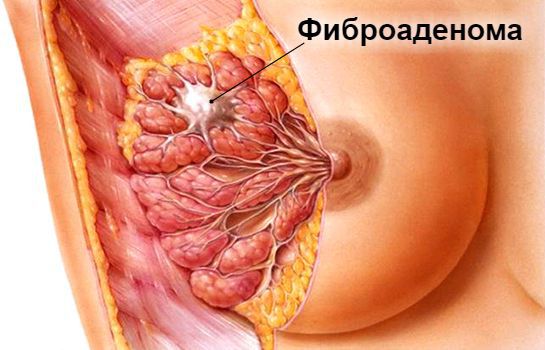
Фиброаденома и эко что делать
ЭКО при фиброаденоме молочной железы и мастопатии
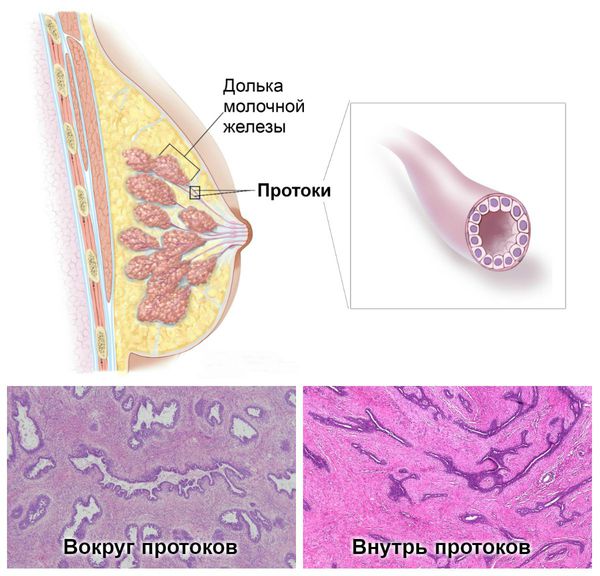
Таким образом, мастопатия — это группа доброкачественных заболеваний, морфологически характеризующихся широким спектром как регрессивных, так и пролиферативных процессов, при которых возникает патологическое соотношение соединительно-тканного и эпителиального компонентов молочных желез с возникновением изменений кистозного, фиброзного и пролиферативного характера. Под этим термином объединены доброкачественные изменения. Однако риск их злокачественного перерождения в 4 раза выше, чем у женщин, не страдающих такими заболеваниями.
Поэтому ранняя диагностика, своевременное лечение – это профилактика развития онкологического процесса.
В современной маммологии выделяют такие виды мастопатии в зависимости от их структуры:
Этиологические факторы возникновения мастопатий разнообразны. Однако основной является теория гормонального дисбаланса в организме женщины. Собственно, поэтому данный вид патологических процессов объединен под единым названием дисгормональные заболевания.
К основным этиопатогенетическим факторам развития мастопатий относят:
Заподозрить мастопатию может и сама женщина по средствам обнаружения характерных для нее симптомов:
При обнаружении женщиной такой симптоматики обязательно необходимо обратиться к врачу – маммологу для проведения комплексного обследования.
Диагностический спектр обследований при данном диагнозе скромен и представляется:
В терапии мастопатии различают:
Мастопатия и ЭКО
Теоретически, так как патогенетически прогестерон благотворно влияет на очаги мастопатии, беременность не противопоказана при данном диагнозе. А наоборот, большое количество гестагенов во время беременности снижает темпы роста мастопатии. Но иногда, гормональный дисбаланс, напротив, стимулирует ее прогрессирование.
Фиброаденома и эко что делать
хирург-онколог, маммолог, кандидат медицинских наук
Ленинградская область, Всеволожский район, пос.Кузьмоловский, Заозерная ул., 2
Врач в третьем поколении. Закончил в 1998 году с отличием Санкт-Петербургскую государственную медицинскую академию им. И.И. Мечникова, после чего сразу же поступил в клиническую ординатуру по хирургии этой же академии. Во время обучения в клинической ординатуре, которую с отличием закончил в 2000 году, получил специализацию по онкологии (1999). Начиная с 1999 года, обучение проводилось на базе Ленинградского областного онкологического диспансера (отделение общей онкологии). С 2000 по 2004 год проходил обучение в аспирантуре и в 2004 году защитил кандидатскую диссертацию на тему «Хирургическое и адъювантное лечение ранних форм рака молочной железы». Имею действительные сертификаты по хирургии (2021) и онкологии (2018), реконструктивной и пластической хирургии (2019). Являюсь лучшим маммологом Санкт-Петербурга 2016 года по версии сайта НаПоправку, лучшим маммологом Санкт-Петербурга в 2020 и 2021 годах по версии Prodoctorov.Ru
Лечу рак молочной железы по федеральным квотам в Клинической больнице Российской академии наук, принимаю и лечу пациентов в клинике онкологических решений ЛУЧ
С 2004 года являюсь главным исследователем и координатором международных клинических исследований по раку молочной железы в Ленинградском областном клиническом онкологическом диспансере, клинике онкологических решений ЛУЧ.
Имею более 10 печатных работ, в том числе в центральной зарубежной печати.
Рабочий телефон +7921 945 33 18
Мобильный телефон +7 921 945 33 18
Телефон администратора +7 981 710 40 41
Противопоказания к ЭКО: какие есть?
Экстракорпоральное оплодотворение сегодня является общепринятой методикой лечения бесплодия. Появившись в конце 20-го века, она используется в центрах репродуктологии во всех развитых странах мира. Сама процедура считается не только эффективной, но и безопасной. Тем не менее, все же существуют состояния организма пациентов и ситуации, несовместимые с возможностью проведения ЭКО. Их игнорирование не только приводит к отторжению эмбриона и потере ребенка, но часто может нанести серьезный ущерб здоровью, а в некоторых случаях даже привести к летальному исходу.
Какие противопоказания к ЭКО бывают?
Все противопоказания к этой процедуре изложены в Приложении 2 к приказу № 107 Министерства здравоохранения РФ от 30.08.2012 года. Условно их можно разделить на две основные категории:
Противопоказаниями к проведению ЭКО являются не только заболевания (то есть патологические состояния организма), но и другие причины, в той или иной степени влияющие на репродуктивные функции:
Наличие противопоказаний к ЭКО свойственно как женщинам, так и мужчинам, так как в искусственном оплодотворении используются половые клетки обоих родителей. Чтобы выявить относительные или абсолютные ограничения для использования этой репродуктивной технологии, семейная пара проходит комплексное медицинское обследование. Это обязательное условие для разработки индивидуального протокола ЭКО, позволяющее уберечь пациентов от лишних денежных трат, психических потрясений и ущерба их здоровью.
Противопоказания к ЭКО у женщин
К этой категории относятся излечимые заболевания женской репродуктивной системы, которые осложняют или делают невозможным искусственное оплодотворение или имплантацию уже зачатого эмбриона в эндометрий матки.
К специфическим относительным противопоказаниям к ЭКО для пациенток можно отнести следующие виды патологий. При их наличии искусственное оплодотворение откладывается на неопределенный срок до их полного устранения или достижения женщиной такого состояния, при котором процедура даст реальный результат, при этом не навредив здоровью. Для этого назначается предварительный курс лечения, по результатам которого врач определяет возможность зачатия и выбирает конкретную программу для достижения максимальных шансов на успешное возникновение беременности.
Доброкачественные опухоли репродуктивных органов. К ним относятся миомы, различные виды кисты яичников, аномальное разрастание эндометрия (слизистой, выстилающей полость матки). Успешность экстракорпорального оплодотворения зависит от расположения, характера и размера опухоли. В зависимости от этого врач может выбрать одну из 2 стратегий:
Выбор той или иной тактики при доброкачественных новообразованиях женских половых органов осуществляется врачом на основании предварительных обследований пациентки. Только после них выносится заключение терапевта об отсутствии противопоказаний к ЭКО или возможности проведения процедуры при их наличии.
Некоторые аномалии репродуктивной системы. К ним относятся врожденные или приобретенные (вследствие травм, хирургических операций, болезней) нарушения анатомического строения половых органов, мешающие естественному зачатию, но не исключающие оплодотворения и деторождения как такового. Распространенный примеры – спаечные процессы во влагалище, шейке матки, фаллопиевых трубах. В зависимости от характера конкретной аномалии может осуществляться их предварительное хирургическое устранение или ЭКО проводится без него, если нарушение не мешает получению яйцеклетки, подсадке эмбриона и рождению ребенка.
Инфекционные заболевания. Согласно приказу Министерства здравоохранения РФ № 107 Министерства здравоохранения РФ от 30.08.2012 года, ЭКО не проводится при наличии у будущей матери следующих инфекций:
В большинстве случаев вступать в протокол ЭКО нельзя до полного излечения инфекционной патологии. Исключения составляют хронические, трудноизлечимые или неизлечимые заболевания – например, ВИЧ, гепатиты, туберкулез. В этих случаях врач может провести экстракорпоральное оплодотворение, если пациентка находится в стадии устойчивой ремиссии
В случае с ВИЧ ЭКО назначается только при наличии вируса у одного из партнеров. При этом пол заболевшего родителя имеет значение:
Гормональные нарушения. Выработка половых гормонов влияет не только на репродуктивную систему будущей матери, но и ее здоровье в целом. При гормональных нарушениях ЭКО не проводится потому, что эта процедура включает стимуляцию яичников, которая может создать опасную нагрузку на организм пациентки. Поэтому перед экстракорпоральным оплодотворением устраняется эндокринное заболевание, вызвавшее сбой в выработке гормонов, или отменяется (корректируется) гормональная терапия, прием контрацептивов. Если по каким-либо причинам такой вариант невозможен, врач может подобрать протокол ЭКО с щадящим режимом стимуляции яичников или полным его отсутствием.
Абсолютные противопоказания к ЭКО у женщин включают непреодолимые патологии, которые делают процедуру невозможной или чрезмерно угрожающей жизни матери.
Злокачественные опухоли. В подавляющем большинстве случаев рак является причиной для полного отказа от ЭКО – независимо от того, в каком органе развивается опухоль. Стимуляция яичников или гормональная поддержка матери после имплантации способны спровоцировать ее резкий рост, тем самым создавая серьезную угрозу жизни самой женщины. Даже после полного излечения от злокаче6ственной онкологии этот риск слишком велик. Однако, в некоторых случаях при согласии пациентки и ее полном информировании о возможной опасности, после консультации с онкологом врач-репродуктолог может провести процедуру.
Пороки развития матки. Этот орган играет важнейшую роль в имплантации эмбриона, его развитии и рождении. При аномалиях анатомического строения матки или ее полном отсутствии (в том числе приобретенном) вынашивание ребенка абсолютно невозможно при существующем уровне развития медицинских технологий. Стать матерью женщина с такой проблемой может только двумя способами:
Тяжелые соматические (общие) заболевания. ЭКО категорически противопоказано при неизлечимых патологиях любых органов или систем, если проведение процедуры создаст неоправданно высокий риск для здоровья или жизни женщины – в частности:
Помимо относительных и абсолютных противопоказаний к ЭКО у женщин имеются также заболевания, которые сложно отнести к одной из этих категорий:
В этих и некоторых других ситуациях ЭКО осуществимо, но несет определенную угрозу жизни и здоровью как самой матери, так и ребенка. Решение о проведении в каждом конкретном случае принимает врач на основании данных диагностических обследований, анализа и сопоставления рисков для пациентки и шансов на успешное наступление беременности.
Противопоказания к ЭКО у мужчин
В связи с тем, что мужчина участвует только в процессе самого оплодотворения, ограничений для него при экстракорпоральном оплодотворении гораздо меньше и подавляющее большинство из них – относительные, то есть потенциально преодолимые. У будущих отцов наиболее распространенными противопоказаниями к ЭКО являются:
Половые инфекции. Сифилис, гонорея, хламидиоз, микоплзмоз, герпес, ВИЧ и другие венерические заболевания – распространенная причина отказа от проведения ЭКО с использованием спермы их носителя. Однако, существующие методы лечения этих патологий, а также очистки эякулята от возбудителей в подавляющем большинстве случаев позволяют получить чистый генетический материал, пригодный для экстракорпорального оплодотворения.
К абсолютным противопоказанием для мужчин при проведении ЭКО можно отнести патологии, при которых их организм не вырабатывает сперматозоиды, из-за чего их нельзя извлечь ни из эякулята, ни из яичек. Это могут быть как врожденные аномалии развития половых органов, приобретенное отсутствие тестикул, некоторые эндокринные расстройства и другие нарушения. В таком случае единственный выход – воспользоваться генетическим материалом мужчины-донора.
Генетические заболевания и ЭКО
Важным аспектом, влияющим на проведение экстракорпорального оплодотворения, является наличие у одного или обоих родителей наследственных заболеваний. Само ЭКО при этом возможно, но велик риск передачи дефектных генов ребенку, из-за которых у него могут развиться врожденные патологии. В таком случае возможно два варианта действий:
В любом случае, при наличии генетических заболеваний родителям придется сделать нелегкий выбор. Большое значение имеет профессионализм и тактичность врача – зачастую именно он будет выбирать, какой способ преодоления бесплодия выбрать, исходя из рисков и возможностей конкретной ситуации.
Возможно ли ЭКО при хронических заболеваниях?
Хроническими называются патологии, характеризующиеся продолжительным течением. Такие заболевания могут протекать достаточно легко и даже вовсе не ощущаться самим пациентом. Тем не менее, они означают наличие в его организме определенных проблем. К хроническим болезням относятся:
Проблема хронических заболеваний в том, что они излечиваются с большим трудом или вовсе неизлечимы на данный момент. В некоторых случаях эти патологии могут обостряться – например, при заражении какой-либо инфекцией, травме, воздействии радиации, токсичных веществ или даже при эмоциональном стрессе.
Возможность проведения ЭКО при хронических заболеваниях определяется его характером и степенью тяжести, а также тем, в какой стадии оно находится – ремиссии или обострения. Например, при тяжелых формах сахарного диабета, онкологии, пороках сердечно-сосудистой системы искусственное оплодотворение невозможно в принципе, так как с высокой долей вероятности пациент может не перенести эту процедуру. Если патологию можно купировать или снизить ее тяжесть до приемлемого уровня, врач назначает ее лечение. Если оно дало результаты, то проведение ЭКО становится возможным. Поэтому семейные пары, в которых один или оба супруга являются хроническими больными, проходят предварительную обязательную консультацию с профильным специалистом, который на основании медицинских обследований разрешает или запрещает экстракорпоральное оплодотворение.
Что такое фиброаденома молочной железы? Причины возникновения, диагностику и методы лечения разберем в статье доктора Степыко С. Б., онколога со стажем в 16 лет.
Определение болезни. Причины заболевания
Ведущий фактор развития фиброаденомы — относительная или абсолютная гиперэстрогения (избыток эстрогенов) и дефицит прогестерона. При относительном повышении уровня эстрогена возрастная норма этого гормона сохраняется, но нарушается его пропорция с прогестероном. Абсолютное повышение означает, что количество эстрогенов выше нормы.
Также риск появления фиброаденомы увеличивается в следующих случаях:
Подростковый возраст, когда происходит становление менструального цикла, сам по себе является одним из факторов риска образования фиброаденомы молочной железы. В этот период гипоталамо-гипофизарная система работает несовершенно, из-за чего в организме может наблюдаться гиперэстрогения, которая сопровождается дисфункциональными маточными кровотечениями.
У женщин с эндометриозом и миомой матки частота развития фиброаденомы возрастает. При воспалительных заболеваниях яичников и доброкачественных опухолях изменяется нейроэндокринная регуляция, часто возникают нарушения менструального цикла и недостаточность лютеиновой фазы. Со временем это приводит к фиброаденоме.
При гиперпролактинемии изменяется нормальная продукция гормонов: высвобождение пролактина подавляет овуляцию, но повышает чувствительность клеток груди к эстрогенам. Таким образом возникает гиперэстрогения на фоне снижения концентрации прогестерона.
Симптомы фиброаденомы молочной железы
Заподозрить фиброаденому на ранней стадии тяжело, так как болезнь протекает без видимых симптомов. Поводом для обращения к врачу становится пальпируемое образование, которое достигает диаметра 2-3 см. Узел чаще располагается в верхне-боковой части молочной железы. В случае множественной фиброаденомы пальпируется сразу несколько узлов разного объёма, расположенных на расстоянии друг от друга.
Для фиброаденомы не характерны изменения кожи, покраснение или деформация. При небольшом объёме опухоли размер молочной железы остаётся прежним. В положении лёжа на спине опухоль не исчезает. Гигантские единичные узлы вызывают одностороннее увеличение груди, заметную асимметрию при визуальном осмотре.
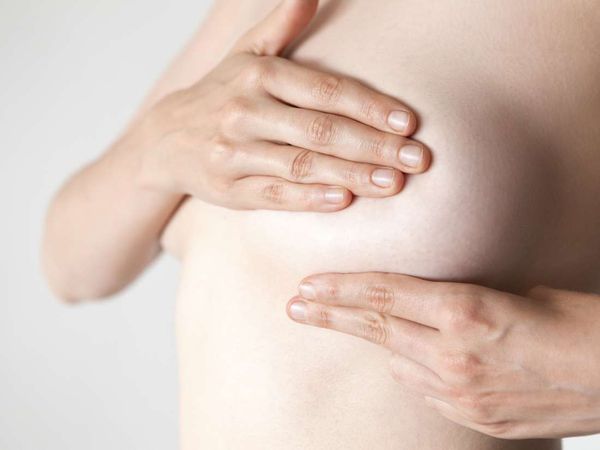
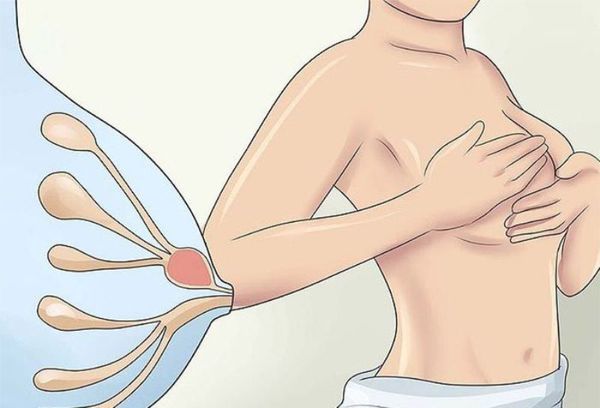
Женщина может самостоятельно обнаружить фиброаденому, если после окончания менструации проведёт самообследование молочных желёз. Во время осмотра груди перед зеркалом заметного нарушения симметрии не будет. При пальпации можно прощупать плотное образование, которое легко смещается под пальцами.
Так как фиброаденома сопровождается гормональными нарушениями, во второй половине цикла у пациенток появляется мастодиния — боль и напряжённость в молочной железе. Болезненность иногда сопровождается изменением чувствительности сосков: даже контакт с одеждой становится неприятным. При этом сама опухоль при пальпации обычно безболезненна.
Во второй половине цикла фиброаденома может увеличиваться в размерах. У женщин с предменструальным синдромом это связано с задержкой жидкости и развитием отёка тканей груди. Иногда такое состояние ошибочно принимают за начало активного роста опухоли.
Для фиброаденомы не характерны изменения лимфоузлов, поэтому при пальпации подключичных, надключичных и подмышечных групп узлов не наблюдается увеличение в размерах или уплотнение тканей.
Патогенез фиброаденомы молочной железы
Основная роль в образовании узловой мастопатии принадлежит эстрогенам. Они вызывают следующие изменения в тканях груди:
Эстрогены влияют на рост фиброаденоматозных узлов не только напрямую, но и косвенно. Непрямой механизм связан с активацией выработки факторов роста, которые поступают в молочную железу с током крови или вырабатываются из расположенных рядом клеток. На ткани молочной железы влияют следующие вещества:
Итак, у женщин с недостатком прогестерона, а также абсолютным или относительным избытком эстрогенов на протяжении всего менструального цикла стимулируется рост эпителиальной и соединительной ткани. Но это проявляется в участках железы, наиболее чувствительных к влиянию гормонов, имеющих больше количество рецепторов к ним. В связи с этим постепенно формируется плотный узел.
В зрелом возрасте в тканях фиброаденомы развивается гиалиноз — участки соединительной ткани, напоминающие хрящ, при этом гибнут клетки, могут появляться кальцификаты — отложения солей кальция. Поэтому доброкачественные опухоли, выявляемые в период менопаузы, имеют обызвествление, которое говорит о длительном существовании образования.
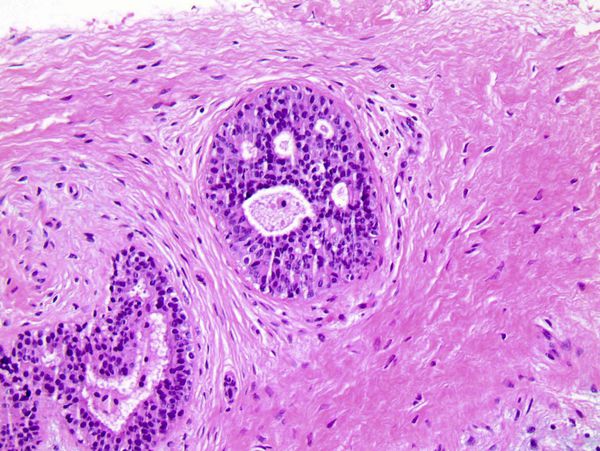
Классификация и стадии развития фиброаденомы молочной железы
По гистологическому строению выделяют следующие типы фиброаденомы:
Периканаликулярная фиброаденома встречается в 51 % случаев. Она чётко отделяется от окружающих тканей и с возрастом подвергается дистрофическим изменениям. Этот тип опухолей чаще наблюдается у женщин после 45 лет.
Осложнения фиброаденомы молочной железы
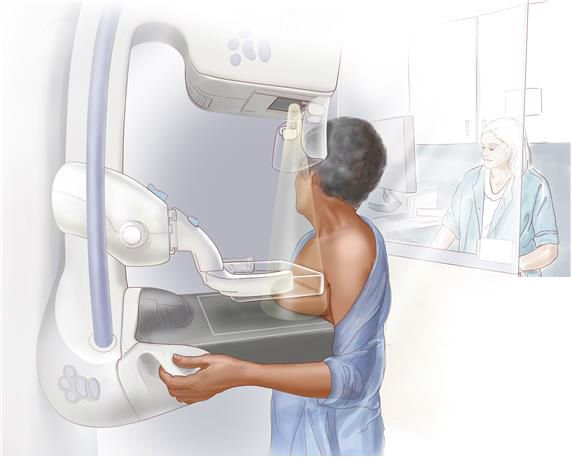
Диагностика фиброаденомы молочной железы
На консультацию к врачу-маммологу лучше приходить после менструации на 5-9 день цикла, чтобы исключить влияние предменструальных изменений на грудные железы: нагрубание и отёк.
Врач выясняет анамнез жизни, чтобы установить факторы, которые могли привести к патологии. Осмотр проводится в положении стоя и лёжа с запрокинутой за голову рукой. При пальпации обнаруживается плотный узел, который легко смещается и не вызывает болезненности. Локализуется преимущественно в верхней части груди. Форма узла обычно овоидная (по типу яйца) или круглая, поверхность чаще бугристая, неровная.
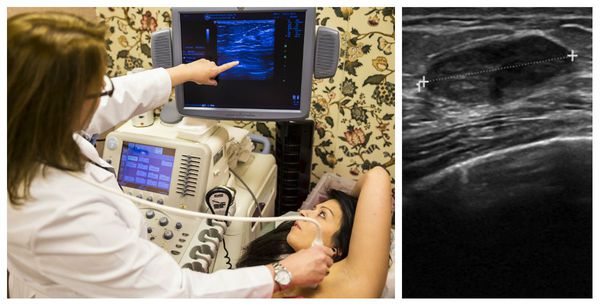
Признаками доброкачественного новообразования на УЗИ являются:
Доброкачественная опухоль вписывается в соотношение по длине и ширине, которое должно быть менее 1:1. При надавливании на очаг наблюдается усиление гомогенности узла. Но при компрессии (сдавлении) внутренняя эхоструктура не изменяется, форма уплощается.
По показаниям проводится МРТ-диагностика. Но она не всегда позволяет отличить злокачественный процесс от доброкачественного. На МРТ-снимке опухоль выглядит, как овальное новообразование с ровными или дольчатыми краями. Картина усиления может быть разной: если его нет или происходит задержка — преобладает фиброз, при выраженном поглощении контраста — аденоматоз.
Точно дифференцировать злокачественное и доброкачественное новообразование можно при помощи цитологического или гистологического исследования. Для этого применяются следующие методы:
Лабораторная диагностика необходима только в плане подготовки к хирургическому удалению опухоли.
Исследование гормонального профиля не входит в перечень обязательных методов, но может проводиться при наличии сопутствующих гинекологических заболеваний.
Лечение фиброаденомы молочной железы
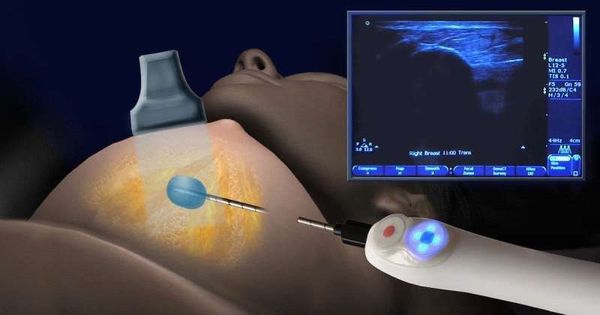
Разработаны абляционные методики удаления фиброаденомы, которые менее травматичны, чем операция на груди, и дают хороший результат. Используют следующие способы:
Криоабляция — это амбулаторная манипуляция, которая проводится под местной анестезией и не требует длительного стационарного лечения. Для женщин всех возрастов, особенно планирующих беременность, этот метод лечения является приоритетным. Рубец после процедуры не формируется, поэтому он не будет блокировать протоки и мешать кормлению грудью.
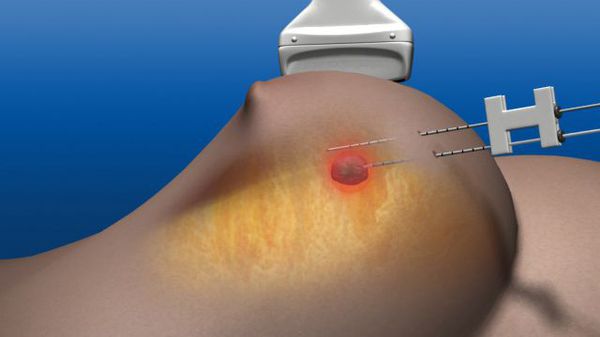
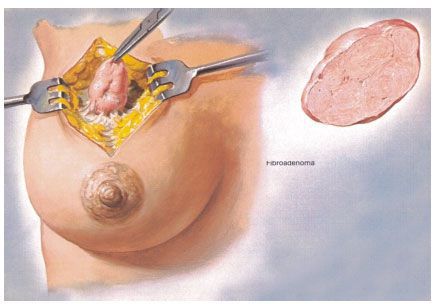
Показаниями для хирургического лечения являются:
В зависимости от размера новообразования, их количества и расположения могут использоваться два типа операции:
После удаления опухоли её отправляют на обязательное гистологическое исследование. При признаках злокачественного процесса, которые были выявлены во время операции, необходимо экстренное гистологическое исследование.
Прогноз. Профилактика
При фиброаденоме без признаков перерождения в рак прогноз благоприятный. Своевременное удаление доброкачественной опухоли даёт хороший косметический эффект. При крупных новообразованиях проводится маммопластика, которая позволяет восстановить привлекательную форму груди.
Состояние молочных желез после вспомогательных репродуктивных технологий

Проведено рандомизированное исследование перед и после применения вспомогательных репродуктивных технологий экстракорпорального оплодотворения (ЭКО) у пациенток с бесплодием трубного происхождения и доброкачественной дисплазией молочных желез. Установлен
A randomized study of patients before and after in vitro fertilization (IVF) with tubal infertility and benign dysplasia of mammal glands before and after IVF was carried out. The number of patients with benign dysplasia of mammal glands has been increased after IVF.
В клинической практике вспомогательных репродуктивных технологий (ВРТ) в течение более 30 лет широко применяются протоколы индукции суперовуляции при экстракорпоральном оплодотворении (ЭКО). Однако вопрос о влиянии ВРТ ЭКО на ткань молочных желез до сих пор остается открытым [3, 5]. Современный рост заболеваемости раком молочной железы (РМЖ) отчасти связан с увеличением распространенности доброкачественной дисплазии молочных желез (ДДМЖ) — N 60.0 по МКБ-10, которая диагностируются у 60–70% женщин с гинекологической патологией. Доказано, что на фоне диффузных форм доброкачественной дисплазии молочных желез частота развития РМЖ встречается в 3–5 раз чаще, чем в популяции, а при узловых формах — в 30–40 раз [1–3, 5, 8]. В свою очередь, одним из факторов риска развития РМЖ является бесплодие. В структуре современных причин женской инфертильности наибольший удельный вес приходится на трубное бесплодие. При этом наиболее перспективными для преодоления трубного бесплодия (N 97.1) признаны именно вспомогательные репродуктивные технологии, среди которых основное место занимает экстракорпоральное оплодотворение.
В научной литературе имеется достаточное количество зарубежных статей, сообщающих о влиянии вспомогательных репродуктивных технологий на состояние молочных желез (МЖ) [13–18]. В российской научной литературе крайне мало исследований в этом направлении, а именно имеется только две диссертационные работы и в 2012 г. публикация единственного клинического случая рака молочной железы после повторного ВРТ ЭКО [3, 5, 10]. В процессе нашего исследования с целью выявления взаимосвязи между состоянием молочных желез на фоне и после проведения ВРТ ЭКО в поисковой строке базы данных PubMed были использованы следующие варианты запроса: benign diseases of mammary glands, breast cancer, in vitro fertilization, tubal infertility. Всего было найдено 170 статей по данной тематике, в которых были освящены аспекты рисков формирования РМЖ после проведения ВРТ ЭКО. В итоге анализ доступной зарубежной и отечественной литературы не дает однозначного ответа о влиянии вспомогательных репродуктивных технологий экстракорпорального оплодотворения на повышение патологии МЖ и возможных рисках развития рака молочной железы в будущем. Обращает на себя внимание, что контингенты обследуемых пациенток и дизайны исследований составлены весьма противоречиво, группы сравнения являлись не равноценными, оценивались только отдаленные результаты исследования, а также не дифференцировалась сама патология МЖ. В связи с вышеизложенным на современном этапе активного развития ВРТ научный интерес представляют исследования состояния МЖ и состояние гормонального фона у женщин с бесплодием после неудачной попытки ВРТ ЭКО. Целесообразность настоящего исследования определяет тот факт, что полученные данные помогут разработать эффективные меры профилактики и реабилитации МЖ после ВРТ ЭКО.
Целью настоящего исследования была оценка состояния молочных желез и гормонального статуса у женщин с бесплодием трубного происхождения после неудачной попытки ВРТ ЭКО.
Материалы и методы исследования
Статистическую обработку результатов проводили с использованием стандартного пакета программ Statistica for Windows (2000, версия 6.0) фирмы Statsoft Inc. и пакета программ Microsoft Excel (2006) корпорации Microsoft [4].
Результаты и обсуждение
При анализе контингента пациенток, полностью соответствующих критериям включения в исследование, после неудачной попытки ВРТ ЭКО нами были рандомизированы методом случайного выбора 140 женщин. Результаты ультразвукового исследования (УЗИ) МЖ показали, что среди этих пациенток перед ВРТ ЭКО без патологии молочных желез было 32 человека (22%), с ДДМЖ с преобладанием железистого компонента — 50 (36%), с ДДМЖ с преобладанием кистозного компонента — 29 (21%) и с ДДМЖ с преобладанием фиброзного компонента — 29 (21%). При обследовании данных пациенток через три месяца после неудачной попытки ВРТ ЭКО отсутствие патологии молочных желез было установлено только у 10 человек (7%), ДДМЖ с преобладанием железистого компонента выявлена у 65 (47%), ДДМЖ с преобладанием кистозного компонента — у 35 (25%) и ДДМЖ с преобладанием фиброзного компонента — у 30 (21%) пациенток (рис.).
Правильная интерпретация полученных эхоскопических данных, а также определение формы ДДМЖ у каждой конкретной пациентки остаются проблемой для специалистов маммологов и врачей ультразвуковой диагностики. Полученные нами при объективном осмотре с применением методов лучевой диагностики данные были автоматически обработаны с помощью предлагаемого диагностического алгоритма (Патент РФ № 2452389 от 10.06.2012 «Способ дифференциальной диагностики форм фиброзно-кистозной болезни у женщин с сохраненной репродуктивной функцией»). Практическая значимость разработанной математической модели не только позволяет просто и объективно диагностировать форму ДДМЖ в любом возрасте, но и оценить эффективность проводимых лечебных мероприятий с позиции доказательной медицины. Показатели лучевых методов исследования были в виде абсолютных значений признаков внесены в предлагаемый алгоритм с последующим пересчетом диагностических коэффициентов. После математической обработки полученных результатов выявилось, что основными значимыми объективными критериями оценки формы ДДМЖ по классификации Н. И. Рожковой (1993) являлись показатели толщины премаммарной клетчатки, фиброгландулярного слоя и ретромаммарной клетчатки [11].
Перед проведением ВРТ ЭКО у пациенток с трубным бесплодием и патологией молочных желез в зависимости от формы ДДМЖ при УЗИ МЖ зарегистрированы следующие значения значимых показателей. При ДДМЖ с преобладанием железистого компонента выявлено повышение толщины фиброгландулярного слоя (18,53 ± 0,53 мм), но уменьшение толщины премаммарной клетчатки (3,87 ± 0,56 мм) и толщины ретромаммарной клетчатки (2,37 ± 0,53 мм), что статистически (р 0,05).
Через три месяца после неудачной попытки ВРТ ЭКО при сравнительном УЗИ МЖ выявлено в группе пациенток без патологии МЖ статистически значимое (р 0,05) (табл. 1).
Таким образом, в результате сравнения состояния молочных желез перед и через 3 месяца после неудачной попытки ЭКО, в исследуемой группе женщин с трубным бесплодием выявлено увеличение числа пациенток с патологией молочных желез после неудачной попытки ЭКО. Перераспределение произошло за счет увеличения числа пациенток с ДДМЖ с преобладанием железистого и кистозного компонентов. Полученные данные позволяют говорить, что ВРТ ЭКО оказывает влияние на состояние молочных желез.
Так как изменения в тканях молочных желез при ДДМЖ напрямую зависят от гормональных изменений в организме, нами также было проведено исследование гормонального статуса пациенток с бесплодием трубного происхождения перед и через три месяца после неудачной попытки ВРТ ЭКО. Перед ВРТ ЭКО у пациенток с бесплодием трубного происхождения и патологией молочных желез выявлено более статистически значимое повышение в сыворотке крови уровней ФСГ, ТТГ, эстрадиола и пролактина при всех формах ДДМЖ, чем у пациенток без патологии молочных желез (р 0,05).
Заключение
Принципиальным отличием нашего исследования явились критерии формирования групп и дизайн. Пациентки имели только один фактор бесплодия — трубный, были молодыми женщинами с хорошим овариальным резервом без эндокринной и соматической патологии. Состояние молочных желез оценивалось до и после неудачной попытки ВРТ ЭКО с использованием единого протокола стимуляции суперовуляции. В результате исследования нами был выявлен факт увеличения числа пациенток с патологией молочных желез через 3 месяца после неудачной попытки ВРТ ЭКО. Анализ структуры ДДМЖ показал, что рост доброкачественной патологии молочных желез произошел за счет форм с преобладанием железистого и кистозного компонентов. Полученные данные подтверждают существующие в мировой литературе предположения о том, что гормональные препараты, применяемые при стимуляция суперовуляции в протоколах ЭКО, оказывают влияние на состояние молочных желез, увеличивая риск развития диффузной доброкачественной дисплазии молочных желез и, весьма вероятно, возможный риск возникновения РМЖ в будущем.
В нашем исследовании при оценке особенностей гормонального статуса у всех пациенток с трубным бесплодием перед и после неудачной попытки ВРТ ЭКО выявлены однонаправленные изменения показателей основных гормонов, имеющих патогенетическую связь с формированием доброкачественной патологии молочных желез и применяемым препаратом рекомбинантного ФСГ. Полученные данные подтверждают существующие предположения о том, что стимуляция суперовуляции в цикле ВРТ ЭКО, оказывая влияние на репродуктивную систему, значимо повышает в сыворотке крови уровни гормонов ФСГ, ТТГ, эстрадиола и особенно пролактина и эта тенденция сохраняется в течение 3 месяцев после неудачной попытки ВРТ ЭКО. Полученные результаты позволяют судить о возникновении гормонального дисбаланса у пациенток, что и приводит к изменениям в состоянии тканей молочных желез и развитию доброкачественной дисплазии. Общеизвестно, что пролактин обладает большим количеством биологических действий, чем остальные гипофизарные гормоны в совокупности, а данные ряда исследований позволяют утверждать с высокой степенью вероятности, что повышение концентрации пролактина в крови ассоциируется с риском развития РМЖ [7]. Однако факт роста патологии молочных желез после ВРТ ЭКО за счет увеличения числа пациенток с ДДМЖ с преобладанием железистого компонента имеет хороший прогноз в плане высокой эффективности терапии. Следовательно, в процессе подготовки пациенток к ВРТ ЭКО, а также после неудачной попытки ЭКО требуется не только обязательное обследование молочных желез, но и лечение выявленной доброкачественной патологии.
Литература
* ФГБОУ ВО СибГМУ МЗ РФ, Томск
** КДО ОГАУЗ ОПЦ, Томск
*** ФГБНУ НИИФиРМ им. Е. Д. Гольдберга, Томск








_570.gif)
_570.gif)
_570.gif)