Фиброз аорты сердца что это такое и как лечить
Фиброз аорты сердца что это такое и как лечить
СН — сердечная недостаточность
ССЗ — сердечно-сосудистые заболевания
FGF — фактор роста фибробластов
PICP — С-концевой пропептид проколлагена I типа
PIIINP — N-концевой пропептид проколлагена III типа
TGF-1β — трансформирующий 1β-фактор роста
На протяжении последних 40 лет сердечно-сосудистые заболевания (ССЗ) занимают лидирующие позиции среди причин общей смертности в нашей стране и во всем мире [1, 2]. Несмотря на некоторое снижение смертности от ССЗ в последние годы, по данным ВОЗ, в 2014 г. 1/3 смертельных исходов имела причиной ССЗ, а в России 60% умерших страдали болезнями системы кровообращения [3]. При этом основой прогрессирования большинства ССЗ, включая ишемическую болезнь сердца (ИБС), являются структурные изменения миокарда и сосудистой стенки, ключевым компонентом которых служит фиброз [4].
Фиброз миокарда характеризуется преобладанием синтеза коллагена I и III типов над его деградацией, что приводит к аккумуляции избытка волокон. Выделяют два различных варианта аккумуляции коллагена при фиброзе миокарда: очаговый фиброз, при котором происходит замещение погибших кардиомиоцитов с формированием рубцов (заместительный фиброз), и диффузный фиброз, который развивается в интерстициальном или периваскулярном пространстве и, как правило, не сопровождается существенной потерей функционирующих клеток (реактивный фиброз) [5]. Оба варианта фиброза можно наблюдать после перенесенного инфаркта миокарда, однако диффузный фиброз наиболее характерен для хронических заболеваний сердца, в частности гипертонической болезни, гипертрофической кардиомиопатии (ГКМП), аортального стеноза [4]. Кроме различных инициирующих факторов развития диффузного и очагового фиброза, следует отметить, что в первом случае для фиброзной ткани характерен избыток коллагена I типа — волокон большого диаметра с большим количеством поперечных сшивок, по сравнению с коллагеном III типа — волокнами малого диаметра с минимальным количеством сшивок, который составляет основу заместительного фиброза [6]. Установлено, что в силу различных биофизических свойств коллагена этих типов — при небольшом увеличении соотношения количества коллагена I и III типов повышается жесткость миокарда.
Основными клетками фиброгенеза в миокарде признаны фибробласты, имеющие наибольшее сродство с интактной тканью, а также способные к появлению в результате эпителиально-мезенхимального перехода [7, 8] в ответ на повреждение, которое стимулирует экспрессию таких факторов, как эндотелин-1, трансформирующий 1β-фактор роста (TGF-1β) и ангиотензин II [9]. Большое значение для инициации фиброза отводится окислительному стрессу — конечному общему пути повреждения при различных патологических состояниях, часто наблюдающихся при заболеваниях сердца, легких и почек [10, 11]. Аккумуляция продуктов окисления и неспособность адаптироваться к стрессу, вызванному активными формами кислорода, могут привести к активации иммунной системы с развитием провоспалительного и профибротического состояния, вызывая функциональные и структурные изменения клеток [12]. При этом семейство факторов роста фибробластов (FGF) играет в этом процессе ключевую роль, способствуя гипертрофии и фиброзу миокарда через стимуляцию митогенактивируемых протеинкиназ и регуляцию активности α-Klotho (независимого от α-Klotho кальцинурин-/ядерного фактора активированных Т-клеток), который ингибирует фиброз миокарда, индуцированное TGF-β1, ангиотензином II и гиперфосфатемией [13], усиливая сопротивление окислительному стрессу и дисфункции эндотелия [14]. В экспериментальных моделях внутривенное введение α-Klotho сопровождалось снижением степени гипертрофии миокарда независимо от других факторов [15], тем не менее механизм независимой от α-Klotho сигнализации FGF в миокарде остается неясным [16], а вопрос о возможности модулирования этой сложной системы в целях улучшения исходов ССЗ пока не имеет ответа.
Доказано, что количественные и качественные характеристики фиброза миокарда ответственны за снижение его эластических свойств с развитием диастолической дисфункции [17], ухудшением сократимости с формированием систолической дисфункции [18], развитием нарушений ритма сердца [19] и ухудшением коронарного кровотока [20] у пациентов с сердечной недостаточностью (СН) различной этиологии.
Представляют интерес данные об ассоциации фиброза предсердий (особенно левого предсердия — ЛП) с развитием их фибрилляции и значимым увеличением концентрации предсердных натрийуретических пептидов в крови [25]. Кроме того, продемонстрирована связь между увеличением объема эпикардиальной жировой ткани и обширностью фиброза предсердий у пациентов с фибрилляцией предсердий. Причем эта связь не зависела от объема ЛП, индекса массы тела и других факторов риска развития мерцательной аритмии [26]. Продемонстрирована профибротическая активность эпикардиальной жировой ткани, которая предположительно реализуется влиянием адипофиброкинов — тромбоспондина-1, активина А, принадлежащего к суперсемейству TGF-β и участвующего в патогенезе фиброза легких, почек и печени [27—29]. Авторы подчеркивают, что секреция адипофиброкинов осуществляется адипоцитами, а также фибробластами эпикардиального, а не подкожного жирового депо [30].
Кроме того, имеются данные об ассоциации степени фиброза миокарда с неблагоприятным долгосрочным прогнозом у больных с СН [31, 32]. Важно отметить, что фиброз выявляют в миокарде пациентов с СН, несмотря на проводимую комбинированную терапию, соответствующую современным рекомендациям [5, 6, 33], а степень фиброза рассматривают в качестве предиктора эффективности длительной терапии СН (в частности β-адрено-блокаторами) [34]. В этой связи очевидна необходимость выявления и оценки степени фиброза миокарда не только с точки зрения понимания клинической картины большинства ССЗ, но и для эффективного прогнозирования и адекватного лечения больных. Кроме того, развитие фиброза миокарда может являться механизмом, посредством которого возраст детерминирует развитие СН в общей популяции [35].
Вопрос относительно адекватной оценки количественных и качественных характеристик фиброза миокарда, особенно в клинической практике, стоит весьма остро. В настоящее время стандартом верификации фиброза является гистопатологический анализ ткани миокарда (полученной при эндомиокардиальной биопсии) с определением объемной фракции коллагена (ОФК) I и III типов, а также оценкой их соотношения ОФКI/ОФКIII. Таким образом, фиброз миокарда характеризуется высокими значениями ОФК, ОФКI, ОФКIII и/или соотношения ОФКI/ОФКIII [36]. Однако вследствие неравномерного распределения коллагена в миокарде возможна ошибка при заборе материала, что может явиться ограничением диагностической ценности этой процедуры. Хотя E. Pearlman и соавт. [37] показано наличие диффузного фиброза миокарда на основании результатов аутопсий пациентов с различными ССЗ без явлений СН, такие наблюдения характеризуют фиброз миокарда как генерализованный процесс, однако на практике гистопатологический анализ может не отражать полной картины и соответственно не предоставлять необходимую информацию относительно не столько наличия фиброза, сколько оценки его тяжести.
Следует отметить, что в качестве альтернативы эндомиокардиальной биопсии следует рассматривать неинвазивные методы диагностики, в частности МРТ сердца, с исследованием интерстициального пространства миокарда посредством измерения его внеклеточного объема с помощью Т1-взвешенных изображений. Так, у пациентов с различными заболеваниями сердца продемонстрирована корреляция между внеклеточным объемом миокарда, оцененным с помощью МРТ сердца, и ОФК [38]. Однако, несмотря на то что аккумуляция фиброзной ткани, приводящая к расширению интерстициального пространства, как правило, служит причиной увеличения внеклеточного объема миокарда, в дальнейшем изучении нуждается вопрос о возможности использования этого показателя в качестве объективного параметра оценки фиброза, сопоставимого с ОФК, оцененной гистологическим исследованием.
В этой связи особый интерес представляет выявление биомаркеров фиброза миокарда, доступных для определения в циркулирующей крови. «Идеальный» маркер фиброза миокарда, безусловно, должен не только отражать наличие и степень выраженности фиброза, но также иметь ценность для стратификации риска неблагоприятного течения ССЗ и определения возможностей и подходов к рациональной терапии у конкретного пациента. Столь высокие требования к маркерам фиброза продиктованы практической потребностью и оценкой процесса фиброза как основополагающего звена патогенеза большинства ССЗ. Однако в настоящее время можно говорить лишь о продолжающемся поиске подобных маркеров, большинство из которых, демонстрируя свою ценность в экспериментальных работах, в клинической практике не соответствуют поставленным требованиям.
Так, связь между биомаркером и гистологическим подтверждением фиброза миокарда в большинстве случаев отсутствует или не имеет убедительной доказательной базы [4]. При переносе экспериментальных данных на клинический уровень нередко маркеры, прогностическая ценность которых в развитии фиброза миокарда подтверждается на моделях животных, не отражают наличия и выраженности фиброза у пациентов в определенных клинических ситуациях [4].
Обнаружена статистически значимая корреляция между уровнем С-концевого пропептида проколлагена I типа (карбоксиконцевого пропептида проколлагена I типа — PICP) в сыворотке крови и общей ОФК у пациентов с гипертонической болезнью с наличием [18, 39] и отсутствием СН [40], а также между концентрацией N-концевого пропептида проколлагена III типа (PIIINP) в сыворотке крови и ОФКIII у пациентов с СН на фоне ИБС и дилатационной кардиомиопатии (ДКМП) [41]. Интерес представляют данные об одновременном изменении (снижении) концентрации PICP и гистологического маркера — ОФК у пациентов с гипертонической болезнью без СН в ответ на лечение лозартаном [42], а при наличии СН — торасемидом [39]. Аналогичные изменения отмечены у больных ДКМП на фоне лечения спиронолактоном [43]; кроме того, уменьшение ОФК, отмеченное у этих пациентов, сопровождалось значительным снижением уровня PIIINP в сыворотке крови [43]. Однако и относительно описанных биомаркеров, имеющих на современном этапе наиболее убедительную доказательную базу диагностической эффективности, существует ряд вопросов, требующих дальнейшего изучения. Во-первых, остается неясным тканевое и органное происхождение PICP и PIIINP. Например, есть данные о высвобождении PICP [18], но не PIIINP [44] миокардом у пациентов с СН, напротив, при аортальном стенозе сообщают о чистом высвобождении из сердца PIIINP [45], другие исследователи не обнаружили его выделения в системный кровоток при ИБС и СН, ДКМП [46], а также у пациентов с ГКМП [47]. Во-вторых, диагностическая ценность этих маркеров существенно меняется в зависимости от заболевания. Так, связь между повышением концентрации PICP и ОФКI установлена у больных с СН на фоне ГКМП [18, 48] и отсутствовала при СН на фоне ИБС или ДКМП [46]; для PIIINP и ОФКIII выявлены противоположные закономерности [18, 48]. В-третьих, изменение концентрации этих биомаркеров в сыворотке крови у пациентов с ССЗ может свидетельствовать об общих изменениях сердечно-сосудистой системы, например при избытке коллагена I и III типов в артериальной стенке у пациентов с гипертонической болезнью [4]. И, наконец, наличие сопутствующих заболеваний (печеночной недостаточности, нарушения метаболизма костной ткани и др.), влияющих на метаболизм коллагена, также может существенно изменять концентрацию этих маркеров в крови [49]. Кроме того, обсуждая проблему верификации фиброза миокарда, следует подчеркнуть имеющиеся экспериментальные [50] и клинические [48, 51] данные о различном влиянии повышенного содержания коллагена на гемодинамику левого желудочка в зависимости от степени поперечной сшивки волокон коллагена, что подтверждает необходимость использования маркеров, также оценивающих соединительнотканную структуру миокарда [4].
Роль других биомаркеров, рассматриваемых с точки зрения их диагностической и прогностической ценности в верификации фиброза миокарда в клинической практике, окончательно не определена. Так, отсутствует доказательная база относительно ценности матриксной металлопротеиназы-1 (ММП-1) [52], тканевого ингибитора ММП-1 (ТИМП-1) [52], остепонтина [53, 54], кардиотрофина-1 [55], которые нередко рассматриваются в качестве маркеров, верифицирующих фиброз. Еще более внушителен список маркеров-кандидатов, роль которых нуждается в уточнении, — PICP [41, 43], ММП-2, 3, 8, 9, ТИМП-4, микроРНК-21 [56], TGF-1β [57, 58], фактор роста соединительной ткани [57], галектин-3 [57, 59] и др. Одной из причин неоднозначной связи верифицированного фиброза с циркулирующими биомаркерами может служить их различная роль в процессе фиброза. В частности, в ответ на стимуляцию альдостероном и ангиотензином макрофаги экспрессируют галектин-3, который является мощным стимулом пролиферации фибробластов и выработки избыточного количества коллагена [12, 60, 61], в то время как ММП выполняют функцию его резорбции. Кроме того, следует учитывать сложность взаимодействия различных биологически активных веществ в процессах регуляции, прогрессирования и регрессирования фиброза [12], причем эти динамичные процессы могут иметь свои особенности в различных органах, развиваясь с неодинаковой интенсивностью, приводя не только к нарушению функции органов, но и грубой структурной перестройке [62].
Важным аспектом изучения фиброза является не только его интерпретация в качестве типового патологического процесса, но и рассмотрение как системного поражения различных органов и тканей [12]. Так, механическое или ишемическое повреждения кардиомиоцитов способно стимулировать повреждение отдаленных органов (легких, почек, печени) посредством реакций врожденного иммунитета, нейрогуморальной активации и, возможно, продуктов метаболизма (например, каталитического железа) [63]. Существуют данные, доказывающие роль фиброза миокарда, легких и почек (путем переноса нейрогуморальной активации на уровень клеточных сигналов) в патогенезе и прогрессировании различных заболеваний [12], связанных с 1/3 всех смертельных исходов в мире [64].
С момента доказательства роли фиброза в развитии дисфункции различных органов, обеспечении системности большинства заболеваний, особенно на конечных стадиях развития, фиброз стали рассматривать в качестве перспективной терапевтической мишени. Причем фиброгенез расценивается именно как динамичный процесс, способный к регрессу или существенному снижению темпов прогрессирования при определенных условиях [62]. В частности, устранение провоцирующего воздействия является одним из основных и эффективных терапевтических подходов. Однако в современной практике наиболее реалистичной терапевтической целью является замедление прогрессирования фиброза, а не его регресс [62]. В частности, ингибиторы ангиотензинпревращающего фермента, антагонисты альдостерона, статины, применяемые для лечения больных с СН, оказывают антифибротические эффекты. Такая терапия способна вызывать «обратное ремоделирование» сердца, уменьшать частоту аритмических ослонений, в частности желудочковой тахикардии [65, 66] и внезапной смерти [67]. Многообещающей представляется идея, основанная на экспериментальных данных о возможности трансформации фибробластов в кардиомиоциты [68, 69] с обеспечением нормальной регенерации миокарда.
Следует отметить, что фиброз различной локализации подтверждает возможность переноса нейрогуморальной активации на уровень клеточных сигналов, являясь одной из стадий патогенеза различных заболеваний. Дальнейшее изучение фиброза миокарда, а также других органов и тканей направлено на получение информации о патогенезе большого числа заболеваний, повышение эффективности диагностики и прогнозирования их течения, а также патогенетически обоснованной терапии.
Заключение
На современном этапе отмечается неуклонный рост ССЗ с развитием СН, в большинстве случаев фиброз миокарда является детерминантой неблагоприятного исхода. В рамках этой концепции верификация фиброза, мониторирование темпов его прогрессирования, оценка антифибротической эффективности проводимого лечения представляют несомненную научную и практическую ценность. Дальнейшее изучение и валидация биомаркеров фиброза позволят существенно повысить эффективность прогнозирования с возможностью выбора и оценки оптимальной лечебной и профилактической тактики ведения пациентов с ССЗ.
Что такое приобретённый порок сердца? Причины возникновения, диагностику и методы лечения разберем в статье доктора Петрова А. А., терапевта со стажем в 6 лет.
Определение болезни. Причины заболевания
Порок сердца — это органическое поражение клапанов сердца, его перегородок, больших сосудов и миокарда (мышечной ткани сердца). Заболевание приводит к нарушению функции сердца, застою крови в венах, тканях и органах.
Пороки могут быть как врождёнными, так и приобретёнными. Врождённые пороки выявляют в первый год жизни во время диспансеризации с помощью УЗИ сердца.
Изменение клапанов возникает под влиянием следующих причин:
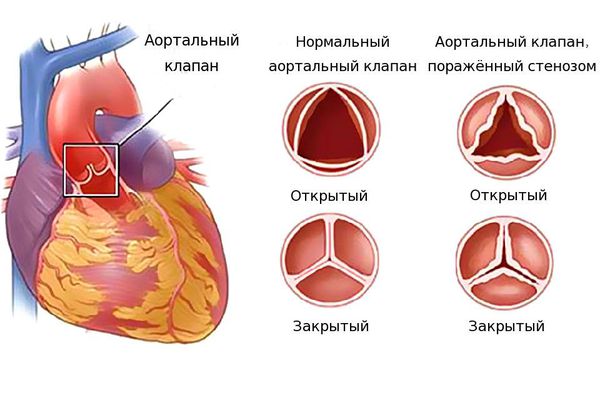
Изменение клапанов проявляется фиброзом (разрастанием соединительной ткани), утолщением створок и кальцинозом (отложением кальция в мягких тканях).
Пороки сердца могут возникнуть в любом возрасте, например после травмы грудной клетки. Но чаще всего заболевание формируется в пожилом возрасте. Это связано с тем, что для воздействия на организм большинства факторов требуется продолжительное время.
Симптомы приобретённых пороков сердца
В большинстве случаев заболевание проходит без симптомов, пока не приведёт к значимому изменению тока крови внутри сердца — ускорению потока или его обратному движению. Это становится причиной нарушения функции сердца и проявляется следующими симптомами:
Другим признаком приобретённых пороков сердца может быть цианоз — синюшное окрашивание кожи и слизистых оболочек разной интенсивности: от лёгкой светло-синей до выраженной синевато-чёрной. Цианоз на губах, кончике носа и кончиках пальцев называют акроцианозом. Он особенно выражен при митральном пороке сердца и получил название «митральный румянец». При аортальных пороках кожные покровы обычно бледные. Это связано с недостаточным наполнением капилляров кровью.
Если застой жидкости происходит в печени и сопровождается разрушением её клеток, то кожные покровы могут приобрести желтушный цвет. Особенно это заметно на белках глаз.
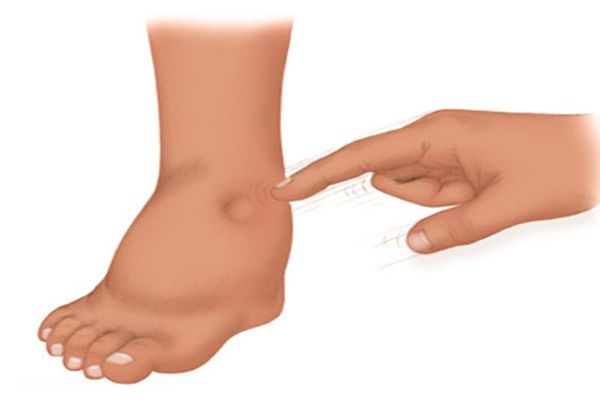
При приобретённых пороках сердца могут появиться отёки. Они выявляются при надавливании большим пальцем в области лодыжек, стопы, крестца и других частей тела.
При выслушивании сердца (аускультации) можно выявить различные шумы. При аускультации лёгких выслушиваются симметричные мелкопузырчатые, напоминающие лопанье пузырьков в газированном напитке влажные хрипы и ослабленное дыхание в нижних отделах.
Патогенез приобретённых пороков сердца
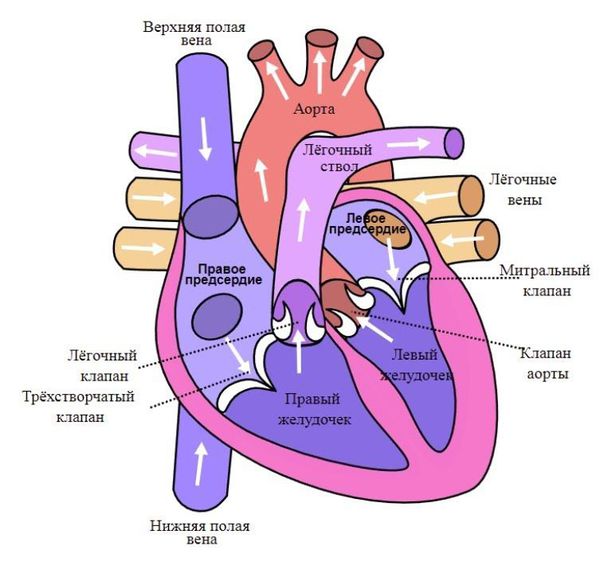
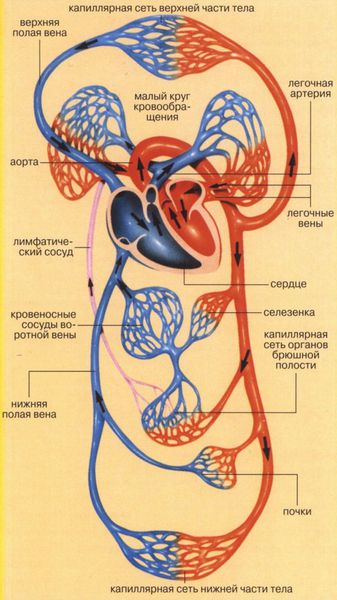
Сердце состоит из двух отделов: левого — артериального и правого — венозного. Артериальная кровь, обогащённая кислородом, течёт в левых отделах сердца, а венозная, обеднённая кислородом кровь, — в правых.
«Левое» сердце состоит из левого предсердия и лёгочных вен, левого желудочка и аорты. «Правое» сердце включает правое предсердие, верхнюю и нижнюю полые вены, правый желудочек и лёгочную артерию. Между предсердиями и желудочками находятся клапаны сердца:
Клапаны, словно двери, пропускают поток крови в одну сторону и не допускают прохода обратно. Если же клапан изменён и при закрытии его образуется щель, то происходит обратный поток крови — регургитация. Щель возникает из-за следующих патологических изменений:
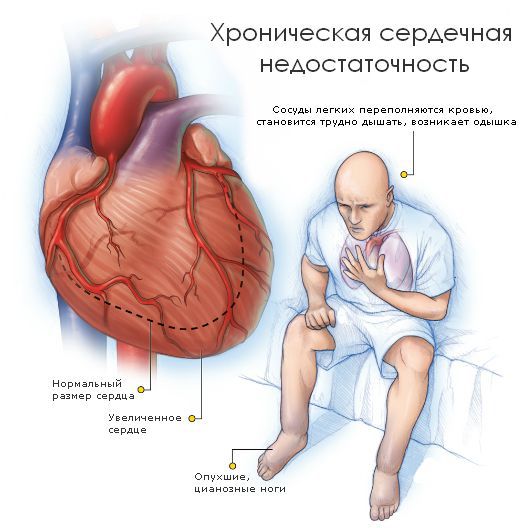
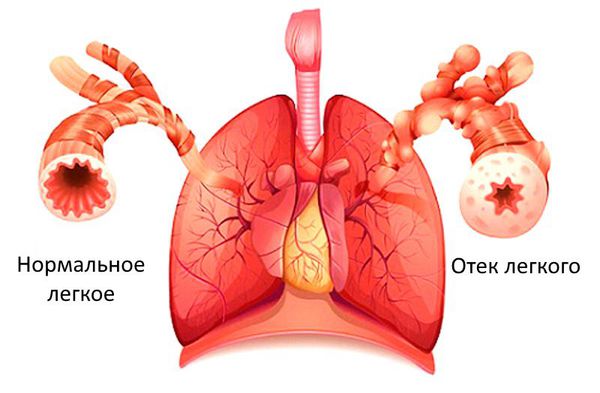
Если же клапан сужен, то это препятствует току крови. Такое состояние называется стенозом. Чаще всего стеноз или недостаточность возникают изолированно в отдельных клапанах, однако возможны ситуации, когда поражены несколько клапанов. Разрушение клапанов приводит к нарушению циркуляции крови, возникновению застойных явлений в малом и большом круге кровообращений. Из-за этого появляются признаки сердечной недостаточности: одышка, отёки, кашель и другие симптомы.
Классификация и стадии развития приобретённых пороков сердца
Существующие классификации приобретённых пороков сердца имеют некоторые различия. Это связано с тем, для каких специалистов они предназначены — кардиологов или кардиохирургов. В общей клинической практике целесообразно использовать классификацию по признакам заболевания в той последовательности, которая принята для постановки диагноза. Наиболее распространено разделение на следующие виды:
Осложнения приобретённых пороков сердца
Если застойные явления происходят в малом круге кровообращения, то возникает дыхательная недостаточность и возможен отёк лёгких. Признаком дыхательной недостаточности является одышка при физической нагрузке. Если одышка возникает при нагрузке, которую пациент раньше выполнял без особых усилий, то она является патологической и следует обратиться к врачу.
При структурных изменениях в сердце могут происходить нарушения ритма: частые экстрасистолии (сильные сердечные толчки с «провалом» или «замиранием» после них), мерцательная аритмия (неравномерное учащённое сердцебиение), приступы тахикардии (увеличение частоты сердечных сокращений). Мерцательная аритмия часто возникает при расширении левого предсердия. Это может привести к тромбозу (закупорке сосуда, питающему головной мозг) и в результате — ишемическому инсульту (нарушению мозгового кровообращения), ослаблению мышц или параличу.
Диагностика приобретённых пороков сердца
После тщательного опроса, изучения истории болезни и осмотра переходят к инструментальным и лабораторным методам исследований:
Эхокардиография.
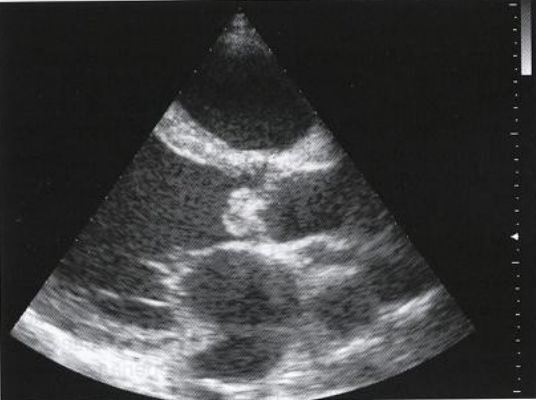
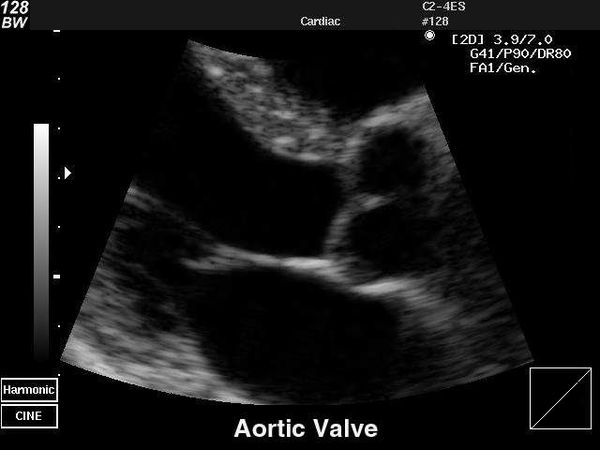
Эхокардиография (ЭхоКГ) — ключевой метод подтверждения диагноза клапанной болезни сердца, а также оценки её тяжести и прогноза. В ходе исследования визуализируют структуру клапанного аппарата, измеряют объёмы и размеры камер сердца, определяют стеноз и наличие обратного тока крови.
Существует трансторакальная и чреспищеводная эхокардиографическая диагностика. Трансторакальный метод — более доступный и неинвазивный. Ультразвуковой датчик располагается на грудной клетке спереди. При чреспищеводном ЭхоКГ датчик вводится в пищевод, исследование проводят на уровне сердца. Так как датчик находится ближе к сердцу, то структуры на экране визуализируются более чётко.
На первом этапе обследования достаточно проведения трансторакального ЭхоКГ.
Другие неинвазивные методы исследования.
2.1 Нагрузочные тесты (стресс-эхокардиография, тредмил-тест, велоэргометрия)
Нагрузочные тесты применяют для выявления объективных признаков заболевания при неспецифических симптомах или их полном отсутствии. Эти тесты особенно полезны для оценки риска сердечно-сосудистых осложнений при аортальном стенозе. Пробы с физической нагрузкой также помогают определить уровень рекомендуемой активности, в том числе оптимальную интенсивность спортивных тренировок. Например при велоэргометрии на пациента прикрепляют электроды, просят сесть на велотренажер и крутить педали. Постепенно нагрузку увеличивают, одновременно следя за состоянием больного.
2.2 Магнитно-резонансная томография сердца. Для обследования пациентов с неодназначными результатами ЭхоКГ применяют магнитно-резонансную томографию сердца (МРТ). С помощью МРТ оценивают тяжесть поражения клапанов, выраженность обратного тока крови, определяют объём желудочков, систолическую функцию, аномалии восходящей аорты и фиброз миокарда. МРТ сердца — эталонный метод для определения объёма и функции правого желудочка. Исследование полезно для оценки последствий обратного тока крови при закрытии трикуспидального клапана.
2.3 Компьютерная томография. Мультиспиральную компьютерную томографию (МСКТ) используют для оценки тяжести поражения клапанов, особенно при аортальном стенозе. МСКТ играет важную роль при планировании транскатетерных вмешательств. Компьютерная томография может быть полезна для исключения ишемической болезни сердца.
2.4 Видеофлюороскопия — это съёмка работы сердца при помощи рентгеновских лучей. Предварительно в организм пациента вводят рентгеноконтрастное вещество, что даёт возможность наблюдать за током крови. Видеофлюороскопия важна для оценки механической дисфункции искусственного клапана.
3. Инвазивные методы исследования.
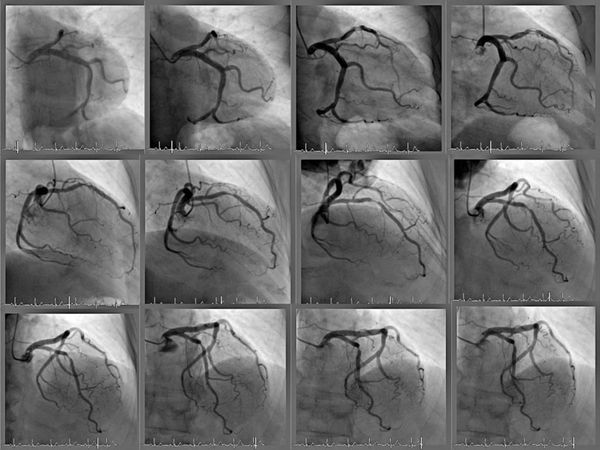
3.1 Коронарная ангиография (КАГ) показана для оценки ишемической болезни сердца (ИБС) при планировании открытого или эндоваскулярного вмешательства — операции на кровеносных сосудах, осуществляемой без разрезов через небольшие проколы на коже.
3.2 Катетеризация сердца — процедура, при которой гибкий катетер (полая трубка) через периферическую артерию или вену на руке или ноге вводится внутрь сосуда. Под контролем рентгеновского аппарата проверяют движение катетера до нужной полости сердца. Процедура даёт представление о давлении внутри камер сердца, составе крови в каждом отделе, работе клапанов, строении стенок и перегородок и используется для оценки кровотока.
Данные ЭхоКГ требуется подтверждать результатами инвазивного исследования, если единственным показанием к хирургическому лечению является высокое давление в лёгочной артерии. В большинстве же случаев эхокардиография — самый доступный метод обследования, с помощью которого с высокой достоверностью можно определить наличие или отсутствие порока сердца.
Лечение приобретённых пороков сердца
Лекарства, способного запустить обратный процесс и восстановить клапан до первоначального состояния, не существует. С помощью медикаментозного метода лечения возможно лишь повлиять на сердечно-сосудистую систему и снизить риск развития осложнений. В тяжёлых случаях применяют хирургические методы лечения.
Медикаментозное лечение
Цель терапии — устранить причины недостаточности кровообращения, улучшить функциональное состояние миокарда, восстановить нормальную циркуляцию крови, микроциркуляцию (транспорт клеток крови и веществ к тканям и от тканей) и предотвратить повторные расстройства кровообращения. Лечение при хронической недостаточности кровообращения включает полноценное сбалансированное питание и лекарственную терапию.
Основные группы препаратов, применяемых при нарушении в работе клапанов:
1. Ингибиторы АПФ (ангиотензинпревращающего фермента) — эналаприл, лизиноприл, рамиприл, периндоприл, фозиноприл. Препараты блокируют превращение гормона ангиотензина I в ангиотензин II. Ангиотензин II оказывает сосудосуживающее действие и вызывает быстрое повышение артериального давления. Ингибиторы АПФ применяют для лечения артериальной гипертензии, терапии или профилактики сердечной недостаточности.
2. Бета-блокаторы — карведилол, бисопролол, метопролол. Эти препараты снижают артериальное давление и нормализуют ритм сердечных сокращений. Действие вызвано блокированием бета-адренорецепторов, отвечающих за реакцию организма на стресс.
3. Антагонисты минералокортикоидных рецепторов — спиронолактон, эплеренон. Препараты понижают артериальное давление и обладают мочегонным воздействием, уменьшая содержание жидкости в тканях.
Существуют различные варианты пороков сердца, для лечения каждого из них применяют различные комбинации препаратов. Также учитывают сопутствующие патологии и индивидуальные особенности пациента.
Например при преобладании застойных явлений дополнительно назначают мочегонные препараты (фуросемид, торасемид), которые снижают объём циркулирующей крови, уменьшая застойные явления в малом и большом круге кровообращений. При наличии тромбов или при высоком риске их появления применяют антикоагулянты — препараты, снижающие свёртываемость крови (варфарин, ривароксабан, дабигатран, апиксабан).
Относительно недавно был разработан новый класс препаратов — ингибиторы рецепторов ангиотензина-неприлизина (сакубитрил). Основное их действие — это повышение количества пептидов, расщепляемых неприлизином. Препараты увеличивают диурез (объём мочи), натрийурез (выведения натрия с мочой), вызывают расслабление миокарда и препятствуют процессам нарушения структуры и функции сердца.
Хирургическое лечение
При наличии показаний, недостаточной эффективности медикаментозного лечения и отсутствии противопоказаний применяют хирургические методы. Многих пациентов пугает необходимость проведения операции на сердце. В некоторых случаях хирургические методы действительно несут определённый риск, но существуют достаточно безопасные операции не на открытом сердце и без больших разрезов. К таким операциям относится баллонная комиссуротомия при стенозе митрального клапана. Метод состоит в расширении клапана с помощью катетера, проведённого через артерию.
Перед оперативным вмешательством проводят необходимые лабораторные, инструментальные исследования и стабилизируют состояние пациента лекарственными препаратами. При подготовке к операции важно уменьшить одышку, отёки, нормализовать пульс и артериальное давление.
Распространённым хирургическим методом является протезирование искусственным или биологическим клапаном. Существуют и клапан-сохраняющие операции, которые заключаются в пластике повреждённого клапана.
Прогноз. Профилактика
При своевременном обращении пациента к врачу и соблюдении рекомендаций прогноз благоприятный. К каждому случаю врач подходит индивидуально, начиная с подбора медикаментозного лечения и до выбора оперативных методов.
Первичная профилактика приобретённых пороков сердца состоит в предупреждении болезней, приводящих к поражению клапанного аппарата сердца: ревматизма, инфекционных эндокардитов, атеросклероза, сифилиса и более редких патологий, например карциноидной болезни.
Профилактика предполагает ведение здорового образа жизни, который включает: