Филадельфийская хромосома что это
«Филадельфийская хромосома» и ее продукты: влияние реципрокной транслокации на развитие некоторых видов гемобластозов
Одними из наиболее агрессивных злокачественных новообразований человека были и остаются гемобластозы — опухоли кроветворной ткани. Своеобразным и наиболее изученным маркером некоторых гемобластозов, а чаще всего хронического миелоидного лейкоза, является «филадельфийская хромосома» — продукт реципрокной транслокации участков хромосом, происходящей без потери генетического материала и с образованием химерных белковых продуктов. В этом материале расскажем о происхождении известной многим «филадельфийской хромосомы» и других транслокаций, приводящих к формированию неопластических процессов в красном костном мозге.
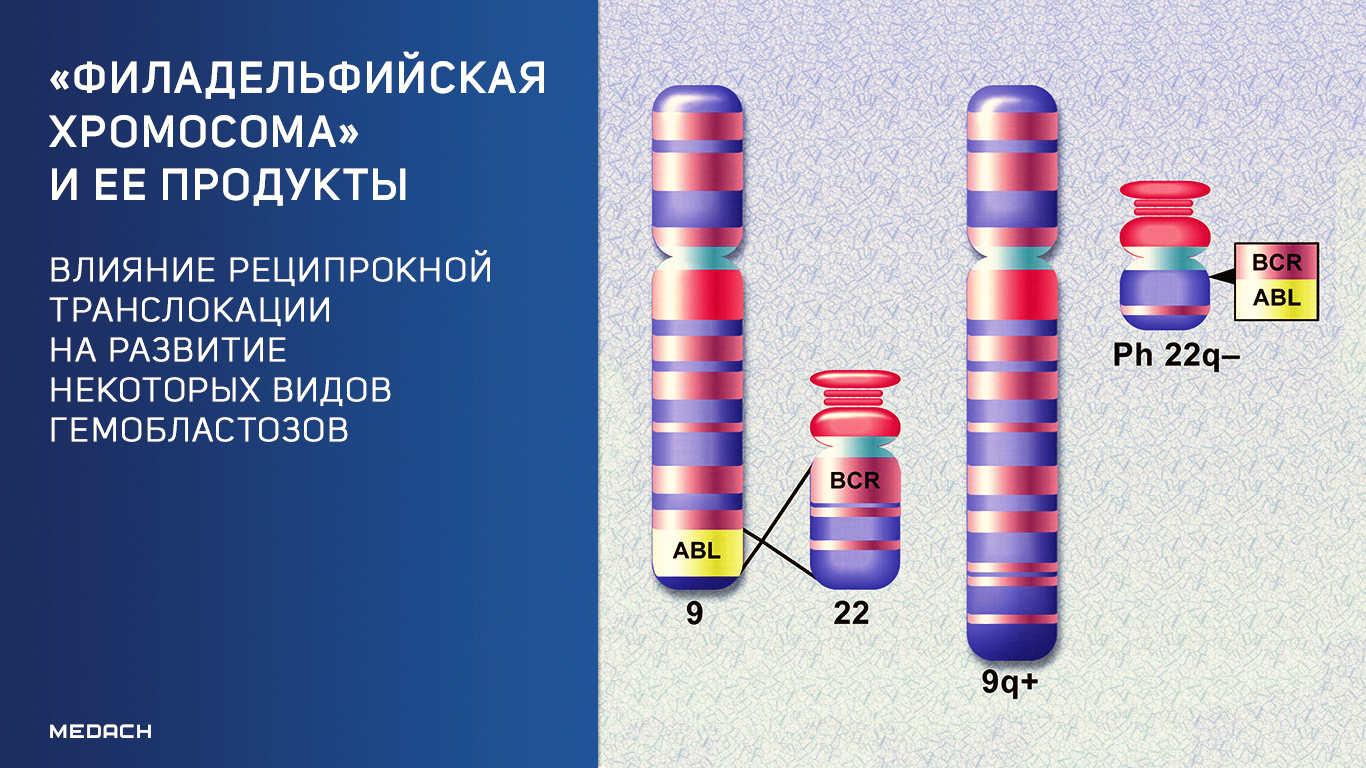
«Филадельфийская хромосома» — это результат транслокации участков 9 и 22 хромосом, не приводящей к потере генетического материала. Вариант такой хромосомной перестройки был открыт в 1960 году в ходе изучения этиологии множества случаев хронического миелоидного лейкоза (ХМЛ). Ассоциированные с данной транслокацией гемобластозы (95 % от общего числа) стали обозначаться как Ph+, но важность открытия заключается не столько в обнаружении собственно транслокации. Функциональная активность данной хромосомной перестройки обусловливается слиянием участков нормальных генов с формированием химерных генов и их белковых продуктов.
Наиболее часто слиянию с другими генами подвергается ген BCR. Причины этого пока не ясны, однако предполагается, что это связано с локализацией BCR в нестабильном участке 9 хромосомы. Этот участок наиболее часто подвергается поломкам в метафазе ввиду репликативного стресса, и транслокация является одним из вариантов такой поломки. Хотя слияние BCR с другими генами было обнаружено и в солидных опухолях внутренних органов, функционально активные химерные белки — продукты слившихся генов — отмечаются исключительно в различных вариантах гемобластозов [1].
Наиболее часто в ткани красного костного мозга при гемобластозах обнаруживается функционально активный химерный белок BCR/ABL — продукт слияния генов BCR и ABL1. Ген BCR/ABL1 включает в себя участки обоих слившихся генов-партнеров в разных вариантах. Наиболее распространенным, особенно среди случаев хронического миелоидного лейкоза, является вариант p210 — слияние экзонов 13 и 14 от BCR с экзоном 1 от ABL. Каждый из структурных вариантов белка BCR/ABL активирует различные сигнальные пути, которые при этом могут иметь только внутриклеточную локализацию (в связи с цитоплазматической локализацией химерных белков). Так, вариант p210 стойко ассоциирован с активацией киназ STAT5 и MAPK [2].
Активация этих и других сигнальных путей ведет к повышению выживаемости опухолевой клетки и скорости ее пролиферации, что обеспечивает агрессивный характер ассоциированных гемобластозов. Наиболее часто химерные гены, образованные в результате слияния BCR, обнаруживаются при хроническом миелоидном лейкозе, остром лимфобластном лейкозе, остром миелобластном лейкозе, истинной полицитемии [1].
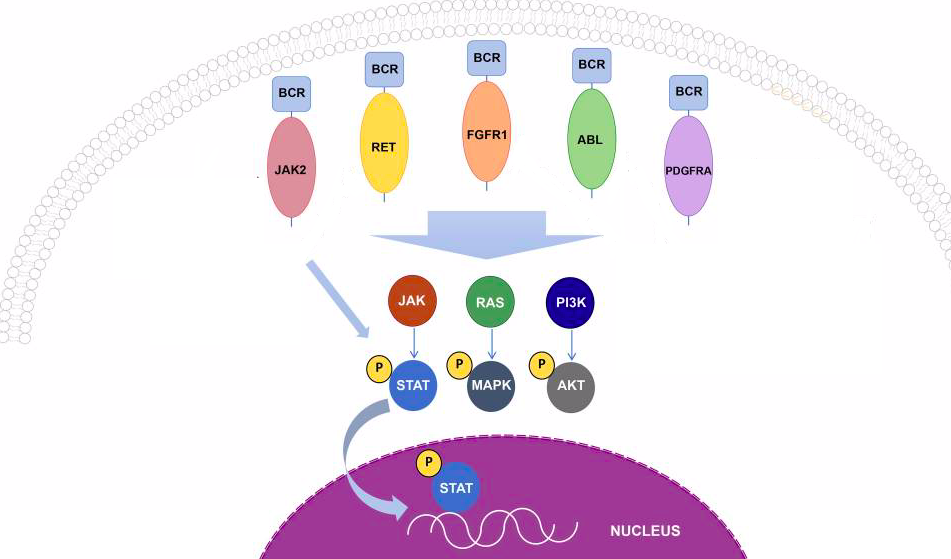
Рисунок 1 | Каскады киназ, ассоциированные с различными слияниями гена BCR.
Интересно, что любой из структурных вариантов гена BCR/ABL1 предполагает расположение BCR в качестве N-концевого участка и ABL — как С-концевого участка. Все варианты химерных генов также включают домен спиральной катушки с участками BCR и функционально активный домен с участками ABL. Предполагается, что домен спиральной катушки от BCR вызывает димеризацию ABL, что модулирует его функциональную активность — именно поэтому лечение Ph+ хронического миелоидного лейкоза основано на ингибировании функции ABL [1].
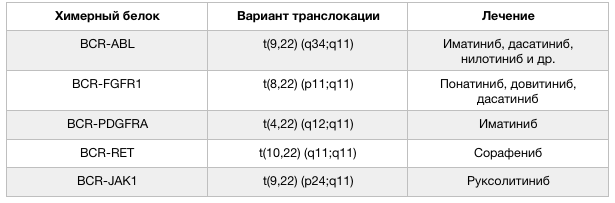
Встречаются и варианты слияния BCR с другими генами. Реже, чем в случае «филадельфийской хромосомы», BCR обнаруживается в ассоциации с FGFR1, PDGFRA, RET и JAK2. Такие транслокации встречаются при различных гемобластозах относительно редко, но клинические данные свидетельствуют о том, что пациенты, несущие данные мутации, должны получать дополнительную персонализированную таргетную терапию. Важным способом определения этой и других транслокаций, ассоциированных с развитием гемобластозов, стали различные методы секвенирования (о них мы писали в этом материале — https://medach.pro/post/1858). К настоящему моменту определено более 500 онкогенных транслокаций, благодаря чему стала возможна по-настоящему персонализированная медицина ассоциированных с ними клинических состояний.
Рисунок 2 | Варианты транслокации с участием гена BCR и лечение гемобластозов, ассоциированных с такими транслокациями [1].
Открытие химерного белка BCR/ABL позволило предложить новые методы лечения пациентов с гемобластозами, в первую очередь — с хроническим миелоидным лейкозом и острым лимфобластным лейкозом. В типичных случаях для лечения ХМЛ использовали интерферон альфа, гидроксикарбамид и бусульфан, однако применение этих препаратов не позволяло добиться полного цитогенетического ответа. В 1996 году был разработан иматиниб — ингибитор ABL, используемый для лечения Ph+ ХМЛ. Его внедрение в клиническую практику привело к существенному удлинению ремиссий хронического миелоидного лейкоза и позволило чаще добиваться значительного гематологического и цитогенетического ответа у большинства пациентов. Вслед за этим последовало открытие ингибиторов тирозинкиназ второго и третьего поколений: к ним относятся такие препараты, как дазатиниб, нилотиниб, босутиниб. Внедрение данных средств позволило увеличить ожидаемую продолжительность жизни пациентов с хроническим миелоидным лейкозом на 3–7 лет [3].
Использование иматиниба и других ингибиторов тирозинкиназ вскоре стало сопровождаться формированием лекарственной резистентности. Наиболее часто такая резистентность связана с формированием мутации T315I. Данная мутация ассоциирована со снижением аффинитета киназных ингибиторов и способна восстанавливать утраченный лейкемогенный потенциал BCR/ABL. Пациентам, несущим такую мутацию, мало помогает таргетная терапия ингибиторами тирозинкиназ, поэтому в настоящее время ведется активный поиск средств, способных обходить действие T315I [4].
Одним из препаратов, обладающих таким потенциалом, является таксодион, полученный из хвойного растения — болотного кипариса (Taxodium distichum). В экспериментах этот препарат в значительной степени индуцирует апоптоз ассоциированных с миелогенными лейкемиями клеток, положительных в отношении гена BCR/ABL. Такcодион снижает активность III митохондриального комплекса дыхательной цепи, что приводит к выработке активных форм кислорода, накопление которых ведет к индукции гибели опухолевых клеток. Таким образом, таксодион имеет большой потенциал как противоопухолевое средство с высокой эффективностью в отношении клеток с BCR/ABL, которое способно функционировать при наличии мутации T315I [5].
Таким образом, «филадельфийская хромосома» раскрывается для нас с новой стороны: становятся известны причины формирования дефекта и следствия его наличия. На сегодняшний день научный поиск в отношении BCR/ABL и других транслокаций значительно продвинулся, что отразилось на продолжительности и качестве жизни пациентов с гемобластозами, однако нельзя заявлять, что патогенез этих злокачественных новообразований полностью изучен. По-прежнему требуются исследования и разработки, способные нивелировать все современные проблемы фармакорезистентности, а возможно и повысить эффективность лечения различных форм гемобластозов.
Источники:
Филадельфийская хромосома что это
Хронический миелоидный лейкоз (ХМЛ) — клональное новообразование, развивающееся из стволовых кроветворных клеток. Это первая опухоль человека, при которой был обнаружен характерный хромосомный маркер. Открытие сделано в 1960 г. американскими исследователями Р. С. Nowell и D. A. Hungerford в Филадельфии, поэтому маркер был назван филадельфийской (Ph)-хромосомой. Именно с этой находки началась клиническая цитогенетика в онкологии.
Филадельфийская хромосома — укороченная хромосома из группы так называемых малых акроцентриков. В каждой нормальной женской клетке эта группа включает две пары хромосом — 21-ю и 22-ю, а в мужских клетках таких хромосом не 4, а 5, поскольку в эту группу, кроме 21-й и 22-й хромосомных пар, включена также Y-хромосома.
Ph-хромосома выявляется при обычной окраске (без G-бендинга) практически у всех больных хроническим миелоидным лейкозом (95—98 %). На дифференциально окрашенных (бендинг) хромосомах видно, что укорочена одна из хромосом 22-й пары.
Примерно у 90 % больных Ph-хромосома видна во всех анализируемых метафазах, у остальных пациентов обнаруживают как клетки с Ph-хромосомой, так и нормальные клетки, причем в отдельных случаях Ph-хромосома регистрируется в меньшинстве клеток костного мозга. Транслокация (9;22) наблюдается в миелоидных клетках, эритробластах, В-и Т-лимфоцитах, мегакариоцитах. Этот факт свидетельствует о том, что заболевание начинается с некоммитированной клетки-предшественницы гемопоэза.
В 1973 г. знаменитым американским исследователем J. D. Rowley было установлено, что Ph-хромосома образуется не вследствие делеции хромосомы 22, как предполагали ранее, а в результате сбалансированной транслокации между хромосомами 9 и 22 (участками 9q34 и 22qll), при этом формируются две маркерные хромосомы, обозначаемые как 9q+ и 22q- (Ph). Изредка наблюдаются перестройки, скрывающие укороченную хромосому 22, — так называемая замаскированная Ph-хромосома, т. е. маленький фрагментик, оторвавшийся от любой другой хромосомы, может «прилепиться» к обломанной хромосоме 22 и «замаскировать» поломку. Эта «маскировка» довольно легко раскрывается при дифференциальной окраске.
Примерно в 10 % случаев наблюдаются атипичные транслокации, при которых стандартное цитогенетическое исследование позволяет увидеть перенос фрагмента хромосомы 22 не на 9-ю, а на какую-либо другую хромосому. Кроме того, иногда при хроническом миелоидном лейкозе обнаруживают сложные Ph-транслокации с участием не двух (9-й и 22-й), а трех или более хромосом.
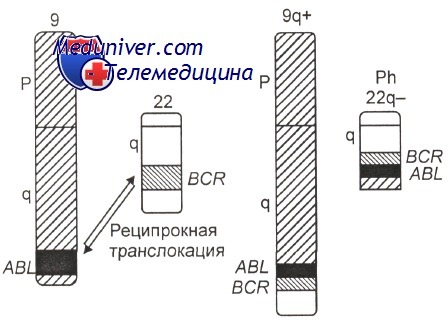
Установлено, что практически при всех Ph-транслокациях участвуют хромосомы 9 и 22, однако это не всегда видно при стандартном цитогенетическом исследовании, но обнаруживается при использовании FISH и ПЦР.
Большинство исследователей считают, что тип Ph-транслокации (стандартная, атипичная или сложная) не имеет клинического значения.
Использование молекулярно-генетических методов позволило установить, что в хромосоме 9 разрыв проходит через ген (протоонкоген) ABL, идентифицированный ранее в одном из вирусов лейкоза у мышей. В хромосоме 22 наблюдается разрыв гена ВСЯ. В результате слияния фрагментов названных генов (ABL и BCR) образуется химерный ген BCR-ABL, расположенный, как правило, на делетированной хромосоме 22 (Ph-хромосома) Схематическое изображение молекулярно-генетических событий, приводящих к развитию хронического миелоидного лейкоза, показано на рисунке.
Примерно в 70 % случаев, кроме транскрипта BCR-ABL, обнаруживают продукт (транскрипт) другого химерного гена, образующегося в результате t(9;22) —ABL-BCR на der (9), однако его роль в развитии хронического миелолейкоза неясна.
Установлен еще один важный факт: примерно у 20—25 % больных хроническим миелолейкозом имеется делеция в маркерной хромосоме 9q+. Эта аномалия не видна при «простом хромосомном анализе». Ее можно обнаружить только при использовании FISH со специально разработанными зондами. Размер делеции варьирует от пациента к пациенту: делетированный участок может включать последовательности гена BCR, перенесенные на хромосому 9 с хромосомы 22, последовательности самой хромосомы 9 или последовательности обеих этих хромосом.
Установлено, что делеция возникает одновременно с формированием специфической t(9;22), ее частота одинакова в группах больных, обследованных на разных стадиях хронического миелолейкоза. Независимо от метода лечения (даже при использовании программ, включающих гливек) прогноз у больных с интерстициальной делецией в маркере 9q+ существенно хуже, чем у больных без этой аномалии. Длительность хронической фазы и соответственно выживаемость у больных с делецией значительно меньше. Так, при обследовании большой группы больных (241) обнаружено, что медиана выживаемости была 38 мес для больных с делецией (39 человек) и 88 мес для группы больных без делеции (202 человека). Различия статистически значимы.
Применение этого информативного прогностического метода пока, к сожалению, не вошло в широкую клиническую практику, поскольку он весьма сложен и требует дорогостоящих реактивов и оборудования.
Роль делеции маркера 9q+ в прогрессии хронического миелолейкоза пока до конца не выяснена. Выпадение кодирующих последовательностей генов ABL и/или BCR в результате делеции приводит к тому, что экспрессируется только один химерный ген BCR-ABL, но нет экспрессии гена ABL-BCR. Возможно, и это событие играет роль в профессии лейкоза. Обсуждается также возможность инактивации неизвестных пока генов-супрессоров, локализованных в хромосомном районе, который делетируется.
Химерный ген BCR-ABL кодирует белок с мол. м. 210 000, обладающий более высокой протеинкиназной активностью, чем продукт нормального протоонкогена ABL (Р145). При лейкозе, вызванном у мышей вирусом Абельсона, онкогенной активностью обладает белок — продукт гибридного гена gag/abl с высокой протеинкиназной активностью. В эксперименте проводили вырезание гена gag/abl, после этого вирус терял способность вызывать лейкоз у мышей.
Изучение разрывов в генах ABL и BCR при хроническом миелолейкозе показало, что у разных больных их локализация неодинакова. Так, в гене ABL протяженность участка, на котором могут происходить разрывы, велика —до 200 kb, а в гене BCR разрывы локализуются обычно на маленьком участке — 8,5 kb, т. е. имеется кластер разрывов, отсюда название самого гена BCR (breakpoint cluster region).
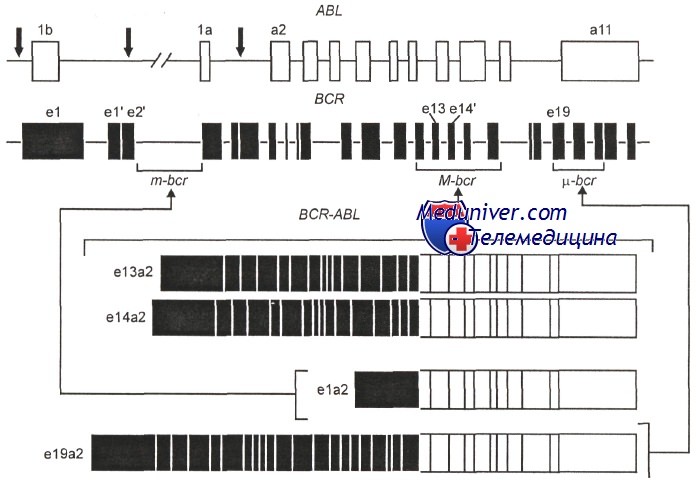
Первый ряд — разрывы в гене ABL; второй ряд — три кластера разрывов в гене BCR: m-BCR, М-BCR и u-BCR. Ниже три типа транскриптов химерных генов BCR-ABL, различающихся по длине вошедших участков гена BCR
В подавляющем большинстве случаев t(9;22) разрывы гена BCR обнаруживают на участке, обозначаемом M-BCR, при этом химерный ген включает длинный фрагмент гена BCR и в результате возникает характерный для хронического миелолейкоза белок P210Bcr/Abl. Кроме того, при t(9;22) разрывы в гене BCR могут локализоваться на одном из двух других типичных участков, называемых m-bcr и u-bcr. Разрывы в области m-bcr приводят к образованию химерного белка Р190Bcr/Abl, т. е. белка меньшей величины, чем Р210Bcr/Abl. При локализации разрывов в u-bcr образуется более крупный белок Р230Bcr/Abl.
Эти молекулярные различия не строго коррелируют с клиническими особенностями лейкозов. Так, Р190Bcr/Abl характерен для двух абсолютно разных лейкозов: с одной стороны, это Ph-позитивный острый лимфобластный лейкоз, а с другой — хронический гранулоцитарный лейкоз с выраженным моноцитозом и миелодиспластическими чертами. При обнаружении Р230Bcr/Abl обычно наблюдается картина так называемого нейтрофильного варианта хронического миелолейкоза, т. е. хронический миелолейкоз, при котором формула крови представлена зрелыми нейтрофилами и единичными метамиелоцитами. Кроме того, название «нейтрофильный гранулоцитарный лейкоз» используется на протяжении многих лет для обозначения Ph(BCR-ABL)-негативного хронического миелолейкоза — относительно доброкачественного варианта, наблюдаемого у пожилых людей, но редко встречающегося и у подростков.
Как отмечалось, коррелятивная связь между типом химерного белка (P190Bcr/Abl, Р210Bcr/Abl или Р230Bcr/Abl) и клинико-гематологичесой картиной лейкоза не является строгой. Любой из этих белков может быть обнаружен при классической картине хронического миелолейкоза. Есть также сообщения о нередком сочетании двух типов белков (Р210Bcr/Abl| и Р190Bcr/Abl) при типичном хроническом миелолейкозе и при остром лимфобластном лейкозе.
Реальная частота «атипичных» белков BCR-ABL при типичном хроническом миелолейкзе неизвестна, поскольку исследования на большом материале не проводились.
Решающая роль гена BCR-ABL и его продукта — белка Р210 в развитии хронического миелолейкоза продемонстрирована на разных модельных системах in vivo и in vitro. Так, трансдукция bcr/abl в стволовые гемопоэтические клетки мыши с последующей трансплантацией этих клеток облученным сингенным животным вызывает у них миелопролиферативное заболевание, сходное с хроническим миелолейкозом человека. Установлено, что онкогенный потенциал химерного белка BCR-ABL обусловлен его высокой тирозинкиназной активностью. Дерегуляция тирозинкиназной активности — одно из центральных событий в злокачественной трансформации клеток.
При введении клеток, экспрессирующих р210Bcr/Abl, группе летально облученных мышей в условиях одного и того же эксперимента у одних животных развивался лейкоз, очень похожий на хронический миелолейкоз человека, а у других — самые разнообразные новообразования из гемопоэтических клеток: миеломоноцитарные лейкозы, макрофагальные опухоли, пре-В- и Т-клеточные лимфомы, ретикулоклеточные саркомы и эритроидные опухоли. Причина различий не выяснена. Эти опыты, как и эксперименты с трансгенными мышами, показывают, что вся цепь событий, приводящая к развитию картины хронического миелолейкоза, пока еще не установлена.
В самом обобщенном виде «молекулярный патогенез» хронический миелолейкоз описывают так: химерный ген BCR-ABL кодирует белок с постоянно активированной тирозинкиназной активностью; это в свою очередь приводит к активации множества сигнальных путей и выраженным изменениям клеточного цикла, адгезии и апоптоза. Считают, что этих событий достаточно для инициации злокачественной трансформации клетки и поддержания опухолевого фенотипа.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Хронический миелолейкоз
Хронический миелолейкоз – это злокачественное миелопролиферативное заболевание, характеризующееся преимущественным поражением гранулоцитарного ростка. Может долгое время протекать бессимптомно. Проявляется склонностью к субфебрилитету, ощущением полноты в животе, частыми инфекциями и увеличением селезенки. Наблюдаются анемия и изменение уровня тромбоцитов, сопровождающиеся слабостью, бледностью и повышенной кровоточивостью. На заключительной стадии развиваются лихорадка, лимфоаденопатия и кожная сыпь. Диагноз устанавливается с учетом анамнеза, клинической картины и данных лабораторных исследований. Лечение – химиотерапия, радиотерапия, пересадка костного мозга.
МКБ-10
Общие сведения
Хронический миелолейкоз – онкологическое заболевание, возникающее в результате хромосомной мутации с поражением полипотентных стволовых клеток и последующей неконтролируемой пролиферацией зрелых гранулоцитов. Составляет 15% от общего количества гемобластозов у взрослых и 9% от общего числа лейкозов во всех возрастных группах. Обычно развивается после 30 лет, пик заболеваемости хроническим миелолейкозом приходится на возраст 45-55 лет. Дети до 10 лет страдают исключительно редко.
Хронический миелолейкоз одинаково распространен у женщин и у мужчин. Из-за бессимптомного или малосимптомного течения может становиться случайной находкой при исследовании анализа крови, взятого в связи с другим заболеванием или во время профилактического осмотра. У части больных хронический миелолейкоз выявляется на заключительных стадиях, что ограничивает возможности терапии и ухудшает показатели выживаемости. Лечение проводят специалисты в области онкологии и гематологии.
Причины
Хронический миелолейкоз считается первым заболеванием, при котором достоверно установлена связь между развитием патологии и определенным генетическим нарушением. В 95% случаев подтвержденной причиной хронического миелолейкоза является хромосомная транслокация, известная как «филадельфийская хромосома». Суть транслокации заключается во взаимной замене участков 9 и 22 хромосом. В результате такой замены формируется устойчивая открытая рамка считывания. Образование рамки вызывает ускорение деления клеток и подавляет механизм восстановления ДНК, что увеличивает вероятность возникновения других генетических аномалий.
В числе возможных факторов, способствующих появлению филадельфийской хромосомы у больных хроническим миелолейкозом, называют ионизирующее облучение и контакт с некоторыми химическими соединениями.
Патогенез
Итогом мутации становится усиленная пролиферация полипотентных стволовых клеток. При хроническом миелолейкозе пролиферируют преимущественно зрелые гранулоциты, но аномальный клон включает в себя и другие клетки крови: эритроциты, моноциты, мегакариоциты, реже – В- и Т-лифоциты. Обычные гемопоэтические клетки при этом не исчезают и после подавления аномального клона могут служить основой для нормальной пролиферации кровяных клеток. Для хронического миелолейкоза характерно стадийное течение.
Источником бластов становятся лимфатические узлы, кости, кожа, ЦНС и т. д. В фазе бластного криза состояние больного хроническим миелолейкозом резко ухудшается, развиваются тяжелые осложнения, завершающиеся гибелью больного. У некоторых пациентов фаза акселерации отсутствует, хроническая фаза сразу сменяется бластным кризом.
Симптомы хронического миелолейкоза
Клиническая картина определяется стадией заболевания. Хроническая фаза в среднем продолжается 2-3 года, в некоторых случаях – до 10 лет. Для этой фазы хронического миелолейкоза характерно бессимптомное течение или постепенное появление «легких» симптомов: слабости, некоторого недомогания, снижения трудоспособности и чувства переполнения живота. При объективном осмотре больного хроническим миелолейкозом может обнаруживаться увеличение селезенки. По анализам крови выявляется повышение количества гранулоцитов до 50-200 тыс./мкл при бессимптомном течении заболевания и до 200-1000 тыс./мкл при «легких» признаках.
На начальных стадиях хронического миелолейкоза возможно некоторое снижение уровня гемоглобина. В последующем развивается нормохромная нормоцитарная анемия. При исследовании мазка крови пациентов с хроническим миелолейкозом отмечается преобладание молодых форм гранулоцитов: миелоцитов, промиелоцитов, миелобластов. Наблюдаются отклонения от нормального уровня зернистости в ту или иную сторону (обильная или очень скудная). Цитоплазма клеток незрелая, базофильная. Определяется анизоцитоз. При отсутствии лечения хроническая фаза переходит в фазу акселерации.
О начале фазы акселерации может свидетельствовать как изменение лабораторных показателей, так и ухудшение состояния пациентов. Возможно нарастание слабости, увеличение печени и прогрессирующее увеличение селезенки. У больных хроническим миелолейкозом выявляются клинические признаки анемии и тромбоцитопении или тробоцитоза: бледность, быстрая утомляемость, головокружения, петехии, кровоизлияния, повышенная кровоточивость. Несмотря на проводимое лечение, в крови пациентов с хроническим миелолейкозом постепенно увеличивается количество лейкоцитов. При этом отмечается возрастание уровня метамиелоцитов и миелоцитов, возможно появление единичных бластных клеток.
Бластный криз сопровождается резким ухудшением состояния больного хроническим миелолейкозом. Возникают новые хромосомные аномалии, моноклоновое новообразование трансформируется в поликлоновое. Отмечается нарастание клеточного атипизма при угнетении нормальных ростков кроветворения. Наблюдаются ярко выраженные анемия и тромбоцитопения. Суммарное количество бластов и промиелоцитов в периферической крови составляет более 30%, в костном мозге – более 50%. Пациенты с хроническим миелолейкозом теряют вес и аппетит. Возникают экстрамедуллярные очаги незрелых клеток (хлоромы). Развиваются кровотечения и тяжелые инфекционные осложнения.
Диагностика
Диагноз устанавливается на основании клинической картины и результатов лабораторных исследований. Первое подозрение на хронический миелолейкоз часто возникает при повышении уровня гранулоцитов в общем анализе крови, назначенном в порядке профилактического осмотра или обследования в связи с другим заболеванием. Для уточнения диагноза могут использоваться данные гистологического исследования материала, полученного при стернальной пункции костного мозга, однако окончательный диагноз «хронический миелолейкоз» выставляется при выявлении филадельфийской хромосомы при помощи ПЦР, флюоресцентной гибридизации или цитогенетического исследования.
Вопрос о возможности постановки диагноза хронический миелолейкоз при отсутствии филадельфийской хромосомы остается дискутабельным. Многие исследователи считают, что подобные случаи могут объясняться комплексными хромосомными нарушениями, из-за которых выявление данной транслокации становится затруднительным. В ряде случаев филадельфийскую хромосому можно обнаружить при использовании ПЦР с обратной транскрипцией. При отрицательных результатах исследования и нетипичном течении заболевания обычно говорят не о хроническом миелолейкозе, а о недифференцированном миелопролиферативном/миелодиспластическом расстройстве.
Лечение хронического миелолейкоза
Тактику лечения определяют в зависимости от фазы заболевания и выраженности клинических проявлений. В хронической фазе при бессимптомном течении и слабо выраженных лабораторных изменениях ограничиваются общеукрепляющими мероприятиями. Больным хроническим миелолейкозом рекомендуют соблюдать режим труда и отдыха, принимать пищу, богатую витаминами и т. д. Лечение может включать:
Прогноз
Прогноз при хроническом миелолейкозе зависит от множества факторов, определяющим из которых является момент начала лечения (в хронической фазе, фазе активации или в период бластного криза). В качестве неблагоприятных прогностических признаков хронического миелолейкоза рассматривают значительное увеличение печени и селезенки (печень выступает из-под края реберной дуги на 6 и более см, селезенка – на 15 и более см), лейкоцитоз свыше 100×10 9 /л, тромбоцитопению менее 150×10 9 /л, тромбоцитоз более 500х10 9 /л, повышение уровня бластных клеток в периферической крови до 1% и более, повышение суммарного уровня промиелоцитов и бластных клеток в периферической крови до 30% и более.
Вероятность неблагоприятного исхода при хроническом миелолейкозе возрастает по мере увеличения количества признаков. Причиной гибели становятся инфекционные осложнения или тяжелые геморрагии. Средняя продолжительность жизни пациентов с хроническим миелолейкозом составляет 2,5 года, однако при своевременном начале терапии и благоприятном течении заболевания этот показатель может увеличиваться до нескольких десятков лет.