Формоза или алендронат что лучше
Новые возможности и перспективы пероральной терапии остеопороза
Многие годы самым используемым лекарственным средством для профилактики переломов у больных с остеопорозом остается алендронат. Новая лекарственная форма алендроната в виде шипучих таблеток приводит к значимому уменьшению числа нежелательных явлений со ст
For many years and today, alendronate remains the most widely used medication for fracture prevention in osteoporosis patients. New soluble form of alendronate in the form of effervescent soluble tablets leads to significant reduction in the number of adverse events in the gastrointestinal tract, improves adherence to prescribed treatment routine and allows to expand the range of application of alendronate.
Медико-социальная значимость остеопороза обусловлена высоким риском развития тяжелых переломов, возникающих на фоне патологической хрупкости костной ткани. По мнению ВОЗ, остеопороз является критической проблемой здравоохранения как причина смерти пожилых людей наряду с сердечно-сосудистыми заболеваниями, онкопаталогией и сахарным диабетом [1]. Медико-экономические исследования подтверждают, что стоимость лечения остеопороза крайне высока и продолжает неуклонно увеличиваться, параллельно с ростом заболеваемости остеопорозом и частоты его осложнений [2]. Однако, согласно статистическим выкладкам Всемирного фонда остеопороза (International Osteoporosis Foundation, IOF), который суммировал данные Франции, Германии, Италии, Испании, Великобритании и Швеции, большая часть финансовых средств системы здравоохранения тратится на лечение осложнений остеопороза — переломов, в то время как расходы на лекарственную профилактику и терапию составляют только 4,7% общих затрат [3]. По прогнозам эпидемиологов к 2025 г. число переломов на фоне остеопороза у пожилых людей увеличится еще на 29% и составит 3,2 млн случаев. Это повлечет увеличение расходов системы здравоохранения до 38,5 млрд евро ежегодно [4, 5].
В настоящее время для лечения остеопороза врачу доступен значительный арсенал современных препаратов, снижающих риск развития переломов у пациентов с остеопорозом: бисфосфонаты (алендронат, золедронат, ибандронат и ризедронат), деносумаб, терипаратид, стронция ранелат. Благодаря многочисленным клиническим испытаниям, проведенным в области лечения остеопороза, врачи обладают полноценной доказательной базой о преимуществах того или иного препарата у разных категорий больных, а расширение фармацевтического рынка приводит к тому, что новые лекарства имеют все более фокусную область применения [2].
Таким образом, среди современных врачей в последнее время довольно четко обрисовались две яркие тенденции при выборе тактики лечения остеопороза: одна из них — это приверженность позиции доказательной медицины на основе результатов масштабных исследований, проводимых на большой статистической выборке пациентов, другая — персонализованный подход к каждому пациенту с учетом его индивидуальных особенностей. Данные тенденции не противоречат, а, наоборот, дополняют друг друга. Руководствуясь научными данными, с одной стороны, клинико-лабораторной картиной заболевания, наличием сопутствующей патологии и факторов риска осложнений у конкретного пациента, с другой, специалист может подобрать наиболее подходящую схему лечения системного остеопороза.
Алендронат — классический «эталонный» препарат для лечения остеопороза
Уже многие годы самым используемым лекарственным средством для профилактики переломов у пациентов с остеопорозом, в первую очередь, из-за его благоприятного профиля соотношения клинической эффективности и стоимости, остаются алендроновая кислота и ее соединения, часто объединяемые общим названием «алендронат». Расходы на годовую терапию алендронатом попадают в зону социальной приемлемости для получения адекватного уровня качества жизни в течение года (quality-adjusted life year — QUALY), установленную органами здравоохранения Великобритании [6]. В связи с этим Британский национальный институт качества медицинской помощи (National Institute for Clinical Excellence, NICE) рекомендует алендронат в качестве лекарственного средства первого выбора для лечения постменопаузального остеопороза, а также как «эталонную» терапию для всех других антиостеопоротических препаратов, которые, в свою очередь, могут быть назначены только пациентам с низкой переносимостью алендроната и/или имеющим тяжелый осложненный остеопороз [7].
Эффективность алендроната при остеопорозе продемонстрирована в ряде крупных клинических исследований с уровнем доказательности A [8–10]. По результатам многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования FIT (Fracture Intervention Trial) было доказано, что терапия алендронатом в течение трех лет приводит к существенному снижению риска переломов как у пациенток с неосложненным остеопорозом, так и у имеющих переломы в анамнезе. У пациенток с переломами позвонков на фоне остеопении или остеопороза, лечившихся алендронатом, относительный риск переломов проксимального отдела бедренной кости в среднем снижался на 51%, переломов позвонков — на 55%, предплечья — на 48% в сравнении с плацебо, p
Л. А. Марченкова 1 , кандидат медицинских наук
Е. В. Макарова
ФГБУ НМИЦ реабилитации и курортологии МЗ РФ, Москва
Новые возможности и перспективы пероральной терапии остеопороза/ Л. А. Марченкова, Е. В. Макарова
Для цитирования: Лечащий врач №12/2017; Номера страниц в выпуске: 35-40
Теги: диабетические осложнения, болевой синдром, сахароснижающая терапия
Формоза или алендронат что лучше
ГБОУ ВПО «Российский университет дружбы народов» Минобрнауки РФ, Москва
Актуальность проблемы
Социальная значимость любого заболевания определяется его распространенностью, трудностями диагностики и терапии, значимым влиянием на показатели инвалидности и смертности населения. По этим критериям болезни, обусловленные или сопровождающиеся нарушениями фосфорно-кальциевого обмена, абсолютно соответствуют статусу социально значимых. В практике эндокринолога заболевания, сопровождающиеся нарушением метаболизма кальция, занимают значительное место. Выраженные нарушения минерального обмена наблюдаются при сахарном диабете, патологии щитовидной железы и надпочечников, гипер- и гипопаратиреозе, пери- и постменопаузе, возрастном андрогенодефиците. Клинические проявления нарушений обмена кальция и фосфора достаточно разнообразны, но наиболее хорошо известны проявления, связанные с поражением костной ткани, включая остеопороз.
Как причина инвалидности и смертности пациентов от переломов костей остеопороз занимает четвертое место среди неинфекционных заболеваний [1]. По данным статистики, только 25 % больных полностью излечиваются после перелома шейки бедра, 50 % больных остаются инвалидами, в 25 % случаев перелом при остеопорозе ведет к смерти больных. В России остеопороз выявлен у 10 % населения (более 14 млн человек) [3, 4]. Ежегодно фиксируют 3 млн переломов позвонков, более 150 тыс. – лучевой кости и более 40 тыс. – проксимального отдела бедренной кости.
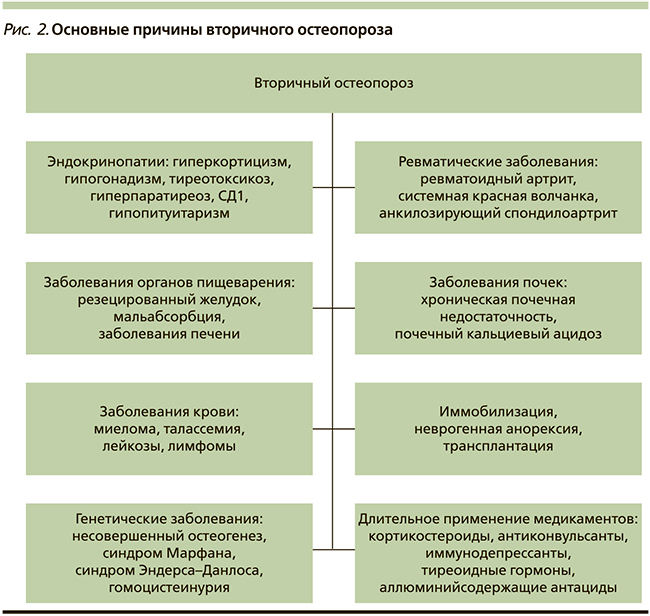
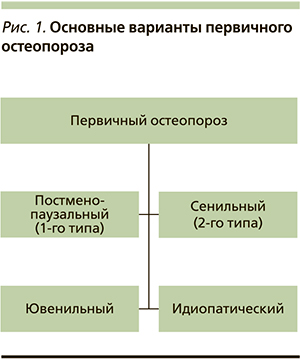
В медицинской литературе остеопороз иногда образно называют «тихой эпидемией». Длительное время заболевание протекает бессимптомно и впервые диагностируется после возникновения перелома. Термин «остеопороз» как название патологического процесса обычно употребляют, когда речь идет о первичном остеопорозе (рис. 1). С патологией эндокринной системы, как правило, связывают проявления вторичного остеопороза, который наблюдается у пациентов на фоне усиленной секреции паратгормона (ПТГ), обусловленной вторичными причинами, в т.ч. эндокринными заболеваниями (рис. 2). Из группы заболеваний, обозначенных как первичный остеопороз, в сферу деятельности эндокринологов входит остеопороз, обусловленный постменопаузой, и, как нам представляется, с полным основанием может быть отнесен остеопороз, обусловленный андрогенодефицитом.
Состояние фосфорно-кальциевого обмена в норме и патологии
Как правило, внеклеточный кальций регулирует сократительную активность мышц, синаптическую передачу сигнала в нервной ткани, агрегацию тромбоцитов и эритроцитов, процесс коагуляции, секрецию гормонов и биологически активных соединений. Внутриклеточный кальций регулирует процессы клеточного цикла и роста, проницаемость клеточных мембран, силу мышечных сокращений, а также секрецию гормонов и биологически активных факторов.
Кальций – важный компонент регуляции функционирования сердечно-сосудистой системы (сократительная функция, сохранение нормального ритма и проводимости, контроль артериального давления), обладает антиоксидантными, противовоспалительными, противоотечными и антиатеросклеротическими эффектами.
Обмен кальция и фосфора в здоровом организме находится в динамическом равновесии, компенсаторные механизмы регулируют его при гипер- или гипокальциемических состояниях.
Реализация этого контроля обеспечивается адекватным уровнем ПТГ, кальцитонина, витамина D и других гормонов:
В основе жизнедеятельности костной системы лежат два взаимосвязанных процесса: созидания (формирования) новой кости и процесс разрушения (резорбции) старой кости. Эти процессы в костной системе осуществляются с разной скоростью в течение всей жизни человека. Ежегодно обмениваются от 1–2 до 10 % костной массы. Последняя достигает своего максимального значения к возрасту 16–20 лет, поэтому детский и подростковый возраст является ответственными периодами для формирования прочного здорового скелета. По достижении пика наступает баланс процессов синтеза и резорбции, который продолжается до 40–45 лет у женщин и 50 лет у мужчин. Затем начинается потеря костной массы, более значительная у женщин после менопаузы [3, 4].
К числу факторов, влияющих на формирование и прочность костей, относятся:
Кость здорового человека – живая активная ткань. Она прочна, способна противостоять значительной нагрузке без перелома, но при этом гибка, способна поглощать энергию, деформироваться и не ломаться. Такие противоречивые свойства кости достигаются за счет особого состава и строения (вплетение коллагена 1-го типа в тройную спираль). При нарушениях фосфорно-кальциевого обмена ситуация меняется. Влияние нагрузки на кость с недостаточной минерализацией приво-дит к тому, что кость сгибается чрез-мерно и ломается, однако, если происходит нагрузка на кость с избыточной минерализацией, она недостаточно сгибается и также подвергается перелому.
Гиперкальциемия, сопровождающаяся избыточной продукцией ПТГ, наблюдается при первичном, вторичном гиперпаратиреозе, множественной эндокринной неоплазии, псевдогиперпаратиреозе (эктопическая продукция ПТГ) и семейном изолированном гиперпаратиреозе. Синдром гиперкальциемии может развиваться на фоне других эндокринопатий – тиреотоксикоз, гипотиреоз, эозинофильная аденома гипофиза (акромегалия), гиперкортицизм, феохромоцитома, ВИПомы. Кроме эндокринных заболеваний причинами гиперкальциемии и объектами для дифференциальной диагностики являются передозировка витамина D, злокачественные опухоли, острая и хроническая почечная недостаточность, иммобилизация после переломов костей, некоторые медикаменты. Избыточное потребление кальция (более 2 г/сут) также может приводить к развитию гиперпаратиреоза.
Гипокальциемия – состояние, связанное с первичной или вторичной недостаточностью продукции ПТГ, недостатком витамина D и резистентностью к ПТГ (псевдогипопаратиреоз). Основные причины: аутоиммунный процесс в паращитовидных железах, послеоперационный или радиойодный гипопаратиреоз, сахарный диабет.
Нарушение функции паращитовидных желез может проявляться как компонент различных генетических синдромов (синдром Ди Джорджа, болезнь Вильсона, гемохроматоз и др.) и аутоиммунного полигландулярного синдрома I типа (гипопаратиреоз, хронический генерализованный гранулематозный кандидоз и хроническая надпочечниковая недостаточность). Недостаточностью кальция сопровождаются эндокринные расстройства, связанные с возрастными изменениями половой системы, – андрогенодефицит у мужчин и постменопаузальные процессы у женщин.
Помимо эндокринных нарушений дефицитом кальция могут сопровождаться заболевания желудочно-кишечного тракта, почек, гиповитаминоз D, повышение уровня магния в сыворотке крови, применение лекарственных средств (гормональные, слабительные, антациды, мочегонные, адсорбенты, противосудорожные средства, тетрациклин).
К числу факторов, способствующих возникновению дефицита кальция в организме, можно отнести малоподвижный образ жизни, употребление массы белков, сахара, соли, животных жиров, продуктов с кислой реакцией (шпинат, ревень и др.) [5].
Дисбаланс фосфорно-кальциевого обмена способствует прогрессированию атеросклероза, развитию артрозов и дорсопатии, артериальной гипертонии, но основным проявлением остается остеопороз, приводящий к значительному повышению риска переломов костей [6, 7].
Первичный гиперпаратиреоз
Наиболее частая причина гиперкальциемии и гипофосфатемии. Заболевание было неоднократно представлено с 1981 г. в научной медицинской литературе под различными названиями: болезнь Реклингаузена, синдром Бернета, фиброзная остеодистрофия, первичный гиперпаратиреоз. Распространенность заболевания составляет 0,05–0,10 % населения и у женщин наблюдается примерно в 4 раза чаще, чем у мужчин.
В 80–89 % случаев причиной заболевания является солитарная аденома паращитовидной железы, значительно реже встречаются множественная аденома (2–3 %), гиперплазия паращитовидных желез (2–6 %) и рак (0,5–3,0 %).
Первичный гиперпаратиреоз наблюдается у 90 % больных множественной эндокринной неоплазией I типа (МЭН I) и у 50 % пациентов с МЭН IIa-типа. Избыточная продукция ПТГ и отсутствие подавления секреции в ответ на гиперкальциемию приводят к ускорению резорбции костной ткани и вымыванию кальция из костей, снижению порога реабсорбции фосфора. Увеличивается клубочковая фильтрация кальция и экскреция фосфора с мочой. Гиперкальциемия поддерживается увеличением канальцевой реабсорбции кальция и повышенным всасыванием кальция в кишечнике. Симтоматика заболевания достаточно разнообразна. Пациенты предъявляют жалобы на общую слабость, потерю аппетита, тошноту, рвоту, запоры, похудание, боли в костях, артралгии, деформацию костей, мышечную слабость, судороги, полиурию, полидипсию, ухудшение памяти, депрессию, кальцинаты мягких тканей и роговой оболочки, отеки на лице, нарушения функции сердечно-сосудистой системы. Преобладание тех или иных симптомов позволяет условно относить проявления патологии конкретного пациента к костной, висцеральной или почечной формам гиперпаратиреоза. Наименее сложной для диагностики формой является «костная», при которой возможны варианты поражения по типу системного остеопороза, кистозно-фиброзного остеита или болезни Педжета. Рентгенологическое обследование позволяет фиксировать типичные изменения костей в виде остеопороза, патологических переломов, субпериостальной резорбции костей, кистозных образований в области эпифизов, деформации скелета. Гиперпаратиреоз встречается достаточно часто, но, к сожалению, диагностика этого заболевания представляется довольно непростой.
Вторичный гиперпаратиреоз
Состояние, связанное с увеличением продукции ПТГ в ответ на длительную гипокальциемию. У больных тиреотоксикозом усиление процессов катаболизма приводит к повышенной резорбции костной ткани, т.к. тиреоидные гормоны активируют преимущественно остеокласты. Преобладание резорбции кости над ее образованием может приводить к гиперкальциемии и кальцийурии, а при длительном некомпенсированном гипертиреозе ожидаемым осложнением можно считать развитие остеопении, особенно у пациентов молодого возраста.
Возникновение остеопороза на фоне гипотиреоза возможно, но связано это с гормональной заместительной терапией (передозировкой тиреоидных препаратов). Для больных гиперкортицизмом, как первичным, так и ятрогенным, избыток продукции глюкокортикоидов сопровождается подавлением активности остеобластов и угнетением всасывания кальция в кишечнике. Гипокальциемия приводит к увеличению выработки ПТГ, развитию вторичного гиперпаратиреоза и активации остеокластов.
Снижение инсулиновой секреции у больных сахарным диабетом типа I сопровождается снижением активности остеобластов и подавлением секреции 1,25(OH)2D3 в почках. На потерю костной массы также влияет усиление секреции глюкокортикоидов в ответ на гипогликемию и снижение физической активности.
Первичный гипопаратиреоз
Недостаточность секреции ПТГ околощитовидными железами, снижение резорбции кальция в канальцах почек, уменьшение абсорбции кальция в кишечнике, приводящее к гипокальциемии. Основные причины – оперативные вмешательства на щитовидной и паращитовидных железах, лечение радиоактивным йодом, нарушения развития паращитовидных желез (врожденная гипоплазия, синдром Ди Джорджи и др.), аутоиммунные процессы и идиопатический гипопаратиреоз. Заболевание может протекать в острой и хронической формах. К числу ведущих синдромов относятся тетания и вегетативная дисфункция. Подтверждение диагноза предусматривает проведение провокационных проб: Труссо, Хвостека, Шлезингера, Вайса.
Постменопаузальный остеопороз
Постменопаузальный остеопороз встречается в клинической практике наиболее часто, отличается быстрым развитием. У женщин в постменопаузе происходит снижение костной массы на 15–20 % в течение 5–10 лет. Основная причина – дефицит эстрогенов, который приводит к повышению числа и активности остеокластов. Повышенная резорбция ведет к необратимой потере кости. Высокая активность остеокластов способствует перфорации трабекул в месте резорбции, нарушается микроархитектоника кости. Страдает в первую очередь трабекулярная кость, поэтому локализация ранних остеопоретических переломов – это кости запястья и позвонки.
Множественная эндокринная неоплазия
Под этим названием объединяют группу синдромов, вызванных опухолями (редко гиперплазией) одновременно нескольких эндокринных желез. Большинство опухолей имеют нейроэктодермальное происхождение и злокачественное течение. В середине XX в. P. Wermer описал синдром, который включал сочетание опухоли паращитовидных желез, гипофоза и поджелудочной железы, и назвал его множественным эндокринным аденоматозом (сейчас – МЭН I). Немного позже J.H. Sipple описал синдром сочетанного проявления симптомов рака щитовидной железы и феохромоцитомы (МЭН IIа). Среди 50 % этих пациентов наблюдаются аденома паращитовидной железы и гиперпаратиреоз. Трудности диагностики связаны с тем, что симптомы поражения разных эндокринных органов проявляются не одновременно. Иногда заболевание начинается с гиперпаратиреоза с характерной клинической симтоматикой, а симптомы поражения других эндокринных желез манифестируют значительно позже, поэтому для установления окончательного диагноза требуется гораздо больше времени.
Проблемы диагностики нарушений фосфорно-кальциевого обмена
Проблема диагностики нарушений фосфорно-кальциевого обмена связана с особенностями заболевания. Отсутствие ярко-выраженных клинических проявлений на начальных этапах заболевания приводит к тому, что визит к эндокринологу оказывается далеко не на первых позициях в диагностической цепочке. Поэтому диагноз нарушений фосфорно-кальциевого обмена эндокринной природы выставляется достаточно поздно. Как правило, первым сигналом к началу обследования пациента становится возникновение патологического перелома. Проведение денситометрии не всегда сразу позволяет получать однозначный ответ. Среди женщин в возрасте 50 лет и старше 50 % имеют переломы, но не страдают остеопорозом, по данным биоэнергетической рентгеновской абсорбициометрии (Wainwright S.A. et al., 2005). В популяции женщин в возрасте 50 лет и старше 96 % переломов типичной локализации могут возникать без снижения минеральной плотности кости (МПК) (Kanis J.A. et al., 2001).
И все же некоторые симптомы у остеопороза присутствуют. К ним относятся боли в спине и пояснице, искривление позвоночника вперед, уменьшение роста на несколько сантиметров в течение года, судороги в ногах, хрупкость ногтей, появление ранней седины. Обычно появление этих симптомов приводит пациентов не к эндокринологу, а к неврологу и терапевту. Остеопороз следует подозревать, если рост снизился более чем на 2 см за год или на 4 см за несколько лет.
Традиционный подход к диагностике остеопороза основан на оценке риска возникновения перелома. Факторы риска остеопороза и переломов принято делить на большие и малые.
Большие факторы риска:
Малые факторы риска:
Заключение
Клиническая эффективность алендроната была неоднократно доказана в рандомизированных исследованиях на больных остеопорозом (уровень рекомендаций А). Он эффективен не только при первичных формах гипопаратиреоза, но и при нарушениях фосфорно-кальциевого обмена у больных гиперпаратиреозом, гиперкортицизмом, тиреотоксикозом, сахарным диабетом. В среднем Фороза снижает риск переломов различной локализации на 50 %, а риск множественных переломов позвонков – на 90 %. Конечно, препарат наделен и некоторыми общими недостатками всех бисфосфонатов: низкая биодоступность таблетированных форм, нефрогенный путь выведения, ограниченное применение пациентами с нарушением функции почек, побочное действие в виде диспепсических расстройств, боли в костях и мышцах, аллергические реакции, но при соблюдении рекомендаций по использованию препарата Фороза® позволяет обеспечивать высокую эффективность в коррекции нарушений фосфорно-кальциевого обмена при эндокринных заболеваниях.
Фороза ® (Forosa)
Владелец регистрационного удостоверения:
Произведено:
Лекарственная форма
Форма выпуска, упаковка и состав препарата Фороза ®
Таблетки, покрытые пленочной оболочкой белого цвета, круглые, двояковыпуклые, с гравировкой «ALN 70» на одной стороне.
| 1 таб. | |
| алендроната натрия тригидрат | 91.35 мг, |
| что соответствует содержанию алендроновой кислоты | 70 мг |
Фармакологическое действие
Ингибитор костной резорбции. Аминобисфосфонат, является аналогом пирофосфата. Механизм действия связан с подавлением активности остеокластов. Стимулирует остеогенез, восстанавливает положительный баланс между резорбцией и восстановлением кости, прогрессивно увеличивает минеральную плотность костей (регулирует фосфорно-кальциевый обмен), способствует формированию костной ткани с нормальной гистологической структурой.
Фармакокинетика
Прием алендроновой кислоты непосредственно перед, во время или после еды приводит к уменьшению биодоступности. При приеме с кофе или апельсиновым соком биодоступность алендроната натрия уменьшается приблизительно на 60%.
После приема внутрь в терапевтических дозах концентрация алендроната в плазме крови обычно ниже наименьшей концентрации, поддающейся определению (менее 5 нг/мл).
Временно распределяется в мягких тканях, затем быстро перераспределяется в кости или выводится с мочой. Связывание с белками плазмы составляет приблизительно 78%. Не метаболизируется. Выводится главным образом почками. T 1/2 в конечной фазе может составлять более 10 лет, что связано с высвобождением активного вещества из костей.
Лечение остеопороза: опыт применения алендроната
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Остеопороз (ОП) – системное заболевание скелета, для которого характерны снижение минеральной плотности и ухудшение качества кости, следствием чего является ее хрупкость и повышение риска переломов. В соответствии с международной классификацией болезней ОП был отнесен к 13–му классу – «Болезни костно–мышечной системы и соединительной ткани». По мнению экспертов ВОЗ, ОП сегодня занимает ведущее место в структуре заболеваемости и смертности населения наряду с инфарктом миокарда, инсультом, раком и внезапной смертью. Последствия ОП в виде переломов позвонков и трубчатых костей обусловливают значительный подъем заболеваемости, инвалидности и смертности.
C использованием передовых, в первую очередь радиологических методов исследования, разработкой и внедрением новых методов профилактики и лечения, а также активной и целеустремленной просветительской деятельности Международного фонда остеопороза (IOF) и его 186 национальных обществ в 90 странах мира, в том числе и Российской ассоциации по остеопорозу, социальная и медицинская значимость заболевания значительно возросли. Официальная регистрация заболеваемости ОП началась в РФ с 1999 г., а за прошедшие 10 лет (1999–2008) общее число зафиксированных случаев ОП среди взрослых жителей России увеличилось почти в 4 раза (с 31 500 чел. в 1999 г. до 115 530 чел. в 2008 г.). Существенное влияние на частоту выявляемости болезни оказало улучшение технической базы для диагностики, а именно поставка в медицинские учреждения костных денситометров, что позволило измерять минеральную плотность костной ткани (МПКТ) и ставить диагноз ОП.
В 2005 г. Российской ассоциацией по ОП разработаны клинические рекомендации по диагностике, профилактике и лечению ОП, включая глюкокортикоидный ОП, а в 2009 г. они были переработаны и дополнены. Рекомендации ранжированы по единой международной системе уровней доказательности. Несмотря на общие рекомендации, лечение ОП у конкретного больного – нередко задача трудная и зависит как от интерпретации врачом состояния больного, так и от готовности пациента к длительной терапии.
Выделяют два основных типа ОП – первичный и вторичный, при этом первичный ОП наиболее распространен: отношение его частоты к частоте всех возможных форм вторичного ОП достигает 4:1 [1].
Первичный ОП условно делится на постменопаузальный и сенильный. Постменопаузальный ОП связан с ускоренной потерей костной массы у женщин после прекращения менструального цикла, и причина его развития – дефицит эстрогенов. Основными причинами развития сенильного ОП у лиц обоего пола являются снижение потребления кальция, нарушение его всасывания в кишечнике и дефицит витамина D, что может приводить к вторичному гиперпаратиреозу и вследствие этого ускорению костного ремоделирования. Одним из факторов, влияющих на развитие сенильного ОП, считают снижение физической активности в пожилом возрасте. Необходимо подчеркнуть, что в процессе старения организма взаимодействие гормонов с факторами роста и другими цитокинами, влияющими на процесс остеобластогенеза, подвергается существенным изменениям, а активность многих локальных факторов снижается.
ОП развивается постепенно и клинически нередко выявляется уже после переломов, что послужило основанием называть его «скрытой эпидемией». Следует отметить, что частота ОП повышается с возрастом, поэтому наблюдаемое в последние десятилетия увеличение продолжительности жизни в развитых странах и связанный с ним быстрый рост числа пожилых людей, особенно женщин, ведет к нарастанию частоты этого заболевания, делая его одной из важнейших проблем здравоохранения во всем мире.
Оказание медицинской помощи больным с первичным ОП проводится на амбулаторном этапе за исключением случаев, требующих хирургического лечения осложнений ОП – переломов. Лечение и наблюдение за больным длительное, в течение нескольких лет, и должно осуществляться врачом первичного звена – участковым терапевтом или врачом общей практики. При выявлении вторичных причин возможного развития ОП пациента следует направить на консультацию к специалисту (ревматологу, эндокринологу и др.).
Среди диагностических мероприятий на первый план выходят клинические методы обследования: изучение жалоб и анамнеза пациента с целью выявления факторов риска ОП и факторов риска падений, а также клинических признаков переломов костей, в том числе переломов позвонков.
Идентификация наличия ОП у конкретного индивидуума включает оценку семейного анамнеза ОП, образа жизни (вредные привычки, физическую активность, питание и др.), наличие переломов, репродуктивный анамнез, наличие заболеваний и медикаментозной терапии, приводящих к развитию ОП (табл. 1).
Падения являются независимым фактором риска переломов, т.к. большинство переломов проксимального отдела бедра и дистального отдела предплечья возникают вследствие падений (табл. 2).
Физикальный осмотр пациента с ОП включает общетерапевтический осмотр с измерением роста и веса. Снижение роста на 2,5 см за год или на 4 см и более по сравнению с ростом в 25 лет может свидетельствовать в пользу ОП, осложненного переломами позвонков. Если перелом был недавно, может отмечаться локальная болезненность в области позвонка, а прогрессирующие изменения осанки могут сопровождаться паравертебральной болезненностью при пальпации и напряжением паравертебральных мышц, ограничением подвижности в позвоночнике.
Для диагностики ОП применяются различные инструментальные методы: рентгенография костей и измерение минеральной плотности кости с помощью костной денситометрии. Рентгенография костей остается единственным методом исследования, позволяющим оценивать анатомические особенности костей и структуру костной ткани, а также различные повреждения скелета. Одним из недостатков рентгенографии в диагностике ОП является низкая чувствительность метода, позволяющая определять уменьшение костной массы, когда степень снижения минерализации достигает 20–40%. В настоящее время рентгенография используется для выявления или подтверждения переломов костей любых локализаций. Для диагностики остеопоротических переломов тел позвонков используется метод рентгеновской морфометрии позвоночника в боковой проекции. Рентгеноморфометрический анализ тел позвонков включает измерение передней, средней и задней высот с вычислением индексов: передний/задний индекс – отношение передней высоты тела позвонка к задней; средний/задний индекс – отношение средней высоты тела позвонка к задней; заднее/задний индекс – отношение задней высоты тела исследуемого позвонка к задним высотам одного–двух вышележащих и нижележащих позвонков. Для оценки деформаций используется количественный метод H. Genant [3]. Индексы тела позвонка более 0,8 (80%) свидетельствуют о нормальной конфигурации позвонка, при показателе любого индекса 0,75–0,79 – о 1–й степени деформации, при 0,6–0,74 – о 2–й степени, а при 0,59 и менее – о тяжелом остеопоротическом переломе позвонка 3–й степени. Для ОП позвоночника характерны такие виды деформаций, как передняя или задняя клиновидная, односторонне– или двояковогнутая деформации, а также компрессионный перелом. Показаниями к направлению пациентов на рентгенологическое обследование являются боль в спине и снижение роста для выявления остеопоротических переломов позвонков
В настоящее время «золотым стандартом» диагностики является измерение МПКТ с помощью двуэнергетической рентгеновской абсорбциометрии (DXA), когда оценивается количество минерализованной костной ткани в сканируемой площади (г/cм2). К стандартным методам исследования относится денситометрия поясничного отдела позвоночника и проксимального отдела бедра (шейка бедра и общий показатель бедра), так как на основании многочисленных методов оценки было показано, что распространенность переломов коррелирует с показателями МПК этих областей. Диагноз ОП ставится женщинам в постменопаузальном периоде и мужчинам в возрасте 50 лет и старше при сопоставлении полученных данных МПКТ с реферативной базой аппарата (среднего значения «пика костной массы» у молодых здоровых людей по Т–критерию) с использованием рекомендации ВОЗ [WHO, 1994], согласно которым к нормальным значениям МПКТ относятся показатели выше –1SD от референтной базы по Т–критерию, значения от –1SD до –2,5SD классифицируются как остеопения, отклонение ниже –2,5 SD – как ОП, а при дополнительном наличии одного и более переломов – как тяжелый ОП. При невозможности проведения исследования позвоночника и бедра, можно использовать результаты измерения дистального отдела предплечья. Показаниями к направлению пациентов на денситометрию является наличие факторов риска ОП у пациентов моложе 65 лет и для оценки эффективности патогенетического лечения ОП.
Для дифференциальной диагностики первичного ОП и метаболических заболеваний скелета, а также перед назначением антирезорбтивной терапии рекомендуется обязательное исследование кальция, фосфора и щелочной фосфатазы в крови, кальция в суточной моче или отношения кальция к креатинину в утренней моче. Следует помнить, что при первичном ОП уровень вышеперечисленных показателей в крови находится в пределах нормы, однако возможна гиперкальциурия, особенно для варианта течения ОП с повышенным костным обменом. Кроме того, могут применяться и дополнительные лабораторные методы, целью которых является установление диагноза основного заболевания, одним из симптомов которого является остеопения (например, тиреотропный гормон, паратиреоидный гормон, 25–гидрокивитамин D и др.).
Для оценки скорости обмена кости могут использоваться маркеры костного формирования (остеокальцин ОС, карбокси– и аминотерминальные пропептиды проколлагена типа I – PICP, PINP, костный изофермент щелочной фосфатазы – bALP), а также маркеры костной резорбции (окси– и дезоксипиридинолины – PYR, DPYR, оксипролин – OHPr в моче, N– и С–телопептиды молекул коллагена I типа, связанные поперечными сшивками – NTX, CTX в сыворотке крови или моче, а также тартратрезистентная кислая фосфатаза – TRACP в плазме крови). Однако в настоящее время нет доказательств значения определения уровня костных маркеров для индивидуальной диагностики ОП и для предсказания риска возникновения переломов у отдельных больных в клинической практике, они могут использоваться для оценки лечебного эффекта препарата (снижение их уровня на 30% и более при приеме антирезорбтивной терапии прогнозирует хорошую эффективность лечения) и улучшения приверженности лечению пациентов.
Лечение ОП включает в себя как немедикаментозные способы терапии, так и фармакологическое вмешательство. Среди первых следует отметить образовательные программы, отказ от вредных привычек (курения, злоупотребления алкоголем, кофеином, тяжелыми физическими нагрузками), занятия физкультурой (ходьба, гимнастика, изометрические упражнения, плавание), профилактика падений (коррекция зрения, лечение сопутствующих заболеваний, оценка и изменение домашней обстановки, обучение стереотипу движений, тренировка равновесия), пациентам с переломами позвонков следует рекомендовать ношение жестких или полужестких корсетов до 4–6 ч при физической нагрузке, т.к. они снижают выраженность болевого синдрома. При ОП должны исключаться такие виды нагрузок, как прыжки и силовые упражнения, резкие наклоны и вращения туловища.
Медикаментозное лечение ОП представляет непростую задачу, так как он диагностируется достаточно поздно, когда уже в анамнезе могут быть переломы различной локализации. Лечение должно быть длительным, поскольку эффект может проявиться спустя многие месяцы. В связи с этим идет постоянный поиск высокоэффективных и недорогих препаратов. Целью терапии является замедление, а если это возможно, прекращение потери костной массы, предотвращение переломов костей, улучшение состояния больного, уменьшение болевого синдрома, улучшение качества его жизни. На сегодняшний день спектр препаратов для лечения и профилактики ОП значительно расширился, их применение снижает риск переломов от 30 до 70%. Препаратами первого выбора патогенетической терапии являются лекарственные средства класса бисфосфонатов (БФ) и стронция ранелат.
Действие БФ основано на снижении скорости костного обмена за счет влияния на остеокласты – клетки, разрушающие старую кость, – при сохранении костной микроархитектоники и повышении минеральной плотности кости (МПК).
Одним из препаратов класса БФ является алендронат, который в течение уже почти 15 лет широко применяется в клинической практике во всем мире. При лечении алендронатом происходит подавление процессов резорбции остеокластами и восстановление процессов метаболизма костной ткани до пременопаузального уровня и предотвращает микроархитектурные нарушения и потери костной ткани. Процессы костного метаболизма остаются стабильными при длительном лечении алендронатом в течение 10 лет, при этом накопление препарата в кости не приводит излишней суппрессии костного обмена, а напротив, демонстрируют, что костный обмен остается на пременопаузальном уровне, а качество кости остается нормальным в течение всего периода лечения.
Данные фармакокинетических исследований подтвердили, что эффективность действия БФ на массу и силу кости зависит от кумулятивной дозы этих препаратов. Так, одно и то же количество алендроната абсорбируется при однократном приеме 70 мг 1 раз/нед. или 10 мг 7 раз/нед.
Эффективность применения алендроната у больных ОП была доказана в ходе проведения нескольких рандомизированных клинических двойных слепых плацебо–контролируемых исследований (РКИ) [4,5,6]. Прием алендроната показал высокую эффективность: он достоверно снижал частоту переломов позвонков на 47%, бедра – на 51–56% и предплечья – на 48% [5,7].
В настоящее время алендронат – первый препарат, который имеет 10–летнюю продолжительность исследования, оценившего динамику МПК в группах больных, принимавших алендронат в течение всего этого периода или переведенных на плацебо спустя первые 5 лет активной терапии. У женщин, продолжавших получать 10 мг/сут. алендроната, происходило постепенное повышение МПК позвоночника до 13,7% (p 0,05). Имеются бесспорные доказательства снижения риска переломов при приеме 10 мг алендроната ежедневно, а отсутствие различий в частоте возникновения переломов на обеих дозах, сопоставимое повышение МПК и аналогичные изменения уровней маркеров костного обмена наводят на мысль о схожем влиянии данных дозировок на риск переломов. На биопсийном материале не было выявлено признаков остеомаляции при приеме обеих доз препарата.
В сравнительном исследовании было показано, что частота желудочно–кишечных НЯ (эзофагит, эрозии, геморрагии, рефлюкс, гастрит, язва желудка и др.) в группах, получавших различные дозы алендроната, была схожей, т. е. увеличение однократно принятой дозы в 7 раз не увеличивало риск развития НЯ [10,11].
В НИИР РАМН проведено изучение эффективности и безопасности алендроната 70 мг/нед. в ходе открытого одногодичного контролируемого исследования [11]. Через год терапии был получен достоверный прирост МПК в позвоночнике и области шейки бедра у больных, получавших алендронат, относительно группы сравнения (р=0,00001 и р=0,030 соответственно). При оценке количества пациентов со значимым приростом МПК в позвоночнике и проксимальном отделе бедра было выявлено, что в группе, получавшей лечение алендронатом, 85,7% пациентов имели прирост более 2% в позвоночнике и 42,8% лиц – в области шейки бедра, а 38,8% имели значимый прирост в обеих областях измерения, что было достоверно выше, чем в группе сравнения (р=0,01). При этом прирост МПКТ более 6% в позвоночнике встречался у 53% женщин, получавших алендронат, а в шейке бедра – прирост более 3% – у 30,6%. Кроме того, при приеме алендроната было достоверно больше женщин положительно ответивших на лечение, чем женщин, у которых эффект отсутствовал (р 0,05). В последующем наблюдении за 208 пациентами была продемонстрирована эффективность терапии алендронатом в течение 2–го года и доказано значительное уменьшение числа новых переломов позвонков в группе алендроната (0,7%) по сравнению с группой плацебо (6,8%; p = 0,026) [13].
Алендронат необходимо принимать натощак сразу после подъема с постели, таблетку нужно запивать 1 стаканом (180–240 мл) чистой воды, а после приема следует находиться в вертикальном положении (сидя или стоя) в течение как минимум 30 мин. БФ могут вызывать побочные эффекты, связанные с поражением ЖКТ, а также головную боль, боли в мышцах и костях, снижение уровня кальция и фосфора в сыворотке крови, в редких случаях – сыпь и эритему. При передозировке БФ – гипокальциемия и гипофосфатемия, расстройства ЖКТ. Соблюдение рекомендаций по приему препарата значительно снижает риск возникновения желудочно–кишечных НЯ. Противопоказания к их назначению: гиперчувствительность к препарату, стриктура и ахалазия пищевода, тяжелая почечная недостаточность (клиренс креатинина ниже 35 мл/мин.), гипокальциемия, беременность и грудное вскармливание, детский возраст, тяжелый гипопаратиреоз, мальабсорбция кальция.
Следует помнить, что прием препаратов влияющих на патогенез ОП, должен проходить на фоне достаточного поступления кальция и витамина D с пищей или в виде лекарственных средств. В качестве донатора витамина D могут применяться активные метаболиты (альфакальцидол и кальцитриол), комбинированное использование их с БФ приводит к увеличению МПК позвоночника и шейки бедра, снижению риска падений и переломов позвонков и периферических костей [14].