Фосфонаты что это такое
Что такое фосфонаты
Что такое фосфонаты
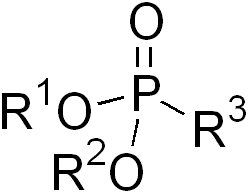
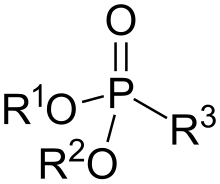
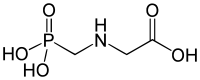
Фосфонаты являются сложными эфирами фосфоновых кислот общей формулы RP(O)(OR 1 )n(OH)2-n. В зависимости от числа гидроксильных групп фосфонаты делятся в на первичные (n=1, кислые фосфонаты), и вторичные (п = 2, полные фосфонаты).
Химические свойства
Первичные фосфонаты являются умеренно сильными кислотами (например, для n-ClC6H4P(O)(OC4H9)OH рКа = 1,7) и образуют соли аминами, вторичные образуют аддукты с кислотами Льюиса (например, с галогенидами бора).
При нагревании первичные фосфонаты диспропорционируют с образованием полифосфатов, вторичные диалкилфосфонаты при нагревании выше 150°С разлагаются с образованием первичных фосфонатов и алкенов:
При взаимодействии с пятихлористым фосфором и первичные, и вторичные фосфонаты образуют хлорангидриды фосфоновых кислот:
RP(O)R 1 2 + PCl 5 RP(O)R 1 Cl + R 1 Cl + POCl 3
Другим серьезным вопросом является влияние макисмально допустимой температуры воды (с учетом пристенных перегревов в котле или теплообменнике), при которой органофосфонаты способны ингибировать солеотложения. Современные теоретические основы ингибирования кристаллизации минеральных солей, позволяющие получить ответы на эти вопросы, развиты в работе (16)
Теоретическое обоснование предлагаемого способа
Способ ингибирования солеотложений основан на введении в воду органофосфоновых кислот, их солей или комплексонов с металлами. При введении кислот, например, нитрилотриметилфосфоновой кислоты, молекулы кислоты в водном растворе подвергаются ионизации
Аналогично подвергаются ионизации и молекулы солей этих кислот. Образовавшиеся ионы взаимодействуют с содержащимися в воде ионами кальция и других металлов с образованием комплексных соединений – фосфонатов: HN ( CH 2 PO 3 H ) + Ca 2+ [ H N ( CH 2 PO 3 H )3 Ca ] Строение фосфонатов хорошо изучено. И в состав наиболее эффективных современных ингибиторов солеотложений входят уже готовые фосфонаты, чаще всего цинка. Ионы фосфонатов, обладающие большим дипольным моментом, адсорбируются на поверхности зародышей кристаллов. В результате зародыши, находящиеся вблизи границы термодинамической устойчивости, не могут расти и растворяться под влиянием флуктуаций, обусловленных тепловым движением. Механизм образования зародышей кристаллов в пересыщенном растворе минеральных солей до настоящего времени однозначно не выяснен. Это не дает возможности обосновывать ингибирование солеотложений строгими расчетами. Очевидно, однако, что рост кристалла возможет только из такого зародыша, который обладает основными элементами симметрии кристаллической решетки минеральной соли. Предположительно зародыш кристалла состоит из нескольких сформированных ячеек кристаллической решетки минеральной соли, а рост такого зародыша осуществляется застройкой соседних ячеек, образующих ступени роста на поверхности зародыша. Адсорбция иона фосфоната на поверхности такого зародыша не дает возможности застроить частицами минеральной соли примыкающие ячейки кристаллической решетки и вследствие этого тормозит рост зародыша.
Очевидно, что адсорбция ионов фосфоната может тормозить только рост зародыша, но никак его первоначальное флуктуационное возникновение. Для того, чтобы тормозить рост зародыша, адсорбированный ион фосфоната должен занять положение, пересекающее границы примыкающей к поверхности зародыша соседней ячейки кристаллической решетки. Для этого зародыш должен иметь хотя бы одну минимально развитую грань. Это возможно только в том случае, если зародыш состоит, как минимум, из двух ячеек кристаллической решетки. С другой стороны введение фосфонатов в оду может предотвратить кристаллизацию минеральных солей только в том случае, когда такой зародыш термодинамически неустойчив. Такой зародыш будет находиться в неустойчивом равновесии с раствором, если при его образовании изменение изобарно-изотермического потенциала (свободной энергии Гиббса) ∆ G будет положительным (17). Значение ∆ G дается формулой
При повышении температуры указанные границы резко снижаются – как из-за увеличения знаменателя правой части неравенства (5), так и за счет уменьшения произведений растворимости указанных солей. Кроме того, полученные соотношения дают только теоретический предел, и все изложенное совершенство не означает, что во всех случаях, когда (5) – (7) выполняются, применение фосфонатов технически эффективно и экономически оправдано. Однако, если эти условия не выполнены, то ингибирование солеотложений фосфонатами вообще невозможно.
1.Hwa Ch.M.Organic phosphorous acid compound-chromate corrosion protection in aqueous system. – Патент США № 3431217, 1969
2.Hatch G.B., Ralston P.H Method of inhibiting corrosion with aminomethylphosphonic acid compositions. – Патент США № 3483133, 1969
3.Дятлова Н.М., Темкина В.Я., Попов К.И. Комплексоны и комплексонаты металлов – М.: Химия, 1988
4.Евсеев А.М., Николаева Л.С., Дятлова Н.М., Самакаев Р.Х. Математическое моделирование процесса ингибирования кристаллизации солей из пересыщенных растворов. – Журнал физической химии, №7/1984.
5.Xiao J.J., Kan A.T., Tomson M.B. The role of calcium phosphino-polycarboxylate complexation in inhibiting BaSO4 precipitation from brine. – «Advanced on crystal growth inhibitor technologies»,ed. by Z.Amjad. N. – Y.: Kluwer Academic/Plenum Publishers, 1999.
6.Tomson M.B., Fu G., Watson M.A. Kan A.T. Mechanism of mineral scale inhibition. – SPE Scale symposium, Aberdeen, 2002.
8. Ковальчук А.П. Состав для ингибирования солеотложений и коррозии и способ его получения. – Патент РФ № 2205157, 2003.
9.Потапов С.А. Перевод систем теплоснабжения на подпитку жесткой недеаэрированной водой. – Журнал «С.О.К.», № 6/2005.
10.Чаусов Ф.Ф., Плетнев М.А., Казанцева И.С. Проблемы и решения при внедрении технологии комплексонной обработки воды. Опыт Удмуртского государственного университета –
11.Ремезов В.Н., Юрин В.М. Проблемы выбора новых технологий. – «ЖКХ», №3/2005.
12.Чаусов Ф.Ф., Савинский С.С., Закирова Р.М., Кузькина С.П., Казанцева И.С. Причина аварии – «Комплексон». – Журнал «С.О.К.», № 7/2006.
13.Правила технической эксплуатации электрических станций и сетей Российской Федерации. – М.:Изд-во «ЭНАС», 2004.
14.Чаусов Ф.Ф., Раевская Г.А. Комплексонный водно-химический режим теплоэнергетических систем низких параметров. Практическое руководство – М.-Ижевск, НИЦ «Регулярная и хаотическая динамика», 2003 – 280 с.
15.Балабан-Ирменин Ю.В., Рудакова Г.Я., Ларченко В.Е., Рубанов А.М. К вопросу о методике выбора марки и дозы антинакипина для систем теплоснабжения. – «Энергосбережение и водоподготовка»,
16.Чаусов Ф.Ф. Ингибирование роста кристаллов солей щелочноземельных металлов в водных растворах. Теория и технические приложения. – Автореф. дисс. на соискание уч. степени канд. хим. наук. – Нижний Новгород, 2005.
СОДЕРЖАНИЕ
Основные свойства
Соли фосфонатов являются результатом депротонирования фосфоновых кислот, которые являются дипротонными кислотами:
RPO (OH) 2 + NaOH → H 2 O + RPO (OH) (ONa) (мононатрий фосфонат) RPO (OH) (ONa) + NaOH → H 2 O + RPO (ONa) 2 (динатрийфосфонат)
Сложные эфиры фосфоновой кислоты являются результатом конденсации фосфоновых кислот со спиртами.
Синтез
Существует несколько методов получения фосфоновых кислот и их солей.
Из фосфоновой кислоты
Большинство процессов начинается с фосфористой кислоты (также известной как фосфоновая кислота, H 3 PO 3 ), использующей ее реактивную связь P-H.
Фосфоновую кислоту можно алкилировать в условиях Манниха с получением аминометилированных фосфонатов, которые используются в качестве комплексообразователей. Одним из примеров является промышленный препарат нитрилотриса (метиленфосфоновой кислоты) :
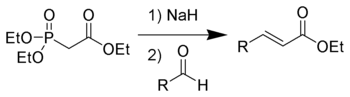
Фосфоновая кислота также может быть алкилирована производными акриловой кислоты с получением фосфоновых кислот, функционализированных карбоксильными группами. Эта реакция является вариантом добавления Майкла :
В муфтах Hirao диалкила фосфиты (который также можно рассматривать как ди-сложные эфиры фосфоновой кислоты: (O = РН (OR) 2 ) подвергаются катализируемым палладий реакция сочетания с арилгалогенидом с образованием фосфоната.
Реакция Михаэлиса-Арбузова
Эти сложные эфиры можно гидролизовать до кислоты (Me = метил):
MePO (OMe) 2 + H 2 O → MePO (OH) 2 + 2 MeOH
В реакции Михаэлиса-Беккера сначала депротонируется диэфир гидрофосфоновой кислоты, а образующийся анион алкилируется.
Из треххлористого фосфора
Этот аддукт реагирует с уксусной кислотой:
Этот хлорид подвергается дегидрохлорированию, чтобы получить цель:
Реакции
Гидролиз
Сложные эфиры фосфоновой кислоты обычно подвержены гидролизу как в кислых, так и в основных условиях. Расщепление связи ПК сложнее, но может быть достигнуто в агрессивных условиях.
O = PC (OR) 2 + 2 H 2 O → O = PC (OH) 2 + 2 ROH
Реакция Хорнера – Уодсворта – Эммонса
Структурные подклассы
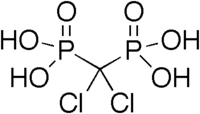
Бисфосфонаты
Тиофосфонаты
Фосфонамидаты
Встречаемость в природе
Использует
Хеланты металлов
Добавки для бетона
Медицина
В медицине фосфонаты и бисфосфонаты обычно используются в качестве ингибиторов ферментов, которые используют фосфаты и дифосфаты в качестве субстратов. В частности, эти ферменты включают те, которые производят промежуточные продукты биосинтеза холестерина.
Ниша использует
Токсикология
Токсичность фосфонатов для организмов, живущих в воде, невысока. Сообщенные значения для 48-часового значения ЛК 50 для рыб составляют от 0,1 до 1,1 мМ. Также коэффициент биоконцентрации для рыб очень низкий.
Биоразложение
В природе бактерии играют главную роль в разложении фосфонатов. Из-за присутствия в окружающей среде природных фосфонатов бактерии развили способность метаболизировать фосфонаты в качестве источников питательных веществ. Некоторые бактерии используют фосфонаты в качестве источника фосфора для роста. Аминофосфонаты также могут использоваться некоторыми бактериями в качестве единственного источника азота. Полифосфонаты, используемые в промышленности, сильно отличаются от природных фосфонатов, таких как 2-аминоэтилфосфоновая кислота, поскольку они намного крупнее, несут высокий отрицательный заряд и образуют комплексы с металлами. Тесты на биоразложение осадка от городских очистных сооружений с HEDP и NTMP не показали никаких признаков разложения. Исследование HEDP, NTMP, EDTMP и DTPMP в стандартных тестах на биоразложение также не позволило идентифицировать какое-либо биоразложение. Однако было отмечено, что в некоторых испытаниях из-за высокого отношения шлама к фосфонату наблюдалось удаление исследуемого вещества из раствора по мере потери DOC. Этот фактор был связан с адсорбцией, а не с биоразложением. Однако бактериальные штаммы, способные разлагать аминополифосфонаты и HEDP в условиях ограниченного фосфора, были выделены из почв, озер, сточных вод, активного ила и компоста.
Самые опасные компоненты бытовой химии
Жизнь современного человека почти невозможна без различных средств бытовой химии, они существенно облегчают уборку, мытье посуды, стирку, другие домашние дела. Но некоторые компоненты этих средств особенно агрессивны по отношению к человеку, животным и окружающей среде. И лучше воздержаться от их покупки или хотя бы использовать как можно реже. Какие именно строчки в составе должны насторожить, мы и расскажем в этом материале.
1. Поверхностно-активные вещества
ПАВы состоят из молекул с двумя «полюсами»: один может взаимодействовать с жиром, другой – с водой, благодаря этому средства с ПАВами так хорошо удаляют грязь. Поверхностно-активные вещества бывают неионогенными, анионными и катионными, вторые более опасны для кожи и окружающей среды. ПАВы добавляют в средства для стирки как основное действующее вещество, поэтому очень важно, чтобы они не оставались на одежде после полоскания, так как в противном случае они могут вызвать негативную реакцию кожи. С точки зрения безопасности лучше не стиральные порошки, а гели. Он содержат меньше анионных ПАВ, а еще он не выделяет пыль, которая попадает в легкие. Но важно помнить, что гели необходимо использовать не в горячей воде, и они подходят скорее для повседневной стирки, а не удаления серьезных загрязнений.
Анионные поверхностно-активные вещества могут спровоцировать аллергическую реакцию, нарушения иммунитета, неблагоприятно влиять на кожу, а в больших концентрациях даже поражать печень, почки, легкие, нервную систему. И самое неприятное, ПАВы, способны проникать через кожный покров, и накапливаться в организме человека. Поэтому особенно важно использовать перчатки при работе с моющими средствами, при ручной стирке, смывать растворы с поверхностей чистой водой. В информации о составе средств бытовой химии указано процентное содержание компонентов. Важно понимать, что чем больше ПАВ содержится в средстве, тем лучше оно справится с загрязнением, но и тем выше опасность для организма.
2. Фосфаты и фосфонаты
Эти вещества связывают кальций, магний и железо, которые в свободной форме мешают работать ПАВ. Они вредны для здоровья (фосфонаты – в меньшей степени) и окружающей среды: попадая в канализацию, они загрязняют воду, и особенно актуально это в силу того, что фосфаты добавляют в стиральные порошки и жидкое мыло.
Немаловажно и то, что фосфаты увеличивают способность анионных поверхностно-активных веществ проникать в организм человека. И эти два вещества зачастую используют в средствах вместе, потому что их сочетание усиливает моющую способность бытовой химии.
Фосфаты могут также приводить к излишнему обезжириванию и обезвоживанию кожи, поэтому важно использовать средства, в которых они содержатся, в перчатках.
Он вам не Вертер: выбираем робот-пылесос
3. Хлор и соединения на его основе
Хлор – очень эффективное средство для дезинфекции, но он крайне агрессивен к окружающей среде и здоровью человека. В процессе использования средств появляются летучие испарения, которые проникают в легкие и вызывают или обостряют заболевания дыхательных путей и сердца. Также соединения активного хлора агрессивны по отношению к коже, средства с ним нельзя использовать без перчаток! Вообще лучше исключить бытовую химию с хлором из своего арсенала, она действительно необходима только в том случае, если нужно продезинфицировать помещение или поверхность, для повседневной уборки такое точно не требуется.
4. Отдушки (ароматизаторы)
Ароматизаторы в бытовой химии могут быть естественными или химическими. Все они могут вызывать в некоторых случаях вызывать аллергическую реакцию, но со вторыми это происходит чаще. К тому же, некоторые вещества, которые используются для ароматизации бытовых средств, могут негативно влиять на здоровье. Некоторые химические вещества имитируют эстроген, а он увеличивает риск развития рака молочной железы. Диэтилфталат всасывается через кожу и накапливается в жировой ткани.
Если вы хотите обезопасить себя, по возможности выбирайте средства с нейтральным запахом или натуральными ароматизаторами типа эфирных масел.
Очень опасная кухня: отделяем мух от котлет, а правду от вымысла
5. Фенол
Фенольные соединения могут добавлять в моющие средства для обеззараживания, а так же в качестве консерванта. Фенол – органическое соединение, которое легко проникает в организм человека и может поражать нервную систему, внутренние органы.
Коронавирус не пройдет: как правильно убирать квартиру во время пандемии
Что же тогда делать?
Внимательное изучение воздействия некоторых компонентов бытовой химии на организм приводит к справедливому вопросу: что же, совсем бытовую химию не покупать? Столь радикально отказываться от них не нужно, но некоторые правила соблюдать необходимо.
1. Выбирайте средства под свою задачу. Если вам нужно отмыть серьезные загрязнения, то и бытовая химия нужна «агрессивная», с действующим веществом, которое может справиться со сложной задачей. Если у вас чувствительная кожа, выбирайте максимально экологичные средства, которые нанесут минимальный вред.
2. Строго следуйте рекомендациям производителя относительно использования бытовой химии. Если рекомендуется надеть перчатки во время уборки, лучше это сделать. Не пренебрегайте правилами, даже если не хочется каждый раз «возиться», это позволяет минимизировать негативное воздействие химии на ваш организм.
3. Храните средства правильно. Только в тех местах, где до них не могут добраться дети и домашние животные, самые агрессивные порошки и гели – отдельно и в максимально недоступном шкафчике. Не используйте упаковки от чистящих средство повторно. Если средство разлилось или рассыпалось, очень тщательно уберите его остатки. И следите за сроками годности (да, у бытовой химии они тоже есть), старые средства лучше не использовать, поэтому вовремя обновляйте свои запасы, а ненужные средства правильно утилизируйте (то есть, не сливайте в канализацию, не высыпайте там, где они могут попасть в почву или воду, привлечь бродячих животных).
Цеолиты в стиральном порошке: вред и польза для человека и экосистемы
Стирка – неотъемлемая часть нашей повседневной жизни. Обычно мы даже не задумываемся из чего состоит моющее средство. И при покупке ориентируемся только на известность марки и надписях на упаковке. А зря, потому как в порошках может быть добавлено такое, от чего вы зачешетесь, покраснеете и зачихаете. Во многие средства для стирки производители добавляют вредные и опасные компоненты, способные вызвать раздражение кожи, аллергию и другие неприятности. Итак, заглянем внутрь упаковки порошка, и выясним, что делают цеолиты в стиральном порошке, вред и польза ПАВ, фосфатов и фосфонатов.
Цеолиты в стиральном порошке: вред и польза
Одной из безопасных добавок в моющие средства считаются цеолиты. Использовать цеолиты в стиральных порошках стали около 25 лет назад с целью замещения вредных для человека фосфатов. Представляют они собой минералы, обладающие свойствами сорбента. И наподобие активированного угля «вытягивают» грязь из одежды. В природе существует больше 40 видов цеолитов, образующихся при определенных условиях из вулканических или донных морских пород. Натуральные цеолиты абсолютно безопасны и даже добавляются в эко-порошки, в составе они значатся под словом zeolith. Разберемся с пользой и вредом цеолитов.
Польза цеолитов
Читайте также: Защита от солнца в городе
Полезны эти минералы в следующем:
Вред цеолитов
НО! Существуют синтетические цеолиты, то есть созданные химиками искусственно. Вот они и представляют опасность. Придумано их более ста видов, в составе порошка обозначены как zeolith A, X, или Y. Их минусы таковы:
Если говорить о природных цеолитах, то они, конечно же, не представляют опасности для человека. А вот их синтетических аналогов лучше избегать. В большинстве порошков спрятаны намного более страшные ингредиенты – фосфаты и фосфонаты.
Цеолиты и фосфаты
Фосфаты (или триполифосфат натрия) относятся к синтетическим моющим средствам и очень неблагоприятно влияют на организм человека. Представляют собой соединение натрия, фосфорной кислоты, калия или кальция. Содержание фосфатов в моющем средстве может достигать 60 %. И чем его больше, тем хуже для нас. В некоторых странах мира этот химикат вообще запрещен. У России в данном отношении законы снисходительней и производители порошков щедро сдабривают свою продукцию этой отравой. Всё потому, что фосфаты обладают хорошей очистительной способностью. А это главное условие для порошка и больших объемов его продаж. Но немаловажной является и безопасность моющего средства. И вот чем эти синтетические добавки могут нам навредить:
Исходя из вышесказанного, делаем вывод о том, что порошки с фосфатами нам в доме не нужны. Они вредны, токсичны и крайне опасны.
Экологическая грамотность населения постоянно повышается. Довольно многие знают о вреде фосфатов и моющие средства с ними не покупают. Производители тоже не стоят на месте и пытаются минимизировать вред, заменяя фосфаты на фосфонаты, утверждая, что они безвредны. Но это не совсем правда.
Фосфонаты в стиральных порошках
Фосфонаты — соединения фосфора с добавление карбона. Относятся к фосфоорганическим — призваны смягчать воду и отстирывать загрязнения. Промышленное название фосфонатов — тетранатрия этидронат. Именно эту маркировку следует искать в составе мыла, моющего средства или порошка. Так же как и цеолитов, фосфонатов создано несколько десятков видов. Одни являются безопасными, а другие ядовиты и часто используются в пестицидах. При некоторых условиях фосфонаты могут превращаться в фосфаты и тогда становятся опасными. Плюс этих эфиров в том, что добавляют их в порошок куда меньше, чем фосфатов. Поэтому они менее опасны и окружающей среде тоже вредят меньше, чем фосфаты.
Что такое ПАВ в стиральном порошке
Главные составляющие любого моющего средства, будь то порошок или гель для мытья посуды, это поверхностно активные вещества, сокращенно – ПАВ. Они относятся к синтетическим химическим соединениям и отвечают за смягчение воды и удаления загрязнений. Исследования этих химических добавок проходили ещё в 60-е годы XX века. Учеными было установлено, что они крайне агрессивны и способны вредить здоровью человека, например:
В порошках ПАВ не должно быть больше 7 %, а во многих страна Европы они запрещены на законодательном уровне и не добавляются даже в моющие средства для автомобиля.
Цеолиты в стиральном порошке, вред и польза — подводим итоги
Особенности применения бисфосфонатов при остеопорозе
Бисфосфонаты – вещества, предотвращающие потерю костной массы. Назначаются при лечении остеопороза и других заболеваний, сопровождаемых частыми переломами. Могут назначаться для снятия болей при опухолевых образованиях в костях, препятствуют распространен
ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ
Мягко, приятно, нас не боятся дети
ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ
Мягко, приятно, нас не боятся дети
Бисфосфонаты (бифосфонаты или дифосфонаты) – фармакологические препараты, предотвращающие потерю костной массы и применяемые для лечения остеопороза и других схожих заболеваний.
Бисфосфонаты известны в фармакологии еще с середины ХІХ века. Изначально они применялись для смягчения воды в оросительных системах (сельское хозяйство). Главное свойство этих веществ – предотвращение растворения гидроксиапатита (основного минерала, входящего в состав костной ткани) а, следовательно, и замедление снижения костной массы, привлекло внимание фармакологов.
Только в 1990 году был представлен первый лекарственный препарат на основе бисфосфонатов, который прочно вошел в комплекс терапевтического лечения болезней, связанных с потерей костной массы. Данная группа препаратов может эффективно использоваться при деформирующих оститах (заболевание Педжета), при метастазах костной ткани (обусловленных гиперкальциемией или без нее), при множественных миеломах, при остеопорозе, при первичных гиперпаратиреозах, при несовершенном остеогенезе и пр. Все перечисленные заболевания характеризуются хрупкостью костей и высокой вероятностью переломов.
Механизм действия бисфосфонатных препаратов
Механизмы действия бисфосфонатов основываются на их структурной схожести с естественными веществами – пирофосфатами. Они входят в состав костного матрикса и являются активными ингибиторами ферментов, которые утилизируют (естественно разрушают) пирофосфаты. Эти вещества связываются с гидроксиапатитными частицами костей, уменьшая их ломкость, и понижают уровень оксипролина и щелочной фосфатазы в составе крови.
Две молекулы фосфатов, соединяясь с ионами кальция, накапливаются в слоях костной ткани, а затем уничтожаются остеокластами. Именно эти фармакологические свойства бисфосфонатов и ингибирование (подавление) остеобластов лежат в основе замедления разрушения и ломкости костей скелета. Более того, некоторые из видов этих соединений способны снижать процессы синтезирования мевалоната, который выступает базисом для образования остеобластов, и понижать содержание геранилдифосфата, который участвует в процессе синтеза некоторых белковых соединений остеокластов.
Ряд исследований подтвердили целесообразность использования бисфосфонатов при лечении опухолевых заболеваний различной качественности. Так бисфосфонаты тормозят процесс сращивания опухолевых клеток с костным матриксом, тем самым предотвращая образование метастаз.
Клинически подтвердились и высокие обезболивающие качества препаратов, которые теперь стали активно применяться в комплексной терапии костных переломов, вызванных остеопорозом или другими схожими заболеваниями. Так, например, снизить боли в спине при компрессионных переломах позвоночника бисфосфонаты помогли более чем 50% пациентов, а полностью снять болевой синдром – у 18%.
В некоторых случаях препараты назначаются для снятия болевого синдрома и для лечения таких заболеваний позвоночника как: грыжа межпозвоночных дисков, протрузия межпозвонковых дисков и т.д.
Разновидности бисфосфонатных препаратов
На сегодняшний день фармакология разработала уже третье поколение бисфосфонатных препаратов, но и от применения предыдущих до конца не отказалась. Все лекарственные вещества на основе бисфосфонатов можно разделить на две группы: азотсодержащие и безазотовые соединения. Они имеют разный механизм воздействия на клетки остеокластов во время их уничтожения.
Бисфосфонаты, не содержащие азот:
Побочные эффекты при приеме бисфосфонатных препаратов
Бесспорно, бисфосфонаты показывают высокий терапевтический результат при лечении остеопороза, гиперкальциемии, при уменьшении болевого синдрома, вызванного заболеваниями позвоночника и раковыми образованиями в костях скелета, останавливают распространение метастазов в костной ткани. В некоторых случаях эти вещества используют при проведении лечения сложных переломов травматического характера или возникающих из-за заболеваний скелета и снижения их плотности.
Также клинически установлено, что бисфосфонаты способны повышать имплантационную стабильность эндопротезов после удаления одной или нескольких костей скелета, снижать кальцификацию протезированных сердечных клапанов, повышать способности иммунной системы.
Но, как и все лекарственные препараты, бисфосфонаты имеют ряд побочных эффектов:
Учитывая все вышеперечисленные побочные эффекты можно сказать, что терапия бисфосфонатами должна проводиться только под наблюдением лечащего врача. При этом конкретно для каждого пациента должна назначаться соответствующая заболеванию дозировка и периодически необходимо выполнять лабораторно-исследовательский контроль состояния костной ткани, крови, мочи и т.д.