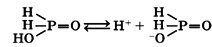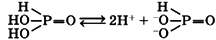Фосфорная кислота и ортофосфорная кислота в чем разница
Фосфорная кислота: получение и свойства
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Химические свойства
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Оксиды фосфора. Фосфорная кислота
Фосфор образует очень большое число различных оксидов и кислот. Среди них наиболее устойчивыми являются оксид фосфора (V) и соответствующая ему ортофосфорная, или фосфорная, кислота Н3РО4.
Оксид фосфора (V), или фосфорный ангидрид Р2О5 – белый порошок, без запаха. По своему характеру является типичным кислотным оксидом. При растворении в воде гидратируется с образованием следующих кислот:
Как кислотный оксид Р2О5 взаимодействует с основаниями и основными оксидами, например:
При взаимодействии Р2О5 со щелочами в зависимости от соотношения реагентов могут образовываться не только средние, но и кислые соли:
Хотя в Р2О5 фосфор имеет высшую степень окисления +5, оксид фосфора (V) не проявляет сколько-нибудь выраженных окислительных свойств, так как эта степень окисления для фосфора очень устойчива.
Оксид фосфора (V) является прекрасным водопоглощающим и водоотнимающим средством. На этом основано его использование в эксикаторах (сосудах для высушивания веществ), при проведении реакций дегидратации и т.д.

Фосфорная (ортофосфорная) кислота Н3РО4 – бесцветное кристаллическое вещество, плавящееся при температуре 42 о С, очень хорошо растворимое в воде. Фосфорная кислота является трёхосновной кислотой средней силы.
В лаборатории её получают окислением фосфора разбавленной азотной кислотой.
В промышленности Н3РО4 получают экстракционным методом, обрабатывая природные фосфаты серной кислотой:
а также термическим методом, восстанавливая природные фосфаты до свободного фосфора, который затем сжигают и образующийся при этом Р2О5 растворяют в воде.
Фосфорная кислота обладает всеми общими свойствами кислот, но она значительно слабее таких кислородсодержащих кислот, как серная и азотная. В отличие от этих кислот фосфорная кислота не обладает даже значительными окислительными свойствами, несмотря на устойчивость степени окисления +5.
Применение фосфорной кислоты
Помимо производства удобрений, фосфорную кислоту используют при изготовлении реактивов, многих органических веществ, для получения катализаторов, для создания защитных покрытий на металлах, в фармацевтической промышленности и т.д.
Соли фосфорной кислоты
Как трёхосновная кислота Н3РО4 образует три ряда солей: средние (нормальные) соли – фосфаты; кислые соли – гидрофосфаты и дигидрофосфаты.
Например, при нейтрализации фосфорной кислоты гидроксидом натрия в зависимости от молярного соотношения кислоты и щёлочи могут идти следующие реакции:
Большинство средних солей – фосфатов – нерастворимо в воде. Исключением являются лишь фосфаты щелочных металлов и аммония. Многие же кислые соли фосфорной кислоты, хорошо растворяются в воде, причем наиболее растворимыми являются дигидрофосфаты.
Фосфорные удобрения
Фосфор, как и азот, является одним из тех элементов, который необходим для питания растений. Поэтому наряду с азотными в сельском хозяйстве широко используются фосфорные удобрения. В качестве удобрения можно использовать только водорастворимые соединения. В связи с этим основная задача при производстве фосфорных удобрений — превращение нерастворимого фосфата кальция (основа фосфоритов и апатитов) в растворимые кислые фосфаты.
Важнейшее фосфорное минеральное удобрение – суперфосфат (или простой суперфосфат), который получают обработкой природных фосфоритов серной кислотой:
Образующаяся смесь содержит дигидрофосфат кальция, который хорошо растворим в воде, и сульфат кальция, который не имеет практического значения.
Для получения двойного суперфосфата из природного фосфорита выделяют сначала фосфорную кислоту по реакции:
Затем полученной кислотой обрабатывают новую порцию фосфорита:
Иногда фосфорную кислоту нейтрализуют гидроксидом кальция, при этом получается так называемый преципитат, который тоже является хорошим удобрением:
СаНРО4 плохо растворяется в воде, но достаточно хорошо растворим при внесении его в кислые почвы.

В последнее время широкое распространение получили сложные удобрения, содержащие несколько необходимых растениям элементов.
Важнейшим из них является аммофос, который содержит азот и фосфор и образуется при взаимодействии аммиака и фосфорной кислоты:
Смесь аммофоса с калийной селитрой KNO3 называется аммофоской. Это удобрение содержит все наиболее необходимые растениям питательные элементы – азот, фосфор и калий.
*на изображении записи минерал апатит
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Фосфорные кислоты
Разновидности фосфорных кислот:
Метафосфорная кислота
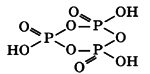
Триметафосфорная кислота (HPO3)3 построена из трех остатков метафосфорной кислоты, которые составляют замкнутый цикл:
Соответственно, тетраметафосфорная кислота (HPO3)4 построена из 4 остатков метафосфорной кислоты, и получается воздействием фосфорного ангидрида P2O5(V) на воду при низких температурах:
P4O10+2H2O = (HPO3)4
Ортофосфорная кислота H3PO4
H3PO4 диссоциирует в три ступени:
Несмотря на тот факт, что фосфорная к-та обладает всеми свойствами общих кислот, она намного слабее, например, азотной или серной кислоты, и не обладает, в отличие от сильных кислот, сколь-нибудь значительными окислительными свойствами, что объясняется устойчивой степенью окисления фосфора (+5).
В промышленности ортофосфорную кислоту получают воздействием серной кислоты на фосфориты и апатиты (экстракционный метод):
Ca3(PO4)2+3H2SO4 = 2H3PO4+3CaSO4
Более чистая кислота получается сжиганием фосфора с последующим растворением в воде образующегося оксида P2O5.
Фосфорную кислоту применяют в производстве:
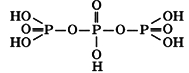
Полифосфорная кислота
Эти кислоты состоят из открытых цепей, в состав которых входят 2..10 атомов фосфора. На рисунке ниже изображена структура молекулы трифосфорной кислоты H5P3O10:
Фосфорноватистая кислота H3PO2
Бесцветные кристаллы, хорошо растворимые в воде.
Водный раствор фосфорноватистой кислоты является сильной одноосновной кислотой:
Фосфорноватистая кислота и ее соли (гипофосфиты) являются сильными восстановителями:
H3PO2+2I2+2H2O = H3PO4+4HI
Фосфористая кислота H3PO3
Твердое бесцветное вещество, обладающее гигроскопическими свойствами, хорошо растворимо в воде.
Водный раствор фосфористой кислоты является двухосновной кислотой средней силы:
Соли фосфористой кислоты, называемые фосфитами, плохо растворимы в воде за исключением фосфитов щелочных металлов.
Фосфористая кислота и ее соли являются сильными восстановителями, восстанавливая неактивные металлы из их соединений:
2AgNO3+H3PO3+H2O = H3PO4+2Ag↓+2HNO3
Получение фосфористой кислоты:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Фосфорная кислота [H3PO4]: Структура | Свойства | Применение
В чистом виде фосфорная кислота представляет собой бесцветное твердое вещество. В менее концентрированном виде это вязкая жидкость без запаха с плотностью 1,885 г/мл. Обычно она нелетучая и нетоксична, но 85-процентный раствор по-прежнему может повредить глаза и вызвать сильное раздражение кожи.
Давайте копнем глубже и выясним, как образуется фосфорная кислота, как она выглядит на молекулярном уровне, каковы ее физические и химические свойства и где она используется.
Профиль фосфорной кислоты
Молярная масса: 97,994 г/моль
Внешний вид: густая бесцветная жидкость.
Точка кипения: 212 °C
Точка плавления: 42,35 °C (кристаллического твердого вещества)
Динамическая вязкость: от 2,4 до 9,4 сантипуаз (85% водный раствор).
Плотность: 1,83 г / см 3 (твердое вещество); 1,68 г / см 3 (85% водный раствор при 25 °C)
Структура
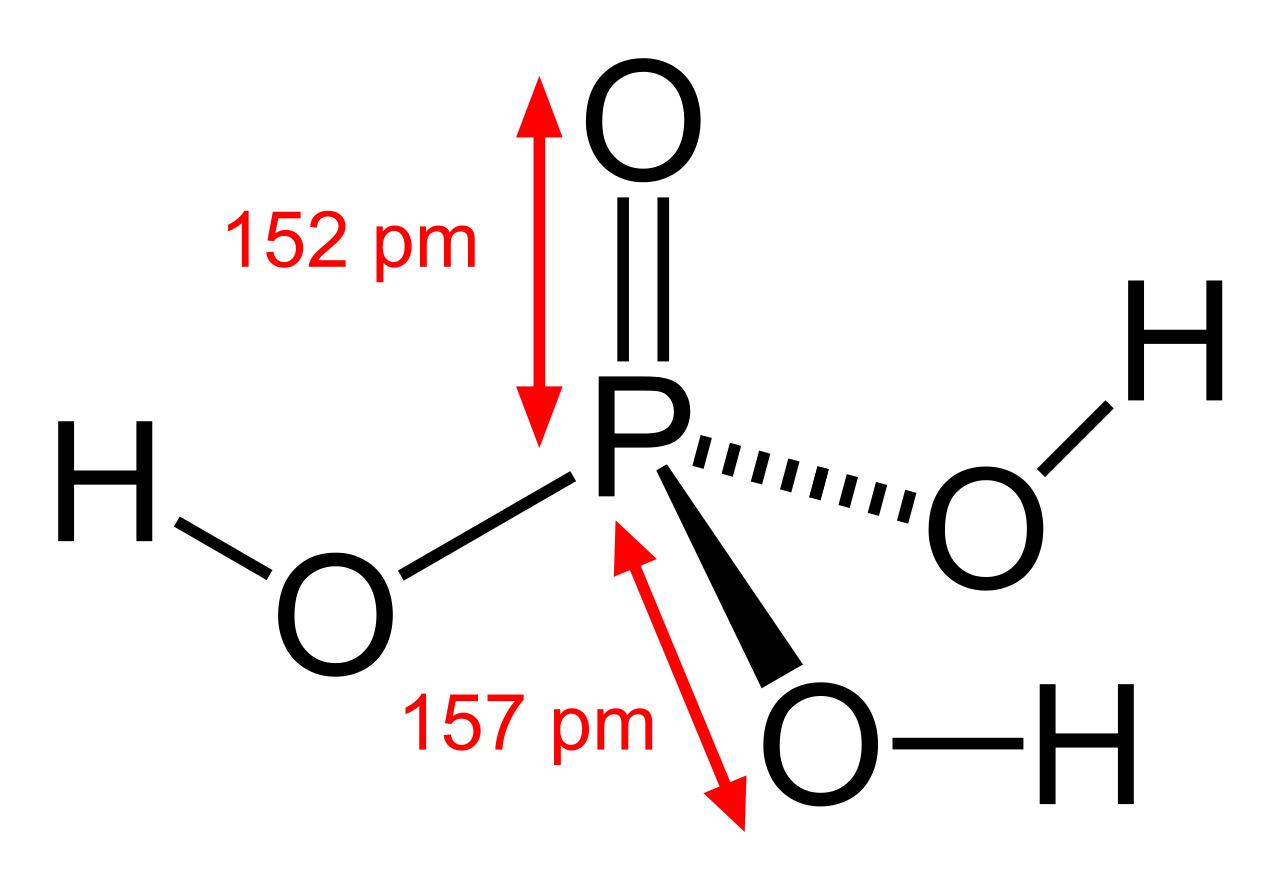
Соединение H3PO4 имеет в общей сложности 32 валентных электрона. Поскольку фосфор является наименее электроотрицательным, он помещается в центре. Атомы водорода присоединяются к внешней стороне атомов кислорода, образуя он-Группы.
В этой структуре каждый атом имеет полную внешнюю оболочку: атомы фосфора и кислорода имеют восемь валентных электронов, а атомы водорода имеют вокруг себя два валентных электрона.
В структуре все еще есть 32 валентных электрона, и каждый атом имеет формальный заряд, равный нулю. Таким образом, это наиболее вероятная или вероятная структура Льюиса для H3PO4.
Соединение содержит 3 одинарные связи ОН, 3 одинарные связи PO и 1 двойную связь P = O. Каждая одинарная связь является сигма-связью, а двойная связь состоит из сигма-связи и пи-связи.
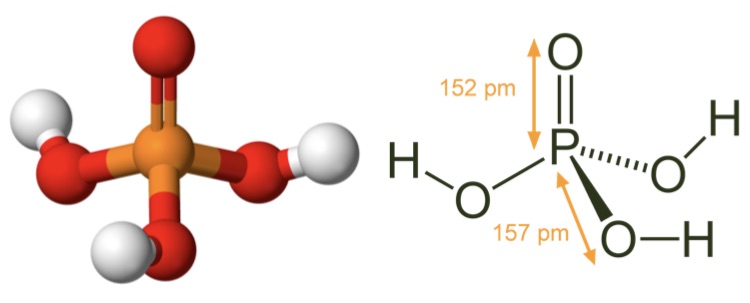
Фосфорная кислота: шарообразная модель и размеры структурной формулы
Молекулярная геометрия PO (OH)3 является тетраэдрической, а кристаллическая структура-моноклинной. А поскольку распределение зарядов на центральных атомах асимметрично, то молекула считается полярной.
Последние достижения в области нанотехнологий, включая методы поглощения рентгеновских лучей вблизи краев и методы рассеяния рентгеновских лучей под большим углом, позволили ученым точно определить структуру фосфорной кислоты. Расстояние связи P=O в структуре близко к 152 пикометрам, и расстояния P=O-O были уточнены до 309 пикометров, с углом связи близким к тетраэдрическому.
Как она производится?
Фосфорная кислота может быть синтезирована либо мокрым способом, либо термическим способом.
В последнем в качестве сырья используются воздух, вода и элементарный фосфор. Он включает в себя три важных этапа: сгорание, увлажнение и запотевание. Вот как это происходит:
Во-первых, жидкий элементарный фосфор сжигается в камере сгорания при высоких температурах в диапазоне от 1650 до 2760 °C. Эта реакция окисления происходит в окружающем воздухе и производит пятиокись фосфора.
Затем продукт гидратируют водой с образованием сильной фосфорной кислоты (в жидком состоянии).
На последнем этапе для удаления фосфорно-кислотного тумана из потока дымовых газов используются высоконапорные каплеуловители.
Концентрация фосфорной кислоты, синтезированной в этом процессе, обычно составляет от 75 до 85 процентов. Такие уровни концентрации необходимы для производства высококачественной химической продукции. Несколько эффективных установок извлекают чрезвычайно концентрированную фосфорную кислоту (до 99,9%), используя тот же тепловой процесс.
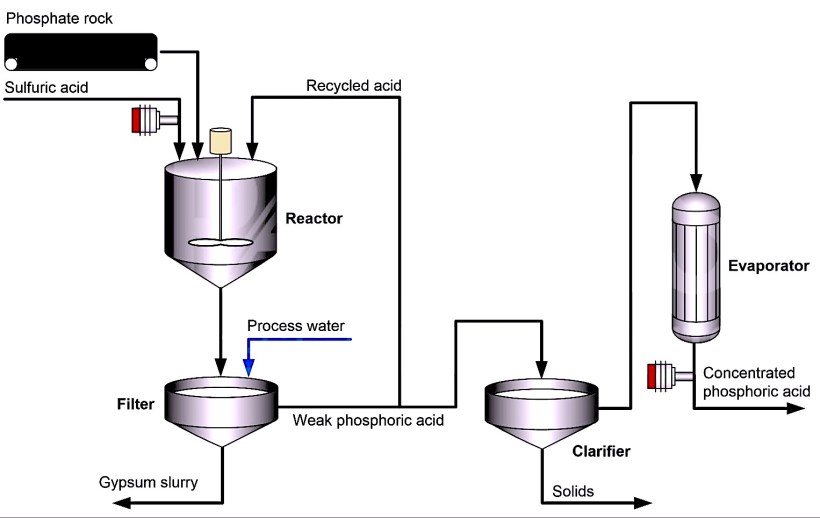
Однако почти 80% фосфорной кислоты производится мокрым способом. В этом методе серная кислота обрабатывается природным фосфатсодержащим минералом, таким как гидроксиапатит.
Минерал высушивают, крошат, а затем подают в реактор вместе с серной кислотой. В результате реакции сульфат сливается с кальцием (из минерала), образуя сульфат кальция (гипс).
Затем добавляется обработанная вода, и гипс вместе с другими нерастворимыми примесями удаляется через фильтр. Фосфорная кислота, полученная этим мокрым способом, содержит 25-30% пятиокиси фосфора.
Обычно эта кислота дополнительно концентрируется, чтобы соответствовать требованиям, предъявляемым к производству удобрений. В большинстве случаев фосфорная кислота концентрируется до 40-55% пятиокиси фосфора с помощью двух / трех вакуумных испарителей.
Свойства
Чистая фосфорная кислота в лаборатории выглядит как плотное, бесцветное, бесформенное кристаллическое твердое вещество, которое плавится при температуре 42,35 °C. Ее физические свойства зависят от чистоты, концентрации кислоты, а также от температуры, при которой вы ее видите.
Фосфорная кислота менее агрессивна и менее опасна по сравнению с азотной и серной кислотами. Это негорючее вещество как в жидкой, так и в твердой форме.
Когда кислота подвергается воздействию тепла, а затем охлаждается до комнатной температуры, она образует прозрачное, хрупкое стекло. После такого воздействия тепла состав кислоты остается прежним.
Обычно фосфорная кислота выпускается в виде бесцветного сиропа с концентрацией в воде 85 процентов и плотностью 1,885 граммов на миллилитр.
В водном растворе фосфорная кислота действует как трипротовая кислота, имеющая три ионизируемых атома водорода. Соединение может потерять эти атомы в виде протонов (ионов H + ).
Кислота растворима как в воде, так и в этаноле. Однако большинство ее солей не растворимы в воде, если нет сильной минеральной кислоты.
Области применения
Фосфорная кислота имеет несколько важных применений. Ее соли, такие как фосфаты аммония и кальция, широко используются в качестве удобрений. Кислота используется для производства электролитов, средств для удаления ржавчины, модификаторов рН, травителей, бытовых чистящих средств и дезинфицирующих средств.
Поскольку это вещество нетоксично и имеет умеренно кислую природу, оно также используется в напитках, пищевых ароматизаторах, косметике, средствах для ухода за зубами и кожей. Давайте подробнее рассмотрим, чем полезна фосфорная кислота.
В менее концентрированной форме она используется для производства различных видов безопасных фосфорных удобрений, которые помогают растениям расти. Фактически, почти 90% синтезированной фосфорной кислоты используется в качестве удобрений.
Многие безалкогольные напитки, в том числе Coca-Cola, содержат фосфорную кислоту. Это придает напитку слегка кисловатый вкус. Несмотря на то, что его концентрация достаточно низкая, экстремальный прием таких напитков может вызвать эрозию зубов и даже привести к образованию почечных камней.
Фосфорная кислота в качестве электролита имеет полезные характеристики, такие как хорошая ионная проводимость, низкая летучесть, стабильность при относительно высоких температурах и устойчивость к диоксиду углерода и монооксиду углерода.
Поскольку чистая фосфорная кислота обладает высокой протонной проводимостью и превосходной термостабильностью, полибензимидазол (PBI), допированный фосфорной кислотой, является наиболее многообещающим среди мембран на основе PBI, которые могут обеспечить хорошую производительность топливных элементов даже при низком уровне увлажнения и температуре 200 °С.
Специфическое применение фосфорной кислоты:
Глобальный рынок
Многие развивающиеся страны начали сосредотачиваться на увеличении добычи фосфатов и производства фосфатов. Правительства некоторых стран уже сотрудничали с различными поставщиками по всему миру для создания заводов по добыче минералов для производства фосфорной кислоты.
В 2019 году объем мирового рынка фосфорной кислоты оценивался в 45,85 миллиарда долларов. Ожидается, что к 2027 году он достигнет более 61 миллиарда долларов, а совокупный годовой темп роста составит 3,7%.
Рынок подразделяется на Азиатско-Тихоокеанский регион, Европу, Северную Америку, Латинскую Америку, Ближний Восток и Африку. Ожидается, что в ближайшем будущем Азиатско-Тихоокеанский регион будет доминировать на мировом рынке. Рост рынка фосфорной кислоты в этих регионах будет дополнительно подпитываться развитым сельскохозяйственным сектором Индии и Китая.
Разница между фосфором и фосфорной кислотой
Содержание:
Что такое фосфорная кислота?
Фосфорная кислота производится путем гидролиза ангидрида кислоты; п4О6.
Но на производстве в промышленных масштабах хлорид фосфора (PCl3) гидролизуется паром.
Фосфорная кислота используется в качестве восстановителя в химическом анализе. Эта кислота легко превращается в фосфорную кислоту при нагревании примерно до 180 ° C. соли, образованные фосфористой кислотой, известны как фосфиты. Наиболее распространенное применение фосфорной кислоты: он используется в производстве основного фосфита свинца (стабилизатор в ПВХ).
Что такое фосфорная кислота?
Фосфорная кислота представляет собой фосфорсодержащую кислоту, имеющую химическую формулу H3PO4. Название этого соединения по ИЮПАК: тригидроксидооксидофосфор. Это трипротонная кислота, потому что она может выделять три протона (иона водорода) в водной среде.
Производство фосфорной кислоты осуществляется двумя основными способами; мокрый процесс и термический процесс. Мокрый процесс включает производство фосфорной кислоты из фторапатита. Он известен как фосфатная порода и имеет химический состав 3Ca.3(PO4)2.CaF2. Эта фосфатная порода тонко измельчается для увеличения площади поверхности и вступает в реакцию с концентрированной серной кислотой, которая дает фосфорную кислоту и гипс (CaSO4.2H2O) как продукты.
Термический процесс производства фосфорной кислоты включает сжигание элементарного фосфора для получения очень чистой фосфорной кислоты. При сжигании элементарного фосфора образуется пятиокись фосфора (P2О5). Затем это соединение гидратируют с образованием фосфорной кислоты.