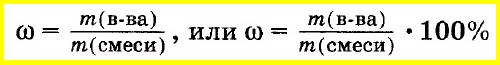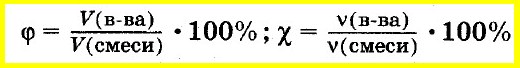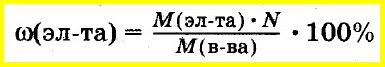как вычислить массовые отношения элементов
Урок №13. Массовая доля химического элемента в соединении
Массовая для элемента в данном веществе (w) – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества.
w – массовая доля элемента в веществе,
n – индекс в химической формуле,
Ar – относительная атомная масса,
Mr – относительная молекулярная масса молекулы вещества.
Массовые доли выражают в процентах или в долях:
w (элемента) = 20% или 0,2.
Вычислите массовые доли элементов в фосфорной кислоте, имеющей простейшую химическую формулу H 3 PO 4 , с точностью до сотых.
Дано :
Найти :
Решение :
1. Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав фосфорной кислоты
2. Вычисляем относительную молекулярную массу соединения
Mr(H 3 PO 4 ) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98
3. Вычисляем массовые доли элементов по формуле:
w (элемента) = (n· Ar(элемента) · 100%) / Mr( молекулы )
w(H) = n(H)·Ar(H)·100% / Mr(H 3 PO 4 ) = 3·1·100% / 98 = 3,06%
w(P) = n(P)·Ar(P)·100% / Mr(H 3 PO 4 ) = 1·31·100% / 98 = 31,63%
w(O) = n(O)·Ar(O)·100% / Mr(H 3 PO 4 ) = 4·16·100% / 98 = 65,31%
Сумма значений массовых долей всех элементов должна составить 100% w(H) + w(P) + w(O) = 100%
3,06% + 31,63% + 65,31% = 100%
Таким образом, массовые доли элементов в фосфорной кислоте вычислены правильно.
Вычисления по химическим формулам
Вычисления по химическим формулам
1. Вычисление относительной молекулярной массы вещества (Mr)
Задание: Вычислить относительную молекулярную массу молекулы серной кислоты (H2SO4)
1. Записать молекулярную формулу серной кислоты.
2.Записать формулу нахождения относительной молекулярной массы вещества
Mr (в-ва) = Ar (эл.1) ·n1 + Ar (эл.2) ·n2 + Ar (эл.3) ·n3
3. Подсчитать по формуле относительную молекулярную массу серной кислоты, подставив в формулу относительные атомные массы элементов и их индексы
Mr(H2SO4 ) = Ar(H)·2 + Ar(S)·1 + Ar(O)·4 = 1·2 + 32 + 16∙4=98
Ответ: Mr (H2SO4 ) = 98.
2. Вычисление массовых отношений элементов в сложном веществе
Задание: Найти массовые отношения элементов в оксиде серы (IV) SO2.
1.Записать формулу для вычисления массовых отношений
m(эл.1) : m(эл.2) = Ar(эл.1) ·n1 : Ar(эл.2) ·n2
2.Вычислить массовые соотношения серы и кислорода, подставив соотношения атомных масс
m(S): m(O) = 32: 16∙2=32 : 32
3. Сократить полученные числа на 32
3. Вычисление массовых долей элементов в сложном веществе
Задание: Определить массовые доли элементов в оксиде железа(III) Fe2O3.
1.Записать формулу для вычисления массовых долей элементов в сложном веществе
w (элемента) = Ar(элемента)∙n :Mr(в-ва)
2.Определить относительную молекулярную массу оксида железа(III)
Mr (Fe2O3) = 56∙2+16∙3 = 160
3.Вычислить массовые доли железа и кислорода, подставив значения атомных масс элементов, их индексов и относительной молекулярной массы вещества
4. Определение простейшей формулы вещества по массовым долям элементов и относительной молекулярной массе вещества
Задание: Определить формулу вещества, в состав которого входит 40% серы и 60 % кислорода. Относительная молекулярная масса вещества 80.
1.Найти количество серы и кислорода по формуле
n(элемента) = Mr(в-ва)·w /Ar(элемента)
2. Записать формулу
5.Нахождение простейшей формулы соединения по массовым долям элементов
Задание: Какова простейшая формула вещества, в котором массовые доли серы, железа и кислорода равны соответственно 24, 28 и 48 %.
1.Записываем формулу определения индексов элементов по массовым долям
2.Подставляем в формулу значение массовых долей и относительных атомных масс серы, железа и кислорода
n(S): n(Fe): n(O) = 24/32: 28/56: 48/16 =
3.Доводим полученные индексы элементов до целых чисел умножением на «4»
4.Записываем простейшую формулу вещества
S3Fe2O12 или Fe2(SО4)3
6. Вывод простейшей формулы соединения по отношению масс элементов в сложном веществе
Задание: Магний соединяется с азотом, образуя нитрид магния, в массовом отношении 18:7. Вывести формулу соединения.
1.Записываем формулу определения индексов элементов по массовым отношениям
n1: n2 = m(эл.1)/Аr(эл.1): m(эл.2)/Аr(эл.2)
2.Подставляем в формулу значение массовых отношений и относительных атомных масс магния и азота
n(Mg): n(N) = 18/24: 7/14 = 0,75:0,5
3. Доводим полученные индексы элементов до целых чисел умножением на «4»
n(Mg): n(N) = (0,75:0,5) ·4 = 3:2
4.Записываем простейшую формулу вещества
7. Вывод формулы соединения на основе продуктов его сгорания
Задание: При сжигании углеводорода массой 8,316 г образовалось 26,4 г CO2. Плотность вещества при нормальных условиях равна 1,875 г/мл. Найдите его молекулярную формулу.
1.Находим молярную массу углеводорода на основе его плотности
М =1,875 г/мл·22, 4 л/моль = 42 г/моль
2. Определим массовую долю углерода в оксиде углерода и его массу
w(С) = 12г/моль/44г/моль = 0,27
m(С) = m(СО2) · w(С) = 26,4 г·0,27 =7,128г
3. Найдем массу водорода в углеводороде
m(Н) = 8,316 г-7,128г = 1,188 г
4.Определим простейшую формулу вещества
n(С):n(Н) = 7,128г/12 г/моль:1,188 г/1 г/моль = 0,594: 1,188 = 1:2, т. е, простейшая формула вещества СН2
5.Определяем молярную массу простейшего вещества и сравниваем ее с молярной массой углеводорода, рассчитанной на основе его плотности
x = 42г/моль: 14г/моль =3
6.Утраиваем индексы элементов в простейшей формуле вещества, т. к. его молярная масса в 3 раза меньше, чем рассчитанная молярная масса углеводорода
Молекулярная формула углеводорода:
Задания для самоконтроля.
1. Вычислите массовые отношения и массовые доли элементов по химическим формулам:
в) сульфата меди CuSO4
Образец выполнения см. п.2 и 3
2. Определите эмпирическую формулу соединения алюминия с углеродом, в котором массовая доля алюминия равна 75%.
Образец выполнения см. п.5
3. Определите формулу вещества, состоящего из 70,9% калия и 29,1% кислорода Относительная молекулярная масса вещества 110.
Образец выполнения см. п.4
4. Определите простейшую формулу оксида, зная, что 3,2 г оксида содержит 2,24 г железа.
Образец выполнения см. п.6
— вычислять относительные молекулярные массы веществ;
— массовые отношения элементов в сложном веществе;
— массовые доли элементов в сложном веществе.
Как вычислить массовые отношения элементов
В химии массовое отношение, часто называемое «процентным составом по массе», представляет собой долю конкретной молекулы, которая состоит из составляющих ее элементов. Например, вода состоит из 11,1 процента водорода (Н) и 88,9 процента кислорода (О), что означает, что 1000-граммовый образец воды (равный 1 литру по объему) состоит из 111 г Н (0,111 × 1000 = 111) и 889 г О (0,889 × 1000).
Этот принцип порождает закон постоянного состава, выдвинутый Джозефом Прустом в 1800 году: данное соединение всегда имеет одинаковую пропорцию по массе составляющих его элементов. Например, вода всегда имеет ровно 8 грамм кислорода на каждый грамм водорода. Углекислый газ всегда содержит 2,67 г кислорода на каждый грамм углерода.
Рассчитать массовые отношения достаточно просто, если у вас есть доступ к периодической таблице (см. Ресурсы) и средства для выполнения базовой алгебры.
Допустим, вы хотите рассчитать массовое соотношение серной кислоты H2SO4.
Определить молярную массу каждого присутствующего элемента
H2SO4 содержит водород (H), серу (S) и кислород (S). Из таблицы Менделеева вы можете видеть, что молярные массы этих элементов:
O = 16,00
Шаг 2: Определите массу каждого отдельного присутствующего элемента
Есть два атома Н, один атом S и четыре атома О, поэтому у вас есть:
S = (1) (32,06 г) = 32,06 г
O = (4) (16,00 г) = 64 г
Шаг 3: Определить молярную массу соединения.
Сложите цифры, которые вы рассчитали на шаге 2:
2 + 32,06 + 64 = 98,06 г
Шаг 4: разделить массу каждого присутствующего элемента на молярную массу
Это означает разделение отдельных масс из шага 2 по результату шага 3.
Для Н, у вас есть 2 ÷ 98,06 = 0,0204 = 2,04 процента водорода
Для S у вас есть 32,06 ÷ 98,06 = 0,3269 = 32,69% серы
Для O, у вас есть 64 ÷ 98,06 = 0,6527 = 65,27 процента кислорода
Совет
Чтобы проверить свою работу, убедитесь, что ваши проценты в сумме равны 100, учитывая незначительные различия в результате округления:
Как вычислить массовые отношения элементов
Ключевые слова конспекта: массовая доля вещества в смеси или растворе, молярная доля вещества, объемная доля вещества, массовая доля элемента в соединении, масса элемента, массовая доля элемента.
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Массовую долю часто выражают в процентах. Для этого отношение массы вещества к массе смеси умножают на 100%:
Аналогично объемную долю вещества вычисляют как отношение объема вещества к объему смеси, а молярную долю вещества — как отношение количества вещества одного из компонентов смеси к сумме количеств веществ всех компонентов смеси:
Массовую долю элемента в соединении вычисляют как отношение массы элемента, входящего в состав данного соединения, к массе всего соединения:
Зная молекулярную формулу соединения, массу элемента, входящего в его состав, вычисляют как произведение молярной массы элемента на число атомов этого элемента в соединении.
В этом случае массовую долю элемента в соединении рассчитывают как отношение этой величины к молярной массе всего соединения:
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1. 25 г оксида магния смешали с 35 г оксида алюминия. Определите массовую долю оксида магния в данной смеси.
Ответ. ω(MgO) = 0,417, или 41,7%.
Задача № 2. Вычислите объемную долю азота в смеси газов, содержащей 32 л азота, 48 л углекислого газа, 36 л гелия и 14 л водорода.
Ответ. φ(N2) = 0,246, или 24,6%.
Задача № 3. Вычислите молярную и массовую долю (в %) оксида углерода (II) в смеси, содержащей 16,8 л (н. у.) оксида углерода (II) и 13,44 л (н. у.) оксида углерода (IV).
Ответ. χ(СО) = 55,56%, ω(СО) = 44,3%.
Задача № 4. В воде растворили 15 г хлорида натрия. Вычислите массу полученного раствора, если массовая доля соли в нем равна 5%.
Ответ: m(р-ра) = 300 г.
Задача № 5. Образец сплава меди с цинком имеет массу 75 г. Массовая доля меди в этом сплаве равна 64%. Определите массу цинка в данном образце.
Ответ. m(Zn) = 27 г.
[highlight]Задача № 6.[/highlight] Объемная доля аммиака в смеси с кислородом равна 40%. Вычислите плотность данной смеси по воздуху.
Ответ. Dвозд(смеси) = 0,896.
Задача № 7. Найдите массовую долю кислорода в фосфате натрия.
Ответ. ω (O) = 39%.
[highlight]Задача № 8.[/highlight] Определите массовую долю фосфора в смеси, содержащей 55 г фосфата натрия и 70 г дигидрофосфата натрия.
Ответ. ω(Р) = 22,77%
[highlight]Задача № 9.[/highlight] Массовая доля серы в техническом сульфате натрия равна 20,48%. Рассчитайте массовую долю примесей в данном продукте (в %).
Ответ. ω (примесей) = 9,12%.
Задача № 10. Плотность смеси оксида азота (II) и оксида азота (IV) по водороду равна 17,8. Найдите массовую долю оксида азота (IV) в данной смеси.
Ответ. ω(NO2) = 45,2%.
Решение задач с долей вещества в смеси, в соединении. Выберите дальнейшие действия:
Нахождение молекулярной формулы вещества (часть С)
Теория к заданию 35 из ЕГЭ по химии
Нахождение молекулярной формулы вещества
Нахождение химической формулы вещества по массовым долям элементов
Массовая доля элемента — это отношение его массы к общей массе вещества, в состав которого он входит:
Массовая доля элемента ($W$) выражается в долях единицы или в процентах.
2. Количества вещества железа и кислорода равны соответственно:
3. Находим соотношение количества веществ железа и кислорода:
4. Так как в формуле должно быть целое число атомов, то это отношение приводим к целым числам:
$Fe : O=1 : 1.33=2 : 2.66=3·3.99=3 : 4$.
5. Подставляем найденные числа и получаем формулу оксида:
Нахождение химической формулы вещества по массовым долям элементов, если указана плотность или относительная плотность данного вещества в газообразном состоянии
3. Отношение между атомами:
4. Определяем молекулярную массу углеводорода по относительной плотности ее паров.
5. Вычисляем относительную молекулярную массу углеводорода по простейшей формуле:
3. Отношение между атомами:
5. Молярная масса может быть представлена в виде:
6. Решаем систему двух уравнений с двумя неизвестными:
Нахождение химической формулы вещества по данным об исходном веществе и о продуктах его сгорания (по уравнению химической реакции)
1. Напишем схему уравнения горения углеводорода
$M=1.97$ г/л$·22.4$ л/моль$=44$ г/моль.
3. Определяем количество вещества:
4. Используя величину молярного объема, находим:
Окончательный вид уравнения: