Щавелевая кислота с чем взаимодействует
Щавелевая кислота
Характеристики и физические свойства щавелевой кислоты
Существует в двух полиморфных модификациях: ромбической бипирамидальной и моноклинной. Хорошо растворяется в воде. Нерастворима в хлороформе, петролейном эфире и бензоле.
Рис. 1. Щавелевая кислота. Внешний вид.
Таблица 1. Физические свойства щавелевой кислоты.
Молярная масса, г/моль
Температура плавления, o С
Температура разложения, o С
Растворимость вводе, г/100 г
Получение щавелевой кислоты
Щавелевая кислота широко распространена в растительном мире. В виде солей она содержится в листьях щавеля, кислицы, ревеня. Соли и эфиры щавелевой кислоты имеют тривиальное название оксалаты. В промышленности щавелевую кислоту получают из формиата натрия:
2H-COONa→ Na-OOC-COO-Na + H2.
Химические свойства щавелевой кислоты
В водном растворе щавелевая кислота диссоциирует на ионы:
Щавелевая кислота проявляет восстановительные свойства: в кислом растворе окисляется перманганатом калия до диоксида углерода и воды. Эта реакция используется в аналитической химии для установления точной концентрации растворов перманганата калия. На восстановительных свойствах щевелевой кислоты основан способ удаления буро-коричневых пятен от перманганата калия.
При нагревании в присутствии серной кислоты сначала происходит декарбоксилирование щавелевой кислоты, а затем разложение образовавшейся из нее муравьиной кислоты:
HOOC-COOH → H-COOH + CO2;
Качественной реакцией для обнаружения щавелевой кислоты и её солей служит образование нерастворимого оксалата кальция:
Применение щавелевой кислоты
Щавелевая кислота используется в лабораторном синтезе, кожевенном деле, текстильной промышленности и в медицине.
Примеры решения задач
Общая концентрация щавелевой кислоты есть сумма равновесных концентраций всех частиц (ионов, молекул), содержащих атомы С и О (обозначим в этом случае концентрацию символом c(C2O4 2- ), или же всех частиц, содержащих Н (сН). Тогда уравнение материального баланса можно записать так:
концентрация молекул H2C2O4 удвоена, поскольку щавелевая кислота содержит два атома водорода).
Также можно пренебречь, поскольку C2O4 2- и HC2O4 — являются весьма слабыми основаниями. Итак,
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Щавелевая кислота, получение, свойства, химические реакции
Щавелевая кислота (также – этандиовая кислота) – органическое вещество, относящееся к двухосновным предельным карбоновым кислотам.
Щавелевая кислота, формула, характеристики:
Щавелевая кислота (также – этандиовая кислота) – органическое вещество, относящееся к двухосновным предельным карбоновым кислотам.
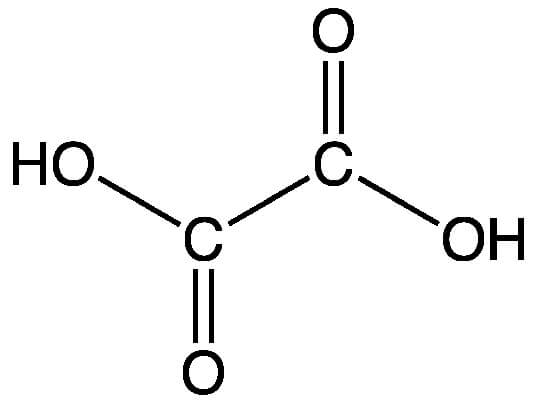
Химическая формула щавелевой кислоты C2H2O4. Рациональная формула щавелевой кислоты HOOC−COOH либо (COOH)2. Изомеров не имеет.
Строение молекулы щавелевой кислоты:
Щавелевая кислота (этандиовая кислота) – простейшая двухосновная кислота, первый член гомологического ряда двухосновных предельных карбоновых кислот.
Является сильной органической кислотой.
Щавелевая кислота по внешнему виду представляет собой бесцветные кристаллы. Имеет две кристаллические модификации: α – орторомбическая бипирамидальная (плотность 1,900 г/см 3 ), β – моноклинная призматическая (плотность 1,895 г/см 3 ).
Хорошо растворяется в воде, неполностью – в диэтиловом и этиловом спирте, не растворяется в бензоле, хлороформе, петролейном эфире
Щавелевая кислота своё название получила из-за того, что образуется при щавелевокислом брожении. Впервые была получена в 1824 году немецким химиком Фридрихом Вёлером из дициана и воды.
В природе щавелевая кислота содержится в щавеле, ревене, кислице, карамболе и некоторых других растениях, а также в сырых овощах в свободном виде и в виде оксалатов калия и кальция.
Соли и сложные эфиры щавелевой кислоты называются оксалатами.
Название щавелевой кислоты на английском – oxalic acid.
Щавелевая кислота обладает токсическим действием, опасна для жизни и здоровья (опасность зависит от концентрации), обладает разъедающими свойствами.
Физические свойства щавелевой кислоты:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | кислый |
| Агрегатное состояние (при 25 °C и атмосферном давлении 1 атм.) | бесцветные кристаллы |
| Плотность орторомбической бипирамидальной кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), г/см 3 | 1,9 |
| Плотность орторомбической бипирамидальной кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), кг/м 3 | 1900 |
| Плотность моноклинной призматической кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), г/см 3 | 1,895 |
| Плотность моноклинной призматической кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), кг/м 3 | 1895 |
| Температура плавления, °C | 189,5 |
| Температура самовоспламенения, °C | 518 |
| Константа диссоциации кислоты | 1,25; 4,14 |
| Удельная теплота сгорания, МДж/кг | 2,79 |
| Молярная масса, г/моль | 90,04 |
Химические свойства щавелевой кислоты:
Щавелевая кислота является сильной органической кислотой и проявляет кислотные свойства, характерные для карбоновых кислот.
Для нее характерны следующие химические реакции:
Получение щавелевой кислоты:
Щавелевую кислоту получают:
Безопасность при обращении с щавелевой кислотой. Требования ГОСТ:
Щавелевая кислота – сильная органическая кислота, в больших количествах может вызывать раздражение слизистых оболочек пищевода, желудка, кишечника, дыхательных путей и кожных покровов.
При работе с щавелевой кислотой следует применять индивидуальные средства защиты (респираторы типа “Лепесток” по ГОСТ 12.4.028, защитные очки по ГОСТ 12.4.013, резиновые перчатки по ГОСТ 20010), а также соблюдать правила личной гигиены.
Помещения, в которых проводятся работы с препаратом, должны быть оборудованы непрерывно действующей приточно-вытяжной вентиляцией. Анализ препарата следует проводить в вытяжном шкафу лаборатории.
Применение щавелевой кислоты:
Щавелевая кислота применяется:
Щавелевая кислота: применение и свойства
Применение щавелевой кислоты
Как и любая кислота, щавелевая благодаря своим уникальным свойствам применяется в следующих отраслях промышленности:
— химической (при изготовлении пластмасс, красителей, чернил, пиротехники);
— металлургической (для чистки металлов от коррозии, оксидов, накипи, ржавчины);
— текстильной и кожевенной (как протрава, при покраске шелка и шерсти);
— пчеловодстве (для обработки пчел);
— бытовой химии (входит в состав многих моющих средств 
— аналитической химии (осадитель редкоземельных элементов);
— микроскопии (отбеливатель срезов);
— косметологии (отбеливающий компонент от веснушек);
— медицине и фармакологии;
— деревообрабатывающей.
Важность щавелевой кислоты для организма
Данное химическое соединение в организме человека – это промежуточный продукт, который выделяется с мочой как соли кальция. При нарушении минерального обмена соли данной кислоты принимают участие в образовании камней в мочевом пузыре и почках. Данная органическая кислота, содержащаяся в сырых овощах, очень полезна для нашего организма. Она легко соединяется с кальцием и способствует его усвоению. Щавелевая кислота в отварных овощах негативно сказывается на здоровье, так как она становится неорганической. Это приводит к связыванию кальция, а как результат – к нехватке его в костной ткани, что является причиной ее поражения. Суточное выделение щавелевой кислоты вместе с мочой у взрослого человека составляет 20 мг, у детей до 1, 29 мг/кг.
Меры предосторожности

— работы проводить в специальной лабораторной посуде из стекла. Если лабораторная посуда будет из другого материла, кислота может вступить с ней в реакцию;
— во избежание попадания щавелевой кислоты на кожу, дыхательные пути, слизистые оболочки все исследования следует проводить: в резинотехнических изделиях (сапоги, прорезиненные фартуки, перчатки смотровые, перчатки нитриловые), защитных средствах (противогаз или респиратор, очки), спецодежда;
— во время использования щавелевой кислоты запрещается принимать пищу, пить, курить;
— после завершения работ необходимо лицо и руки тщательно промыть теплой водой с мылом или нейтрализующим средством (раствором питьевой соды);
— запрещается транспортировка и хранение щавелевой кислоты совместно с пищевыми продуктами;
— соблюдать меры противопожарной безопасности, если есть необходимость в использовании нагревательных приборов.
Нужно знать, что щавелевая кислота относится к сильным органическим кислотам, употребление ее в большом количестве может стать причиной раздражения слизистой пищевода, кишечника, желудка, кожи и дыхательных путей. При попадании данного химического реактива в организм может появиться жжение, кровавая рвота. Первая помощь в таких ситуациях – обильно промыть водой пораженный участок кожи. Хранить кислоту нужно в закрытой полиэтиленовой упаковке в хорошо вентилируемом помещении на поддонах.
Щавелевую кислоту купить
Щавелевую кислоту купить, борную кислоту купить, лимонную кислоту купить, молочную кислоту купить, как и любой другой химический реактив, можно в магазине химических реактивов Москва розница и опт «Прайм Кемикалс Групп». На нашем сайте есть все, что нужно современной научной или производственной лаборатории. Покупая любой товар в нашем интернет-магазине, вы приобретаете товар c сертификатом качества, отвечающий всем стандартам ГОСТ по доступным ценам и исключаете возможность покупки подделки.
“Prime Chemicals Group” – гарантия качества предлагаемой продукции.
Щавелевую кислоту купить с доставкой по городу и области можно Выгодно!
Щавелевая кислота, получение, свойства, химические реакции
Щавелевая кислота, получение, свойства, химические реакции.
Щавелевая кислота (также – этандиовая кислота) – органическое вещество, относящееся к двухосновным предельным карбоновым кислотам.
Щавелевая кислота, формула, характеристики:
Щавелевая кислота (также – этандиовая кислота) – органическое вещество, относящееся к двухосновным предельным карбоновым кислотам.
Химическая формула щавелевой кислоты C2H2O4. Рациональная формула щавелевой кислоты HOOC−COOH либо (COOH)2. Изомеров не имеет.
Строение молекулы щавелевой кислоты:
Щавелевая кислота (этандиовая кислота) – простейшая двухосновная кислота, первый член гомологического ряда двухосновных предельных карбоновых кислот.
Является сильной органической кислотой.
Соли и сложные эфиры щавелевой кислоты называются оксалатами.
Название щавелевой кислоты на английском – oxalic acid.
Щавелевая кислота обладает токсическим действием, опасна для жизни и здоровья (опасность зависит от концентрации), обладает разъедающими свойствами.
Физические свойства щавелевой кислоты:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | кислый |
| Агрегатное состояние (при 25 °C и атмосферном давлении 1 атм.) | бесцветные кристаллы |
| Плотность орторомбической бипирамидальной кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), г/см 3 | 1,9 |
| Плотность орторомбической бипирамидальной кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), кг/м 3 | 1900 |
| Плотность моноклинной призматической кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), г/см 3 | 1,895 |
| Плотность моноклинной призматической кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), кг/м 3 | 1895 |
| Температура плавления, °C | 189,5 |
| Температура самовоспламенения, °C | 518 |
| Константа диссоциации кислоты | 1,25; 4,14 |
| Удельная теплота сгорания, МДж/кг | 2,79 |
| Молярная масса, г/моль | 90,04 |
Химические свойства щавелевой кислоты:
Щавелевая кислота является сильной органической кислотой и проявляет кислотные свойства, характерные для карбоновых кислот.
Для нее характерны следующие химические реакции:
Щавелевая кислота вступает в реакцию с хлоратом калия. В результате реакции образуется карбонат калия, диоксид хлора, углекислый газ и вода.
Данная реакция используется для лабораторного синтеза диоксида хлора.
Щавелевая кислота вступает в реакцию с аммиаком, растворенном в воде. В результате реакции образуется оксалат аммония.
Данные реакции применяют для получения йодоводорода и хлороводорода.
Щавелевая кислота вступает в реакцию с карбонатом калия (или карбонатом натрия ). В результате реакции образуется оксалат калия (или оксалат натрия ), углекислый газ и вода.
В водном растворе щавелевая кислота диссоциирует на ионы.