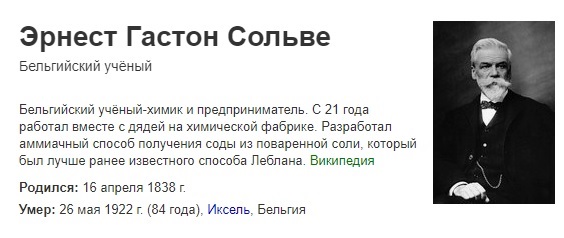
Щелочь что это в быту
Статья по химии на тему «Щелочи в быту»
Щелочи, это кристаллические основания, которые отлично растворяются в воде. Они мылкие на ощупь и являются сильными катализаторами для воздействия на различные материалы, в том числе на фарфор или стекло. Поэтому хранить их в сосудах, которые состоят из этих материалов категорически запрещено. Чаще всего для этого используют пластмассовую тару.
Каустическая сода или едкий натр, научное название – гидроксид натрия. Кристаллообразное вещество светлого желтого или полностью белого цвета, в промышленности изготавливается в виде гранул. Отлично растворяет различные жиры и обладает сильнейшим моющим эффектом. Очищает масляные пятна с разных изделий, очищает канализационные трубы от жировых наростов.
Гашеная известь или по-научному – гидроксид кальция. Чаще применяется в строительной индустрии для побелки и штукатурки стен и потолков.
Нашатырный спирт или раствор аммиака – жидкость с резким раздражающим неприятным запахом, которая негативно воздействует на слизистые глаз и носа. В быту применяется как 25-ти процентный раствор. С его помощью можно стирать шерстяные изделия и удалять пятна, которые имеют органическое происхождение: смолы, жиры, молоко. В последнее время широко используется в составах средств для мытья окон. Так как аммиак имеет отличные моющие свойства, он не оставляет разводов на поверхности стекла. Также слабый раствор нашатырного спирта используют для очистки и придания блеска изделиям из золота и серебра, для этого раствор нужно подогреть, а потом опустить туда украшения на некоторое время. Аммиак способен образовывать соединения с металлами, которые растворяются в воде.
Что такое щелочь, где ее применяют и используют?
Что такое щелочь, где ее применяют и используют?
Щелочи представляют собой растворимые основания. Их кристаллы при растворении становятся едкими и «мыльными». Исходя из этого, для оказания неотложной помощи при ожогах щелочами используют слабые растворы кислот (преимущественно уксусной и борной). Этот прием получил название реакции нейтрализации, в результате которой образуются соль и вода. А при работе с ними используют защитные очки и резиновые перчатки
Щелочи относят к сильным основаниям – они активно реагируют с другими веществами благодаря легкому отщеплению гидрокси-групп. Как и другие основания, они при нагревании распадаются на воду и оксид, а их растворы изменяют цвет индикаторов.
Щелочи хранят в пластиковой посуде, поскольку они разъедают даже фарфор и стекло. Они сильно впитывают влагу.
Применение щелочи. Каустическая сода (она же гидроксид натрия или едкий натр) обладает моющими способностями, используется в составе многих средств бытовой химии. Больше всего подходит для растворения жиров. Едкий натр также применяют для изготовления целлюлозы в бумажной промышленности, производства масел в нефтепереработке, он выступает в роли катализатора или реагента в химической отрасли. Его применяют в производстве экологически чистого биодизельного топлива. И что совершенно удивительно, эта щелочь используется при изготовлении какао, мороженого, шоколада, хлеба, напитков.
Гашеная известь (гидроксид кальция) нашла широкое применение в строительстве для побелки и штукатурки стен.
Нашатырный спирт (раствор аммиака) обладает сильным запахом. Смягчает при стирке шерсть, удаляет пятна от молока, смолы, жира. Хорошо без разводов отмывает стекло, золото, серебро.
Щелочи используют в рыбоводстве для дезинфекции прудов и в качестве удобрения. Они выступают в качестве электролита для щелочных аккумуляторов.
Щелочи широко используют в медицине как антисептики, прижигающие и раздражающие препараты, поскольку они способны растворять белки. Щелочные минеральные воды благотворно влияют на организм при заболеваниях желудочно-кишечного тракта. Эти вещества также применяют при лечении подагры (растворяют мочевую кислоту), стоматита, заболеваний дыхательной системы (муколитическое действие), как мочегонное средство, при отравлении кислотами (в данном случае работает та же реакция нейтрализации).
Щелочи участвуют в процессах изготовления мыла, искусственного волокна, каучука, красителей, витаминов, обработки древесины, очистки металлических предметов, а также участвуют в химической и легкой промышленности, сельском хозяйстве (удобрения), металлургии. Щелочи выступают как хладагент в холодильных установках.
Как видно из статьи, щелочи играют огромную роль в жизни человека. Но следует помнить об опасностях, которые подстерегают при работе с ними. Соблюдая технику безопасности, нам удалось сделать их своими помощниками.
Свойства и способы применения каустической соды в быту
Гидроксид натрия или каустическая сода (caustic soda) — самая популярная в употреблении щелочь во всем мире. В год ее производится около 57 млн тонн. В обиходе это вещество называют еще едким натром. Связано это с тем, что оно способно разъедать кожу, бумагу и другие органические соединения. Каустическая сода считается незаменимым чистящим веществом как на производстве, так и в быту.
Свойства вещества
Едкий натр — очень сильное химическое вещество, которое обладает способностью полностью диссоциировать в воде. Связано это с тем, что связь электронов в металле очень слабая, поэтому он легко отдает их. Формула каустической соды — NaOH и она представляет собой вещество белого цвета, которое практически не обладает запахом. Свойства гидроксида натрия:
При длительном взаимодействии с углекислым газом, находящемся в воздухе, образуется кальцинированная сода. Каустик не взаимодействует с резиновыми изделиями, сталью и чугуном.
В жидком виде он представляет собой мыльный раствор, хорошо проводящий электрический ток. Если его хранить в открытой таре, гидроксид превращается в газообразное состояние. Благодаря этим свойствам каустик с успехом применяется как в промышленности, так и в домашних условиях.
История производства
Аммиачный метод сохранился до XX века. Электрохимический способ, который широко применяется и сейчас, появился на грани двух веков. Большая доля производства приходится на КНР, США и некоторые страны Европы.
В России выпуск каустической соды отстает от показателей этих стран, но вполне удовлетворяет требованиям внутреннего рынка.
Вплоть до XVII века содой называли буквально все подобные вещества и их исследования не проводились. Когда появилась более существенная потребность в этом химическом продукте, началось его расширенное производство.
Параллельно проводились исследования и эксперименты по совершенствованию производства. В начале XVIII века химик Анри Луи Дюамель де Монсо разделил три вещества, которые ранее имели общее название соды:
Чуть позже был открыт химический метод получения вещества. За последующее столетие было изобретено насколько способов получения каустика, но сохранился только один метод — электрохимический.
Применение едкого натра
У этого вещества довольно широкий спектр использования в текстильной, химической, пищевой, нефтяной и других отраслях производства. В большей части стиральных порошков, чистящих и моющих средств можно встретить формулу каустика. При производстве мороженого, какао, шоколада и других пищевых продуктов гидроксид натрия известен как добавка E524.
В домашних условиях вещество используется для борьбы с жировыми и органическими загрязнениями. Очень часто щелочи в быту используют для чистки канализации, дезинфекции помещений, обезжиривания поверхностей и стирки белья.
Чистка канализационных труб
На внутренней поверхности трубопроводов оседают жировые отложения, пищевые остатки и т. д. Постепенно все элементы спрессовываются и уменьшают проходную способность.
Вода начинает уходить медленно, появляется посторонний запах, который распространяется по всему помещению. Основные причины:
При проведении очистных работ, желательно на несколько минут сделать промыв трубопроводов горячей водой, чтобы вся система и отложения хорошо прогрелись, после этого они отлично будут поддаваться взаимодействию с каустиком. Для правильного проведения мероприятий по очистке существует несколько способов:
В сложных случаях к едкому натру добавляют пищевой уксус или эссенцию.
Сначала наливают в отверстие 150 мл уксуса и добавляют 150 г каустика. Из-за активной реакции отверстие желательно закрыть специальной пробкой. По истечении 2 часов трубопроводы следует промыть теплой водой.
Уборка выгребных ям и стирка
Ямы на даче или загородном доме, где собираются все нечистоты, необходимо периодически чистить. Разница состоит в том, что жидкая фракция впитывается через стенки, а более густая собирается на дне и удаляется, когда это необходимо. Бывают случаи, когда стенки покрываются органической пленкой и жидкость перестает уходить.
Тогда яма очень быстро заполняется, и отходы начинают переливаться. Чтобы избавиться от этой проблемы, следует взять каустик из расчета 4 кг на 1 м³ объема ямы. Необходимое количество едкого натра растворяют в воде и аккуратно выливают в яму. Через 2−3 дня в результате реакции пленка исчезает, уровень грязной жидкости уменьшается, но на дне остается осадок.
Часто слабый раствор едкого натра используется для замачивания белья во время ручной или машинной стирки белья из хлопка и льна. При добавлении вещества вода становится более мягкой, и пятна хорошо отстирываются даже с самых грязных вещей. Для приготовления раствора следует 3 ст. ложки вещества растворить в 5 л воды и на 1—2 часа поместить в него белье.
Затем вещи следует постирать, используя обычный порошок. Если стирать в машинке, то в закладку порошка добавляют 2—3 ст. ложки каустика. Отлично отстирываются даже застарелые и чересчур замасленные пятна, особенно такой способ используется при стирке рабочей спецодежды. Изделия из шелковой или шерстяной ткани стирать с каустиком нежелательно, так как можно повредить вещи.
Обработка поверхностей и изготовление мыла
Едкий натр применяется для очищения эмалированных раковин, загрязненных печей, посуды от копоти и нагара. Предварительно каустик смешивают с жидким моющим средством или порошком и разводят до состояния пасты.
Затем полученная масса наносится на загрязненную поверхность и выдерживается некоторое время. Через 20—30 минут нанесенную пасту смывают теплой водой. Отлично очищается посуда при кипячении в растворе:
В эмалированную или стальную емкость наливают хорошо размешанный раствор и доводят до кипения. По очереди опускают грязную металлическую посуду на 2 часа, а стеклянную или фарфоровую — на 10 минут.
Затем посуду следует ополоснуть чистой водой. Каустик не подходит для чистки оцинкованной, алюминиевой и тефлоновой посуды. Несложно приготовить хозяйственное мыло в домашних условиях. Для этого следует взять:
В предварительно подготовленной емкости каустик смешивают с водой до полного растворения. Растительное масло немного разогревают и осторожно вливают в раствор гидроксида натрия. Хорошо все размешивают до однородной массы.
Добавляют эфирное масло, настой на травах и еще раз перемешивают. Готовую смесь разливают по формам и убирают в сухое прохладное место. Через 4—5 дней готовое мыло достают из формочек и дают ему подсохнуть некоторое время. Когда на нем появится белый налет, мыло готово.
Щелочь
Производство широкого спектра потребительских товаров зависит от использования щелочей 
Немного исторических моментов из истории получения щелочи.
Лебланский способ производства доминировал в мировом производстве до конца 19-го века, но после первой мировой войны был полностью вытеснен другим методом конверсии соли, который был усовершенствован в 1860-х годах Эрнестом Солве из Бельгии. В конце XIX века появились электролитические методы производства каустической соды, объемы которых быстро росли.
По методу Солве, аммиачно-содовый процесс производства кальцинированной соды протекал следующим образом: поваренная соль в виде сильного рассола химически обрабатывалась для устранения примесей кальция и магния и затем насыщалась рециркулирующим газом аммиака в башнях. После, аммиачный рассол насыщался газом с использованием газообразного диоксида углерода при умеренном давлении в башне другого типа. Эти два процесса дают бикарбонат аммония и хлорид натрия, двойное разложение которого дает желаемый бикарбонат натрия, а также хлорид аммония. Затем бикарбонат натрия нагревают до разложения его до необходимого карбоната натрия. Аммиак, вовлеченный в процесс, почти полностью восстанавливается путем обработки хлоридом аммония с известью, с получением аммиака и хлорида кальция. Восстановленный аммиак затем повторно используют в описанных выше процессах.
В нескольких местах в мире существуют значительные запасы минеральной формы кальцинированной соды, известной как природная щелочь. На таких месторождениях производят большую часть природной щелочи в мире из обширных месторождений в подземных шахтах.
Природный натрий металлический.
Прочитайте статью Щелочи (источник «Энциклопедический словарь химика»)и получите больше представления о том что такое щелочь, или посмотрите видеоролик об этом химическом реактиве Щелочи.
Использование щелочи в окружающей нас среде
Щелочь снискала широкое применение в нашей жизни. Благодаря щелочи можно в той или иной форме добиться смягчения воды и удалить из нее примеси, такие как марганец, фториды и органические танины. В тяжелых отраслях промышленности используют щелочь в виде извести для поглощения и нейтрализации оксидов серы в выбросах в атмосферу, тем самым уменьшая вероятность выпадения кислотных осадков. Диоксид серы, производимый промышленными предприятиями и выпускаемый в атмосферу, возвращается на землю в виде кислотных дождей или серной кислоты. Такие территории, подвергшихся воздействию кислотных дождей, обрабатываются с помощью авиации препаратами, в состав которых входит щелочь. Это позволяет контролировать и нейтрализовывать критический уровень рН воды и почвы на участках, где произошли такие техногенные выбросы. Внесение щелочи в отходы и сточные воды, поддерживая правильный уровень рН в окислительных процессах при их разложении. Стабилизирует образования осадка в сточных водах и уменьшает запах или образования патогенных бактерий. Обработанный негашеной известью ил из сточных водоемов, соответствует экологическим нормам, что делает его пригодным в дальнейшем в использовании в качестве удобрения на сельскохозяйственных землях.
Промышленное применение щелочи
В промышленных и горных работах применение щелочей в сточных водах помогает нейтрализовать вредные соединения и произвести их очистку. Обработка избыточной щелочью, повышает рН воды до 10,5-11 и может дезинфицировать воду и удалять тяжелые металлы. Щелочи, такие как известь, являются ключевыми в химическом производстве карбида кальция, лимонной кислоты, нефтехимии и магнезии. В бумажной промышленности карбонат кальция является каустифицирующим агентом для отбеливания. Сталелитейная промышленность зависит от извести в качестве компонента для удаления примесей, таких как газообразный монооксид углерода, кремния, марганца и фосфора.
Моющие средства образованные щелочью
Щелочные моющие средства помогают при очистке поверхностей с сильными загрязнениями. Эти экономичные, водорастворимые щелочи с рН от 9 до 12,5 могут нейтрализовать кислоты в различных типах грязи и отложениях.
Щелочь в производстве стекла и керамики
Щелочь является основным сырьем в производстве стекла. Известняк, а также песок, кальцинированная сода, известь и другие химикаты, обжигаются при чрезвычайно высоких температурах и превращаются в расплавленную массу. Стеклодувы и гончары используют щелочи для глазурей и флюсов, которые реагируют с кислотами с образованием силикатов (стекла) при нагревании. Концентрированные щелочи создают более насыщенный цвет в глазури.
Литература о щелочи
«Среди многочисленных веществ, которыми химики с давних времен пользовались в своих лабораториях, почетное место всегда занимали едкие щелочи — едкое кали и едкий натр. Сотни различных химических реакций осуществляются в лабораториях, на заводах и в быту при участии щелочей. С помощью едких кали и натра можно, например, сделать растворимыми большинство нерастворимых веществ, а самые сильные кислоты и удушливые пары можно благодаря щелочам лишить всей их жгучести и ядовитости.
Едкие щелочи — очень своеобразные вещества. На вид это беловатые, довольно твердые камни, ничем как будто не примечательные. Но попробуйте взять едкое кали или натр и зажать его в руке. Вы почувствуете легкое жжение, почти как от прикосновения к крапиве. Долго держать в руке едкие щелочи было бы нестерпимо больно: они могут разъесть кожу и мясо до кости. Вот почему их называют «едкими», в отличие от других, менее «злых» щелочей — всем известных соды и поташа. Из соды и поташа, кстати сказать, почти всегда и по лучались едкие натр и кали.
У едких щелочей сильнейшее влечение к воде. Оставьте кусок совершенно сухого едкого кали или натра на воздухе. Через короткое время на его поверхности неизвестно откуда появится жидкость, потом он весь станет мокрым и рыхлым и под конец расползется бесформенной массой, как кисель. Это из воздуха щелочь притягивает к себе пары воды и образует с влагой густой раствор. Кому впервые приходится погрузить пальцы в раствор едкой щелочи, тот с удивлением заявляет: — Как мыло! И это совершенно правильно. Щелочь — скользкая, как мыло. Больше того: мыло потому и «мыльно» на ощупь, что его изготовляют с помощью щелочей. Раствор едкой щелочи и на вкус напоминает мыло.
Но химик узнаёт едкую щелочь не по вкусу, а по тому, как это вещество ведет себя с краской лакмус и с кислотами. Бумажка, про питанная синей краской лакмус, мгновенно краснеет, когда ее опус кают в кислоту; а если этой покрасневшей бумажкой дотронуться до щелочи, то она тотчас же опять становится синей. Едкая щелочь и кислота не могут мирно существовать рядом ни одной секунды. Они тотчас же вступают в бурную реакцию, шипя и разогреваясь, и уничтожают друг друга до тех пор, пока в растворе не останется ни крупинки щелочи или ни капли кислоты. Только тогда наступает успо коение. Щелочь и кислота «нейтрализовали» друг друга, говорят в таких случаях. От соединения их между собой получается «нейтральная» соль — ни кислая, ни едкая. Так, например, от соединения жгучей соляной кислоты с едким натром получается обыкновеннейшая поваренная соль.»
Отличительные признаки щелочи.
Из выше прочитанного мы уже знаем, что противоположностью щелочи является кислота. Вместо горького вкуса 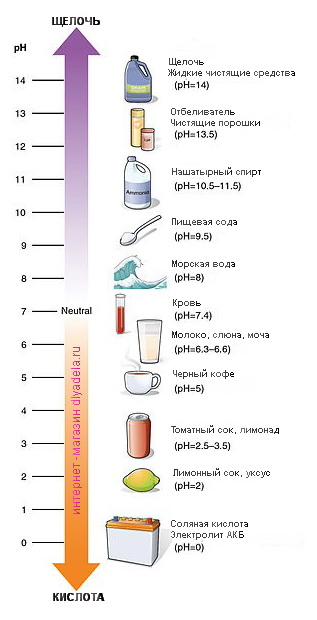
Почему вещество щелочное?
Таким образом, нам уже известно, что рН уровень представляет собой шкалу, значения которой колеблятся от 0-14 и указывают, является ли вещество щелочью или кислотой. Однако мы действительно не знаем, почему. Давайте рассмотрим этот вопрос более детально.
Уровень рH вещества зависит от того, как атомы расположены и объединены в веществе. Чистая вода находится прямо в середине шкалы и имеет pH 7. Это означает, что она содержит равное количество атомов водорода (H +) и гидроксидных атомов (OH-). Когда вещество имеет больше атомов водорода (Н +), это кислота. Когда вещество имеет больше гидроксидных атомов (OH-), оно является щелочным.
Где купить щелочь?
Купить щелочь в Новосибирске со степенью очистки ЧДА (чистая для анализов) в магазине «Для дела» можно на странице заказов: едкий натр NaOH или едкий кали KOH. Для иногородних покупателей товар может быть отправлен Почтой РФ или транспортными компаниями.
Щелочи: понятие, свойства и применение
К щелочам принято относить гидроксиды щелочных и щелочно-земельных металлов.
Все щелочи — это основания, но не наоборот, нельзя считать определения «основание» и «щелочь» синонимами.
Правильное химическое название щелочей — гидроксид (гидроокись), например, гидроокись натрия, гидроксид калия. Часто употребляются также названия, которые сложились исторически. Ввиду того, что щелочи разрушают материалы органического происхождения — кожу, ткани, бумагу, древесину, их называют едкими: например, едкий натр, едкий барий. Однако понятием «едкие щелочи» химики определяют гидроксиды щелочных металлов — лития, натрия, калия, рубидия, цезия.
Свойства щелочей
Щелочи — твердые вещества белого цвета; гигроскопичные, водорастворимые. Растворение в воде сопровождается активным выделением тепла. Вступают в реакции с кислотами, образуя соль и воду. Эта реакция нейтрализации является важнейшей из всех свойств щелочей. Кроме этого, гидроксиды реагируют с кислотными оксидами (образующими кислородосодержащие кислоты), с переходными металлами и их оксидами, с растворами солей.
Гидроксиды щелочных металлов растворяются в метиловом и этиловом спиртах, способны выдерживать температуры до +1000 °С (за исключением гидроксида лития).

Если сравнивать щелочи по химической активности, то она увеличивается при движении по столбцу таблицы Менделеева сверху вниз.
Концентрированные щелочи разрушают стекло, а расплавы щелочей — даже фарфор и платину, поэтому растворы щелочей не рекомендуется хранить в сосудах с пришлифованными стеклянными пробками и кранами, так как пробки и краны может заклинить. Хранят щелочи, обычно, в полиэтиленовых емкостях.
Именно щелочи, а не кислоты, вызывают более сильные ожоги, так как их сложнее смыть с кожи и они проникают глубоко в ткань. Смывать щелочь надо неконцентрированным раствором уксусной кислоты. Работать с ними необходимо в средствах защиты. Щелочной ожог требует немедленного обращения к врачу!
Применение щелочей
— В качестве электролитов.
— Для производства удобрений.
— В медицине, химических, косметических производствах.
— В рыбоводстве для стерилизации прудов.
В магазине «ПраймКемикалсГрупп» вы найдете самые востребованные щелочи по выгодным ценам.
Едкий натр
Самая популярная и востребованная в мире щелочь.
Применяется для омыления жиров в производстве косметических и моющих средств, для изготовления масел в процессе нефтепереработки, в качестве катализатора и реактива в химических реакциях; в пищепроме.
Едкое кали
Применяется для производства мыла, калийных удобрений, электролитов для батареек и аккумуляторов, синтетического каучука. Также — в качестве пищевой добавки; для профессиональной очистки изделий из нержавеющей стали.
Гидроксид алюминия
Востребован в медицине как отличный адсорбент, антацид, обволакивающее средство; ингредиент вакцин в фармацевтике. Кроме этого, вещество применяется в очистных сооружениях и в процессах получения чистого алюминия.
Гидроокись кальция
Популярная щелочь с очень широким спектром применения, которую в быту знают под названием «гашеная известь». Используется для дезинфекции, смягчения воды, в производстве удобрений, едкого натра, «хлорки», строительных материалов. Применяется для защиты деревьев и деревянных сооружений от вредителей и огня; в пищепроме как пищевая добавка и реактив при производстве сахара.
Гидроокись лития
Востребованное соединение в химпроме как сырье; в стекольной, керамической, 
Гидроокись бария
Применяется в химпроме как катализатор, а также в пищепроме для очистки жиров, сахара.
В аналитической химии применяются фиксаналы щелочей, которые можно купить у нас:
— стандарт-титр Натрий гидроокись (Натрий гидроксид) 0,1 H
— стандарт-титр Калий гидроокись (Калий гидроксид) 0,1 Н