Уросепсис что это такое
Гнойные воспаления почек: почему возникают и как лечить
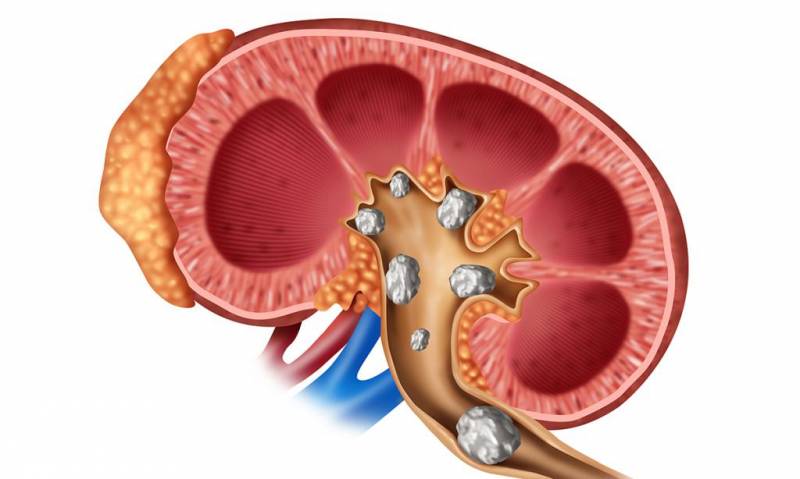
Гной в почках — опасное явление, имеющее инфекционную природу. При несвоевременном обращении к урологу такие воспалительные процессы как пионефроз, паранефрит, карбункул, абсцесс приводят к сепсису и летальному исходу.
Причины возникновения гнойного воспаления в почке
Нагноение — следствие некоторых заболеваний почек и органов мочевыделительной системы (пиелонефрит и др.). Одной из причин возникновения воспалительных процессов является инфицирование почек болезнетворными организмами.
После поражения микробами на поверхности органа появляется инфильтрат, наполненный гноем. Если вовремя от него не избавиться, гнойный мешок может вызвать отмирание тканей почки. При его разрыве жидкость изливается в брюшную полость. Последствия в этом случае непредсказуемы.
Другой причиной гнойного воспаления почек может стать механическое повреждение органа (например, ножевые ранения, неверное введение катетера в мочевой пузырь и т.д.). Возникновение инфильтрата может вызвать и нестерильность во время проведения хирургических вмешательств.
Симптоматика
Гнойные заболевания почек могут иметь характерные проявления или проходить практически бессимптомно. Из-за того, что в некоторых случаях воспалительный процесс протекает в скрытой форме, постановка правильного диагноза затрудняется.
Чаще всего симптоматика довольно бурная:
Лабораторные исследования позволяют выявить высокий уровень лейкоцитов в крови, что указывает на воспалительный процесс в организме.
Особенно опасен гной в почках для беременных. Из-за гормональной перестройки организма и увеличения нагрузки на органы здоровье женщины в этот период становится очень уязвимым. На фоне воспалительного процесса у будущей мамы может развиться гестоз и анемия. Гнойная почка может стать причиной прерывания беременности, гипоксии и внутриутробного инфицирования плода, возникновения пороков развития плода, смерти матери и ребенка.
К группе риска относят также больных диабетом. Это заболевание является причиной глубоких нарушений гомеостаза. Из-за этого пациенты, страдающие сахарным диабетом, сталкиваются с гноем в почках в 4 раза чаще, чем люди с неосложненным анамнезом. Более того, после удаления инфильтрата у больных могут развиваться тяжелые осложнения (уросепсис, почечная недостаточность и др.), вызывающие летальный исход.
Методы лечения гноя в почке
Самолечение воспалительных процессов недопустимо. При появлении тревожных симптомов необходимо немедленно обратиться к врачу. Лечение заболевания производится строго в условиях стационара.
Консервативная терапия гнойной почки считается малоэффективной. Прогноз для пациентов условно неблагоприятный, так как длительное лечение воспалительного процесса может привести к серьезным осложнениям (поражению второй почки, уросепсису, прорыву гноя и т.д.). По этой причине наиболее эффективным методом признано хирургическое вмешательство. Гнойный очаг удаляется с последующим дренажом брюшной полости. В тех случаях, когда некротическое поражение слишком велико, врач может принять решение удалить больную почку.
После проведения операции пациентам показана интенсивная антибактериальная терапия, способствующая выведению токсинов из организма.
Если вы почувствовали недомогание, не стоит откладывать поход к врачу, так как малейшее промедление может стоить вам жизни. Врачи клиники урологии имени Р. М. Фронштейна Первого Московского Государственного Медицинского Университета имени И.М. Сеченова (Государственный центр урологии) окажут вам квалифицированную помощь и помогут сохранить здоровье.
Уросепсис
Уросепсис — это генерализованный неспецифический инфекционно-воспалительный процесс, вызванный проникновением в кровяное русло уроинфекционных патогенов и их токсинов. Проявляется внезапным ухудшением состояния, гипертермией, ознобами, тахикардией, олигурией, симптомами общей интоксикации, усугубляющими основную уропатологию. Диагностируется с помощью общего и биохимического анализов крови и мочи, УЗИ, КТ мочевыводящих органов, экскреторной урографии, микробиологических методов исследования. Для лечения уросепсиса проводится хирургическая санация очага инфекции в комбинации с антибактериальной, инфузионной, дезинтоксикационной, иммуномодулирующей терапией.
МКБ-10
Общие сведения
Впервые о лихорадочных приступах, возникших после катетеризации и операций на уретре, в 1833-1837 годах сообщили французские хирурги А. Вельпо и Ж. Сивиаль. В 1899 году были описаны острая и хроническая формы мочевой лихорадки. В настоящее время распространенность уросепсиса в индустриально развитых европейских странах достигает 16,5-33 случаев на 100 тысяч населения, показатель продолжает ежегодно увеличиваться, при этом возрастает количество заболеваний, вызванных грамположительной флорой и кандидами.
По данным российских исследований, летальность при урогенной форме сепсиса остается стабильно высокой и составляет от 35 до 65%. Заболевание больше распространено у мужчин, что связано с более частым проведением эндоскопических инвазивных вмешательств у пациентов мужского пола.
Причины уросепсиса
Возбудителями заболевания являются те же микроорганизмы, которые обычно высеиваются у пациентов, страдающих острыми и хроническими инфекционными болезнями мочевыделительных органов. В 79-80% случаев уросепсис вызывается грамотрицательной условно-патогенной микрофлорой, в первую очередь – кишечной палочкой, реже — протеем, синегнойной палочкой, клебсиеллой, серратией, у 10-10,5% больных — грамположительными бактериями (энтерококками, эпидермальным стафилококком), в 0,75% наблюдений — кандидами. У 9% пациентов определяются полимикробные ассоциации. По мнению специалистов в сфере урологии и нефрологии, предпосылками, способствующими генерализации уроинфекции, являются:
Патогенез
Входными воротами для проникновения возбудителей генерализованной инфекции в кровь обычно являются почки и мочевыводящие пути, в тканях которых персистирует патогенная флора. В крайне редких случаях уросепсис начинается без предшествующей уроинфекции после травмы уретры, мочевого пузыря, мочеточников, полученной в ходе эндоскопического исследования. Быстрому распространению микроорганизмов способствует застой мочи и наличие факторов патогенности — фимбрий, гемолизинов, гемагглютининов, способности микробов вырабатывать беталактамазы расширенного спектра, повышающие их устойчивость к антибиотикам.
По результатам последних исследований в области иммунологии и генетики, при уросепсисе бактериальный агент играет роль пускового фактора, запускающего каскадную гиперергическую воспалительную реакцию. В ответ на действие микробных эндотоксинов происходит активация комплемента, стимулирующая выделение гистамина. На фоне эндотоксемии повышается активность свертывающей системы крови, усиливаются адгезивные свойства тромбоцитов и нейтрофилов, в больших количествах выделяются медиаторы воспаления, кислородные радикалы, протеазы. В конечном итоге это приводит к множественному повреждению сосудистого эндотелия с последующим развитием полиорганной недостаточности. У части больных на фоне септицемии формируются вторичные гнойные метастазы в других органах.
Классификация
При выделении различных форм уросепсиса учитывают тип возбудителя, механизм его проникновения в кровоток, фазу и особенности клинического течения септического процесса. Различают бактериальные, вирусные, грибковые варианты заболевания. При наличии источника инфекции в органах мочевыводящего тракта уросепсис называют эндогенным, при инфицировании во время инвазивных процедур — экзогенным. Наиболее значимой для прогнозирования исхода и разработки оптимальной врачебной тактики является классификация процесса по динамике нарастания и выраженности симптоматики. Существуют следующие клинические формы септического состояния:
Септический процесс развивается поэтапно и может быть стабилизирован на любой стадии. Начальная токсемическая фаза уросепсиса (синдром системной воспалительной реакции) характеризуется циркулированием в крови бактериальных эндотоксинов и развитием гиперергического воспаления. В септицемической фазе отмечается бактериемия, которая в дальнейшем может осложниться формированием гнойных метастазов (фаза септикопиемии).
Симптомы уросепсиса
Основными клиническими проявлениями молниеносной и острой форм заболевания являются резкое ухудшение состояния больного, длительно страдающего урологическим заболеванием либо перенесшего инвазивное вмешательство на мочевыводящих органах, высокая температура тела, сильный озноб, судороги, значительная тахикардия. Прогностически неблагоприятным симптомом считается гипотермия ниже 35,5° С. При уросепсисе часто наблюдается нарушение оттока мочи, уменьшение ее количества. Появляются и нарастают признаки общей интоксикации в виде головных болей, слабости, тошноты.
При присоединении сосудистых нарушений отмечается падение артериального давления, побледнение кожных покровов, оглушенность, спутанность, потеря сознания, мелкоточечные кровоизлияния. Для подострой и хронической форм уросепсиса характерен длительный субфебрилитет, который периодически можно сменяться кратковременными подъемами температуры до фебрильных цифр. У таких пациентов на фоне клинической симптоматики основного урологического расстройства сильно выражены интоксикационные астеновегетативные нарушения — быстрая утомляемость, слабость, головокружения, потливость, сердцебиение.
Осложнения
При стремительном прогрессировании симптомов, неадекватной терапии, нарастании коагулопатических расстройств уросепсис осложняется ДВС-синдромом. У 58,7% пациентов выявляется почечная недостаточность, у 55,5% появляются метастатические гнойные очаги в различных органах, у 42,2% поражается печень — возникает токсический гепатит, острая печеночная недостаточность, гепаторенальный синдром. В 14,8% случаев наблюдаются кровотечения разной локализации, в том числе из стрессовых язв желудка. На фоне полиорганной недостаточности повышается риск развития респираторного дистресс-синдрома, тяжелой энцефалопатии вплоть до септического психоза и мозговой комы. Уровень смертности при тяжелых септических процессах достигает 65%.
Диагностика
О возможном начале уросепсиса свидетельствует связь общетоксической реакции с предшествующим урологическим заболеванием или инвазивным вмешательством на органах мочевыделительной системы. Диагностический поиск направлен на выявление признаков системного воспаления, первичного инфекционного очага, определение возбудителя инфекционного процесса и его чувствительности к антибиотикам, оценку функциональной состоятельности почек. Рекомендованными методами обследований при подозрении на уросепсис являются:
В качестве альтернативных или дополнительных методов диагностики могут быть рекомендованы МСКТ почек, МСКТ цистоуретрография, МРТ урография. Для определения возбудителя выполняется посев мочи на микрофлору и трехкратный бактериологический посев крови. Поскольку даже при самом тщательном проведении исследования микробиологическая верификация уросепсиса возможна лишь у половины пациентов, для выявления системного воспаления оценивают содержание в сыворотке крови прокальцитонина — суррогатного маркера генерализованной инфекционно-воспалительной реакции.
Меньшей специфичностью отличается повышение концентрации С-реактивного белка, альбуминов, отдельных фракций глобулинов. Для обнаружения возможной почечной дисфункции применяют биохимический анализ крови на креатинин, азот мочевины, мочевую кислоту, калий, назначают нефрологический комплекс. Дифференциальную диагностику уросепсиса проводят с хирургическими, акушерскими септическими состояниями, перитонитом, тяжелыми формами пиелонефрита, пионефроза, паранефрита, карбункулом и абсцессом почки, эндогенными интоксикациями (уремической, раковой). Диагностику и лечение осуществляет специалист-уролог или нефролог, по показаниям назначаются консультации других специалистов.
Лечение уросепсиса
Основными задачами при урогенных септических состояниях являются элиминация возбудителя, коррекция полиорганных расстройств, восстановление гомеостаза. С учетом тяжести состояния пациента рекомендуется госпитализация в палату интенсивной терапии урологического или реанимационного отделения и соблюдение строгого постельного режима. Этиотропное лечение уросепсиса предполагает эффективную санацию инфекционного очага и проведение адекватной антибактериальной терапии. Антибиотики назначают в два этапа:
Чтобы восстановить адекватную тканевую и органную перфузию, корректировать расстройства гомеостаза, уменьшить токсемию, проводят активную инфузионную и противошоковую терапию. При значительной артериальной гипотензии и дефиците ОЦК под контролем диуреза вводят кристаллоидные и коллоидные растворы, плазмозаменители, альбумин, прямые антикоагулянты, ксантиновые ингибиторы фосфодиэстеразы, селективные β₁-адреномиметики.
Пациенту с уросепсисом обеспечивают адекватное энтеральное питание специальными сбалансированными смесями. Для усиления иммунитета назначают заместительную терапию специфическими иммуноглобулинами, используют иммуномодуляторы. Эффективность лечения существенно возрастает при хирургической санации очага инфекции не позднее двух часов после диагностирования уросепсиса. С учетом состояния пациента выполняют чрескожную пункционную или классическую открытую нефростомию.
Для нормализации пассажа мочи при обструктивных состояниях может применяться эпицистостомия, уретеролитотомия, уретеролитоэкстракция. При значительной деструкции печеночной паренхимы показана экстренная нефрэктомия. С детоксикационной целью в предоперационном периоде и после операции рекомендованы экстракорпоральные методы: плазмаферез, плазмосорбция, гемофильтрация, гемодиафильтрация.
Прогноз и профилактика
Хотя при поздней диагностике и неэффективной терапии уросепсис характеризуется высокой вероятностью летального исхода, выявление расстройства на стадии токсемии позволяет снизить смертность с 65% до 7,5%. Профилактика основана на грамотной санации очагов уроинфекции, устранении обструкции мочевыводящих путей, проведении превентивной антибиотикотерапии перед диагностическими и лечебными урологическими вмешательствами, соблюдении техники выполнения медицинских процедур. Важную роль в предупреждении уросепсиса играют контроль своевременного опорожнения мочевого пузыря, снижающий риск избыточного накопления патогенов, укрепление иммунитета, исключение переохлаждений.
Уросепсис. Патогенез, диагностика и лечение
Полный текст
Аннотация
В клинической лекции представлены современные данные о терминологии, классификации, патогенезе, методам диагностики и лечения уросепсиса. Особое внимание уделено лабораторным и клиническим критериям оценки тяжести и прогноза заболевания, а также методам профилактики уросепсиса.
Ключевые слова
Полный текст
ВВЕДЕНИЕ
Сепсис представляет собой угрожающую жизни полиорганную дисфункцию, вызванную нерегулируемым ответом организма на инфекцию [1]. Лечение септических состояний остается одной из наиболее сложных медицинских проблем XXI в., решение которой требует мультидисциплинарного подхода. Сепсис занимает 11-е место среди всех причин смерти взрослых, причем в развитых странах наблюдается тенденция к увеличению частоты сепсиса в среднем на 7–8 % в год [2, 3].
Существует также значительное количество классификаций сепсиса, в основу которых положены разные критерии: характер течения (молниеносный, острый, подострый, хронический, рецидивирующий), характеристика и локализация входных ворот (раневой, ожоговый, абдоминальный, акушерско-гинекологический, ангиогенный, уросепсис, билиарный, пульмоногенный, катетер-ассоциированный, пупочный, криптогенный), этиологические признаки (грамнегативный, грампозитивный, стафилококковый, стрептококковый, колибациллярный, псевдомонадный, вирусный, грибковый) и др.
Наибольшее клиническое распространение получила классификация American College of Chest Physicians / Society of Critical Care Medicine (АССР/SССМ), в основе которой лежит выраженность реакции организма на инфекционный процесс [4]. В данной классификации впервые предложено использовать термин «синдром системной воспалительной реакции» (ССВР) — системная реакция организма на воздействие сильных раздражителей (инфекция, травма, операция и др.). Данная классификация представлена в табл. 1.
Классификация и критерии диагностики септических поражений АССР/SССМ [4]
Classification and diagnostic criteria for septic lesions ACCR/SCCM [4]
Форма септического поражения
Синдром системной воспалительной реакции
Характеризуется двумя или более из следующих признаков:
· температура тела >38 или 90/мин;
· частота дыхания >20/мин или гипервентиляция (РаСО2 12 ∙ 10 9 /мл или 9 /мл или незрелых форм >10 %
Наличие очага инфекции и 2 или более признаков синдрома системной воспалительной реакции
Сепсис, сочетающийся с органной дисфункцией, гипотензией, нарушениями тканевой перфузии. Проявлением последней являются повышение уровня лактата, олигурия, острое нарушение сознания
Тяжелый сепсис с признаками тканевой и органной гипоперфузии, артериальной гипотонии, не устраняющейся с помощью инфузионной терапии и требующей назначения катехоламинов
Синдром полиорганной дисфункции
Дисфункции 2 и более систем/органов, определяемые по критериям шкалы SOFA
Рефрактерный септический шок
Сохраняющаяся артериальная гипотония — систолическое АД 2 /3 больных — женщины [5]. В 25 % случаев уросепсис является осложнением острого пиелонефрита. В большинстве случаев при уросепсисе патогенами являются представители семейства Enterobacteriaceae, а первое место занимает Escherichia coli. Так же как и при других формах сепсиса, тяжесть заболевания определяется преимущественно состоянием иммунной системы организма.
Основными факторами риска развития уросепсиса являются обструкция мочевых путей на любом уровне, врожденные уропатии, нейрогенный мочевой пузырь, а также эндоскопические вмешательства на мочевых путях. Наибольшему риску развития уросепсиса подвержены следующие группы больных: пациенты старшего возраста, при наличии сахарного диабета, иммуносупрессии, больные, получающие противоопухолевые химиопрепараты или кортикостероиды. В урологии развитию гнойно-септических осложнений предрасполагают также следующие факторы: 1) использование искусственных материалов: дренажей, катетеров, протезов, сфинктеров, слингов и т. д., что ведет к развитию инфекций биопленок и инфекций инородного тела; 2) изменение характера оперативных вмешательств в урологии и внедрение высокотехнологичных малоинвазивных методов, например дробление камня вместо удаления его целиком или послойная резекция простаты вместо удаления гиперплазированных узлов единым блоком. Во время фрагментации камней микроорганизмы и их токсины выходят в мочевые пути и под давлением ирригационной жидкости или повышенного внутрилоханочного давления поступают в кровоток. В результате развиваются токсинемия, бактериемия, синдром системной воспалительной реакции и септические осложнения. В ходе трансуретральных вмешательств на предстательной железе под давлением ирригационной жидкости и за счет травмы также возможно поступление эндотоксинов и микроорганизмов в кровоток.
Патогенез септических поражений определяется сложным и тесным взаимодействием трех факторов: патогенности микроорганизма, состояния первичного очага инфекции и иммунореактивности организма. Развитие органно-системных повреждений при сепсисе прежде всего связано с неконтролируемым распространением из первичного очага инфекционного воспаления провоспалительных медиаторов эндогенного происхождения, с последующей их активацией в других органах и тканях, с вторичным выделением аналогичных эндогенных субстанций, повреждением эндотелия и снижением органной перфузии и доставки кислорода. Диссеминация микроорганизмов может вообще отсутствовать или быть кратковременной. Суммарные эффекты, оказываемые медиаторами, формируют ССВР. В ее развитии можно выделить три основных этапа.
Этап 1. Локальная продукция цитокинов в ответ на действие микроорганизмов.
Особое место среди медиаторов воспаления занимает цитокиновая сеть, которая контролирует процессы реализации иммунной и воспалительной реактивности. Цитокины вначале действуют в очаге воспаления и на территории реагирующих лимфоидных органов, выполняя в итоге ряд защитных функций, участвуя в процессах заживления ран и защиты клеток организма от патогенных микроорганизмов.
Этап 2. Выброс малого количества цитокинов в системный кровоток.
Малые количества медиаторов способны активировать макрофаги, тромбоциты, выброс из эндотелия молекул адгезии, продукцию гормона роста. За счет поддержания баланса и контролируемых взаимоотношений между про- и антивоспалительными медиаторами в нормальных условиях создаются предпосылки для заживления ран, уничтожения патогенных микроорганизмов, поддержания гомеостаза. К системным адаптационным изменениям при остром воспалении можно отнести стрессорную реактивность нейроэндокринной системы, лихорадку, выход нейтрофилов в общий кровоток из сосудистого и костномозгового депо, усиление лейкоцитопоэза в костном мозге, гиперпродукцию белков острой фазы в печени, развитие генерализованных форм иммунного ответа.
Этап 3. Генерализация воспалительной реакции.
При выраженном воспалении некоторые цитокины могут проникать в системный кровоток и накапливаться в количествах, достаточных для реализации своих эффектов. В случае неспособности регулирующих систем к поддержанию гомеостаза деструктивные эффекты цитокинов и других медиаторов начинают преобладать, что приводит к нарушению проницаемости и функции эндотелия капилляров, запуску синдрома диссеминированного внутрисосудистого свертывания, формированию отдаленных очагов системного воспаления, развитию моно- и полиорганной дисфункции. Нарушения функции печени, почек, кишечника способствуют появлению новых факторов повреждения. К таковым относятся продукты нормального метаболизма в высоких концентрациях (лактат, мочевина, креатинин, билирубин), медиаторы регуляторных систем (калликреинкининовой, свертывающей, фибринолитической, перекисного окисления липидов, нейромедиаторы), продукты нарушенного обмена (альдегиды, кетоны, высшие спирты).
ЛАБОРАТОРНЫЕ КРИТЕРИИ СЕПСИСА
Критериями ССВР являются изменения в клиническом анализе крови: лейкоцитоз >12 ∙ 10 9 /л, или лейкопения 9 /л, или отмечается сдвиг в сторону незрелых форм (>10 %) при нормальном содержании лейкоцитов [4]. В крови увеличивается содержание билирубина выше 20 мкмоль/л в течение двух дней или повышается уровень трансаминаз в 2 раза и более от нормы [6]. При тяжелом сепсисе к вышеперечисленным критериям добавляются тромбоцитопения, нарушение свертывания крови — МНО >1,5, PTT >60 с, гипербилирубинемия не менее 34,2 мкмоль/л, повышение уровня лактата >2 ммоль/л, гиперкреатининемия >176,8 ммоль/л [6, 7].
Важное значение в диагностике и оценке тяжести сепсиса имеют биологические маркеры (биомаркеры) сепсиса — это молекулярные, биохимические или клеточные показатели, которые можно определить в биологических средах — тканях, клетках или жидкости. Биомаркеры должны обладать следующими свойствами: высокой чувствительностью и специфичностью, доступностью, быстротой получения результата, воспроизводимостью, корреляцией значения с тяжестью и исходом.
Основными биомаркерами сепсиса являются прокальцитонин, С-реактивный белок и пресепсин.
Прокальцитонин (ПКТ) является предшественником гормона кальцитонина и представляет собой полипептид молекулярной массой около 14,5 кДа, состоящий из 116 аминокислотных остатков. В норме ПКТ образуется в С-клетках щитовидной железы, где в результате специфического внутриклеточного протеолитического расщепления практически полностью трансформируется в кальцитонин, поэтому в плазме крови у здоровых людей определяются лишь следовые концентрации ПКТ ( 2 нг/мл является специфичным биологическим маркером при тяжелых бактериальных инфекциях и сепсисе. Концентрации ПКТ >10 нг/мл наблюдаются почти исключительно у пациентов с тяжелым сепсисом и септическим шоком. При грибковых и вирусных инфекциях, а также при аллергических и аутоиммунных заболеваниях уровень ПКТ существенно не повышается, что позволяет использовать этот маркер с дифференциально-диагностической целью. При локальном воспалении выброс ПКТ обычно выражен существенно меньше, что позволяет использовать данный маркер также для оценки степени генерализации процесса [8]. Генерализация инфекции характеризуется быстрым, в течение нескольких часов, повышением уровня ПКТ, концентрация которого в плазме крови может достигать весьма высоких значений (>500 нг/мл). На фоне эффективного лечения происходит снижение и нормализация уровня ПКТ. При неадекватной терапии сохраняется высокий уровень ПКТ и может наблюдаться дальнейший его рост, что свидетельствует о необходимости немедленного пересмотра схемы антибиотикотерапии и, возможно, подключения дополнительных методов лечения. В ряде случаев динамика уровней ПКТ в большей степени, чем его абсолютные значения, показательна для оценки состояния больного. Если на фоне проводимого лечения регистрируется снижение уровня ПКТ на 30 % и более за сутки [9], то такая терапия может быть признана эффективной. Для оценки состояния больного и выбора адекватной лечебной тактики у пациентов с инфекцией или высоким риском ее развития необходим ежедневный мониторинг уровня ПКТ.
При этом важно учитывать, что существуют клинические состояния, не связанные с инфекционным процессом, и при которых происходит повышение уровня ПКТ в крови: нейроэндокринные опухоли, мелкоклеточный рак легких, карциноидный синдром, малярия. Например, после тяжелой травмы и хирургического вмешательства концентрация прокальцитонина в крови быстро повышается, а затем, при отсутствии инфекции, снижается и приходит к норме через 3–5 дней, в течение которых нельзя уверенно подтвердить или исключить сепсис на основе только определения прокальцитонина [10].
В табл. 2 приведены обобщенные рекомендации по клинической интерпретации результатов ПКТ-теста.
Таблица 2 / Table 2
Клиническая интерпретация результатов ПКТ-теста при подозрении на тяжелую бактериальную инфекцию и сепсис
Clinical interpretation of the results of the PCT test in cases of suspected severe bacterial infection and sepsis