Уровень резистенции порог что это
Резистентность к антиретровирусным препаратам
Что такое резистентность?
Резистентность – это устойчивость вируса к применяемой антиретровирусной терапии. Резистентность к АРВ-препаратам формируется в том случае, когда в структуре вируса происходят изменения. Они называются мутациями. Появление мутаций у вируса может означать, что препараты либо не будут действовать так же эффективно, как раньше, либо не будут действовать вообще.
Вы можете быть инфицированы таким штаммом ВИЧ, который уже имеет резистентность к некоторым или всем препаратам.
Как появляется резистентность?
Мутации, приводящие к резистентности, обычно возникают тогда, когда вы продолжаете принимать терапию при определяемой вирусной нагрузке.
Если вирусная нагрузка по истечении 2-3 месяцев выше 400 копий/мл или после 6 месяцев приема препаратов держится на уровне выше 50 копий/мл, возможно, вам необходимо сменить терапию.
Врач должен подробно изучить, почему результаты лечения не столь хороши, как ожидалось. Возможно, он захочет обсудить, как вы соблюдаете приверженность и справляетесь с побочными эффектами. Может возникнуть необходимость провести анализ на резистентность и определить содержание препаратов в крови.
Резистентность может развиваться и при низких уровнях вирусной нагрузки – между 50 и 500 копиями/мл. В идеале рекомендуется сделать анализ на вирусную нагрузку через четыре недели после начала терапии. В последствии необходимо осуществлять контроль каждые три месяца.
Получите результаты анализа, как только они будут готовы (обычно через две недели). Не ждите до следующего визита.
Что такое кросс-резистентность?
К некоторым препаратам может развиться кросс-резистентность. Это значит, что если есть резистентность к одному препарату, то может иметь место и резистентность к другим препаратам, относящимся к одному классу, даже если они никогда не использовались в лечении.
Существуют различные степени кросс-резистентность.
Что такое анализ на резистентность?
Анализы на резистентность (резистентность в переводе на русский язык обозначает устойчивость) могут показать, есть ли у вас подобные мутации. Метод исследования доступен не во всех странах. Некоторые препараты особенно подвержены резистентности, например, невирапин, эфавиренц и 3TC.
Если при приеме этих препаратов у вас сохранится определяемый уровень вирусной нагрузки или она возрастает до уровня выше 2000 копий/мл, можно предположить, что у вас резистентность к одному или нескольким АРВ-препаратам в вашей комбинации.
Как я могу избежать резистентности?
Необходимо использовать ту комбинацию, которая достаточно сильна, чтобы свести к минимуму риск развития резистентности.
Лучший способ предотвратить формирование резистентности – достичь неопределяемого уровня вирусной нагрузки ниже 50 копий/мл и поддерживать ее на этом уровне. Предохраняться всегда при половых контактах, чтобы не произошло повторное заражение устойчивым штаммом ВИЧ.
Вирусная нагрузка. Что это за показатель и как правильно его интерпретировать.

Современные возможности ПЦР диагностики COVID-19 в лаборатории ДИЛА позволяют ответить на несколько действительно важных вопросов:
От показателя ВН (высокая, средняя, низкая) напрямую зависит заразность инфицированного человека для окружающих.
Интенсивнее всего вирус размножается за 1-3 дня до появления симптомов и в первые 5-7 дней после первых проявлений. В этот период количество вирусов в 1 мл выделений из носоглотки может составлять сотни тысяч и миллионы частиц, что соответствует среднему и высокому показателю вирусной нагрузки и делает пациента максимально заразным для окружающих. Затем количество вирусов, выделяемых человеком начинает снижаться. Обычно начиная с 7-10 дня от начала клинических проявлений человек перестает быть заразным, что соответствует снижению показателей вирусной нагрузки. В этот период вирусная РНК в анализе еще может выявляться (ПЦР позитивный с низким уровнем ВН), однако большинство исследований показывает, что после 10 дня клинических проявлений вирус теряет свою способность к репликации (размножению), а значит, и способность заражать других людей.
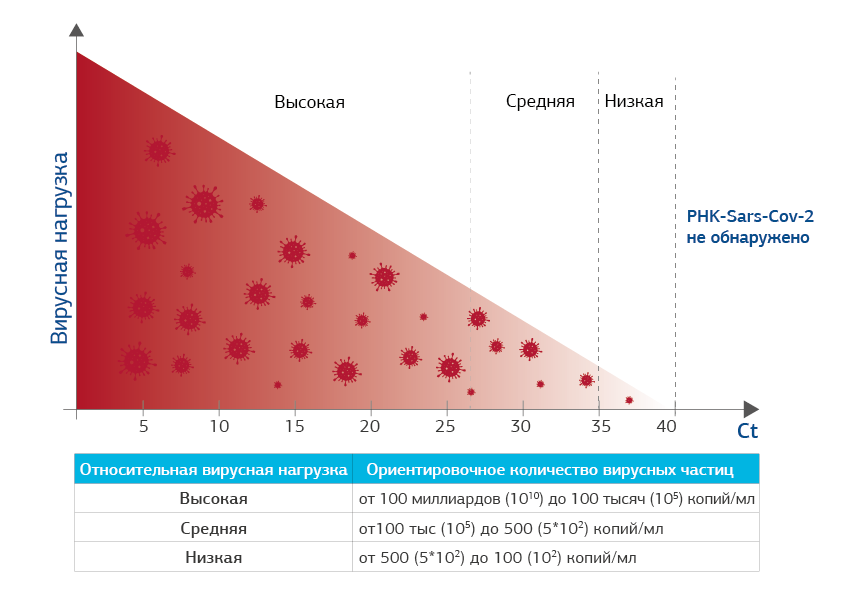
Как определяется ВН и что значит показатель Сt*
Как понимать полученный результат исследования
Если значение Ct низкое (5-15), это говорит о том, что вирусная нагрузка высокая и вирус SARS COV-2 передает свою генетическую информацию и размножается очень активно, образуя новые вирусные РНК в большом количестве и тем заразнее человек.
Если вирусных частичек мало, для их выявления нужно большее количество циклов. Чем выше значение порогового цикла (Ct=30-35-40), тем меньше вирусных частиц находится в образце.
Результат ПЦР отрицательный в том случае, если РНК вируса выявить не удается даже при самом высоком пороговом цикле чувствительности прибора – более 40 циклов амплификации (Сt больше 40: РНК SARS COV-2 не выявлена).
Сt 5-27.
Высокая ВН
Сt 28-34.
Средняя ВН
Человек болен COVID-19, есть риск заражения окружающих.
Рекомендуется:
Человек заражен COVID-19, есть риск заражения окружающих.
Рекомендуется:
Ct 35-40.
Низкая ВН
Человек болен COVID-19, риск заражения окружающих сохраняется, но он вероятно низок. Возможно самое начало заболевания.
Рекомендуется:
Человек заражен COVID-19. Чаще всего это может быть в период выздоровления (выведения вируса).
Рекомендуется (если был контакт с больным COVID-19):
Риск заражения окружающих отсутствует.
Возможно:
Для уточнения диагноза рекомендуется:
Риск заражения окружающих отсутствует.
Тест на імуноглобуліни класу G допоможе уточнити, чи перехворіли ви на коронавірусну інфекцію раніше.
При обнаружении любого из определяемых генов коронавируса результат теста является положительным, что означает присутствие вируса в организме.
Важно помнить, что клинические проявления заболевания могут отсутствовать при любом уровне вирусной нагрузки. При положительном результате ПЦР с высоким уровнем вирусной нагрузки и отсутствии симптомов заболевания (бессимптомном течении) вы высоко заразны для окружающих, поскольку из носоглотки выделяется много вирусов при дыхании, разговоре. Для контроля снижения заразности можно провести повторное ПЦР-тестирование с определением уровня вирусной нагрузки через 7-10 дней
Л.С. Страчунский В.В. Рафальский
НИИ антимикробной терапии Смоленской государственной медицинской академии
Антибиотикорезистентность, которая традиционно считалась проблемой только для внутрибольничных инфекций и осложненных ИМП, выходит сейчас на первый план при неосложненных амбулаторных ИМП. В течение последних десятилетий в мире отмечено несколько тенденций в динамике антибиотикорезистентности уропатогенной E. coli, заставляющих пересматривать требования к антибиотикам для терапии ИМП. В частности, наиболее авторитетными руководствами по терапии ИМП, не рекомендуется использовать ко-тримоксазол, как препарат выбора, при неосложненных ИМП, если уровень резистентности E.coli к этому антибиотику превышает 10-20% [2, 6]. В регионах, где уровень резистентности к ко-тримоксазолу превышает пороговый уровень, в качестве препаратов выбора должны рассматриваться другие антимикробные препараты, такие как фторхинолоны, фосфомицин.
Этиология внебольничных ИМП
Наличие или отсутствие осложняющих факторов у пациентов с ИМП является одним из ключевых параметров, определяющих особенности наблюдения пациентов и выбора терапии [28]. К микробиологическим особенностям осложненных ИМП относятся: более широкий спектр возбудителей и высокая частота выделения резистентных бактерий, по сравнению с неосложненными ИМП [29]. E. coli является основным возбудителем как при неосложненных, так и при осложненных ИМП. Однако, при осложненных ИМП более часто выделяются другие бактерии, такие как, Proteus mirabilis, Klebsiella spp., Citrobacter spp., Pseudomonas spp., Enterococcus spp. и др.
Полученные нами данные свидетельствуют о том, что основным возбудителем внебольничных ИМП в России у всех категорий пациентов является E. coli [30]. Наибольшее этиологическое значение E.coli имеет при внебольничных ИМП у взрослых пациентов (85,9%) и несколько меньше у беременных женщин и детей (53,1% и 62,9% соответственно). Учитывая наибольшую этиологическую значимость E.сoli в структуре ИМП во всех изучаемых популяциях пациентов, для практики, в первую очередь, важно знать антибиотикорезистентность именно этого возбудителя.
Антибиотикорезистентность E.сoli
Мониторинг резистентности возбудителей ИМП постоянно проводятся во многих странах мира, и является либо самостоятельным исследованием, либо частью более масштабных проектов, например SENTRY. Нередко эти исследования являются многоцентровыми международными, например проект ECO-SENS, который проводится на территории стран Европы и Канады [8].
Для анализа изменений резистентности уропатогенов к антибиотикам с течением времени наибольший интерес представляют эпидемиологические исследования, проводимые в Северной Америке в течение последних 10-15 лет [7, 14] (Рисунок 1). В США, как и большинстве стран Европы, отмечается четкая тенденция роста резистентности уропатогенной E.coli к аминопенициллинам (ампициллин) и ко-тримоксазолу. В то же время чувствительность к нитрофурантоину и фторхинолонам (ципрофлоксацин) остается высокой. Данные исследования ECO-SENS свидетельствуют о высоком уровне устойчивости в Европе уропатогенной E.coli к таким антибиотикам как ампициллин и ко-тримоксазол. Резистентность к фторхинолонам, нитрофуранам и фосфомицину по данным этого исследования была невысокой.
Рисунок 1. Динамика резистентности штаммов E.coli, выделенных у взрослых с неосложненными внебольничными ИМП в Северной Америке, % [7]
Исследование ECO-SENS подтвердило предположение о существовании значительных географических отличий в уровне и характере антибиотикорезистентности. Так, частота выделения штаммов E.coli, резистентных к ко-тримоксазолу, колебалась от 12,2% в Великобритании до 25,7% в Испании, а к ципрофлоксацину от 0,6% до 14,7% в тех же странах.
Таблица 1. Резистентности штаммов E.coli, выделенных у взрослых с неосложненными внебольничными ИМП в некоторых странах Европы, данные исследования ECO-SENS, % [8]
| Страна | Ампициллин | Ко-тримоксазол | Ципрофлоксацин | Нитрофурантоин | Фосфомицин |
| Бельгия | 30,7 | 14,6 | 2,9 | 0,7 | 0,7 |
| Франция | 27,6 | 15,1 | 2,0 | 1,0 | 1,0 |
| Германия | 29 | 21 | 2,2 | 0,7 | 0 |
| Нидерланды | 28,7 | 10,3 | 2,1 | 1,0 | 0,5 |
| Норвегия | 23,8 | 11,3 | 0 | 0 | 1,2 |
| Испания | 53,9 | 25,7 | 14,7 | 4,2 | 0,5 |
| Великобритания | 37,2 | 12,2 | 0,6 | 0 | 0 |
| По всем странам в среднем | 29,8 | 14,8 | 2,3 | 1,2 | 0,7 |
В связи с существованием региональных отличий в уровне антибиотикорезистентности, крайне важной задачей является мониторинг резистентности возбудителей ИМП в России. Данные по этиологии возбудителей различных форм амбулаторных ИМП и их антибиотикорезистености были получены в ходе многоцентровых проспективных эпидемиологических исследований UTIAP-I, UTIAP-II, АРМИД, АРИМБ, организованных НИИ антимикробной химиотерапии Смоленской государственной медицинской академии и Научно-методическим центром по мониторингу за антибиотикорезистентностью Минздрава России. Особенностью данных исследований явилось использование во всех исследовательских центрах стандартизованной методики бактериологического исследования мочи. Собранные в исследовательских центрах штаммы передавались для реидентификации и определения чувствительности к антибактериальным препаратам в центральную лабораторию. Оценка чувствительности микроорганизмов была проведена к основным антибиотикам применяемых для терапии ИМП: ампициллину, амоксициллину/клавуланату, гентамицину, ко-тримоксазолу, нитрофурантоину, цефуроксиму, цефотаксиму, ципрофлоксацину, фосфомицину.
Таблица 2. Резистентность E.coli, выделенной у пациентов с амбулаторными ИМП в России, к пероральным антибиотикам, %
β-лактамы
Высокая резистентность возбудителей ИМП к β-лактамам описана в литературе достаточно давно. Около 25% уропатогенных штаммов E.coli еще в начале 90-х были резистентны к ампициллину и цефалоспоринам I поколения [14]. В настоящее время этот уровень превышает 40% как в США, так и в европейских странах [7, 8]. Устойчивость E.coli, выделенной от пациентов с ИМП в России составляет от 31,6 до 51,5% в зависимости от популяции пациентов (Таблица 2).
Рисунок 2. Распределение МПК амоксициллина/клавуланата для штаммов E.coli, выделенных от пациентов с неосложненными ИМП (пунктиром обозначены пограничные концентрации)
Сульфаметоксазол/триметоприм (ко-тримоксазол)
До 1990 гг резистентность к ко-тримоксазолу среди возбудителей внебольничных ИМП была низкой и не превышала 5% [11]. Однако в последние 10-15 лет отмечается четкая тенденцию к росту резистентности уропатогенной E coli к ко-тримоксазолу. Как было сказано выше, в США резистентность к этому антибиотику возросла за последние 20 лет с 7% до 18-20%. Аналогичная закономерность выявлена в Великобритании и Канаде [31, 13].
В России резистентность E coli, выделенной у пациентов с ИМП, к ко-тримоксазолу колеблется от 14,5% в случаях ИМП у беременных до 35,5% при ИМП у детей. У взрослых с неосложненными ИМП этот показатель составляет 21%. Очевидно, что уровень резистентности к этому антибиотику превысил критический уровень в 10-20%, что не позволяет рассматривать этот препарат в качестве терапии выбора при ИМП.
Нефторированные (ранние, примитивные) хинолоны
Фторхинолоны
Фторхинолоны сохраняют высокую активность в отношении других грам(-) возбудителей ИМП. Отмечается относительно высокая резистентность энтерококков к фторхинолонам (20-40%), однако этиологическая роль этих возбудителей для амбулаторных ИМП невелика. S saprophyticus, как правило, чувствителен к большинству фторхинолонов, МПК ципрофлоксацина и офлоксацина несколько выше, чем других препаратов этой группы [26].
Нитрофурантоин
Уровень резистентности других грам(-) уропатогенов, например K. pneumoniae, к нитрофурантоину выше, чем у E. coli [7]. Нитрофурантоин остается активным и в отношении грам(+) возбудителей ИМП, например S. saprophyticus и энтерококков, включая ванкомицинрезистентные штаммы.
Нитроксолин
Рисунок 3. Распределение МПК нитроксолина для штаммов E.coli, выделенных от пациентов с неосложненными ИМП (пунктиром обозначены пограничные концентрации), Россия, 2000-01 гг.
Фосфомицин
В Европе, несмотря на широкое применение препарата, резистентность к нему очень низкая и колеблется от 0 до 1,5% [8]. Подобно нитрофурантоину, фосфомицин сохраняет свою активность и в случае инфекций, вызванных возбудителями, резистентными к другим антибиотикам. Было показано, что 100% фторхинолон-резистентных уропатогенных E. coli чувствительны к фосфомицину [27]. Вероятно, такая особенность фосфомицина объясняется наличием нескольких механизмов действия. Благодаря уникальному механизму действия фосфомицина, практически не встречается перекрестная резистентность с другими антибиотиками.
По данным многоцентровых российских исследований (UTIAP, ARMID, ARIMB), не выявлено штаммов E.coli, резистентных к фосфомицину (Таблица 2). Данные полученные в России вполне согласуются с данными, полученными в крупных зарубежных многоцентровых микробиологических исследованиях, таких, как ECO-SENS [8], свидетельствующие о крайне низкой (0-1%) частоте выделения устойчивых к фосфомицину штаммов.
Влияние антибиотикорезистентности на эффективность терапии ИМП
Способность микроорганизмов формировать устойчивость к антибиотикам сопряжена с рядом негативных последствий, как для отдельных пациентов, так и для общества в целом. При устойчивости возбудителя инфекции к антибиотикам резко возрастает вероятность неудачи эмпирического лечения конкретного пациента. Назначить адекватную терапию и предотвратить неблагоприятный исход возможно при своевременном получении данных о спектре и уровне антибиотикорезистентности возбудителя. В то же время, каждое конкретное заболевание, вызываемое резистентным микроорганизмом, является проявлением процесса формирования и распространения устойчивости в микробной популяции.
До настоящего времени существовал некоторые сомнения относительно влияния резистентности уропатогенов, выявляемой in vitro на клиническую и микробиологическую эффективность антибиотикотерапии ИМП, так как известно, что уроантисептики, создают достаточно высокие концентрации в моче. В последние годы получены данные, доказывающие снижение клинической эффективности антибиотика, в частности ко-тримоксазола, в случае широкого распространения резистентных штаммов.
Оказалось, что МПК для большинства штаммов E coli, резистентных к ко-тримоксазолу выше, чем концентрации этого антибиотика в моче [17]. Исследования по изучению чувствительности возбудителей ИМП в России позволили рассчитать МПК[1] и МПК90 основных антибиотиков, применяемых для терапии ИМП и сравнить их с пиковыми концентрациями в моче (Рисунок 4). Пиковые концентрации триметоприма (основного и наиболее активного компонента ко-тримоксазола) и ампициллина в моче ниже МПК90 штаммов E.coli, выделенных у пациентов с ИМП. Напротив, фосфомицин и фторхинолоны накапливаются в моче в очень высоких концентрациях, позволяющих превысить МПК90 в 31 и 19 раз, соответственно. Таким образом, ко-тримоксазол и ампициллин в большинстве случаев не создают в моче концентраций достаточных для эрадикации возбудителя.
Аналогичные данные были получены при изучении пациентов с острым пиелонефритом (Рисунок 6) [24]. В многоцентровом рандомизированном исследовании, выполненном в США, женщины с острым внебольничным пиелонефритом получали терапию либо ципрофлоксацином 500 мг 2 раза в день в течение 7 дней, либо ко-тримоксазолом 960 мг 2 раза в день в течение 14 дней. При оценке бактериологической эффективности, оказалось, что если инфекция была вызвана чувствительным к ко-тримоксазолу штаммом, то частота эрадикации составляла 96%, а если резистентным, то 50% (p
Вирусная нагрузка. Что это за показатель и как правильно его интерпретировать.
Современные возможности ПЦР диагностики COVID-19 в лаборатории ДИЛА позволяют ответить на несколько действительно важных вопросов:
От показателя ВН (высокая, средняя, низкая) напрямую зависит заразность инфицированного человека для окружающих.
Интенсивнее всего вирус размножается за 1-3 дня до появления симптомов и в первые 5-7 дней после первых проявлений. В этот период количество вирусов в 1 мл выделений из носоглотки может составлять сотни тысяч и миллионы частиц, что соответствует среднему и высокому показателю вирусной нагрузки и делает пациента максимально заразным для окружающих. Затем количество вирусов, выделяемых человеком начинает снижаться. Обычно начиная с 7-10 дня от начала клинических проявлений человек перестает быть заразным, что соответствует снижению показателей вирусной нагрузки. В этот период вирусная РНК в анализе еще может выявляться (ПЦР позитивный с низким уровнем ВН), однако большинство исследований показывает, что после 10 дня клинических проявлений вирус теряет свою способность к репликации (размножению), а значит, и способность заражать других людей.
Как определяется ВН и что значит показатель Сt*
Как понимать полученный результат исследования
Если значение Ct низкое (5-15), это говорит о том, что вирусная нагрузка высокая и вирус SARS COV-2 передает свою генетическую информацию и размножается очень активно, образуя новые вирусные РНК в большом количестве и тем заразнее человек.
Если вирусных частичек мало, для их выявления нужно большее количество циклов. Чем выше значение порогового цикла (Ct=30-35-40), тем меньше вирусных частиц находится в образце.
Результат ПЦР отрицательный в том случае, если РНК вируса выявить не удается даже при самом высоком пороговом цикле чувствительности прибора – более 40 циклов амплификации (Сt больше 40: РНК SARS COV-2 не выявлена).
Сt 5-27.
Высокая ВН
Сt 28-34.
Средняя ВН
Человек болен COVID-19, есть риск заражения окружающих.
Рекомендуется:
Человек заражен COVID-19, есть риск заражения окружающих.
Рекомендуется:
Ct 35-40.
Низкая ВН
Человек болен COVID-19, риск заражения окружающих сохраняется, но он вероятно низок. Возможно самое начало заболевания.
Рекомендуется:
Человек заражен COVID-19. Чаще всего это может быть в период выздоровления (выведения вируса).
Рекомендуется (если был контакт с больным COVID-19):
Риск заражения окружающих отсутствует.
Возможно:
Для уточнения диагноза рекомендуется:
Риск заражения окружающих отсутствует.
Тест на імуноглобуліни класу G допоможе уточнити, чи перехворіли ви на коронавірусну інфекцію раніше.
При обнаружении любого из определяемых генов коронавируса результат теста является положительным, что означает присутствие вируса в организме.
Важно помнить, что клинические проявления заболевания могут отсутствовать при любом уровне вирусной нагрузки. При положительном результате ПЦР с высоким уровнем вирусной нагрузки и отсутствии симптомов заболевания (бессимптомном течении) вы высоко заразны для окружающих, поскольку из носоглотки выделяется много вирусов при дыхании, разговоре. Для контроля снижения заразности можно провести повторное ПЦР-тестирование с определением уровня вирусной нагрузки через 7-10 дней
РЕЗИСТЕНТНОСТЬ МИКРООРГАНИЗМОВ И АНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯ
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
S.V.Sidorenko — Department of Microbiology and Clinical Chemotherapy, Russian Medical Academy of Postgraduate Training, Moscow
S.V.Sidorenko — Department of Microbiology and Clinical Chemotherapy, Russian Medical Academy of Postgraduate Training, Moscow
| Ферменты | Устойчивость к антибиотикам |
| Грам (+) микроорганизмы | |
| APH (3′)-III | Кан, Нео, Амк, Изп |
| ANT (4′)-I | Тоб, Амк, Изе |
| ANT (6)-I | Стр |
| ААС (6′)-APH (2») | Ген, Тоб, Нтл, Амк, Изп |
| Грам (-) микроорганизмы | |
| ANT(2″) | Кан, Ген, Тоб |
| ААС (2′) | Ген, Тоб, Сиз, Нтл |
| AAC(3)-V | Ген, Тоб, Нтл |
| AAC(3)-I | Ген, Сиз |
| AAC(6′)-I | Тоб, Нтл, Амк, Сиз |
| APH(3′)-I | Кан, Нео, Мон |
| APH (3′)-II | Кан, Нео, Мон, Ген |
| APH (3′)-VI | Кан, Амк, Изп |
| Примечание: Кан – канамицин, Нео – неомицин, Мон – мономицин, Стр – стрептомицин, Ген – гентамицин, Тоб – тобрамицин, Нтл – нетилмицин, Сиз – сизомицин, Амк – амикацин, Изп – изепамицин. | |
Мировое научное сообщество осознало бесперспективность пассивного отношения к процессам возникновения и распространения резистентности, поскольку оно неизбежно приводит к проигрышу человека в борьбе с микроорганизмами на популяционном уровне. Подобно тому как в подавляющем большинстве областей внутренней медицины приоритет отдается выявлению и коррекции ранних стадий патологических процессов у отдельных пациентов, так и в отношении всей популяции человека необходимо выявлять ранние стадии распространения резистентных микроорганизмов и предпринимать адекватные меры. При этом речь идет не столько о пропаганде и быстрейшем внедрении в практику новых АБП, к чему непроизвольно подталкивает фармацевтическая индустрия, сколько о раннем выявлении неблагоприятных тенденций и разработке мер, направленных на «продление жизни» известных препаратов. Работы в этом направлении находятся в центре внимания ряда международных и национальных организаций (Всемирной Организации Здравоохранения, Международного и Европейского обществ химиотерапии, Альянса за разумное использование антибиотиков и др.), однако в Российской Федерации уровень осознания проблем антибиотикорезистентности все еще можно относить к рудиментарному.
Вполне естественно, что для профессионалов в большинстве областей медицины сегодня уже недостаточно банального общего представления о возможности формирования у микроорганизмов устойчивости к АБП. Необходимо владение информацией о тех микроорганизмах и АБП, для которых наиболее характерно формирование устойчивости, а также об основных закономерностях и механизмах этого процесса.
Понятие и механизмы резистентности к АБП
Основным отличием, хотя и не принципиальным, АБП от антисептиков является наличие механизма действия, направленного на угнетение более или менее специфичного для микроорганизмов (прокариот) метаболического процесса. Угнетение происходит в результате связывания АБП с некой мишенью, в качестве которой может выступать либо фермент, либо структурная молекула микроорганизма. Благодаря этому АБП подавляют жизнедеятельность микроорганизмов в концентрациях, не наносящих вреда эукариотическим клеткам организма хозяина.
Таблица 2. Возможные варианты перекрестной резистентности между хинолонами
| Налидиксовая кислота | Норфлоксацин | Пефлоксацин | Ципрофлоксацин Офлоксацин Ломефлоксацин | Спарфлоксацин Тровафлоксацин Грепафлоксацин |
| Примечание: S – чувствительность, R – резистентность. | ||||
Механизмы устойчивости к отдельным группам АБП
Ограниченный объем публикации позволяет остановиться только на механизмах устойчивости к клинически наиболее важным АБП.
Устойчивость к b- лактамным антибиотикам опосредуют в основном два механизма. Первым является модификация чувствительной мишени – появление пенициллинсвязывающих белков (ПСБ), обладающих пониженной аффинностью к b- лактамным антибиотикам. Второй – гидролиз антибиотиков, опосредуемый ферментами b- лактамазами. Более детально механизмы резистентности к b- лактамным антибиотикам и их клиническое значение рассмотрены в статье, ранее опубликованной в Русском медицинском журнале [1].
Механизмы устойчивости к аминогликозидным антибиотикам
Механизмы устойчивости к нефторированным и фторированным хинолонам
Механизмы устойчивости к макролидным, линкозамидным и стрептограминовым антибиотикам (МЛС группа)