Увеличение тимуса у грудных детей что это
УЗИ вилочковой железы у детей: показание к проведению, как делается, что показывает – МЕДСИ
Оглавление
Ультразвуковое исследование (УЗИ) — процедура, безопасная для ребенка любого возраста. Она позволяет провести точную диагностику быстро и безболезненно. При этом не применяется рентгеновское излучение, которое вредно для детского организма. В основе принципа его действия лежит эффект различного отражения звуковых волн высокой частоты от разных типов органов и тканей.
Что из себя представляет вилочковая железа?
Вилочковая железа (тимус) является важной частью организма, отвечающей за выработку Т-лимфоцитов для иммунитета человека. Она размещается в верхней области грудной клетки (в верхнем средостении).
Размеры и масса железы меняются на протяжении всей жизни человека:
Вилочковая железа имеет серо-розовый цвет тканей, а в пожилом возрасте — желтоватый.
С какой целью проводят УЗИ тимуса?
Врач назначает УЗИ вилочковой железы для детей в случае, когда имеются жалобы на постоянные болезни ребенка (простуды, ОРЗ и др.) и низкий иммунитет. Это необходимо, чтобы определить причины возникновения регулярных недомоганий.
Ультразвуковое исследование позволяет выявить патологическое увеличение размеров тимуса — тимомегалию. В результате ее появления ослабляется иммунитет, и ребенок начинает регулярно заражаться различными болезнями от других детей и взрослых. В таком случае на фоне обычной простуды может возникнуть аллергия, расстройство ЖКТ, появляется высокая температура.
Показания к проведению
УЗИ тимуса назначается при таких симптомах, как:
Что может выявить УЗИ?
УЗИ вилочковой железы у детей помогает выявить следующие виды заболеваний и нарушений:
Также ультразвуковое исследование позволит определить такие параметры, как:
Как проводится?
Процесс проведения УЗИ вилочковой железы довольно прост:
Вся процедура занимает порядка 10–15 минут.
Подготовка
Перед проведением ультразвукового исследования вилочковой железы не требуется сложной подготовки:
Расшифровка результатов
Для расшифровки результатов врач должен знать точную массу тела ребенка, поскольку от этого значения зависит определение нормального объема и веса вилочковой железы (их соответствия возрастным нормам).
В норме масса железы составляет 0,3 % от общей массы тела. При превышении данного значения ставится диагноз «тимомегалия». Она бывает трех степеней, а ее значение измеряется особым индексом КТТИ:
Также на сонограмме (результате УЗИ) могут быть обнаружены и такие изменения железы, как: опухоль, чрезмерное разрастание тканей и др.
Можно ли исследовать тимус другими способами
УЗИ вилочковой железы как методика используется относительно недавно. Ранее для целей выявления нарушений в работе и строении вилочковой железы использовали рентгенологическое исследование. Но такой анализ нельзя проводить часто, в отличие от УЗИ, поскольку рентген-облучение является вредным для детского организма.
Если результаты УЗИ тимуса оказались недостаточно однозначными или контрастными, врач может назначить дополнительные виды обследования:
ТИМОМЕГАЛИЯ И СИНДРОМ ПЛАТТЕРА
История относительно интенсивного изучения вилочковой железы ( glandula thymus, thymus ) насчитывает около 400 лет. Начало его относится к 1614 г., когда профессор Базельского университета Феликс Платтер описал происшедшую у него
В середине XIX в. профессор Венского университета Карл Рокитанский высказал предположение об инкреторной функции вилочковой железы. Данная концепция была положена в основу представлений о тимико-лимфатическом статусе [1, 2] как врожденной особенности конституции, предрасполагающей к внезапной смерти от незначительных причин. В симптомокомплекс тимико-лимфатического статуса включались первичная гиперфункция вилочковой железы, гипоплазия надпочечников, сердца и аорты [1–5]. С этого времени причиной тимической смерти стали считать острую надпочечниковую недостаточность [3, 4]. Однако отсутствие характерных для тимико-лимфатического состояния признаков во многих случаях при такой смерти, в том числе и симптомов надпочечниковой недостаточности, позволило поставить под сомнение и данную концепцию.
В начале 1960-х гг. было доказано, что тимус является центральным органом иммунной системы. С этого времени вилочковая железа рассматривается в качестве железы внутренней секреции, действие гормонов которой направлено на дифференцировку тимических лимфоцитов. Открытие основной функции вилочковой железы — продукции Т-лимфоцитов и регуляции иммунитета, а также принадлежность ее к системе эндокринных желез позволяют рассматривать данный орган как коммутатор иммунной и эндокринной систем. В серии работ отечественных исследователей последних 20 лет доказывается, что дети с большой вилочковой железой относятся к числу иммунодефицитных лиц.
В 1970 г. проф. Т. Е. Ивановской [6] для обозначения увеличенной вилочковой железы вместо вышеуказанных терминов был предложен термин «тимомегалия». Под тимомегалией российские морфологи понимают увеличение объема и массы тимуса выше предельных возрастных значений с сохранением нормальной гистоархитектоники органа. Начиная с 1970 г., этот термин стал широко использоваться как морфологами, так и клиницистами.
Однако проведенные исследования показали, что тимомегалия является лишь одним из симптомов того состояния, которое существует у детей, имеющих увеличенную вилочковую железу [7]. В связи с отсутствием другого термина, отражающего сущность состояния, которое имеет место у детей с увеличенной вилочковой железой (соответствующей тимомегалии в понимании патологоанатомов), предлагаем называть его синдромом Платтера.
Термином «синдром Платтера» следует обозначать состояние, при котором клинические и параклинические методы обследования позволяют выявить у детей и подростков ряд специфических изменений организма, сочетающихся с первичной длительно сохраняющейся тимомегалией. Клиническое понимание тимомегалии при синдроме Платтера отражает морфологическое состояние вилочковой железы, при котором масса и объем тимуса превышают предельные возрастные значения при сохранении нормальной гистоархитектоники органа.
Диагностика тимомегалии в клинической практике
Ориентировочная диагностика тимомегалии может быть проведена с помощью объективного исследования: осмотра, пальпации, перкуссии. Однако оценка результатов во многом субъективна и зависит от опыта исследователя [7].
Из инструментальных методов, позволяющих объективно выявить тимомегалию, используются рентгенодиагностика и ультразвуковое исследование (УЗИ).
Рентгенодиагностика. Методологической основой рентгенодиагностики увеличенного тимуса является следующее положение: в норме у детей любого возраста на стандартных рентгенограммах грудной клетки в прямой проекции тень тимуса не должна выходить за пределы тени сосудистого пучка и сердца.
В целях диагностики тимомегалии на рентгенограммах грудной клетки в прямой проекции мы применяли кардио-тимико-торакальный индекс (КТТИ) по J. Gewolb [8] и вазокардиальный индекс (ВКИ) [7]. Оба индекса определяются на стандартных рентгенограммах грудной клетки в прямой проекции. КТТИ представляет собой частное от деления ширины сосудистого пучка на уровне бифуркации трахеи (точка carina) на ширину грудной клетки на уровне купола диафрагмы. ВКИ представляет собой частное от деления ширины сосудистого пучка на уровне бифуркации трахеи (точка carina) на максимальную ширину тени сердца. Максимальная ширина тени сердца определяется как сумма двух перпендикулярных отрезков, опущенных на вертикальную линию (проведенную через середину позвоночного столба) из максимально удаленных от нее точек сердца слева и справа (рис. 1).
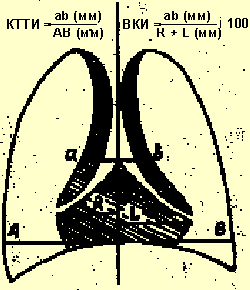 |
| Рисунок 1. Схема вычисления индексов КТТИ и ВКИ |
Выявление в средостении характерной овальной, треугольной или лентовидной тени с прямым, волнообразным или неровным контуром, расположенной с одной или обеих сторон сосудистого пучка, искажающей линию «сердечной талии» слева и/или вазокардиальный угол справа, позволяет сделать заключение о существовании у пациента тимомегалии. Наличие увеличенных значений КТТИ и ВКИ подтверждает данный диагноз. Рентгенологический метод, однако, информативен только для детей грудного и раннего возраста, поскольку у детей в возрасте старше 3 лет, как правило, тимус располагается за тенью сосудистого пучка и сердца. В таблице 1 приведены значения КТТИ и ВКИ у детей первых 3 лет жизни при разных степенях увеличения тимуса.
УЗИ. УЗИ тимуса в нашей стране впервые было проведено у новорожденных детей С. М. Воеводиным [9]. Путем клинико-морфологических сопоставлений нами были разработаны коэффициенты пересчета линейных параметров тимуса в более привычные для клиницистов формы (объема и массы органа). Округленные величины указанных коэффициентов, по нашим данным, равны 0,7 (для массы) и 0,5 (для объема). Таким образом, величины массы и объема тимуса при ультразвуковом сканировании вычисляются следующим образом:
М = 0,7 в a в b в c;
V = 0,5 в a в b в c,
где a, b, c — линейные параметры тимуса (ширина, длина, передне-задний размер, выраженные в см); 0,7 и 0,5 коэффициенты пересчета линейных параметров на массу и объем органа соответственно [10]. Для практических целей массу и объем вилочковой железы достаточно определять так, как это указано выше: без вычисления объема и массы отдельных долей.
Методом центильного распределения нами были определены нормальные значения массы и объема тимуса для детей в возрасте 1–24 мес (табл. 2). При превышении массы и объема тимуса выше верхних предельных значений нормы состояние ребенка следует расценивать как тимомегалию.
На основании анализа более 5000 рентгенограмм, выполненных у детей грудного возраста при подозрении на пневмонию, диагноз которой рентгенологически не был подтвержден, тимомегалия нами была выявлена у 35% пациентов 1 — 3 мес, у 15% детей в возрасте 3–6 мес, у 8% — в возрасте 7–15 мес, у 2% — в возрасте 16 — 36 мес, а в популяции детей старше 3 лет частота выявления тимомегалии не превышала 0,5% [8].
Наблюдение за одними и теми же детьми на протяжении длительного отрезка времени позволило нам сделать вывод, что тимомегалия в детском возрасте может быть как транзиторной, так и стойкой.
В 1993 г. нами совместно с О. В. Зайратьянцем была предложена классификация тимомегалии в детском возрасте на основе клинико-морфологических данных. Несколько измененный вариант указанной классификации приведен в табл. 3 (см. рубрику «Под стекло»). Наиболее частым вариантом тимомегалии в детском возрасте является синдром Платтера.
Анализ родословных позволил выявить у родственников первой и второй линии родства детей с синдромом Платтера высокую частоту встречаемости злокачественных новообразований, аутоиммунных заболеваний и заболеваний системы эндокринных органов. Так, злокачественные новообразования встречаются в каждой третьей семье, где есть дети с синдромом Платтера, с такой же частотой в этих семьях регистрируются эндокринные заболевания (преимущественно сахарный диабет и заболевания щитовидной железы). В семьях детей с синдромом Платтера статистически чаще, чем в семьях детей из выборки общей популяции, распространены аутоиммунные заболевания (диффузные болезни соединительной ткани) и туберкулез. Помимо этого, многие родители детей с указанным синдромом в дошкольном и младшем школьном возрасте относились к группе часто болеющих, т. е. к группе детей имевших повышенную склонность к острым респираторным вирусным инфекциям (ОРВИ).
Характер перечисленных заболеваний (склонность к вирусным, аутоиммунным, онкологическим заболеваниям, туберкулезу) может указывать на существование у близких родственников детей с синдромом Платтера недостаточной активности клеточного звена иммунной системы, поскольку, согласно современным воззрениям, все перечисленные заболевания находятся под контролем Т-клеточного иммунитета, формируемого вилочковой железой. При этом не совсем ясно, чем объясняется высокая отягощенность родственников детей с синдромом Платтера болезнями системы эндокринных органов. Однако не следует забывать о том, что эндокринные заболевания (в том числе сахарный диабет, диффузный токсический зоб, гипотиреоз) могут иметь аутоиммунный генез.
В таком случае у близких родственников детей с синдромом Платтера отчетливо просматривается тенденция к заболеваниям, связанным с иммунными механизмами клеточного типа, контролирующимися вилочковой железой. Это позволяет предполагать возможность передачи детям, у которых развился синдром Платтера, какого-то дефекта Т-звена иммунной системы.
Антенатальный период у большинства детей с синдромом Платтера осложняется хронической гипоксией, обусловленной острыми инфекционными заболеваниями или обострением хронических экстрагенитальных заболеваний матерей, наличием у них сосудистой дистонии, анемии, гестозов.
Осложненное течение интранатального периода отмечается не менее чем у 2/3 детей с синдромом Платтера. Наиболее частыми осложнениями этого периода явились стремительные или затяжные роды, приведшие к наложению щипцов или экстренному кесареву сечению.
Группа детей с указанным синдромом по фенотипу гетерогенна. 90% детей имеют мягкие округлые формы тела, некоторую пастозность тканей, относительно крупные черты уплощенного лица, прямой тип лба, широкоовальные глаза, относительно короткий нос с низким переносьем, средней величины или толстые губы, слабый изгиб профиля, короткую шею. Дети этой группы имеют как бы увеличенные поперечные размеры тела: широкое лицо, широкая грудная клетка, широкие плечи, широкие ладони и стопы, относительно короткие и широкие пальцы. Около 3/4 детей-европеоидов этой подгруппы имеют нежную, но несколько утолщенную, слабопигментированную белую кожу, для которой характерно быстрое развитие ожога после инсоляции, светлую окраску волос и глаз, слабое развитие мускулатуры, сниженную физическую активность. Дети данной подгруппы отличаются хорошим (и даже избыточным) аппетитом и высокими темпами роста.
В дошкольном и младшем школьном возрасте у них отмечаются хорошее развитие подкожного жирового слоя, слабое развитие мускулатуры, снижение общего тонуса и тургора тканей, а также физической активности, замедленная реакция на внешние раздражители, замедленное образование новых условных рефлексов, ослабление процессов внутреннего торможения с преобладанием реакций внешнего торможения.
Клиническая характеристика детей с синдромом Платтера включает характеристику системы лимфоидных органов, которая, согласно мнению большинства исследователей, отличается генерализованной гиперплазией системы лимфоидных органов: лимфатических узлов, лимфатических фолликулов корня языка, задней поверхности глотки, поверхности надгортанника, гипертрофией небных и глоточной миндалин. Наши наблюдения, однако, показали, что состояние периферических лимфоидных органов зависит от воздействия антигенного стимула — при отсутствии такого воздействия генерализованная гиперплазия периферического лимфоидного аппарата не развивается [7].
К числу особенностей физического развития детей грудного и раннего возраста относятся: высокие темпы увеличения длины тела, слабое развитие скелетной мускулатуры, несвоевременность и неправильный порядок прорезывания молочных зубов, относительно позднее начало самостоятельной ходьбы.
В эмоциональной сфере в первые 2–3 мес жизни обращает внимание менее выраженный комплекс оживления (за счет снижения двигательной активности).
Начало становления речи у детей с синдромом Платтера не отличалось от такового у детей соответствующего возраста в популяции в целом: гуление, слоги и первые слова у них появлялись своевременно.
К возрасту 10–11 мес они начинали произносить первые одно- и двусложные слова, к 1 году количество активно произносимых слов достигало 10–12. В дальнейшем 8% детей данной группы до 2-летнего возраста продолжали пользоваться только этими 10–12 словами. В возрасте 4,5–6 лет 25% детей этой группы страдали дислалией, требующей проведения корригирующих логопедических занятий в условиях детской поликлиники или в условиях специализированного детского сада. У отдельных пациентов нарушение, связанное с произношением звуков, сохранялось и в подростковом возрасте.
Состояние здоровья детей с синдромом Платтера. Здесь рассматриваются только те заболевания и патологические состояния, которые достоверно чаще встречались у детей с указанным синдромом, по сравнению с детьми из общей популяции. При анализе структуры выявленных заболеваний наибольшую по численности группу составили аномалии развития (выявлены у 80% наблюдавшихся пациентов) — пороки развития, множественные стигмы дизэмбриогенеза, биохимические дефекты. Пороки развития чаще проявлялись гипоплазией органов и тканей: широкие отверстия паховых каналов и пупочного кольца, септальные дефекты в сердце, гипоплазия аорты, сердца, легких, почек, щитовидной железы и др.
Вторая группа заболеваний была представлена патологическими состояниями нервной системы. Наряду с заболеваниями нервной системы, обусловленными биохимическими дефектами (синдром Менкеса; ганглиозидоз Gm1; фенилкетонурия; галактоземия), обращали на себя внимание такие синдромы, как гипертензионно-гидроцефальный (у 49%), фебрильных судорог (у 20%), мышечной гипотонии (у 18%) и вегетативно-висцеральной дисфункции (у 12,5%). Включение в комплекс обследования электрофизиологических методов, компьютерной и ядерно-магнитно-резонансной томографии привело к существенному увеличению частоты выявления гипертензионно-гидроцефального синдрома (выявлен у 90%). Указанный синдром у 2/3 детей сочетался с синдромами фебрильных судорог и вегетативно-висцеральных дисфункций, однако последние два синдрома у части детей встречались и изолированно.
Изолированный синдром вегетативно-висцеральных дисфункций характеризовался крайне выраженным полиморфизмом проявлений: нарушение терморегуляции, дыхания, сердечной деятельности, функции желудочно-кишечного тракта, пароксизмальное повышение артериального давления и другие расстройства. Мы склонны считать, что синдром вегето-висцеральных дисфункций у детей с синдромом Платтера встречается значительно чаще, чем у указанных 12,5% пациентов. На существование гиподиагностики синдрома вегето-висцеральных дисфункций могут указывать выявленные нами фенотипические особенности детей, в том числе очень хороший (скорее избыточный) аппетит, склонность к задержке жидкости, как бы немотивированный субфебрилитет. Наши наблюдения показали, что у большинства детей с якобы немотивированным субфебрилитетом последний хорошо контролировался мочегонными средствами, что явно указывает на связь этого симптома с ликворной гипертензией, в том числе с повышением давления в области третьего желудочка мозга — месте локализации центра терморегуляции.
У детей с синдромом Платтера обращал на себя внимание и синдром мышечной гипотонии, который у ряда пациентов был настолько сильно выражен, что специалисты высказывали предположение о наличии у них болезни Верднига–Гоффманна или миелодисплазии.
Таким образом, частое выявление у детей с синдромом Платтера внутренней гидроцефалии, изолированного синдрома вегето-висцеральных дисфункций, наличие вегетативных нарушений указывает на возможность нарушения функции диэнцефальной области. Изменения со стороны скелетной мускулатуры трактовать сложнее. Однако если учесть, что средний мозг, примыкающий к области сильвиева водопровода, контролирует регуляцию мышечного тонуса и сигналы к мышцам поступают через ретикулярную формацию по двум ретикулоспинальным путям [11], то это нарушение может быть рассмотрено с позиции существования у данного контингента детей внутренней гидроцефалии и расстройства ликвородинамики, поскольку гипоталамус, таламус и ретикулярная формация являются звеньями единой суперфункциональной системы, корригирующей гомеостатические программы наиболее сложных вегетативных, эндокринных, трофических и психических функций [12].
У 9% пациентов школьного возраста с синдромом Платтера зарегистрированы заболевания нейроэндокринной и эндокринной системы (диэнцефальный синдром, несахарный диабет, транзиторный несахарный диабет, транзиторный гипопаратиреоз, инсулинозависимый сахарный диабет, поликистоз яичников, эутиреоидная струма, диффузный токсический зоб, субкомпенсированный гипокортицизм). У детей с синдромом Платтера, отмечается тенденция к высоким показателям роста и слабой пигментации кожи, что может также указывать на дисфункцию гипоталамо-гипофизарной системы. Кроме того, у этих детей существует ряд симптомов, которые мы назвали торакальными и к числу которых относится синдром сдавления средостения. Этот синдром мы наблюдали только у детей первых 2–2,5 мес жизни при значительном увеличении тимуса.
Все исследователи, занимавшиеся изучением особенностей лиц со стойкой тимомегалией (а основную группу в них, вне всякого сомнения, составляют дети с синдромом Платтера), обращали внимание на их пониженную физическую активность.
При специальном опросе 72 пациентов в возрасте 10–24 лет с синдромом Платтера у 46% из них было отмечено негативное отношение к физическим нагрузкам, особенно к бегу на длинные дистанции и езде на велосипеде. Подростки и лица молодого возраста, способные передать ощущения, появлявшиеся при физической нагрузке, отмечали на ее фоне чувство слабости, ощущение нехватки воздуха.
Когда у 30 подростков с синдромом Платтера, не имевших органических заболеваний сердца, было проведено эхокардиографическое исследование сердца на аппарате 128 х Р — ACUSON (США) с определением массы миокарда левого желудочка сердца, у 27 из них индексированная (относительно массы тела) масса миокарда левого желудочка сердца оказалась достоверно меньше (р
Л. Г. Кузьменко, доктор медицинских наук, профессор
РУДН, Москва
Синдром увеличения вилочковой железы у детей раннего возраста
ПГЕ2 – простагландин Е2
ИЛ – интерлейкин
БАВ – биологически активные вещества
ГМ-КСФ – гранулоцитарно-макрофогальный колониостимулирующий фактор роста
АДГ – антидиуретический гормон
КРГ – кортикотропин релизинг-гормон
АКТГ – адренокортикотропный гормон
С проблемой увеличения вилочковой железы у детей раннего возраста сталкиваются многие родители. Разберемся в причинах появления этого заболевания.
Анатомия вилочковой железы
Вилочковая железа располагается в верхней передней части грудной полости непосредственно позади рукоятки грудины, плотно приле-гая к ней своей передней поверхностью. Она состоит из двух уплощенных в передне-заднем направлении треугольных долей, представленных серорозовой массой [1].
Примерно в 25% случаев у вилочковой железы встречаются добавочные или аберрантные дольки. В них возможно развитие тех же патологических изменений, что и в основной железе [2].
Вилочковая железа покрыта соединительно-тканной капсулой, от которой отходят соединительно-тканные перегородки или септы. Септы разделяют паренхиму, хотя и не полностью, на дольки размером 0,2-5 мм.
Кровоснабжение вилочковой железы осуществляется многочисленными тимическими артериями, отходящими от внутренней грудной артерии, верхних и нижних щитовидных артерий и др.
Соединительная ткань, сопровождающая сосуды корковой зоны тимуса, отделена от паренхимы органа плотной базальной мембраной эпителия тимуса. Обнаружение двух базальных мембран между крово-током и внутренней средой тимуса в корковой зоне позволило предположить существование гематотимического барьера [2].
Иннервация вилочковой железы осуществляется от симпатического и парасимпатического отдела вегетативной нервной системы.
Эмбриогенез вилочковой железы. Возрастная эволюция с момента закладки.
Источником предшественников лимфоцитов тимуса в эмбриональный период служит гемопоэтическая ткань печени, клетки которой колонизируют орган [2].
Первые лимфоциты в тимусе появляются у человека на 3 месяце. Число лимфоцитов в вилочковой железе растёт наиболее быстро в периоды с 12 по 15 недели и с 18 по 22 недели. При этом число Т-лимфоцитов среди них с 12 недели составляет около 80-85% и не меняется до рождения. С 12 недели начинается заселение Т-лимфоцитами периферических лимфоидных органов по мере их созревания, начиная с селезёнки [1]. Число В-лимфоцитов в тимусе составляет около 1% и мало меняется в дальнейшем до рождения [1].
В эмбриогенезе на пути миграции органа нередко формируются дополнительные его доли, например на шее или рядом со щитовидной, паращитовидной и слюнными железами [2].
Все структурные компоненты вилочковой железы обнаруживаются уже на 12 неделе развития эмбриона. К моменту рождения доношенного плода вилочковая железа структурно и функционально сформирована полностью и имеет следующие характеристики:
Относительная масса тимуса, обусловленная массой паренхимы органа, выше при рождении, уменьшение её отмечается в пубертатном периоде, и вновь увеличение в пожилом возрасте.
Абсолютная масса тимуса, обусловленная массой стромы (с жировой клетчаткой), постепенно нарастает в течение жизни.
Возрастная (физиологическая) инволюция вилочковой железы подразумевает уменьшение с возрастом массы и объёма паренхимы органа [1].
Объём и масса истинной паренхимы вилочковой железы несколько увеличивается в первые месяцы жизни, а затем прогрессивно снижается с довольно большой скоростью до 40 лет, после чего скорость инволюции замедляется [1].
Выделяют следующие этапы возрастной инволюции вилочковой железы:
С возрастом снижаются все показатели Т-системы иммунитета, включая число Т-лимфоцитов в периферической крови и лимфоидных органах, продукцию интерлейкинов.
В 70-90 лет продукция тимических гормонов падает на 50-70%, а продукция Т-лимфоцитов хоть и сохраняется, но на более низком уровне [1].
Возрастная инволюция обусловлена прежде всего внутритимическими факторами и генетически запрограммирована.
Снижение функции вилочковой железы с возрастом является, по-видимому, причиной развития иммунодефицита при старении, что приводит к учащению иммунопатологических процессов и онкологических заболеваний с возрастом [1].
Таким образом, у человека активный рост тимуса наблюдается в неонатальный период и в течение первых двух лет жизни. В возрасте с 2 до 5 лет происходит нарастание функциональной активности иммунной системы. От 11 до 15 лет рост тимуса приостанавливается и снова возобновляется между 17 и 19 годами.
Физиология вилочковой железы
Основная функция тимуса направлена на контроль пролиферации и дифференцировки Т-лимфоцитов.
Выделяя индукторы и хемотаксические вещества, тимус активирует выход предшественников Т-клеток из костного мозга и их дальнейшую миграцию.
Проникая в тимус, предшественники Т-лимфоцитов в форме лимфобластов попадают в микроокружение клеток, под влиянием которых вступают в стадии пролиферации и дифференцировки.
В результате дифференцировки лимфоцитов в тимусе появляются субпопуляции разного функционального назначения (индукторы, хелперы, супрессоры, цитотоксические клетки и др.).
В селекции зрелых Т-лимфоцитов при эмиграции их из органа прямо или косвенно участвуют все структуры тимуса, начиная с анатомических (коллекторная система сосудов, гематотимический барьер) и кончая молекулярными (рецепторы клеток).
Однако и при этом не все лимфоциты покидают тимус в зрелой форме, окончательная дифференцировка таких лимфоцитов происходит в других органах (лимфоидные органы, кожа, кишечник, печень, легкое).
В процессе дозревания лимфоциты могут повторно посещать тимус [1].
Функция вилочковой железы находится в тесной взаимосвязи с её строением.
Эпителиальные клетки и клетки мезенхимального происхождения из системы мононуклеарных фагоцитов создают в вилочковой железе микроокружение, обеспечивающее созревание и дифференцировку Т-лимфоцитов [5].
Структурно-функциональной единицей вилочковой железы в настоящее время считается ячейка сети эпителиальных клеток, содержащая лимфоциты и макрофаги и прилегающий участок ВПП с сосудами и клетками мезенхимального происхождения [2].
Тимус играет важную роль в развитии и регуляции не только иммунных, но и многих других физиологических, в том числе нейроэндокринных процессов.
Строма тимуса продуцирует различные гуморальные факторы.
Так, тимические макрофаги продуцируют:
Известно, что этапы роста, дифференцировки, метаболическая и функцианальная активность клеток тимуса регулируется различными БАВ (биологически активными веществами).
БАВ тимуса условно подразделяются на:
Регуляторные полипептиды:
Ростовые факторы
Понятие условно, так как некоторые регуляторные пептиды также выполняют эту функцию:
Нейропептиды
Клетками тимуса синтезируются нейрофизин, вазопрессин, окситоцин, нейроспецифическая энолаза, соматостатин, хромогранин А.
Функции основных тимических гормонов [1].
Влияет на пре-Т-лимфоциты, блокирует нервно-мышечную передачу.
Тимический гуморальный фактор
Тимический фактор Х
Восстанавливает число Т-лимфоцитов.
Тимический сывороточный фактор (тимулин)
Влияет на разные этапы дифференцировки Т-лимфоцитов, на дифференцировку цитотоксических Т-лимфоцитов.
Влияет на ранние этапы дифференцировки Т-лимфоцитов, на дифференцировку Т-хелперов.
Оказывает АКТГ-подобное действие.
Влияет на дифференцировку Т-супрессоров, на поздние этапы дифференцировки Т-лимфоцитов.
Влияет на ранние этапы дифференцировки Т-лимфоцитов.
Таким образом, тимус является уникальным комплексным органом нейроэндокринной и иммунной системы, способным продуцировать различные биологически активные вещества, играющие главную роль не только в иммунологических, но и во многих других физиологических процессах. [3].
Вилочковая железа
Нейроэндокринные и иммунные взаимоотношения.
В последние годы придаётся большое значение установлению координационных связей между эндокринной и иммунной системами.
Целой серией научных исследований установлено тесное взаимодействие вилочковой железы и коры надпочечников, гипофиза, щитовидной, паращитовидных и половых желёз [6]. Так, между гормонами вилочковой железы и инсулином, гормоном роста, соматомединами, пролактином прослеживается синергизм. Антагонистические взаимоотношения отмечаются между гормонами вилочковой железы и паратгормоном, половыми стероидами (эстрогенами, тестостероном). Особенно важна связь между гипоталамо-гипофизарно-адреналовой системой и тимусом, которую осуществляют цитокины, высвобождаемые при воспалительной реакции, в частности ИЛ-1 и ИЛ-6. Цитокины усиливают секрецию КРГ с последующим возрастанием секреции АКТГ и концен-трации кортизола.
В свою очередь кортизол стимулирует выработку мозговым слоем надпочечников адреналина и норадреналина, которые принимают непосредственное участие в ответной реакции организма на поддержание гемодинамики. (рис.1) [7].
В части случаев латентная функциональная недостаточность надпочечников и дефицит глюкокортикоидов приводят к гиперплазии лимфоидной ткани тимуса без выраженной гиперплазии его эпителиальных элементов. В этом случае тимомегалию рассматривают как приобретенную на фоне недостаточности тимических гормонов [1].
Помимо отрицательной обратной связи, т.е. подавления секреции рилизинг-гормона конечным продуктом системы, на регуляцию выработки кортизола влияет ряд других факторов: время суток, уровень стресса и наличие воспалительных цитокинов.
Клинико-рентгенологический синдром увеличения вилочковой железы
Педиатру чрезвычайно важно знать клинико-рентгенологический синдром увеличения вилочковой железы, который встречается у детей первых 3-х лет жизни. Диагностировать этот синдром можно лишь после проведения рентгенографического исследования грудной клетки.
Бесспорным рентгенологическим признаком увеличения тимуса является обнаружение симптома, столбообразного или причудливого сердца, когда тень увеличенной вилочковой железы, сливаясь с тенью сердца, создаёт причудливую картину срединной тени.
Способы определения синдрома увеличения вилочковой железы
2 способ – определение кардиотимико-торакального индекса (КТТ-индекс) для косвенного подтверждения увеличения тимуса [9]. Индекс определяется путем деления ширины кардиотимической тени у места бифуркации трахеи (III ребро) на поперечный размер грудной клетки на уровне купола диафрагмы.
Увеличение индекса выше 0,38 свидетельствует о тимомегалии. Величины КТТ-индекса от 0,33 до 0,40 характерны для I степени увеличения (заметное) тимуса, а величины индекса от 0,40 и выше соответст-вуют II степени увеличения (значительное) тимуса. При нормальных размерах тимуса КТТ-индекс не превышает 0,33 [9].
Тень тимуса, расположенная в пределах I-II четверти любой половины грудной клетки указывает на допустимо-нормальные размеры ви-лочковой железы, тень тимуса, расположенная в пределах делений III-IV соответствует тимомегалии. Выход тени тимуса за линию CD является показанием для наблюдения за ребёнком, если он идёт на оперативное лечение.
Что следует ожидать от детей у которых случайно выявлен клинико-рентгенологический синдром увеличения тимуса?
Прежде всего, такой ребенок может иметь следующие особенности в иммунном статусе:
Подобные изменения могут сопровождаться частыми инфекциями и являются прогностически благоприятным фоном для развития лимфо-пролиферативных и аутоиммунных заболеваний.
Изменения в нейроэндокринном статусе характеризуется развитием третично-вторичной надпочечниковой недостаточности во время операций или тяжелых заболеваний.
Причины развития третично-вторичной надпочечниковой недостаточности
При функциональной недостаточности тимуса, которая возможна при синдроме гиперплазии тимуса, снижается количество дифференцированных (зрелых) Т-лимфоцитов, что в свою очередь может привести к недостаточной продукции отдельных цитокинов при различных патологических состояниях и в первую очередь, при общем воспалительном процессе.
Так, уменьшение выработки таких цитокинов как ИЛ-1 и ИЛ-6 при тяжелых заболеваниях сопровождается недостаточной активацией гипоталaмо-гипофизарно-адреналовой системы. Это в свою очередь приводит к снижению секреции кортиколиберина-АКТГ-кортизола. Снижение выработки кортизола приводит к снижению секреции катехоламинов (норэпинефринов) мозговым слоем надпочечников. В результате возможны тяжелые гемодинамические расстройства, вплоть до шока.
У каких детей возможно заподозрить синдром увеличения вилочковой железы?
При исследовании такого ребёнка возможно пропальпировать край селезёнки. В крови имеет место относительный лимфоцитоз.
Тактика ведения и наблюдения детей с синдромом увеличения вилочковой железы
Настоящая тактика применяется нами в течение более 10 лет на базе Архангельской областной детской клинической больницы и позволила избежать грозных осложнений при тяжелых состояниях, развившихся на фоне общего воспалительного синдрома или при оперативных вмешательствах у детей. За основу нами были взяты рекомендации кафедры детской и подростковой эндокринологии РМАПО, которые были адаптированы в течение последних лет к нашим условиям.
План ведения детей раннего возраста с синдромом увеличения вилочковой железы при различных ситуациях
1. При стрессовых ситуациях и при тяжелых заболеваниях этим детям необходимо использовать глюкокортикоиды коротким курсом (обычно преднизолон), не более 3-5 дней, на высоте тяжести заболевания из расчета 1,5-2 мг/кг/сут per os с последующей отменой препарата без предварительного снижения дозы.
2. Подготовка детей в возрасте до 3-х лет к операции.
Затем еще 3 дня преднизолон из расчета 1,5 мг/кг/сут со снижением дозы в течение 3-х дней и с полной отменой на 7-й день. Обязатель-но проводить контроль АД.
Проводимые мероприятия позволяют избежать третично-вторичной надпочечниковой недостаточности, которая в ряде случаев может привести к смерти в связи с развитием тяжелого расстройства гемодинамики.
3. Тактика ведения детей с синдромом увеличения тимуса при обычных заболеваниях.
В питании обязательно должно быть достаточное количество животных жиров (соответствующие возрасту), продуктов содержащих аскорбиновую кислоту.
В качестве неспецифического стимулятора коры надпочечников используется солодка (глицирам по 0,025 – 0,005 2 раза в день за 30 минут до еды. Курс лечения 2 недели, или корень солодки в виде настоя 15,0:200 по 1 чайной ложке 4 раза в день, также 2 недели), для улучшения синтеза стероидных гормонов аскорбиновая кислота по 25 мг 2 раза в сутки на 10 дней. Детям можно использовать адаптогены (элеутеро-кокк 1 капля на год жизни на 2 недели).
Детям с синдромом увеличения тимуса не рекомендуется использовать аспирин, в связи с возможностью развития аспириновой астмы.
Наблюдение детей с синдромом увеличения вилочковой железы
Эти дети склонны к частым простудным и аллергическим заболеваниям. Поэтому нужен режим, правильное питание, соответствующее возрасту. Нарушение диеты недопустимо. Ребёнка с синдромом увеличения тимуса необходимо наблюдать до конца 3-го года жизни, беречь от инфекций.
Вакцинация должна проводиться в обычном режиме, по календарю. Самое важное, чтобы перед вакцинацией и в период после вакци-нации ребёнок ничем не болел.
