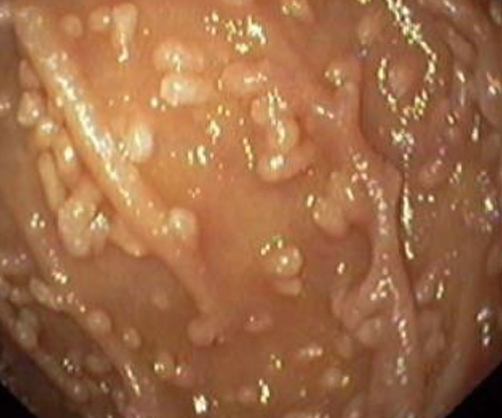
Узелковая лимфоидная гиперплазия селезенки у собаки что это
Эндоскопические методы диагностики и лечения селезенки у собак
Авторы: Позябин С. В. ФГБОУ ВПО «Московская государственная академия ветеринарной медицины и биотехнологии имени К. И. Скрябина»; Чернов А. В. Референц-клиника KARL STORZ «Эндовет» (Курган, Россия)
Ключевые слова: селезенка, собака, эндоскопия.
Сокращения: СОЭ – скорость оседания эритроцитов, УЗИ – ультразвуковое исследование, ЭКГ – электрокардиограмма.
Введение
Хирургические болезни селезенки у собак – нередко встречающаяся патология; по нашим данным, ее доля составляет 2,6 % в общей хирургической патологии органов брюшной полости. Комплексный подход, включающий в себя гематологические, сонографические и рентгенологические исследования, позволяет с достаточной точностью поставить диагноз. Однако, применяя только указанные методики исследований, невозможно с высокой степенью вероятности прогнозировать эффективность консервативного и оперативного лечения данной патологии. И, кроме того, ошибочный диагноз и неверная оценка состояния селезенки обусловят выбор неправильной хирургической тактики. Поэтому внедрение в практику высокотехнологичных и точных методов исследований, с помощью которых можно не только поставить диагноз, но и определить прогноз лечения, является актуальным направлением современной ветеринарной медицины.
Цель исследований
Разработать алгоритм диагностики хирургической патологии селезенки у собак и сравнить эффективность рентгенологического, сонографического и эндоскопического методов диагностики при данной патологии.
Материалы и методы
Материалом послужили клинически больные собаки обоего пола (n=30) разных пород и возрастов. Протокол диагностики хирургической патологии селезенки включал в себя рентгено- и сонографию селезенки, а также клинические и биохимические исследования крови (определяли количество эритроцитов, концентрацию гемоглобина, содержание гемоглобина в эритроцитах, значения гематокрита и СОЭ, как одних из важнейших показателей гемопоэтической функции селезенки, а также активность аланин- и аспартатаминотрансферазы, общего белка и соотношения альбуминов и глобулинов плазмы крови).
Для сонографических исследований использовали аппараты Mindrаy DP-6900 ( 1 )* (n=18) и Medison ( 2 )* (n=12) с конвексным и микроконвексным датчиком; для рентгенографии – рентгеновские аппараты Арман 10л-6 ( 1 ) (n=18) и Siemens D 800 S ( 2 ) (n=12). Эндоскопическое оборудование выбирали с оптикой диаметром 5 мм и углом обзора 30 градусов.
Исходя из топографии селезенки у собак, мы предложили оперативный лапароскопический доступ к данному органу с учетом необходимости осмотра всех его частей, а также большой кривизны желудка и желудочно-селезеночной связки. Проекция селезенки на переднюю брюшную стенку располагается в области левого подреберья и доходит до пупочной, иногда позади пупочной области. Поэтому предложенная схема эндоскопического исследования селезенки позволяет перейти к лапароскопическому или лапароскопически ассистированному оперативному вмешательству на данном органе.Пневмоперитонеум для лучшей визуализации органов брюшной полости и возможности выполнения манипуляций мы создавали путем абдоминоцентеза иглой Вереша, отступив каудальнее пупка приблизительно на 1/3 расстояния от него до лонных костей, используя данные топографии селезенки, полученные при сонографическом исследовании каждой конкретной собаки. При этом использовали диоксид углерода с респираторной поддержкой смесью с концентрацией кислорода 80 %. После создания карбонперитонеума в спинном положении животного с давлением в брюшной полости 6–8 мм рт. ст., немного сместившись каудальнее, вводили первый троакар и приступали к первичному осмотру селезенки. В таком положении хорошо визуализируется вся париетальная поверхность органа, структура капсулы, цвет, наличие новообразований, некрозов, а кроме того, можно адекватно оценить объем и степень спленомегалии.
Результаты
У 8 из 12 (¹), 8 из 18 (²) животных был подтвержден и уточнен с помощью морфологических и цитологических исследований (рис. 4) первичный диагноз на новообразования селезенки, причем в двух случаях в ходе эндоскопического исследования была обнаружена генерализация опухолевого процесса с вовлечением печени и лимфатических узлов желудка и брыжейки кишечника.
У 2 из 12 (¹) и 2 из 18 (²) животных после эндоскопических исследований первичный диагноз спленомегалии был уточнен: определен заворот селезенки (рис. 5), что послужило основанием для видеоассистированной хирургической операции по коррекции заворота селезенки и спленэктомии, в результате чего животные выздоровели. У 3 животных в этой группе с первичным диагнозом по результатам УЗИ «новообразование селезенки» при эндоскопии поставлен диагноз «острый инфаркт селезенки»; животным проведена видеоассистированная операция по спленэктомии.У 2 из 12 (¹) и 8 из 18 (²) животных подтвержден первичный диагноз, установленный на основании УЗИ «разрыв селезенки» и проведена эндоскопическая операция (рис.6), заключающаяся в окончательной остановке кровотечения из селезенки с помощью би- или монополярной электрокоагуляции и проведением ревизии брюшной полости.
Заключение
Разработанный нами алгоритм действий при диагностике хирургической патологии селезенки у животных заключается в первичном выполнении гематологических исследований, а также УЗИ не только селезенки, но и всех органов брюшной полости. Однако не всегда по данным гематологических и сонографических исследований удается адекватно оценить степень поражения органа, выработать адекватную схему лечения. Таким животным выполняли рентгенографию (в дорсовентральной и латеральной проекции). Патология селезенки не была верифицирована ни в одном случае, что может объективно свидетельствовать о низкой информативности рентгенографии для диагностики заболеваний селезенки у собак, что не умаляет его достоинств как метода диагностики сопутствующей патологии.
На основании предварительных данных комплексного исследования проведена лапароскопическая диагностика. Предложенный нами метод позволяет провести осмотр всего органа и выполнить необходимые манипуляции (взятие материала на гистологические и цитологические исследования, остановка кровотечения), является безопасным и эффективным при патологии данного органа. Кроме того, основываясь на данных наших исследований, можно сделать вывод, что рентгенологический метод исследования селезенки является малоинформативным, однако важен при верификации метастазов новообразований в легкие. Сонографические исследования высоко информативны при опухолевом процессе, однако не могут раскрыть причин спленомегалии и определить тип новообразования.
Таким образом, разработанный нами алгоритм визуальной диагностики селезенки, включающий гематологические, сонографические, рентгенологические и эндоскопические методики верификации диагноза при хирургической патологии селезенки у животных является наиболее эффективным и обеспечивает 100%-ю информативность.
Нодулярная лимфоидная гиперплазия (НЛГ)
Нодулярная лимфоидная гиперплазия (НЛГ) ― довольно редкое доброкачественное заболевание, характеризующееся множественными узелками в слизистой оболочке различных отделов желудочно-кишечной трубки: тонкой и толстой кишки, а также желудка.
Распространенность этого заболевания до конца неизвестна, оно достаточно часто встречается у детей до 10 лет, однако иногда может наблюдаться и у взрослых лиц.
Классификация НЛГ
Выделяют две формы заболевания:
1) Фокальная НЛГ ― представлена отдельными очагами, локализованными чаще всего в терминальном отделе подвздошной кишки, прямой кишке и других участках желудочно-кишечного тракта
2) Диффузная НЛГ ― для этой формы характерно вовлечение больших участков желудочно-кишечной трубки (например, вся тонкая кишка).
Этиопатогенез НЛГ
Патогенетические механизмы развития НЛГ до сих пор остаются неясными. Однако существуют несколько теорий, которые отличаются друг от друга в зависимости от того, имеется ли у пациента ассоциированное иммунодефицитное состояние или нет.
Так, если у пациента подтвержден иммунодефицит, то образование узелков в слизистой оболочке может быть результатом скопления предшественников плазматических клеток (неспособных к полноценному созреванию В-лимфоцитов).
НЛГ при отсутствии нарушений иммунодефицита может быть связана с иммунной стимуляцией лимфоидной ткани кишечника. Эта гипотеза предполагает наличие постоянных раздражителей (триггеров) в просвете желудочно-кишечной трубки, чаще всего инфекционного происхождения. Повторяющаяся стимуляция иммунных клеток может привести к возможной гиперплазии лимфоидных фолликулов. Такой механизм может объяснить нередкую ассоциацию лямблиоза и Helicobacter pylori с НЛГ (см.ниже).
Клинические проявления НЛГ
Зачастую НЛГ не имеет никаких симптомов и является случайной находкой во время эндоскопического исследования желудка, толстой и тонкой кишки. Однако некоторые исследователи связывают НЛГ с желудочно-кишечными симптомами, такими как хроническая диарея, боль в животе, желудочно-кишечное кровотечение (оккультное или явное, из прямой кишки) и кишечная непроходимость (очень редко). У части пациентов может отмечаться потеря белка и снижение массы тела.
Насколько велик вклад НЛГ в возникновение симптомов, до сих пор остается неясным. Является ли это состояние первопричиной жалоб или НЛГ ― всего лишь случайная находка у пациента с желудочно-кишечной симптоматикой? Вопросов больше, чем ответов.
Ассоциированные с НЛГ заболевания и состояния
Достаточно часто по сравнению с другими лицами НЛГ выявляется у пациентов с иммунодефицитами. Так, 20% больных, страдающих общим вариабельным иммунодефицитом (ОВИД), имеют НЛГ. ОВИД ― заболевание, характеризующееся снижением уровней иммуноглобулинов различных субклассов (G, A, M), нарушенным иммунным ответом из-за снижения выработки антител. Пациенты часто страдают рецидивирующими бактериальными инфекциями дыхательных путей, аутоиммунными заболеваниями и имеют повышенный риск развития онкологических патологий. НЛГ при ОВИД обычно генерализованная, с вовлечением всей тонкой кишки.
НЛГ нередко ассоциирована с селективным дефицитом IgA, который выявляется у 1 из 300-700 лиц европеоидной расы. У таких людей отмечается снижение уровня IgA в крови ниже 0,7 г/л при нормальных или даже повышенных уровнях других иммуноглобулинов. Большинство лиц с селективным дефицитом IgA бессимптомны, однако у части из них встречаются рецидивирующие инфекции верхних дыхательных путей, аутоиммунные заболевания, аллергии и желудочно-кишечные патологии (целиакия, НЛГ).
НЛГ может быть ассоциирована с лямблиозом как у лиц с нормальным иммунным ответом, так и с иммунодефицитом. Триада НЛГ + лямблиоз + снижение уровня гамма-глобулинов известна как синдром Германа (англ. Herman’s syndrome).
Инфекция Helicobacter pylori может быть причиной развития НЛГ с вовлечением желудка и 12-перстной кишки.
НЛГ также нередко встречается у лиц с ВИЧ-инфекцией, может быть ассоциирована с семейным аденоматозом толстой кишки и синдромом Гарднера.
Существуют данные о возможной ассоциации синдрома раздраженного кишечника (СРК) с НЛГ. При этом рядом авторов НЛГ рассматривается как проявление малоактивного воспаления в слизистой оболочке толстой кишке у пациентов с СРК.
Осложнения НЛГ
НЛГ ― заболевание доброкачественное, и крайне редко приводит к развитию осложнений. Однако описаны случаи кишечной непроходимости у лиц с распространенным процессом в тонкой кишке, а также кишечных кровотечений..
Известно, что у лиц с НЛГ повышается риск лимфопролиферативных заболеваний (лимфомы), однако точный риск не установлен.
Диагностика НЛГ
Существует два основных метода диагностики НЛГ:
1) Эндоскопический ― выявление узелков различных размеров (2-10 мм, в среднем 5 мм) на слизистой оболочке желудка, тонкой кишки, толстой/прямой кишки. Такие узелки (чаще всего в виде выступающих папул) могут быть обнаружены при гастроскопии (ЭГДС), колоноскопии, энтероскопии или капсульной эндоскопии.
На фото ― НЛГ в 12-перстной кишке.
2) Гистологический метод ― выявление в слизистой оболочке и в поверхностной части подслизистого слоя увеличенных (гиперплазированных) лимфоидных фолликулов, которые обычно формируют группы, и могут практически сливаться между собой.
Дифференциальный диагноз
Дифференциальный диагноз ЛНГ проводится с лимфопролиферативными заболеваниями (лимфома тонкой кишки, желудка). При локализации НЛГ в толстой кишке ее элементы (узелки) могут напоминать аденоматозные полипы.
Важно помнить, что у некоторых пациентов при проведении илеоколоноскопии в подвздошной кишке могут также выявляться лимфоидные фолликулы. В этой зоне концентрация лимфоидных фолликулов максимальная по сравнению с другими отделами кишечной трубки. При этом в отличие от НЛГ узелки (те самые лимфоидные фолликулы) небольших размеров (1-3 мм, реже больше), они располагаются отдельно друг от друга, не сливаясь, между ними видны участки нормальной слизистой. Эти изменения не следует рассматривать как патологию, они ― вариант нормы.
Лечение НЛГ
Сама по себе ЛНГ не требует лечения. В случае, если имеются ассоциированные заболевания (лямблиоз, инфекция Helicobacter pylori), следует провести терапию, направленную на удалению возбудителя.
Прогноз НЛГ
Прогноз НЛГ в целом благоприятный, в большинстве случаев требуется лишь динамическое наблюдение за пациентом.
Эндоскопические методы диагностики и лечения селезенки у собак
Ключевые слова: селезенка, собака, эндоскопия.
Сокращения: СОЭ – скорость оседания эритроцитов, УЗИ – ультразвуковое исследование, ЭКГ – электрокардиограмма.
Введение
Хирургические болезни селезенки у собак – нередко встречающаяся патология; по нашим данным, ее доля составляет 2,6 % в общей хирургической патологии органов брюшной полости. Комплексный подход, включающий в себя гематологические, сонографические и рентгенологические исследования, позволяет с достаточной точностью поставить диагноз. Однако, применяя только указанные методики исследований, невозможно с высокой степенью вероятности прогнозировать эффективность консервативного и оперативного лечения данной патологии. И, кроме того, ошибочный диагноз и неверная оценка состояния селезенки обусловят выбор неправильной хирургической тактики. Поэтому внедрение в практику высокотехнологичных и точных методов исследований, с помощью которых можно не только поставить диагноз, но и определить прогноз лечения, является актуальным направлением современной ветеринарной медицины.
Цель исследований
Разработать алгоритм диагностики хирургической патологии селезенки у собак и сравнить эффективность рентгенологического, сонографического и эндоскопического методов диагностики при данной патологии.
Материалы и методы
Материалом послужили клинически больные собаки обоего пола (n=30) разных пород и возрастов. Протокол диагностики хирургической патологии селезенки включал в себя рентгено- и сонографию селезенки, а также клинические и биохимические исследования крови (определяли количество эритроцитов, концентрацию гемоглобина, содержание гемоглобина в эритроцитах, значения гематокрита и СОЭ, как одних из важнейших показателей гемопоэтической функции селезенки, а также активность аланин- и аспартатаминотрансферазы, общего белка и соотношения альбуминов и глобулинов плазмы крови).
Для сонографических исследований использовали аппараты Mindrаy DP-6900 ( 1 )* (n=18) и Medison ( 2 )* (n=12) с конвексным и микроконвексным датчиком; для рентгенографии – рентгеновские аппараты Арман 10л-6 ( 1 ) (n=18) и Siemens D 800 S ( 2 ) (n=12). Эндоскопическое оборудование выбирали с оптикой диаметром 5 мм и углом обзора 30 градусов.
Исходя из топографии селезенки у собак, мы предложили оперативный лапароскопический доступ к данному органу с учетом необходимости осмотра всех его частей, а также большой кривизны желудка и желудочно-селезеночной связки. Проекция селезенки на переднюю брюшную стенку располагается в области левого подреберья и доходит до пупочной, иногда позади пупочной области. Поэтому предложенная схема эндоскопического исследования селезенки позволяет перейти к лапароскопическому или лапароскопически ассистированному оперативному вмешательству на данном органе.Пневмоперитонеум для лучшей визуализации органов брюшной полости и возможности выполнения манипуляций мы создавали путем абдоминоцентеза иглой Вереша, отступив каудальнее пупка приблизительно на 1/3 расстояния от него до лонных костей, используя данные топографии селезенки, полученные при сонографическом исследовании каждой конкретной собаки. При этом использовали диоксид углерода с респираторной поддержкой смесью с концентрацией кислорода 80 %. После создания карбонперитонеума в спинном положении животного с давлением в брюшной полости 6–8 мм рт. ст., немного сместившись каудальнее, вводили первый троакар и приступали к первичному осмотру селезенки. В таком положении хорошо визуализируется вся париетальная поверхность органа, структура капсулы, цвет, наличие новообразований, некрозов, а кроме того, можно адекватно оценить объем и степень спленомегалии.
Результаты
У 8 из 12 (¹), 8 из 18 (²) животных был подтвержден и уточнен с помощью морфологических и цитологических исследований (рис. 4) первичный диагноз на новообразования селезенки, причем в двух случаях в ходе эндоскопического исследования была обнаружена генерализация опухолевого процесса с вовлечением печени и лимфатических узлов желудка и брыжейки кишечника.
У 2 из 12 (¹) и 2 из 18 (²) животных после эндоскопических исследований первичный диагноз спленомегалии был уточнен: определен заворот селезенки (рис. 5), что послужило основанием для видеоассистированной хирургической операции по коррекции заворота селезенки и спленэктомии, в результате чего животные выздоровели. У 3 животных в этой группе с первичным диагнозом по результатам УЗИ «новообразование селезенки» при эндоскопии поставлен диагноз «острый инфаркт селезенки»; животным проведена видеоассистированная операция по спленэктомии.У 2 из 12 (¹) и 8 из 18 (²) животных подтвержден первичный диагноз, установленный на основании УЗИ «разрыв селезенки» и проведена эндоскопическая операция (рис.6), заключающаяся в окончательной остановке кровотечения из селезенки с помощью би- или монополярной электрокоагуляции и проведением ревизии брюшной полости.
Заключение
Разработанный нами алгоритм действий при диагностике хирургической патологии селезенки у животных заключается в первичном выполнении гематологических исследований, а также УЗИ не только селезенки, но и всех органов брюшной полости. Однако не всегда по данным гематологических и сонографических исследований удается адекватно оценить степень поражения органа, выработать адекватную схему лечения. Таким животным выполняли рентгенографию (в дорсовентральной и латеральной проекции). Патология селезенки не была верифицирована ни в одном случае, что может объективно свидетельствовать о низкой информативности рентгенографии для диагностики заболеваний селезенки у собак, что не умаляет его достоинств как метода диагностики сопутствующей патологии.
На основании предварительных данных комплексного исследования проведена лапароскопическая диагностика. Предложенный нами метод позволяет провести осмотр всего органа и выполнить необходимые манипуляции (взятие материала на гистологические и цитологические исследования, остановка кровотечения), является безопасным и эффективным при патологии данного органа. Кроме того, основываясь на данных наших исследований, можно сделать вывод, что рентгенологический метод исследования селезенки является малоинформативным, однако важен при верификации метастазов новообразований в легкие. Сонографические исследования высоко информативны при опухолевом процессе, однако не могут раскрыть причин спленомегалии и определить тип новообразования.
Таким образом, разработанный нами алгоритм визуальной диагностики селезенки, включающий гематологические, сонографические, рентгенологические и эндоскопические методики верификации диагноза при хирургической патологии селезенки у животных является наиболее эффективным и обеспечивает 100%-ю информативность.