за что отвечает 8 ген в организме
За что отвечает 8 ген в организме
Гемофилия А – это наследственное заболевание, связанное с нарушением процесса свертываемости крови. Генетической причиной заболевания являются мутации в гене F8, который отвечает за синтез 8-го фактора коагуляции крови. Этот ген расположен на половой хромосоме X, поэтому наследование заболевания различается у женщин и мужчин (X-сцепленное наследование). При этом наличие хотя бы одной копии нормального, неповрежденного гена не приводит к развитию заболевания (рецессивный тип наследования), хотя у гетерозигот по мутации в этом гене наблюдается повышенный риск кровотечений, свойственных больным гемофилией А. Все это говорит о том, что в подавляющем большинстве случаев заболевание проявляется у мужчин, так как в их генотипе всего одна X-хромосома и если на ней располагается дефектный ген, то нет второй копии, так как нет гомологичной хромосомы, которая могла бы нивелировать эффект этой мутации. При этом мальчикам X-хромосома приходит от матери, которая может быть скрытым, гетерозиготным, носителем мутации в гене F8. Заболевание в среднем встречается у 1 из 5000 мальчиков. Теоретически женщины тоже могут болеть гемофилией, однако вследствие особенности работы X-хромосом, которых в генотипе каждой женщины 2, такие случаи встречаются крайне редко.
При мутации в гене F8 c него нарабатывается дефектный белок, который не может выполнять свою функцию. Это в свою очередь приводит к нарушению работы каскада свертывания крови. Такие нарушения проявляются у больного как частые и продолжительные кровотечения даже после незначительных травм или и вовсе в отсутствии травмирующих воздействий. При тяжелых формах гемофилии А нередко развиваются угрожающие жизни кровотечения.
Примерно 50 % случаев вызваны одной из двух мутаций в гене F8, которые являются крупными перестройками. Другие мутации выявляются с помощью секвенирования кодирующей последовательности гена F8. К крупным перестройкам относятся диагностируемые данным тестом мутации: инверсии интрона 22 и интрона 1 в гене F8, ответственные за 45% и 5% случаев тяжелой формы гемофилии А, соответственно.
Инверсия, затрагивающая 22 интрон, происходит из-за того, что между определенным участком 22 интрона (Int22h1) гена F8 и очень похожим на него участком ДНК в теломерной области Х-хромосомы (Int22h2 и Int22h3) может происходить взаимообмен на разных стадиях формирования клеток. Такая перестройка гена влечет за собой существенное нарушение синтеза белка-продукта гена F8.
При инверсии, затрагивающей 1-й интрон гена F8, не происходит считывания первых 9-ти экзонов гена, что приводит к формированию неполноценного белка, который не может выполнять свою функцию.
Для анализа наличия инверсии интрона 1 в лаборатории Genetico используется метод с использованием классической полимеразной цепной реакции (ПЦР). Для детекции инверсии 22 интрона – специально разработанная ПЦР длинных фрагментов, которая позволяет выявлять более крупные перестройки, чем обычная ПЦР, что необходимо при анализе инверсии 22 интрона гена F8.
Для проведения исследования необходимо сдать кровь из вены.
В день сдачи биоматериала для анализа не рекомендуется употреблять жирную пищу.
Для проведения исследования необходимо сдать кровь из вены.
В день сдачи биоматериала для анализа не рекомендуется употреблять жирную пищу.
В случае выявления мутации в гене F8 в результате обследования предоставляется информация об обнаруженном нарушении ДНК с указанием генотипа пациента.
Болезнь Альцгеймера: ген, от которого я без ума
Болезнь Альцгеймера, настигающая большинство людей в старости, является одной из самых острых проблем здравоохранения
Автор
Редакторы
В начале XX века с помощью немецкого психиатра Алоиса Альцгеймера мир узнал о существовании новой нейродегенеративной болезни. И хотя долгое время исследователи не воспринимали генетическую предрасположенность в качестве важного фактора для развития болезни Альцгеймера, вскоре ситуация изменилась. Однако и сейчас о природе этого заболевания идут ожесточенные споры: кто же во всем виноват — β-амилоид или APOE4?
Бета-амилоид, образующий при болезни Альцгеймера нерастворимые бляшки в нервных клетках, традиционно считался основной причиной нейротоксичности при этом заболевании, однако в действительности дело обстоит не так просто. В частности, токсичными могут быть не только фибриллярные, но и промежуточные сферические агрегаты Aβ (см. «Альцгеймеровский нейротоксин: ядовиты не только фибриллы» [14]), на вероятность развития БА положительно влияет недосып (см. «Новый шаг к пониманию болезни Альцгеймера: возможно, недосыпание является одним из факторов риска» [15]), ну а на сладкое — в реальности бета-амилоид может быть вообще не нейротоксином, а компонентом врождённого иммунитета в нервной системе человека (см. «Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета» [16]). — Ред.
Профессор Роузес сразу понял, что его коллега нашел нечто важное. Двумя годами ранее ими было обнаружено, что экспрессия некоторых генов из хромосомы 19 способствует развитию деменции, а поскольку Роузес знал, что ген, кодирующий ApoE, также находится на этой хромосоме, его молниеносно осенила идея участия ApoE в развитии болезни Альцгеймера (БА).
В организме человека есть три варианта гена APOE, кодирующих изоформы белка Е2, Е3 и Е4, и Роузес решил выяснить их влияние на развитие болезни Альцгеймера. Для определения отдельных аллелей нужно было провести полимеразную цепную реакцию (ПЦР) [17]. Так как ученый имел весьма скромный опыт работы с ПЦР, он хотел привлечь в свою команду нейрофизиологов, но получил отказ: хотя они и были заняты охотой за генами, которые лежат в основе болезни Альцгеймера, АРОЕ показался им неподходящим кандидатом. Роузес вспоминает, как позже в лаборатории ходили разговоры: «. начальник совсем потерял голову от своих безумных идей».
Но Роузес не сдавался. Он попросил помощи у своей жены, генетика Энн Сондерс (Ann Saunders), которая использовала ПЦР в своих исследованиях. Она только что родила дочь и была в декретном отпуске, и потому они заключили соглашение. «Она сделала все эксперименты, пока я присматривал за ребенком», — говорит профессор. В течение трех недель супруги собрали данные, которые в дальнейшем легли в основу серии знаковых публикаций. Они выяснили, что аллель APOE4 способствует развитию БА [1].
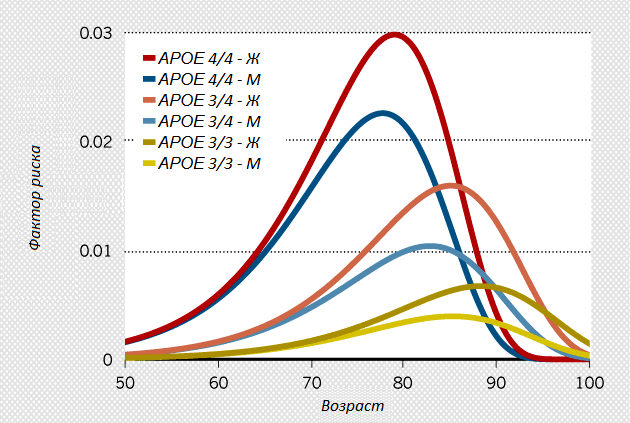
Сегодня, двадцать лет спустя, APOE4 остается ведущим фактором риска для наиболее распространенной формы деменции. Наследование одной копии APOE4 вчетверо повышает риск возникновения заболевания, двух копий — в 12 раз (рис. 1). Однако данные Роузеса в основном не воспринимали всерьез или критиковали. Впоследствии, даже когда мнение об ApoE поменялось, большинство ученых все равно продолжали работать с β-амилоидом, как бы «зациклившись» на классике. Но некоторые лаборатории все равно исследовали ApoE, несмотря на равнодушие финансирующих учреждений и научного сообщества и на отсутствие ресурсов, необходимых для проведения масштабных экспериментов.
Рисунок 1. Носители аллеля APOE4 более подвержены развитию болезни Альцгеймера по сравнению с теми, кто унаследовал две копии аллеля APOE3
Долгое время было неизвестно, какие функции белок ApoE выполняет в головном мозге, и постепенно эта головоломка стала интересовать многих нейрофизиологов. Интерес к липопротеинам продолжал расти, — отчасти потому, что клинические испытания лекарств, нацеленных на β-амилоид, часто заканчивались неудачей. Многие исследователи начали скрупулезно изучать белок ApoE4 и, как следствие, привлекли внимание фармацевтических компаний. «Амилоидные подходы» постепенно перестали использовать, зато начали разрабатывать препараты, направленные на аполипопротеин.
«Несмотря на отсутствие уверенных доказательств, амилоидная гипотеза стала в свое время сильным научным постулатом», — говорит Завен Хачатурян, президент некоммерческой компании «Предотвратим Болезнь Альцгеймера» (Prevent Alzheimer’s Disease 2020) и бывший координатор деятельности, связанной с исследованием БА в Национальных институтах здоровья США. До недавнего времени, по его словам «никто не пытался задать фундаментальный вопрос — правильно ли мы определили основную предпосылку болезни?».
Жесткая конкуренция
Существуют разные доводы относительно того, почему открытие Роузеса было проигнорировано. Многие сходятся во мнении, что генетик выбрал неудачное время для обнародования своих результатов. В 1991 году Джон Харди (John Hardy) и Дэвид Олсоп (David Allsop) предложили «гипотезу амилоидного каскада». Они утверждали, что болезнь Альцгеймера является результатом аномального накопления β-амилоидных бляшек в тканях мозга [3]. Научное сообщество поддержало предложенную идею, которую вскоре начали активно финансировать.
Но Роузес не подписался под этой теорией: «. амилоиды являются одними из многих веществ, которые формируют бляшки; в конечном итоге они разрушают клетки и вызывают атрофию мозга. У меня и мысли не было, что это было причиной деменции». Говоря так, он, возможно, хотел скрыть возможную связь ApoE/Аβ, и случайно создал конкуренцию между двумя гипотезами за финансирование. К сожалению, Роузес так и не получил гранты для работы с ApoE.
Были и технические препятствия для изучения ApoE. Белок входит в состав различных липопротеинов плазмы крови и является довольно сложной фармакологической мишенью при работе с головным мозгом. ApoE имеет липофильную часть и поэтому при биохимическом анализе может агрегировать с другими молекулами. Работа с такими белками требует глубокого понимания биохимии липопротеинов и методик работы с ними.
Три оставшихся препарата, которые нацелены на β-амилоид, в настоящее время проходят испытания на больных, а также на людях с высоким риском БА, у которых еще не развились симптомы. Позитронно-эмиссионная томография показала, что мозг подопытных с высоким риском развития БА отличается от здорового мозга за десятилетия (!) до того, как начинает накапливаться β-амилоид или разрушаться нейроны [4]. В результате исследований, которые будут проводиться в течение следующих шести лет, ученые поймут, способны ли данные лекарства отсрочить наступление заболевания или нет. Среди исследователей и представителей фармацевтической индустрии появилось ощущение, что это — последний шанс для амилоидной гипотезы. На фоне этих сомнений ApoE вновь оказался в центре внимания.
По словам Мака, если испытания закончатся неудачей, ученые будут отчитываться перед инвесторами, предоставляя все данные доклинических и ранних клинических испытаний. Он надеется, что исследователи АроЕ вскоре получат большое преимущество. Несмотря на препятствия в этой области, у ученых продолжает крепнуть подозрение, что именно ApoE4 является предпосылкой для возникновения болезни. Этот факт подтверждают группы Мака и Гольцмана (Holtzman) в опытах на трансгенных мышах, которые несут в себе изоформы ApoE человека.
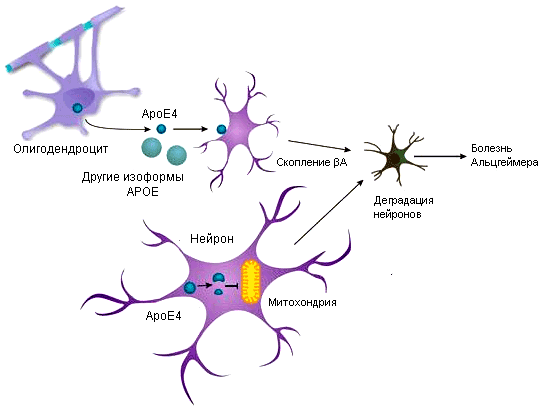
Скорее всего, ApoE участвует в развитии БА двумя различными путями, один из которых — амилоид-зависимый. И у животных, и у человека ApoE4 способствует отложению Aβ в мозговом веществе, в то время как ApoE3 считается «нейтральной» изоформой, а ApoE2 — «защитной» формой, уменьшающей накопление бляшек [5]. «Это достаточно убедительные данные», — говорит Хольцман.
Другой механизм не предусматривает взаимосвязи с амилоидом. Когда нейроны находятся в состоянии стресса, они экспрессируют ApoE для своего восстановления. «Плохая» форма — ApoE4, — как правило, разрушается на токсичные фрагменты, которые повреждают митохондрии и модифицируют цитоскелет.
Рисунок 2. Две расходящиеся гипотезы о том, как АроЕ способствует болезни
Оценить вклад этих двух механизмов в риск развития болезни Альцгеймера крайне сложно, говорит Хольцман, но он и его коллеги считают, что трансформация вредоносной изоформы ApoE в «нейтральную» может стать перспективным подходом для лечения БА. В Гладстоне исследователи начали изучать этот вопрос, и уже найдены небольшие регуляторные молекулы, которые трансформируют ApoE4 в ApoE3-образный белок и тем самым снижают аномальную фрагментацию первого [7]. В культуре клеток даже низкие концентрации этих молекул могут уменьшить разрушение митохондрий и дисфункцию нейронов [8]. В настоящее время эти молекулы проходят испытания на животных, и если они в конечном счете окажутся безопасными и эффективными, врачи будут назначать их пациентам, предрасположенных к БА, так же, как статины — больным с высоким уровнем холестерина и с повышенным риском сердечно-сосудистых заболеваний.
Более чем достаточно
Несмотря на отсутствие грантов на исследования ApoE, Роузес никогда не сдавался. Но через несколько лет, когда его группа обнаружила связь между ApoE и болезнью Альцгеймера, он устал от постоянного денежного противостояния и оставил науку. Проработав в фармацевтической индустрии десять лет, в течение которых он не переставал исследовать ApoE, в 2008 году он снова возвращается в Дьюковский университет.
В 2009 году его группа описала участок некодирующей ДНК с геном TOMM40, который располагается рядом с APOE на девятнадцатой хромосоме. Этот участок ДНК (сокращенно — 523) варьирует по длине и, в зависимости от этого, может определять уровень экспрессии генов TOMM40 и АРОЕ [9].
По словам Роузеса, это было важное открытие, так как белок, кодируемый геном TOMM40 — Tom40, — является необходимым для «здоровых» митохондрий. Tom40 образует канал во внешней митохондриальной мембране, через который импортируются белки, необходимые для нормального деления этой органеллы. «Мы знали о существовании такого механизма в течении 10 лет, — говорит ученый, — но то, что он приводит к болезни Альцгеймера, мы и не подозревали».
Роузес продолжал утверждать, что участок 523 можно использовать для разработки терапии и более точного предсказания болезни. Подавляющее большинство людей рискует встретиться со своим Альцгеймером, если только проживет достаточно долго, а ведь носителями аллеля APOE4 являются только 25% населения. Значит, тест на носительство этого аллеля никогда не будет до конца точным предиктором. Но генотипирование по обоим генам — АРОЕ и TOMM40 — может существенно увеличить точность, как говорит Роузес. В его лаборатории открыли, что APOE3 — наиболее частая изоформа — обычно наследуется вместе или с коротким, или с очень длинным участком 523. И у носителей двух аллелей APOE3 возраст наступления заболевания будет зависеть от конкретного варианта участка 523, наследуемого вместе с APOE.
Некоторым лабораториям удалось найти доказательства, подтверждающие гипотезу Роузеса, однако у других повторить исследования на TOMM40 так и не удалось, и возникли сомнения в реальности влияния этого гена на риск развития БА [10]. Однако Роузес не сомневается в правильности своих гипотез и считает, что геномные исследования, не подтвердившие его результатов, обладали недостаточной силой для выявления сцепливания TOMM40 и болезни Альцгеймера.
Роузес надеется, что вскоре он сможет подкрепить свои результаты клиническими исследованиями, которые будут проводиться в основанной им компании Zinfandel Pharmaceuticals. Вместе с японской фармацевтической компанией Takeda Зинфандель в настоящее время финансирует фазу III клинических испытаний (под названием TOMMORROW), призванную проверить идеи Роузеса на деле. TOMMORROW должна оценить риски развития БА в зависимости от возраста пациента и вариантов APOE и TOMM40. Для запуска программы будут отобраны около 6000 здоровых пожилых людей, и исследования будут продолжаться около 5 лет.
Программа будет также исследовать возможность того, что пиоглитазон — препарат для лечения пациентов с сахарным диабетом 2 типа, — в малых дозах будет задерживать развитие БА у лиц, отнесенных к группе высокого риска развития болезни Альцгеймера. Проверка этой идеи вызвана тем, что опубликованы результаты опытов на животных и даже на людях, которые говорят о способности пиоглитазона предотвращать или уменьшить патологию и симптомы, связанные с болезнью Альцгеймера [11]. Роузес думает, возможный механизм этого — стимуляция деления митохондрий.
Даже если получить мощное лекарство против болезни Альцгеймера так и не удастся, толк в этих испытаниях все равно будет: научившись задерживать развитие БА хотя бы на два года, можно уменьшить число больных в США через 50 лет на 2 млн. человек, что очень и очень неплохо [12]. Кроме того, результаты этих испытаний заставят исследователей всего мира по-новому взглянуть на деменцию. Такое сложное расстройство, как болезнь Альцгеймера, нельзя изучать только с одной стороны, — пусть и включающей ApoE4 или еще что-нибудь. По-видимому, нейрофизиологи близки к тому, чтобы признать ограниченность своих прежних взглядов и частично пересмотреть их, направив исследования по новым дорожкам, в конце которых будет разгадка проблемы, лишающей нас ума.
По материалам рубрики News Feature в Nature [13].
Сколько у нас генов?
Сколько у нас генов?
Найти ответ на этот вопрос оказалось куда сложнее, чем кто-либо предполагал
Автор
Редактор
Статья на конкурс «био/мол/текст»: Это интересный вопрос, ответ на который должен был дать проект «Геном человека», завершившийся в 2003 году. После того как ученые получили основную информацию о геноме человека, они попытались определить число генов, но эта задача оказалось не такой простой. Цель настоящей статьи — суммировать и проанализировать научные данные по составлению каталога генов у человека.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2018.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Как же мало известно о генах! Первый раз я остро ощутила это, находясь на практике в лаборатории медицинской генетики Харбинского медицинского университета. Исследовательская группа, где я проходила стажировку, занималась изучением онкогена Sei-1, который индуцирует образование двухминутных хромосом (DM), что способствует развитию онкогенеза. Однако механизм образования онкогена Sei-1 остается неизвестным до сих пор. А ведь различные мутации генов являются причиной возникновения и других опасных заболеваний человека, помимо рака. Итак, в данной статье мы изложим некоторые соображения о том, почему мы все еще многое не знаем о генах, а также сформулируем наше мнение о том, сколько генов у человека.
В 1977 году Фредерик Сэнгер впервые разработал метод секвенирования ДНК [1], основанный на терминации ДНК-полимеразной реакции с помощью дидезоксинуклеотидов, за что в 1980 году был удостоен Нобелевской премии в области химии. В этом же году Нобелевскую премию получили Максам и Гилберт, которые предложили метод секвенирования ДНК путем химической деградации. В 1985 году была выявлена первая полная последовательность ДНК бактерии (Haemophilus influenzae), в 1996 году получен первый геном эукариотической клетки (дрожжи Saccharomyces ceravisiae), а в 1998 году расшифрован геном дождевого червя (Caenorhabditis elegans). Завершение в 2003 году проекта «Геном человека» привело к публикации полной последовательности человеческого генома. Но «полной» ее можно назвать весьма условно, учитывая, что около 8% не секвенировано и по сей день [2].
Проект «Геном человека» и полный список генов
Выявление полного списка генов необходимо для выяснения молекулярных механизмов возникновения и развития рака, шизофрении [3], деменции, а также многих других заболеваний человека. Секвенирование ДНК, выделенной из тканей больных, позволяет выявлять такие мутации, как нуклеотидные замены, делеции и вставки, ответственные за возникновение этих заболеваний.
Рисунок 1. Арт-проект на выставке «Геном — расшифровка кода жизни» в Национальном музее естественной истории в Вашингтоне
Собственно, ради этого и затевался проект «Геном человека» (Human genome project, HGP), который продолжался с 1990 по 2003 год. Его основной задачей было определение нуклеотидной последовательности ДНК человека и локализации 100 000 человеческих генов (как тогда полагали) [4]. Параллельно с этим планировалось изучить ДНК набора модельных организмов, чтобы получить сравнительную информацию, необходимую для понимания функционирования генома человека. Предполагалось, что информация, полученная в результате HGP, станет настольной книгой для биомедицинской науки в XXI веке [5]. Целями данных исследований являлось получение информации о причинах ряда болезней [6] и, в конечном итоге, разработка способов лечения более чем 4000 генетических заболеваний, которые затрагивают человечество, включая многофакторные, в которых генетическая предрасположенность играет важную роль. Считалось, что результаты секвенирования генома позволят определить локализацию каждого гена и их общее количество. Однако последовавшие за этим события доказали обратное: сегодня существует несколько баз данных генов, которые существенно отличаются друг от друга. Причем число белок-кодирующих генов совпадает, а число генов других типов расходится.
Проект «Протеом человека»
В 2010 году по инициативе Организации по изучению протеома человека (Human proteome organization, HUPO) был начат проект «Протеом человека» (HPP), целью которого является создание полного списка белков вида Homo sapiens [7]. Для этого, во-первых, предполагается идентифицировать и охарактеризовать, по крайней мере, по одному белковому продукту белок-кодирующих генов, их однонуклеотидные полиморфизмы и варианты сплайсинга, а также виды посттрансляционной модификации белков [8]. Во-вторых, данные протеомики, полученные в результате реализации HPP, способствуют, в дополнение к геномным данным, решению различных биомедицинских задач и созданию новых аннотированных баз знаний, таких как neXtProt [9].
В настоящее время neXtProt содержит информацию о 17 487 белках, существование которых экспериментально подтверждено, 1728 белках, подтвержденных на уровне транскриптов, 515-и, определенных на основании гомологии, 76-и предсказанных и 571-м неизвестной природы. Особый интерес вызывают белки, существование которых экспериментально не доказано, хотя данные о том, что они кодируются геномом, существуют. Это так называемые «потерянные» белки, которые составляют примерно 18% всех кодируемых белков. Для выявления и характеристики таких белков создан ресурс MissingProteinPedia [7].
«Протеом человека» является продолжением проекта «Геном человека». Предполагается, что благодаря проекту по изучению протеома мы узнаем точное количество белок-кодирующих генов, что впоследствии позволит понять, сколько всего генов у человека.
Немного о РНК
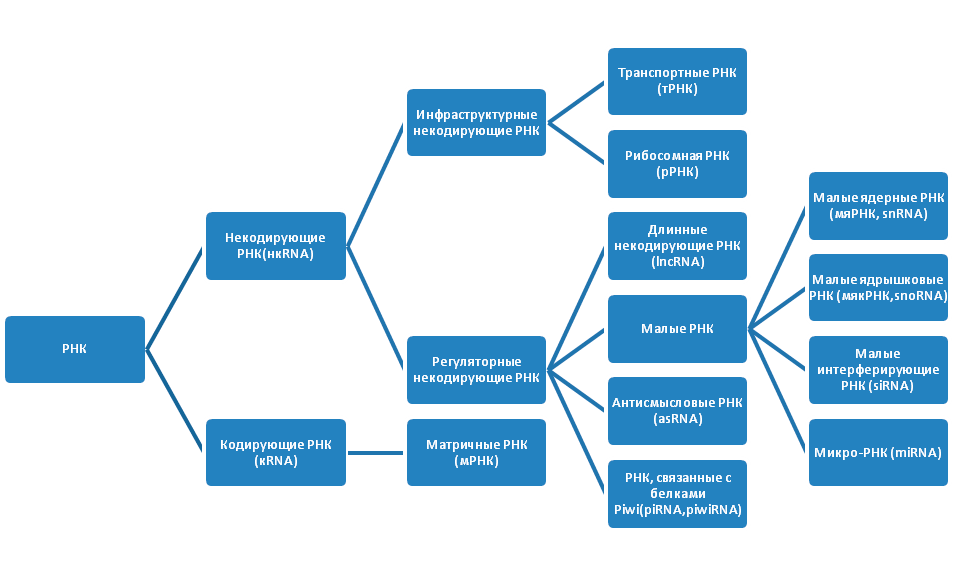
Проект «Геном человека» показал, что молекулы РНК также важны для жизни, как и ДНК. Внутри клеток существует множество РНК (рис. 2). Изначально РНК подразделяются на некодирующие РНК (нкРНК), которые не транслируются в белки, и кодирующие РНК (мРНК), служащие матрицей для синтеза полипептидных цепей белка. Некодирующие РНК имеют более сложную классификацию. Они бывают инфраструктурными и регуляторными. Инфраструктурные РНК представлены рибосомными РНК (рРНК) и транспортными РНК (тРНК). Молекулы рРНК синтезируются в ядрышке и составляют основу рибосомы, а также кодируют белки субъединиц рибосомы. После того, как рРНК полностью собраны, они переходят в цитоплазму, где в качестве ключевых регуляторов трансляции, участвуют в чтении кода мРНК. Последовательность из трех азотистых оснований в мРНК указывает на включение определенной аминокислоты в последовательность белка. Молекулы тРНК, приносят указанные аминокислоты на рибосомы, где синтезируется белок.
Рисунок 2. Виды РНК
рисунок автора статьи
Регуляторные нкРНК очень широко представлены в организме, классифицируются в зависимости от размера и выполняют ряд важных функций (табл. 1).
| Название | Обозначение | Длина | Функции | |
|---|---|---|---|---|
| Длинные некодирующие РНК | днкРНК, lncRNA | 200 нуклеотидов | 1. Регулируют избирательное метилирование ДНК, направляя ДНК-метилтрансферазу 2. Руководят избирательной посадкой репрессорных комплексов polycomb | |
| Малые РНК | Малые ядерные РНК | мяРНК, snRNA | 150 нуклеотидов | 1. Участвуют в сплайсинге 2. Регулируют активность факторов транскрипции 3. Поддерживают целостность теломер [13] |
| Малые ядрышковые РНК | мякРНК, snoRNA | 60–300 нуклеотидов | 1. Участвуют в химической модификации рРНК, тРНК и мяРНК 2. Возможно, участвуют в стабилизации структуры рРНК и защите от действия гидролаз | |
| Малые интерферирующие РНК | миРНК, siRNA | 21–22 нуклеотидов | 1. Осуществляют антивирусную иммунную защиту 2. Подавляют активность собственных генов | |
| Микро-РНК | мкРНК, miRNA | 18–25 нуклеотидов | Подавляют трансляцию путем РНК-интерференции | |
| Антисмысловые РНК [14] | asRNA | 1. Короткие: менее 200 нуклеотидов 2. Длинные: более 200 нуклеотидов | Блокируют трансляцию, образуя гибриды с мРНК | |
| РНК, связанные с белками Piwi | piRNA, piwiRNA | 26–32 нуклеотидов | Их также называют «стражами генома», они подавляют активность мобильных генетических элементов во время эмбриогенеза | |
Проблема терминологии
Прежде чем ответить на вопрос: «Сколько у нас генов?», нужно понять, что же такое ген?
Основное внимание HGP было направлено на белок-кодирующие гены [15]. Однако, как было указано в первоначальном докладе HGP в 2001 году, «тысячи генов человека продуцируют некодирующие РНК (нкРНК), являющиеся их конечным продуктом», хотя на тот момент было известно около 706 генов нкРНК [2]. В своей недавней статье, опубликованной в журнале BMC Biology Стивен Зальцберг (Steven L. Salzberg) дает следующее определение гена [16]:
Ген любой участок хромосомной ДНК, который транскрибируется в функциональную молекулу РНК или сначала транскрибируется в РНК, а затем транслируется в функциональный белок.
Это определение включает как гены некодирующих РНК, так и белок-кодирующие гены, и позволяет определять все варианты альтернативного сплайсинга в одном локусе как варианты одного и того же гена. Это позволяет исключить псевдогены – нефункциональные остатки структурных генов, утратившие способность кодировать белок.
Результаты двух первых исследований свидетельствовали о наличии у человека 31 000 [2] и 26 588 белок-кодирующих генов [17], а в 2004 появилась полная последовательность генома человека [4], и авторы подсчитали, что полный каталог насчитывает 24 000 белок-кодирующих генов. Каталог человеческих генов Ensembl включает 22 287 белок-кодирующих генов и 34 214 транскриптов [18].
Секвенирование нового поколения (NGS)
Появление высокопроизводительных методов параллельного секвенирования (в ходе такого секвенирования миллионы фрагментов ДНК из одного образца секвенируются одновременно) или секвенирования нового (следующего) поколения (next-generation sequencing, NGS) [1] позволило значительно ускорить поиск функциональных участков генома [4]. Биотехнологические компании разработали и коммерциализировали различные платформы для NG-секвенирования, позволяющие секвенировать от 1 млн до десятков млрд коротких последовательностей (ридов, reads) длиной 50–600 нуклеотидов каждая. К наиболее популярным платформам относятся такие, как Illumina и IonTorrent, использующие амплификацию ДНК с помощью ПЦР [19], а также платформы одномолекулярного секвенирования, такие как Helicos Biosciences HeliScope, Pacific Biosciences SMRT (single molecule real-time sequencing), и нанопорового секвенирования Oxford Nanopore, осуществляющие секвенирование в реальном времени и позволяющие прочитывать значительно более длинные риды — до 10–60 тыс. нуклеотидов. Кроме того, изобретение секвенирования РНК (RNA-seq) в 2008 году, которое создавалось для количественного определения экспрессии генов, также способствовало обнаружению транскрибируемых последовательностей, как кодирующих, так и некодирующих РНК [20].
Благодаря NGS, базы данных днкРНК и других генов РНК (таких как микро-РНК) резко выросли за десятилетие, и текущие каталоги генов человека теперь содержат больше генов, кодирующих РНК, чем белки (табл. 2).
| Типы генов | Gencode | Ensembl | RefSeq | CHESS |
|---|---|---|---|---|
| Белок-кодирующие гены | 19 901 | 20 376 | 20 345 | 21 306 |
| Гены длинных некодирующих РНК | 15 779 | 14 720 | 17 712 | 18 484 |
| Антисмысловые РНК | 5501 | — | 28 | 2694 |
| Другие некодирующие РНК | 2213 | 2222 | 13 899 | 4347 |
| Псевдогены | 14 723 | 1740 | 15 952 | — |
| Общее число транскриптов | 203 835 | 203 903 | 154 484 | 323 827 |
Рисунок 3. Последовательность ДНК, получаемая после секвенирования человеческого генома
В ходе секвенирования РНК обнаружилось, что альтернативный сплайсинг, альтернативное инициирование транскрипции и альтернативное прерывание транскрипции проиcходят гораздо чаще, чем полагали, затрагивая до 95% человеческих генов. Следовательно, даже если известно местоположение всех генов, сначала нужно выявить все изоформы этих генов, а также определить, выполняют ли эти изоформы какие-либо функции или они просто представляют собой ошибки сплайсинга.
Базы данных генов человека
Задача по составлению каталога всех генов по-прежнему не решена. Проблема заключается в том, что за последние 15 лет только две исследовательские группы составили список доминантных генов: RefSeq, которая поддерживается Национальным центром биотехнологической информации (NCBI) при Национальных институтах здоровья (NIH), и Ensembl/Gencode, которая поддерживается Европейской молекулярно-биологической лабораторией (EMBL). Однако, несмотря на большой прогресс, сейчас в каталогах различается количество белок-колирующих генов, генов длинных некодирующих РНК, псевдогенов, а также варьирует количество антисмысловых РНК и других некодирующих РНК (табл. 2). Каталоги еще дорабатываются: например, в прошлом году сотни генов, кодирующих белок, были добавлены или удалены из списка Gencode. Эти разногласия объясняют проблему создания полного каталога человеческих генов.
В 2017 году была создана новая база данных генов человека — CHESS. Примечательно, что она включает все белок-кодирующие гены как Gencode, так и RefSeq, так что пользователям CHESS не нужно решать, какую базу данных они предпочитают. Бóльшее количество генов может вызывать больше ошибок, но создатели считают, что бóльший набор окажется полезным при исследовании болезней человека, которые еще не отнесены к генетическим. Набор генов CHESS в настоящее время в версии 2.0 еще не окончательный, и, безусловно, создатели работают над его усовершенствованием.
Таким образом, все еще неизвестно, сколько всего генов у человека. Существует ряд проблем, затрудняющих эту задачу. Например, многие гены (особенно, гены днкРНК), видимо, имеют высокую тканеспецифичность. Из этого следует, что пока ученые подробно не исследуют все типы клеток человека, они не могут быть уверены, что обнаружили все человеческие гены и транскрипты. Безусловно, сегодня знания о человеческих генах стали значительно обширнее, чем в начале проекта «Геном человека», а технологии совершеннее. Это дает надежду на то, что в скором времени мы узнаем точный ответ на поставленный вопрос.