за что отвечают макрофаги
Функции макрофагов в различных условиях микроокружения опухоли
Связанные с опухолью макрофаги, как известно, стимулируют ключевые этапы прогрессирования опухоли. В этом обзоре рассказывается о многочисленных экспериментальных и клинических исследованиях, проведенных с целью изучения функций, регуляции и клинической значимости опухолевых макрофагов. В отношении клинической значимости наиболее интересны три участка инвазии раковых клеток: опухолевые гнезда, пограничная зона между стромой и опухолевыми клетками, а также области, близкие к сосудистой сети опухоли или удаленные от нее. Более полное понимание разнообразия опухолевых макрофагов может привести к разработке избирательных методов лечения, основанных на восстановлении противораковых функций этих клеток.
Вступление
Опухолевые макрофаги (ОМ) изобилуют в большинстве типов злокачественных новообразований, способствуют опухолевому ангиогенезу, выходу раковых клеток из опухоли в кровоток, способствуют их выживанию и постоянному росту в метастатических колониях, подавлению противоопухолевых иммунных механизмов. В то же время ОМ могут подавлять, дополнять или опосредовать противоопухолевые эффекты цитотоксических агентов, лучевой терапии, антиангиогенных препаратов и ингибиторов контрольных точек.
Происхождение этих клеток в настоящее время является предметом обсуждения. Недавние исследования показали, что макрофаги во многих тканях происходят не из циркулирующих моноцитов, как первоначально предполагалось, а из эмбриональных макрофагов (особенно из макрофагов желточного мешка), которые закладываются в тканях во время развития. Эти предшественники остаются в тканях взрослого организма и размножаются, таким образом, сохраняясь независимо от гемопоэтической системы взрослого человека. В некоторых органах, например, в кишечнике, основные популяции макрофагов развиваются путем рекрутирования моноцитов. Выборочное истощение каждого из этих двух подтипов ОМ показало, что только эмбриональные макрофаги поддерживают опухолевый рост.
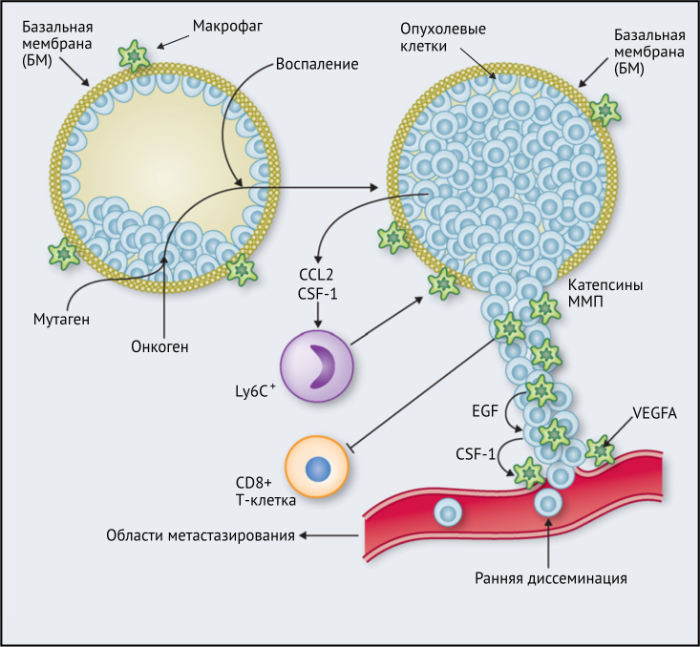
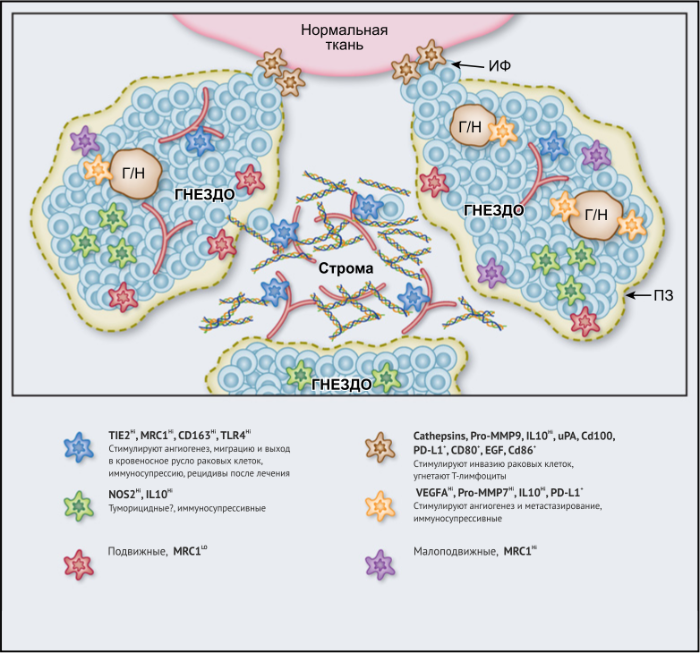
ОМ могут находиться в различных состояниях активации. Обычно они отклоняются от «классически» активированного, агрессивного по отношению к опухоли фенотипа (иногда называемого M1) в сторону «альтернативно» активированного опухолевого промотора (M2). Однако как и макрофаги во многих других тканях, ОM обладают замечательной функциональной пластичностью и часто экспрессируют маркеры, характерные для обоих состояний активации, что делает такой полярный подход к их классификации неточным. Предполагается, что функции ОМ могут, по крайней мере частично, регулироваться их расположением в опухоли; что они проявляют разные функции по меньшей мере в трех областях инвазии раковых клеток: области высокой плотности раковых клеток (так называемом «опухолевом гнезде»); периваскулярной (ПВ) нише; и плохо васкуляризованных гипоксических/некротических областях опухоли (Рис.1 и 2).
Области инвазии
Существует по крайней мере три основных локализации, в которых прогрессия опухоли была ассоциирована с повышенной инвазией клеток.
Результаты исследований, проведенных на мышах, показывают, что макрофаги способствуют развитию злокачественных опухолей различными способами: реконструируют внеклеточный матрикс, опосредуют разрушение базальной мембраны, увеличивают подвижность раковых клеток, и их способность к миграции, способствуют прогрессированию преинвазивных поражений, выделяют фактор роста эндотелия сосудов A (VEGF-A). Макрофаги вокруг преинвазивных поражений молочных желез у мышей высвобождают CXCR2-связывающие хемокины CXCL1 и CXCL5, которые способствуют миграции и инвазии соседних предростопластических (предраковых) эпителиальных клеток. В то же время подавление активности макрофагов вызывало замедление развития инвазии опухолевых клеток и развития опухоли в целом.
Недавнее исследование на модели рака легких Kras G12D показало, что нарушение регуляции онкогенов, таких как Myc, в раковых клетках вызывает трансформацию медленно прогрессирующей аденомы легкого в агрессивную аденокарциному. Это связано с тем, что изменения в Myc стимулировали увеличение экспрессии CCL9 и IL-23 эпителиальными клетками легких. CCL9 затем стимулировал накопление VEGFA + макрофагов и, следовательно, ангиогенез опухоли, а также PD-L1-зависимое вытеснение T- и B-клеток. Кроме того, IL-23 стимулировал гибель Т- и В-клеток и цитотоксических NK-клеток (Рис.1).
Следует отметить, что антитела против CD68 продолжают широко использоваться в качестве иммунных меток ОМ в опухолях (Таблица 1). Однако как и многие другие антитела, маркирующие отдельные типы клеток, человеческие анти-CD68 иногда маркируют клетки, отличные от ОM. Например, методом качественного анализа с помощью иммуноокрашивания удалось установить, что некоторые клетки CD68 + в опухолях молочной железы человека не экспрессируют рецептор к КСФ-1 (КСФ-1Р), CD45 или другие маркеры эпителиальных клеток, эндотелиальных клеток или клеток стенок сосудов (то есть гладкомышечных клеток, перицитов или фибробластов). Остается неизвестной как принадлежность этих клеток, так и то, маркируются ли они антителами к CD68 иного происхождения.
ОМ в ИФ опухоли поджелудочной железы RIP1-Tag2 мыши усиливают инвазивный потенциал раковых клеток посредством экспрессии катепсинов B и S, двух ферментов, регулируемых IL-4, высвобождаемым раковыми клетками и инфильтрирующими опухоль Т-клетками. Кроме того, было показано, что CD4 + Т-клетки в опухолях MMTV-PyMT увеличивают инвазивность раковых клеток благодаря IL-4, что затем стимулирует ОM экспрессировать эпидермальный фактора роста (EGF).
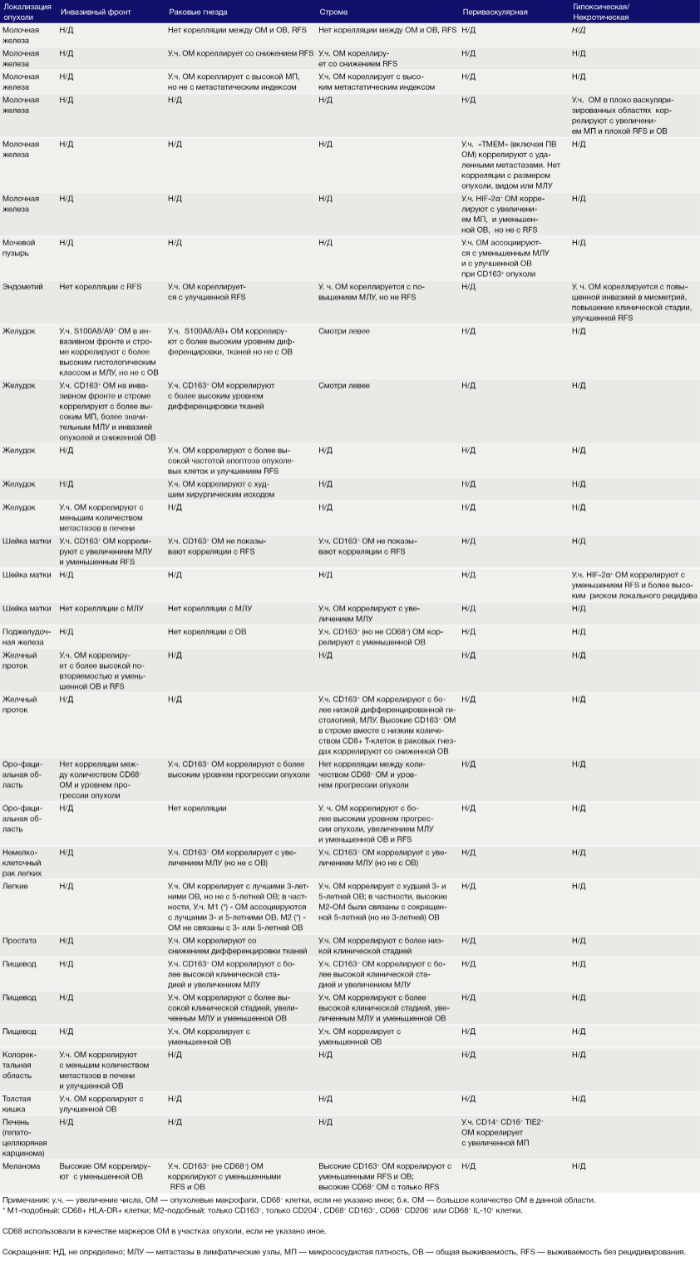
Эти экспериментальные данные хорошо согласуются с данными исследований, согласно которым ОM в ИФ опухолей желудка человека выделяют MMP9 — фермент, разрушающий матрикс, — и рецептор сериновых протеаз, урокиназный активатор плазминогена (УАП, урокиназа). Интересно, что ОМ вдоль ИФ первичной карциномы толстой кишки экспрессируют CD80 и CD86 (костимуляторные сигналы, необходимые для активации Т-клеток), что указывает на то, что они могут иметь потенциал для стимулирования противоопухолевого иммунитета при этом типе рака. Это может объяснить наблюдение, что повышенное количество CD68 + ОM в ИФ колоректальных опухолей человека коррелируют с более высокой выживаемостью без рецидива (RFS) (Таблица 1). Тем не менее, в ИФ опухолей могут присутствовать различные ОM-подмножества, причем некоторые из них являются иммуносупрессивными. Например, ОM в ИФ гепатоцеллюлярных карцином (ГЦК) экспрессируют более высокое количество лиганда иммуносупрессивной контрольной точки PD-L1, чем ОМ в других опухолевых гнездах, и связаны с плохой выживаемостью. Кроме того, было показано, что семафорин 4D (SEMA4D, CD100) — цитокин, экспрессия которого особенно выражена в ИФ опухоли толстой кишки Colon26, стимулирует ОM, которые экспрессируют иммуносупрессивный цитокин IL-10 в ИФ, и таким образом подавляют активированные CD8 + Т-клетки. Блокада антител SEMA4D подавляла ОМ в ИФ и повышала эффективность лечения ингибиторами контрольных анти-PD-1 и анти-CTLA4 (Рис.2).
Опухолевые гнезда
Возможные функции ОМ в непосредственной близости от раковых клеток в опухолевых «гнездах», по-видимому, варьируются в зависимости от типа опухоли. Например, ОM, экспрессирующие NOS2 — фермент, связанный с их цитотоксическим потенциалом, — обнаруживаются в тесном контакте с раковыми клетками в некоторых опухолях предстательной железы, а большое количество ОM в опухолевых гнездах коррелирует с улучшенным прогнозом при раке эндометрия, а также снижением количества рецидивов рака желудка (Таблица 1). Повышенное количество ОM коррелирует с уменьшенной общей выживаемостью и RFS при злокачественных меланомах, а также опухолях молочной железы и пищевода (Таблица 1). ОМ в гнездах ГЦК человека экспрессируют IL-10 и рекрутируют иммуносупрессивные клетки FoxP3 + Treg, хотя нет данных, что эти Treg влияют на исход заболевания (Рис. 2).
Интересно, что ОМ экспрессируют сигнальный регуляторный белок альфа (SIRP-α) на своей поверхности, который связывается с трансмембранным белком CD47 на злокачественных клетках. Когда это происходит, подавляется способность ОM обнаруживать и фагоцитировать опухолевые клетки. Различные исследования показали, что блокирование CD47 прерывает этот сигнал «не ешь меня» и вызывает разрушение опухолей при посредстве ОM у мышей, а высокая экспрессия CD47 обуславливает плохой прогноз рака мочевого пузыря, острого миелоидного лейкоза, неходжкинских лимфом и рака молочной железы. Так опухолевые клетки уклоняются от наблюдения ОМ.
Строма
В области стромы большинства солидных опухолей опухолевых клеток обычно мало либо нет вовсе. Она состоит из сложной сети макромолекул, формирующих внеклеточный матрикс(ВКМ), к которым относятся коллагеновые фибриллы, ламинин, фибронектин, тенасцин C и гиалуроновая кислоту (ГК). В нем часто находятся популяции различных клеток, включая фибробласты, эндотелиальные клетки, перициты, лимфоциты и миелоидные клетки. Ряд исследований показал, что компоненты ВКМ (и/или продукты его протеолиза), такие как фибронектин, ламинин-10, версикан (хондроитинсульфатсодержащий протеогликан) и фрагменты ГК, регулируют фенотип макрофагов. Пинто и его коллеги в исследованиях in vitro показали, что бесклеточный ВКМ, выделенный из колоректальных опухолей, стимулирует макрофаги экспрессировать IL-10, TGF-β и снижает экспрессию рецепторов хемокинов C-C 7 (CCR7), TNF-α и IL-6. Кроме того, повышенная экспрессия стромальными ОМ лигандов хемокинов C-C 18 (CCL18) связана с повышенным метастазированием и снижением выживаемости у пациентов при раке молочной железы. Это согласуется с рядом исследований, свидетельствующих о корреляции между большим количеством стромальных ОМ и низкой общей выживаемостью и RFS при опухолях молочной железы, пищевода, желудка, поджелудочной железы, орофациальных, кожных (Таблица 1). Существует зависимость от типа опухоли, поскольку такой корреляции при раке эндометрия, шейки матки и легких не выявлено, а при раке мочевого пузыря прослеживается уменьшение метастазирования в лимфатических узлах и улучшение выживаемости (Таблица 1).
Помимо описанных выше химических компонентов стромы опухоли, функции ОМ также регулируют ее биофизические свойства. Архитектоника и плотность ВКМ регулирует экспрессию различных провоспалительных генов макрофагами in vitro путем активации сигнальных путей TLR4 в этих клетках. Высокие уровни 22 общих составляющих матрикса («меток матрикса») положительно коррелируют как с плотностью опухоли, так и с инфильтрацией ОМ при метастазах рака яичников, хотя еще предстоит выяснить, есть ли причинно-следственная связь между инфильтрацией и структурой опухоли. Также следует отметить, что разные области стромы при данной опухоли могут различаться по своим химическим и биофизическим свойствам и влиять на ОМ по-разному (Рис. 2).
Периваскулярная ниша
Подмножество ОМ лежит близко или на поверхности кровеносных сосудов в опухолях мышей и человека. Эти клетки часто экспрессируют большое количество маркеров, связанных с M2: TIE2 (основной рецептор ангиопоэтина), MRC1 и CD163, — и играют ключевую роль в стимулировании ангиогенеза опухоли, метастазирования и рецидива после терапии первой линии. Из-за их относительно высокой экспрессии TIE2 эти клетки первоначально назывались «TIE2-экспрессирующие моноциты/макрофаги (TEM)». Частота TEM также положительно коррелирует с плотностью микрососудов (MVD) у некоторых типов опухолей человека (Табл. 1).
Генетическая делеция периваскулярных (ПВ) TIE2 + ОМ или фармакологическая блокада основного лиганда TIE2 — ангиопоэтина 2 (AGPT2), — продемонстрировали важную роль этого подмножества ОM в ангиогенезе опухоли и ее росте у различных мышиных моделей рака. Стимуляция экспрессии генов TEM, выделенных из опухолей мыши, привела к более высокой экспрессии ряда генов, способствующих развитию опухолей, включая Mmp9, Vegfa, Cxcl12, Tlr4 и Nrp1, чем TIE2- ОM из тех же опухолей.
ПВ TIE2 + ОM также участвовали в рецидиве первичных опухолей мыши после различных форм лечения. Они учащают рецидивы глиомы после местного облучения, а также при опухолях легких и молочной железы после химиотерапии. В такие моменты они экспрессируют большое количество CXCR4 и рекрутируются с помощью активированного CXCL12 в ПВ нише. Это подмножество ОМ затем стимулирует реваскуляризацию и рост опухоли посредством высвобождения VEGF-A. Позднее исследование подтвердило, что экспрессия TIE2 в ОМ необходима для стимуляции васкуляризации после химиотерапии у мышей. Кроме того, недавно рекрутированные моноциты также мигрируют вокруг опухолей, не подвергавшихся терапии, зависимым от CXCR4 образом. Меченые моноциты проникали в ПВ зону опухоли PyMT, где они затем подвергались воздействию TGFβ, выделяемого раковыми клетками, что стимулировало эти моноциты повышать свою экспрессию CXCR4 и мигрировать к CXCL12-экспрессирующим фибробластам вокруг опухолевых кровеносных сосудов в богатых коллагеном стромальных областях. Как только они примыкают к сосудам, моноциты дифференцируются в «метастаз-ассистирующие» ПВ ОM, участвующие в TMEM.
Наконец, в метастатических областях, таких, как легкие, подмножество макрофагов CCR2 + Ly6C + способствует выходу раковых клеток в кровеносное русло и образованию из них метастазов. Эти «метастаз-ассоциированные макрофаги» (MAM) были использованы в мышиных моделях опухолей, чтобы напрямую связать молекулу адгезии сосудистых клеток-1 (VCAM-1) с раковыми клетками через их α4-интегрины. Этот процесс впоследствии увеличивает выживаемость раковых клеток в таких метастатических областях. Кроме того, связывание CCL2 с CCR2 на MAM стимулирует высвобождение ими CCL3, который связывается с CCR1 на раковых клетках и облегчает их удержание в легких. Эти MAM также способствуют постоянному росту метастатических повреждений с помощью сигналов VEGFR1 и CSF-1R.
Гипоксические/некротические области
Гипоксия является отличительной чертой солидных опухолей и связана с увеличением инвазии и метастазов, сопротивлением терапии и плохим клиническим исходом. Гипоксические области обычно имеют парциальное давление кислорода (рО2) ниже 10 мм рт. ст. Они расположены более чем в 150 мкм от опухолевых кровеносных сосудов. Они образуются в опухолях, когда потребность клеток в кислороде опережает их снабжение плохо организованными опухолевыми сосудами. Эти области были идентифицированы в опухолевых срезах с использованием маркеров гипоксических клеток, например, пимонидазола, или иммуноблока для индуцируемой гипоксией альфа-субъединицы транскрипционных факторов HIF 1 и 2. Большое количество гипоксических ОМ ассоциируется с повышенным уровнем ангиогенеза опухолей, метастазами, сниженной RFS и/или снижением общей выживаемости при раке молочной железы, эндометрия и шейки матки (Таблица 1).
ОM в таких областях регулируют HIF 1 и 2 и различные гены-мишени HIF, такие как VEGF-A, GLUT1 и MMP7. Хемокины, усиливающие гипоксию, рекрутируют в гипоксические области ОМ, в том числе хемокин C-X-C 12 (CXCL12), полипептид-активирующий эндотелий-клеточный моноцит II (EMAP-II), эндотелин 2, VEGF-A и SEMA3A. Гипоксические ОМ иммобилизируются в этих областях прямым ингибирующим действием гипоксии на их подвижность и снижением экспрессии их рецепторов опухолевых хемокинов CCR2, CCR5 и NRP1.
Гипоксические ОМ способствуют ангиогенезу опухоли, уклонению от иммунитета и метастазированию в различных экспериментальных моделях. Например, они регулируют экспрессию большого количества проангиогенных и иммуносупрессивных цитокинов в гипоксических зонах опухоли, а когда их проникновение в гипоксические области опухолей затруднено сигнальной блокадой SEMA3A/NRP1, опухолевый ангиогенез заметно снижается и противоопухолевый иммунитет восстанавливается. Гипоксические ОМ также способны подавлять активацию Т-клеток различными способами, влияя на IL-10 и на контрольные точки, например, через лиганд PD-L1. Макрофаги, кокультивированные с клетками ГЦК в гипоксических условиях, увеличивают экспрессию индоламин 2,3-диоксигеназы (IDO), которая подавляет пролиферацию местных цитотоксических Т-клеток и увеличивает популяцию клеток Treg.
Хотя воздействие гипоксии само по себе не может изменить фенотип ОМ в отношении стимуляции роста опухоли, некоторые исследования показали, что низкий уровень рН и лактат (которые накапливаются в слабо васкуляризированных, гипоксических областях из-за плохого сосудистого питания) совместно индуцируют проангиогенный фенотип ОМ, который, в свою очередь, восстанавливает перфузию крови. Действительно, молочная кислота может стимулировать экспрессию VEGF-A макрофагами. Как упоминалось ранее, этот цитокин является не только проангиогенным в опухолях, но также способен стимулировать выход в сосуды раковых клеток.
Опухолевая гипоксия также может модулировать функции ОМ опосредованно, стимулируя раковые клетки выделить белок группы 1 с высокой подвижностью (HMGB1), который, в свою очередь, стимулирует продукцию IL-10 ОM. Гипоксия также индуцирует метаболические изменения в ОМ, которые затем непосредственно влияют на функции соседних клеток. Например, гипоксия стимулирует экспрессию REDD1, ингибитора mTOR и ключевого модулятора метаболизма в ответ на доступность питательных веществ и потребность в энергии. Ингибирование mTOR в ОM сильно снижает их поглощение глюкозы и активность гликолиза, оставляя больше глюкозы для соседних эндотелиальных клеток. Это повышает способность раковых клеток проникать в сосудистое русло, соответственно, приводит к формированию отдаленных метастазов.
Таблица 1. Опухолевые макрофаги в различных злокачественных новообразованиях человека: корреляция с клинико-патологическими проявлениями
Заключение
Ряд экспериментальных исследований на мышах подтвердил способность различных опухолевых популяций дифференцированно регулировать фенотип ОМ. Важность этого подчеркивается клиническими отчетами, показывающими, что число или фенотип ОМ в определенных областях опухоли коррелируют с RFS и выживаемостью (Таблица 1).
Имеются данные о роли подмножеств ОM в определенных областях опухолей, ограничивающих ответ опухолей на лечение. Например, облучение, сосудистые разрушающие агенты и цитотоксические препараты индуцируют пролиферацию ПВ ОM, что способствует ангиогенезу опухоли и рецидиву после терапии. Гипоксические ОМ также были вовлечены в устойчивость опухолей к противоопухолевой терапии и способствуют рецидиву.
Демонстрация того, что ОМ стимулируют ряд механизмов опухолеобразования на мышиных моделях опухолей, побудила к развитию терапевтических подходов к истощению или перепрограммированию ОМ. На сегодняшний день общие ингибиторы ОМ, включая те, которые нацелены на CSF-1-CSF-1R и CCL-CCR2, в значительной степени не показали эффективности в клинических испытаниях в качестве монотерапии рака, хотя они могут оказаться эффективными в сочетании с другими терапевтическими агентами. Ингибитор CSF-1-R PLX3397 показал значительную эффективность при лечении теносиновиальной гигантоклеточной опухоли, лечение также выявило побочное действие, вызванное долгосрочным истощением всех макрофагов.
Таргетная терапия в отношении определенных ОM-подмножеств в опухолях может стать отличным методом в качестве противоопухолевой терапии посредством истощения или перепрограммирования тех ОМ, которые способствуют с помощью различных механизмов опухолевой прогрессии, при этом она должна оставлять или усиливать те подмножества ОМ, которые способствуют противоопухолевому иммунитету. Прогресс в нашем понимании того, как фенотип подмножеств ОМ в различных областях опухоли зависит от их онтогенеза, статуса активации и сложного комплекса местных взаимодействий поможет разработать такой терапевтический подход. Раскрытие сложного массива влияний на поведение ОM потребует многогранного подхода к исследованиям, однако это может привести к появлению новых возможностей в лечении опухолевых заболеваний, появлению новых таргетных противоопухолевых препаратов.
Источник: Yang M. et al. Diverse Functions of Macrophages in Different Tumor Microenvironments //Cancer research. – 2018. – Т. 78. – №. 19. – С. 5492-5503.
Макрофаг многоликий и вездесущий
Сто тридцать лет назад замечательный русский исследователь И.И. Мечников в опытах на личинках морских звезд из Мессинского пролива сделал удивительное открытие, круто изменившее не только жизнь самого будущего Нобелевского лауреата, но и перевернувшее тогдашние представления об иммунной системе.
Втыкая в прозрачное тело личинки розовый шип, ученый обнаружил, что занозу окружают и атакуют крупные амебоидные клетки. И если чужеродное тело было небольшим, эти блуждающие клетки, которые Мечников назвал фагоцитами (от греч. пожиратель), могли полностью поглотить пришельца.
Долгие годы считалось, что фагоциты выполняют в организме функции «войск быстрого реагирования». Однако исследования последних лет показали, что благодаря своей огромной функциональной пластичности эти клетки еще и «определяют погоду» многих метаболических, иммунологических и воспалительных процессов, как в норме, так и при патологии. Это делает фагоциты перспективной мишенью при разработке стратегии лечения ряда тяжелых заболеваний человека
Подвижные клетки иммунной системы – фагоциты или макрофаги, присутствуют практически во всех тканях организма. Они осуществляют активный захват, переваривание и обезвреживание чужеродных микроорганизмов (вирусов, бактерий, одноклеточных, паразитов), а также утилизацию биологического «мусора», такого как «невостребованные» и погибшие клетки (например, «стареющие» эритроциты).
В зависимости от своего микроокружения тканевые макрофаги могут выполнять и различные специализированные функции. Например, макрофаги костной ткани – остеокласты, также занимаются выведением из кости гидроксиапатита кальция. При недостаточности этой функции развивается мраморная болезнь – кость становится чрезмерно уплотненной и при этом хрупкой.
Но самым, пожалуй, удивительным свойством макрофагов оказалась их огромная пластичность, т. е. способность изменять свою транскрипционную программу («включение» тех или иных генов) и свой облик (фенотип). Следствием этой особенности является высокая разнородность клеточной популяции макрофагов, среди которых присутствуют не только «агрессивные» клетки, встающие на защиту организма-хозяина; но и клетки с «полярной» функцией, отвечающие за процессы «мирного» восстановления поврежденных тканей.
Липидные «антенны»
Своей потенциальной «многоликостью» макрофаг обязан необычной организации генетического материала – так называемому открытому хроматину. Этот не до конца изученный вариант структуры клеточного генома обеспечивает быстрое изменение уровня экспрессии (активности) генов в ответ на различные стимулы.
Выполнение макрофагом той или иной функции зависит от характера получаемых им стимулов. Если стимул будет распознан как «чужой», то происходит активация тех генов (и соответственно функций) макрофага, которые направлены на уничтожение «пришельца». Однако макрофаг могут активировать и сигнальные молекулы самого организма, которые побуждают эту иммунную клетку участвовать в организации и регуляции обмена веществ. Так, в условиях «мирного времени», т. е. при отсутствии патогена и обусловленного им воспалительного процесса, макрофаги участвуют в регуляции экспрессии генов, отвечающих за метаболизм липидов и глюкозы, дифференцировку клеток жировой ткани.
Интеграция между взаимоисключающими «мирным» и «военным» направлениями работы макрофагов осуществляется путем изменения активности рецепторов клеточного ядра, представляющих собой особую группу регуляторных белков.
Среди этих ядерных рецепторов следует особо выделить так называемые липидные сенсоры, т. е. белки, способные взаимодействовать с липидами (например, окисленными жирными кислотами или производными холестерина) (Смирнов, 2009). Нарушение работы этих чувствительных к липидам регуляторных белков в макрофагах может быть причиной системных обменных нарушений. Например, дефицит в макрофагах одного из этих ядерных рецепторов, обозначаемых как PPAR-гамма, приводит к развитию диабета 2 типа и дисбалансу липидного и углеводного обмена во всем организме.
Клеточные метаморфозы
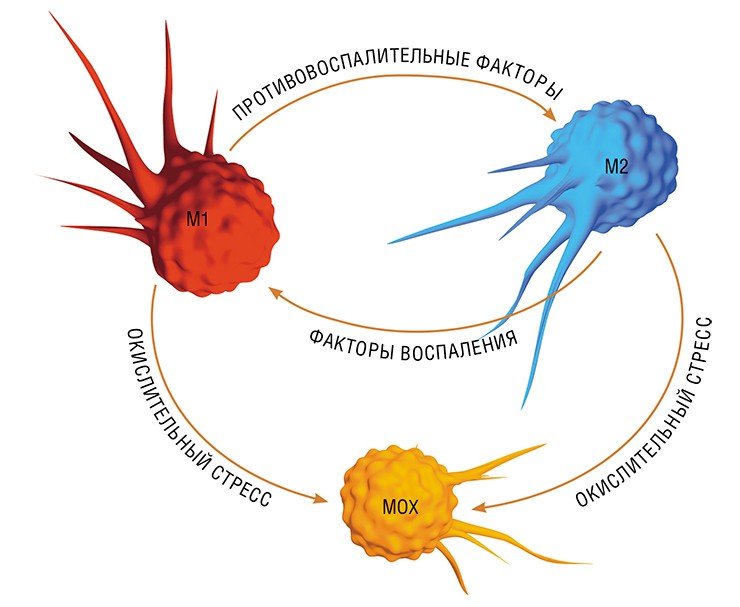
В разнородном сообществе макрофагов на основе базовых характеристик, определяющих их принципиальные функции, выделяют три основных клеточных субпопуляции: макрофаги М1, М2 и Мox, которые участвуют, соответственно, в процессах воспаления, восстановления поврежденных тканей, а также защите организма от окислительного стресса.
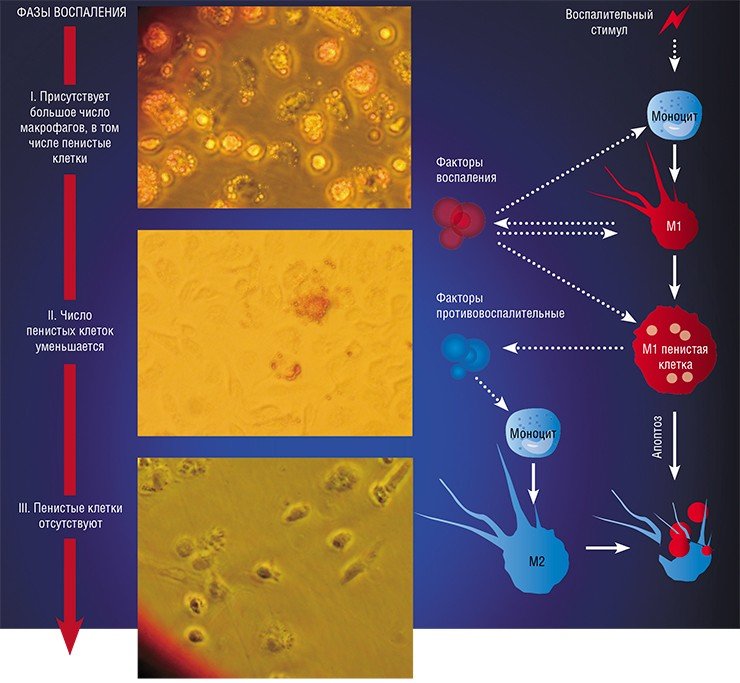
«Классический» макрофаг М1 формируется из клетки-предшественника (моноцита) под действием каскада внутриклеточных сигналов, запускающихся после распознавания инфекционного агента с помощью специальных рецепторов, расположенных на поверхности клетки.
Образование «пожирателя» М1 происходит в результате мощной активации генома, сопровождаемой активацией синтеза более чем сотни белков – так называемых факторов воспаления. К ним относятся ферменты, способствующие генерации свободных радикалов кислорода; белки, привлекающие в очаг воспаления другие клетки иммунной системы, а также белки, способные разрушать оболочку бактерий; воспалительные цитокины – вещества, обладающие свойствами активировать иммунные клетки и оказывать токсическое действие на остальное клеточное окружение. В клетке активируется фагоцитоз и макрофаг начинает активно разрушать и переваривать все, что встретится на его пути (Шварц, Свистельник, 2012). Так появляется очаг воспаления.
Однако уже на начальных этапах воспалительного процесса макрофаг М1 начинает активно секретировать и противовоспалительные субстанции – низкомолекулярные липидные молекулы. Эти сигналы «второго эшелона» начинают активировать вышеупомянутые липидные сенсоры в новых «рекрутах»-моноцитах, прибывающих в очаг воспаления. Внутри клетки запускается цепь событий, в результате которых активирующий сигнал поступает на определенные регуляторные участки ДНК, усиливая экспрессию генов, отвечающих за гармонизацию обмена веществ и одновременно подавляя активность «провоспалительных» (т. е. провоцирующих воспаление) генов (Душкин, 2012).
Так в результате альтернативной активации образуются макрофаги М2, которые завершают воспалительный процесс и способствуют тканевому восстановлению. Популяцию М2 макрофагов можно, в свою очередь, разделить на группы в зависимости от их специализации: уборщики мертвых клеток; клетки, участвующие в реакции приобретенного иммунитета, а также макрофаги, секретирующие факторы, которые способствуют замещению погибших тканей соединительной тканью.
Еще одна группа макрофагов – Мох, формируется в условиях так называемого окислительного стресса, когда в тканях возрастает опасность повреждения их свободными радикалами. Например, Мох составляют около трети всех макрофагов атеросклеротической бляшки. Эти иммунные клетки не только сами устойчивы к повреждающим факторам, но и участвуют в антиоксидантной защите организма(Gui et al., 2012).
Пенистый камикадзе
Одной из самых интригующих метаморфоз макрофага является его превращение в так называемую пенистую клетку. Такие клетки были обнаружены в атеросклеротических бляшках, а свое название получили из-за специфического внешнего вида: под микроскопом они напоминали мыльную пену. По сути, пенистая клетка – это тот же макрофаг М1, но переполненный жировыми включениями, преимущественно состоящими из водонерастворимых соединений холестерина и жирных кислот.
Была высказана гипотеза, ставшая общепринятой, что пенистые клетки образуются в стенке атеросклеротических сосудов в результате неконтролируемого поглощения макрофагами липопротеинов низкой плотности, переносящих «плохой» холестерин. Однако впоследствии было обнаружено, что накопление липидов и драматическое (в десятки раз!) возрастание скорости синтеза ряда липидов в макрофагах можно спровоцировать в эксперименте только лишь одним воспалением, без всякого участия липопротеинов низкой плотности (Душкин, 2012).
Это предположение подтвердилось клиническими наблюдениями: оказалось, что превращение макрофагов в пенистую клетку происходит при разнообразных заболеваниях воспалительной природы: в суставах – при ревматоидном артрите, в жировой ткани – при диабете, в почках – при острой и хронической недостаточности, в ткани мозга – при энцефалитах. Однако понадобилось около двадцати лет исследований, чтобы понять, как и зачем макрофаг при воспалении превращается в клетку, нафаршированную липидами.
Оказалось, что активация провоспалительных сигнальных путей в М1 макрофагах приводит к «выключению» тех самых липидных сенсоров, которые в нормальных условиях контролируют и нормализуют липидный обмен (Душкин, 2012). При их «выключении» клетка и начинает накапливать липиды. При этом образующиеся липидные включения представляют собой вовсе не пассивные жировые резервуары: входящие в их состав липиды обладают способностью усиливать воспалительные сигнальные каскады. Главная цель всех этих драматических изменений – любыми средствами активировать и усилить защитную функцию макрофага, направленную на уничтожение «чужих» (Melo, Drorak, 2012).
Однако высокое содержание холестерина и жирных кислот дорого обходится пенистой клетке – они стимулируют ее гибель путем апоптоза, запрограммированной клеточной смерти. На внешней поверхности мембраны таких «обреченных» клеток обнаруживается фосфолипид фосфатидилсерин, в норме расположенный внутри клетки: появление его снаружи является своеобразным «похоронным звоном». Это сигнал «съешь меня», который воспринимают М2 макрофаги. Поглощая апоптозные пенистые клетки, они начинают активно секретировать медиаторы заключительной, восстановительной стадии воспаления.
Фармакологическая мишень
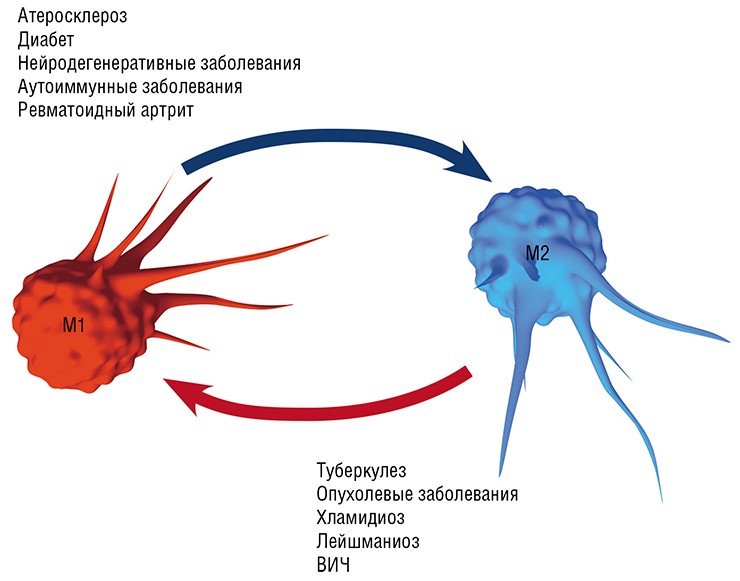
Воспаление как типовой патологический процесс и ключевое участие в нем макрофагов является, в той или иной мере, важной составляющей в первую очередь инфекционных заболеваний, вызванных различными патологическими агентами, от простейших и бактерий до вирусов: хламидиальные инфекции, туберкулез, лейшманиоз, трипаносомоз и др. Вместе с тем макрофаги, как уже упоминалось выше, играют важную, если не ведущую, роль в развитии так называемых метаболических заболеваний: атеросклероза (главного виновника сердечно-сосудистых заболеваний), диабета, нейродегенеративных заболеваний мозга (болезнь Альцгеймера и Паркинсона, последствия инсультов и черепно-мозговых травм), ревматоидного артрита, а также онкологических заболеваний.
Разработать стратегию управления этими клетками при различных заболеваниях позволили современные знания о роли липидных сенсоров в формировании различных фенотипов макрофага.
Так, оказалось, что в процессе эволюции хламидии и туберкулезные палочки научились использовать липидные сенсоры макрофагов, чтобы стимулировать не опасную для них альтернативную (в М2) активацию макрофагов. Благодаря этому поглощенная макрофагом туберкулезная бактерия может, купаясь как сыр в масле в липидных включениях, спокойно дожидаться своего освобождения, а после гибели макрофага размножаться, используя содержимое погибших клеток в качестве пищи (Melo, Drorak, 2012).
Если в этом случае использовать синтетические активаторы липидных сенсоров, которые препятствуют образованию жировых включений и, соответственно, предотвращают «пенистую» трансформацию макрофага, то можно подавить рост и понизить жизнеспособность инфекционных патогенов. По крайней мере в экспериментах на животных уже удалось в разы снизить обсемененность легких мышей туберкулезными бациллами, используя стимулятор одного из липидных сенсоров или ингибитор синтеза жирных кислот (Lugo-Villarino et al., 2012).
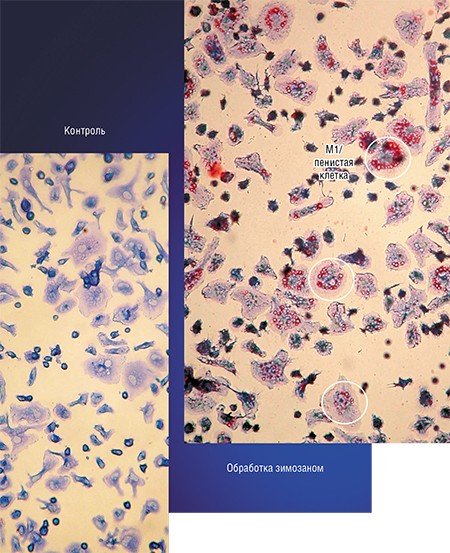
Формированию таких нестабильных атеросклеротических бляшек и способствует макрофаг М1/пенистая клетка, который продуцирует ферменты, растворяющие коллагеновое покрытие бляшки. В этом случае наиболее эффективная стратегия лечения – превращение нестабильной бляшки в стабильную, богатую коллагеном, для чего требуется трансформировать «агрессивный» макрофаг М1 в «умиротворенный» М2.
Экспериментальные данные свидетельствуют, что подобной модификации макрофага можно добиться, подавляя в нем продукцию провоспалительных факторов. Такими свойствами обладает ряд синтетических активаторов липидных сенсоров, а также природные вещества, например, куркумин – биофлавоноид, входящий в состав корня куркумы, хорошо известной индийской пряности.
Нужно добавить, что такая трансформация макрофагов актуальна при ожирении и диабете 2 типа (большая часть макрофагов жировой ткани имеет М1 фенотип), а также при лечении нейродегенеративных заболеваний мозга. В последнем случае в мозговых тканях происходит «классическая» активация макрофагов, что приводит к повреждению нейронов и накоплению токсичных веществ. Превращение М1-агрессоров в мирных дворников М2 и Mox, уничтожающих биологический «мусор», может в ближайшее время стать ведущей стратегией лечения этих заболеваний (Walace, 2012).
С воспалением неразрывно связано и раковое перерождение клеток: например, имеются все основания считать, что 90 % опухолей в печени человека возникает как следствие перенесенных инфекционных и токсических гепатитов. Поэтому с целью профилактики раковых заболеваний необходимо контролировать популяцию М1 макрофагов.
Однако не все так просто. Так, в уже сформированной опухоли макрофаги преимущественно приобретают признаки статуса М2, который содействует выживанию, размножению и распространению самих раковых клеток. Более того, такие макрофаги начинают подавлять противораковый иммунный ответ лимфоцитов. Поэтому для лечения уже образовавшихся опухолей разрабатывается другая стратегия, основанная на стимулировании у макрофагов признаков классической М1-активации (Solinas et al., 2009).
Примером такого подхода служит технология, разработанная в новосибирском Институте клинической иммунологии СО РАМН, при которой макрофаги, полученные из крови онкобольных, культивируют в присутствии стимулятора зимозана, который накапливается в клетках. Затем макрофаги вводят в опухоль, где зимозан освобождается и начинает стимулировать классическую активацию «опухолевых» макрофагов.
Сегодня становится все более очевидно, что соединения, вызывающие метаморфозы макрофагов, оказывают выраженное атеропротективное, антидиабетическое, нейропротективное действие, а также защищают ткани при аутоиммунных заболеваниях и ревматоидном артрите. Однако такие препараты, имеющиеся на сегодня в арсенале практикующего врача, – фибраты и производные тиазолидона, хотя и снижают смертность при этих тяжелых заболеваниях, но при этом имеют выраженные тяжелые побочные действия.
Эти обстоятельства стимулируют химиков и фармакологов к созданию безопасных и эффективных аналогов. За рубежом – в США, Китае, Швейцарии и Израиле уже проводятся дорогостоящие клинические испытания подобных соединений синтетического и природного происхождения. Несмотря на финансовые трудности, российские, в том числе и новосибирские, исследователи также вносят свой посильный вклад в решение этой проблемы.
Так, на кафедре химии Новосибирского государственного университета было получено безопасное соединение TS-13, стимулирующее образование Мox фагоцитов, которое обладает выраженным противовоспалительным эффектом и оказывает нейропротективное действие в экспериментальной модели болезни Паркинсона (Дюбченко и др., 2006; Зенков и др., 2009).
В Новосибирском институте органической химии им. Н. Н. Ворожцова СО РАН созданы безопасные антидиабетические и противоатеросклеротические препараты, действующие сразу на несколько факторов, благодаря которым «агрессивный» макрофаг М1 превращается в «мирный» М2 (Dikalov et al., 2011). Большой интерес вызывают и растительные препараты, получаемые из винограда, черники и других растений с помощью механохимической технологии, разработанной в Институте химии твердого тела и механохимии СО РАН (Dushkin, 2010).
С помощью финансовой поддержки государства можно в самое ближайшее время создать отечественные средства для фармакологических и генетических манипуляций с макрофагами, благодаря которым появится реальная возможность превращать эти иммунные клетки из агрессивных врагов в друзей, помогающих организму сохранить или вернуть здоровье.
Душкин М. И. Макрофаг/пенистая клетка как атрибут воспаления: механизмы образования и функциональная роль // Биохимия, 2012. T. 77. C. 419—432.
Смирнов А. Н. Липидная сигнализация в контексте атерогенеза // Биохимия. 2010. Т. 75. С. 899—919.
Шварц Я. Ш., Свистельник А. В.Функциональные фенотипы макрофагов и концепция М1-М2-поляризации. Ч. 1 Провоспалительный фенотип. // Биохимия. 2012. Т. 77. С. 312—329.