желтая сарцина что это
Род Sarcina



Род Gaffkya
Род Staphylococcus
Род Micrococcus
Представители этого рода отличаются от микрококков тем, что являются факультативными анаэробами и вызывают ферментацию глюкозы в анаэробных условиях с образованием кислоты, кроме того, многие виды стафилококков патогенны. Большинство видов требуют органических источников азота и витаминов для роста. Многие штаммы образуют оранжевый или желтый пигмент. Типовой вид рода — Staphylococcus aureus. Staphylococcus aureus — возбудитель гнойных инфекций, он может вызывать маститы, фурункулезы, абсцессы внутренних органов. Staphylococcus epidermidis — менее вирулентный возбудитель тех же инфекций.
Стафилококки нередко вызывают пищевые отравления, что связано с их способностью вырабатывать яды — энтеротоксины. При попадании токсинов в желудочно-кишечный тракт возникают тошнота, рвота, понос.
Встречаются чаще всего на коже и слизистых теплокровных животных, в различных пищевых продуктах, воздухе. Сапрофитные стафилококки трудно отличить от микрококков.
Представители этого рода характеризуются тем, что образуют тетрады клеток, часто окружены толстыми капсулами. Аэробы и факультативные анаэробы. Оптимум температуры 37 °С. Патогенны для мышей и некоторых других животных. Типовой вид — Gaffkya tetragena.
Деление клеток в трех взаимно перпендикулярных направлениях обусловливает образование правильных пакетов кокков, характерных для представителей этого рода. Следует отметить, что род этот весьма гетерогенный. В него входят как неподвижные, так и подвижные виды (Sarcina ureae), как аэробные, так и облигатно анаэробные виды. В связи с этим род Sarcina подразделяется на подроды:
3. Подрод Sarcinococcus — аэробы, не превращают мочевину в аммонийные соли. Сюда входят наиболее часто встречающиеся в воздухе, воде и почве виды: Sarcina lutea, Sarcina flava (желтый пигмент), Sarcina auran-tiaca (оранжевый) и Sarcina litoralis (красный пигмент) — галофильный вид.
4. Подрод Urosarcina — аэробы, превращают мочевину в аммонийные соли. Представитель этого подрода — Sarcina urea — интересен тем, что образует эндоспоры. Последние локализуются в центре клетки. Кроме того, клетки этого вида подвижны и имеют по одному длинному жгутику. Все виды сарцин относятся к сапрофитам или факультативным паразитам. Как и микрококки, они участвуют в круговороте веществ в природе.
Апенченко Ю.С., Червинец В.М., Иванова И.И., Басалаева Н.В., Беляева Е.А. Микробиоценоз верхних отделов пищеварительного тракта у детей с ГЭРБ и хроническим гастродуоденитом // Клиническая лабораторная диагностика. 2013. № 4. С. 40–43.
Микробиоценоз верхних отделов пищеварительного тракта у детей с гастроэзофагеальной рефлюксной болезнью и хроническим гастродуоденитом
Ю.С. Апенченко, В.М. Червинец, И.И. Иванова, Н.В. Басалаева, Беляева Е.А.
Тверская государственная медицинская академия
Рассматривается микробный спектр слизистой оболочки пищевода и желудка детей с гастроэзофагеальной рефлюксной болезнью и хроническим гастродуоденитом. У пациентов с заболеваниями верхних отделов пищеварительного тракта условно-патогенные микроорганизмы выделяются чаще, их штаммы обладают факторами агрессии и цитотоксичностью. У детей с рефлюксной болезнью микробный пейзаж в пищеводе шире как в количественном, так и в видовом отношении по сравнению не только со здоровыми подростками, но и с детьми с изолированным гастродуоденитом.
Ключевые слова: микрофлора, пищеварительный тракт, дети, гастроэзофагеальная рефлюксная болезнь, хронический гастродуоденит
The microbiocenosis of upper parts of digestive tract of children with gastroesophageal reflux disease and chronic gastroduodenitis
Yu.S. Apentchenko, V.M. Tchervinetz, I.I. Ivanova, N.B. Basalayeva, Ye.A. Beliyeva
The article considers the microbe specter of mucous coat of esophagus and stomach in children with gastro esophageal refux disease and chronic gastroduodenitis. In patients with diseases of upper parts of digestive tract, the opportunistic pathogenic bacteria are isolated more often and their strains have aggression factors and cytotoxicity. In children with refux disease the microbe landscape of esophagus is larger both in numerical and specifc respect as compared to healthy adolescents and children with isolated gastroduodenitis.
Key words: microflora, digestive tract, children, gastro esophageal refux disease, chronic gastroduodenitis
Апенченко Юлия Сергеевна, доц. каф. педиатрии. Адрес: 170100, Тверь, ул. Советская, 4. Телефон: (4822)32-17-79 e-mail: apen(а)mail.ru
Болезни органов пищеварительной системы в структуре соматической патологии у детей занимают одно из ведущих мест. По некоторым данным, их распространенность превышает 400‰ [6]. На рост гастроэнтерологических заболеваний влияют особенности современного образа жизни и питания, стрессы, неблагоприятная экологическая обстановка, в определенной мере – широкое внедрение ультразвукового и эндоскопического методов диагностики. В настоящее время отмечаются уменьшение частоты выявляемости язвенной болезни и гастродуоденитов и рост частоты заболеваний пищевода [6]. К ним в первую очередь относится гастроэзофагеальная рефлюксная болезнь (ГЭРБ).
ГЭРБ – хроническое рецидивирующее заболевание, в основе которого лежит патологический гастроэзофагеальный рефлюкс (ГЭР), отличающийся от физиологического прежде всего продолжительностью, частотой и наличием клинической симптоматики. По данным многоцентрового эпидемиологического исследования МЭГРЕ, распространенность ГЭРБ в популяции составляет 13,3% [4].
Одним из нерешенных аспектов проблемы ГЭРБ является сочетание ее с инфицированностью Helicobacter pylori, причем высказываются противоположные точки зрения: H. pylory способствует возникновению ГЭРБ, и H. pylori способствует предупреждению ГЭРБ. По данным Н. O’Connor, хеликобактерная инфекция, вызывая гиперсекрецию, может способствовать развитию ГЭРБ, тем не менее эпидемиологические исследования не подтверждают это [10]. Ц.Г. Масевич и И.А. Лосева, обследовав группу больных, у которых H. pylori определялся на слизистой оболочке не только желудка, но и пищевода, выявили у них более выраженные эндоскопические изменения в пищеводе [5]. Предположение о протективной роли H. pylori относительно развития ГЭРБ основано на эпидемиологических данных о том, что рефлюксная болезнь при хеликобактерной инфекции встречается реже, чем у неинфицированных пациентов. Возможно, это связано не только с выработкой аммиака в результате инфицирования. Чем больше выраженность воспаления в теле желудка, тем чаще атрофия, ниже секреция кислоты и меньше вероятность развития ГЭРБ, и наоборот [9].
Микробиоценоз верхних отделов пищеварительного тракта состоит не только из H. pylori. Несмотря на то что традиционно постулируется скудность мукозной микрофлоры гастродуоденальной зоны из-за бактерицидного действия желудочного сока, В. М. Червинец, С. Н. Базлов и соавт. выделили различные микроорганизмы из биоптатов слизистой оболочки у 90% здоровых лиц. При обострении язвенной болезни из биоптатов периульцерозной зоны выделялось большее количество микроорганизмов, всегда в сочетаниях с цитотоксичностью [1, 7].
Обнаружен определенный микробиоценоз желудка у детей с хроническим гастродуоденитом (ХГД), причем микробный пейзаж был разным при H. pylori-ассоциированном гастродуодените и гастродуодените без инфекции H. pylori [3]. Изменяются спектр и количество микроорганизмов и у больных эзофагитами [8].
Материалы и методы. Предпринята попытка оценить микробный спектр верхних отделов пищеварительного тракта у детей с ГЭРБ и ХГД. Для изучения особенностей микробиоценоза слизистой оболочки обследовано 45 детей в возрасте от 15 до 18 лет.
Все обследованные разделены на 3 группы. В 1-ю группу вошло 14 детей с ГЭРБ, во 2-ю группу – 13 детей с ХГД и в 3-ю группу (контрольную) – 18 здоровых добровольцев без заболеваний верхних отелов пищеварительного тракта. У всех получено информированное согласие на проведение исследования.
Помимо клинико-анамнестического метода исследования, использовались возможности инструментальной и лабораторной диагностики: детям проводились 24-часовая рН-метрия, эзофагогастродуоденоскопия (ЭГДС), микробиологическое исследование биоптатов слизистой оболочки верхних отделов пищеварительного тракта.
Суточный мониторинг рН выполняли с помощью портативного прибора Гастроскан-24 в условиях свободной активности обследуемого с последующей дешифровкой записи на персональном компьютере с помощью программы «Исток-Система». Во время исследования дети вели дневник с указанием возникающих жалоб, времени приема пищи и медикаментов, сна, горизонтального и вертикального положения тела.
Для оценки кислых ГЭР использовали общепринятые показатели, предложенные DeMeester: процент времени с рН в пищеводе менее 4 (в том числе в горизонтальном и вертикальном положении тела), общее число рефлюксов за сутки, число рефлюксов продолжительностью более 5 мин, длительность наиболее продолжительного рефлюкса. На основании этих данных рассчитывался интегративный показатель DeMeester.
ГЭР расценивался как физиологический, если забросы были непродолжительными, возникали не более 46 раз в сутки, в основном после еды, в вертикальном положении. Характеризующие их цифровые показатели были в пределах нормы по demeester.
Если время, в течение которого в пищеводе регистрировался рН менее 4,0, превышало 4,2% от общего времени исследования (более 1 ч за сутки), или общее число кислых забросов было больше 46 в сутки, делалось заключение о наличии патологического кислого ГЭР.
ЭГДС проводилась для оценки состояния слизистой оболочки верхних отделов пищеварительного тракта и определения наличия эзофагита, гастродуоденита.
Диагноз ГЭРБ и ХГД ставился на основании характерных клинических проявлений: жалоб пациентов, объективного статуса и результатов инструментального обследования.
Микробная обсемененность верхних отделов пищеварительного тракта определялась в биоптатах слизистой оболочки нижней трети пищевода и тела желудка, взятых при ЭГДС. Биопсийный материал помещали в транспортную среду portagerm-pylori (ВВL®), предназначенную для сохранения H. pylori, а также в транспортную среду Амиес. Время транспортировки в лабораторию составляло от 30 мин до 2 ч.
Посевы культивировали соответственно в аэробных, анаэробных и микроаэрофильных условиях с использованием микроанаэростатов (BBL®) и газогенераторных пакетов Gas pack plus (ВВГ®) и campy Рак plus (BBL®) в течение 24–72 ч при 37°C. Идентификацию бактерий осуществляли с помощью идентификационных АРi-систем («Bio merieux»).
Количество бактерий определяли путем подсчета колониеобразующих единиц на 1 г биоптата (КОЕ/г) с учетом массы биоптата и разведения [2, 7].
Протеолитические ферменты у микроорганизмов выявляли по наличию зон просветления вокруг колоний при посеве на среды с казеином. Цитотоксичность микроорганизмов определяли путем инкубации тестируемых штаммов с культурой клеток Нeр-2. Степень выраженности цитотоксичности учитывали по изменению характера монослоя в виде отслоения клеток, изменения их морфологии, наличию деструкции [7].
Значимость различий определялась по критерию углового преобразования Фишера.
Результаты и обсуждение. По результатам ЭГДС у всех детей 1-й и 2-й группы определялся поверхностный гастрит и дуоденит. Катаральный эзофагит выявлен у 50% детей с ГЭРБ и у 46,2% детей без ГЭРБ.
Микробиоценоз пищевода. Из слизистой оболочки пищевода у детей с ГЭРБ выделялись представители 13 родов микроорганизмов, у детей без ГЭРБ – 8 родов, у здоровых подростков – 10 родов. Микроорганизмы определялись в ассоциации из 3–7 культур у детей с ХГД и из 3–5 культур у здоровых лиц. Чаще сочетались стафилококки, стрептококки, лактобациллы. У детей с ГЭРБ к этому сочетанию нередко присоединялись сарцины, у детей без ГЭРБ – бактероиды.
Трансляция: как и зачем ингибировать биосинтез белка в собственных клетках?
Трансляция: как и зачем ингибировать биосинтез белка в собственных клетках?
3D-структура эукариотической рибосомы
визуализация автора статьи с использованием скрипта проф. Ненада Бана на основе структуры рибосомы 4V88 [17]
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Биосинтез белка (трансляция) — ключевой процесс клеточного метаболизма, в ходе которого специальные молекулярные машины — рибосомы, — раскодируя последовательность нуклеотидов в матричной РНК, производят полипептидную цепь. Как и к любым другим биомолекулам, к компонентам трансляционного аппарата можно подобрать ингибиторы. Подавление трансляции в эукариотических клетках с помощью малых молекул в последние годы всё чаще применяется при терапии различных заболеваний (в том числе генетических). Казалось бы, для чего ингибировать процесс, который обеспечивает клетку строительным материалом, ферментами, регуляторами и прочими необходимыми для жизни компонентами? Дело в том, что часто при раковой трансформации или вирусной инфекции рибосомы начинают «подыгрывать» врагу, смещая трансляцию в сторону «нежелательных» мРНК. Например, вирусы, чтобы качнуть чашу весов в свою сторону, могут использовать множество интересных механизмов для модификации клеточной трансляции. Таким образом, лекарства, которые подавляют биосинтез белка, могут намного сильнее затормозить рост клеток, вышедших из-под контроля, нежели «законопослушных». Это их свойство и используется при терапии.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2021/2022.
Партнер номинации — компания Cytiva.
Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Я работаю в лаборатории системной биологии старения в отделе взаимодействия вирусов с клеткой НИИ физико-химической биологии имени А.Н. Белозерского МГУ. На втором курсе моя курсовая работа была связана с поиском ингибиторов трансляции у эукариот и созданием базы таких ингибиторов. Данная статья подготовлена по материалам обзора, опубликованного в спецвыпуске журнала «Биохимия» [1].
Молекулярный аппарат трансляции и его консервативность
Трансляционный цикл на множестве этапов может быть нарушен или замедлен многочисленными и разнородными по химическому строению ингибиторами. Ключевые компоненты трансляционного аппарата клетки — это рибосомы и факторы трансляции (белки, помогающие рибосоме реализовывать разные этапы трансляционного цикла), а также большое количество вспомогательных белков, необходимых для обеспечения синтеза нужными материалами: например, аминоацил-тРНК-синтетазы (АРСазы) — ферменты, соединяющие тРНК с соответствующей ей аминокислотой; или регуляторы биосинтеза белка — компоненты сигнальных путей, связанных с трансляцией. При подборе ингибиторов нельзя не учитывать, что многие из этих молекул есть у всех живых организмов, и некоторые из них довольно консервативны. А значит, одни и те же вещества могут действовать как на про-, так и на эукариот, что не всегда приемлемо.
Каждый живой организм на Земле может быть отнесен к одному из трех доменов жизни: это максимально удаленные друг от друга в эволюционном смысле группы — эукариоты (здесь ищите самые известные царства: животных, растений и грибов), бактерии и археи [2]. Эта удаленность означает, что они давно разошлись (то есть их последний общий предок жил давно [3]), и у представителей групп накопилось множество отличий. Но есть и признаки, по которым представители различных доменов похожи друг на друга. Речь идет об основополагающих признаках: например, способности удваивать ДНК, синтезировать на ее основе РНК и в конце концов получать закодированный в ней белок. Трансляция относится к самым консервативным биологическим процессам.
При ближайшем рассмотрении оказывается, что устройство белоксинтезирующего аппарата довольно схоже у представителей разных доменов. К примеру, основные факторы инициации и элонгации у бактерий имеют гомологов у архей, а рибосомы архей по многим аспектам строения очень напоминают рибосомы эукариот (что даже позволило создать из рибосом дрожжей гибридные рибосомы, в которых одна из субъединица очень напоминала рибосомную субъединицу архей [4]). В пределах этих трех доменов есть отличия, но мы видим, что трансляционная машинерия в целом очень консервативна, и таких отличий не так много. Это является несомненным свидетельством общности (монофилетичности) происхождения жизни.
Хотя это зависит от того, какие критерии для отнесения к живому используются. В зависимости от них под определение «живое» может попасть даже клетка из компьютерной игры Конвея «Жизнь», но под критерии классического определения жизни подпадают всё же только представители этих трех доменов.
Ингибиторы трансляции как антибиотики
Подробнее про различные классы антибиотиков и про то, как они действуют, можно прочитать в статье «Биомолекулы» «Антибиотики vs Бактерии. “Война Бесконечности” или всему есть предел?» [6].
Однако в этой статье речь пойдет об ингибиторах эукариотической трансляции — ведь многие из них служат мощными противоопухолевыми и антивирусными препаратами, используются для иммуносупрессии при пересадке органов или для обезболивания. Некоторые из этих веществ рассматривают даже как возможное «лекарство от старости». Но перед тем как переходить к их рассмотрению, нам придется вспомнить основные этапы трансляционного цикла.
Трансляционный цикл
Чтобы оценить все разнообразие ингибиторов биосинтеза белка, давайте для начала ознакомимся с теми этапами трансляционного цикла, на которые может быть направлено их действие. Эти этапы изображены на рисунке 1 (кликнув на элемент, вы можете прочитать про него подробнее в «Википедии»). Кстати, некоторые этапы этого сложного процесса до сих пор плохо изучены.
Рисунок 1. Трансляционный цикл эукариот (с подсказками!) и избранные сигнальные каскады, влияющие на него. Также показаны самые известные и изученные ингибиторы цикла (черная рамка означает принципиально другой механизм действия). Вещества сгруппированы в соответствии со стадиями синтеза белка, в которых участвуют их мишени. Стадии обозначены кодами. Инициация трансляции: i.1 — связывание eIF2 с Met-тРНК и образование тройного комплекса eIF2/Met-тРНКi/GTP (TC); i.2 — взаимодействие eIF4A и eIF4G; i.3 — взаимодействие eIF4E и eIF4G; i.4 — связывание eIF4E с m 7 G-кэпом на 5′-конце мРНК; i.5 — ингибирование хеликазной (расплетающей мРНК) активности eIF4A при посадке eIF4F на мРНК и последующем рибосомном сканировании; i.6 — узнавание AUG-кодона при сканировании; i.7 — взаимодействие eIF5B с 60S-субъединицей; i.8 — взаимодействие eIF6 с 60S-субъединицей; i.9 — присоединение 60S-субъединицы к 48S преинициаторному комплексу (48S PIC) с образованием 80S инициаторного комплекса (80S IC). Элонгация и сопутствующие реакции: e.1 — аминоацилирование тРНК; e.2 — диссоциация eEF1A/GDP после доставки аминоацил-тРНК (Аа-тРНК); e.3 — продвижение полипептида в рибосомном тоннеле; e.4 — декодирование; e.5 — пептидилтрансферазная реакция; e.6 — транслокация; e.7 — диссоциация eEF2/GDP после транслокации. Терминация: t.1 — узнавание стоп-кодона; t.2 — гидролиз пептидил-тРНК. Рециклинг: r.1 — диссоциация 60S-субъединицы. Коды модуляторов сигнальных каскадов: s.1–s.3 — активаторы киназ фактора eIF2; s.4 — ингибиторы фосфатаз фактора eIF2; s.5 — ингибиторы киназы PI3K; s.6 — ингибиторы активного центра киназы mTOR; s.7 — аллостерические ингибиторы mTOR в составе комплекса mTORC1. Рисунок позаимствован из нашей статьи в журнале «Биохимия» [1]. Более полная его версия с поясняющими таблицами доступна на сайте базы ингибиторов EuPSIC
Схема может показаться сложной, но в действительности это не так. Попробуйте выхватить взглядом желтую 40S-субъединицу (в свободном от других компонентов трансляции виде ее можно найти рядом со стадией i.1) и пройтись по циклу, как в настольной игре, посмотрев на все, что успевает с ней за это время произойти. Особенно любознательным предлагаем покликать по элементам схемы и прочитать о каждом из этапов дополнительно.
Этапы трансляции
Трансляционный цикл принято подразделять на несколько этапов:
Отдельно происходит активация аминокислот с помощью аминоацил-тРНК-синтетаз (см. e.1 на рисунке 1).
Некоторые трансляционные факторы известны уже очень давно, для них понятна функция, известны ортологи у архей и бактерий (подробнее про гомологичные взаимоотношения генов можно прочитать здесь [7]) и выяснено, являются ли они строго необходимыми для синтеза белка — ведь некоторые вирусные мРНК, например, могут обходиться без целого ряда факторов инициации трансляции [8], [9]. Роль других участников была открыта относительно недавно. Примером таких белков служат факторы DENR и MCTS1 (см. область рециклинга (r) на рисунке 1), изучением которых, кстати, занимается наша лаборатория.
На рисунке 1 (см. s.1, s.2) также изображена часть путей внутриклеточного сигналинга, которые непосредственно регулируют трансляцию. Кроме того, существует еще и сложнейший процесс сборки рибосомы из рибосомной РНК и белков, который протекает по большей части в ядре. Его также можно подавить низкомолекулярными веществами, но о них известно гораздо меньше, а их специфичность часто оставляет желать лучшего.
Типы ингибиторов
С ингибиторами трансляции удобно знакомиться, если классифицировать их согласно мишеням, на которые они воздействуют.
Ингибиторы эукариотической рибосомы
Многие из ингибиторов действуют на рибосомы. При этом они могут быть универсальными (подавлять трансляцию у всех доменов живого), а могут — специфичными (например, к рибосоме эукариот или даже каких-то узких таксономических групп). Специфичность действия, как правило, определяется тонкими различиями в строении места связывания: структурные исследования показывают, что часто достаточно замены одного нуклеотида в рРНК или разницы в единственной аминокислотной позиции рибосомного белка, чтобы конфигурация участка не позволяла ингибитору связаться. Подавляющее большинство ингибиторов рибосомы действует на стадии элонгации, однако существуют и другие типы, перечисленные в таблице 1 (заметьте, что пункты могут перекрываться).
| Типы ингибиторов | Классы химических веществ и известные представители | Краткие комментарии |
|---|---|---|
| Рибосом-направленные ингибиторы инициации трансляции | Эдеин, MDMP, eIFsixty-4 | Небольшая группа ингибиторов, механизмы действия которых сильно различаются. Основной механизм — нарушение взаимодействия с лигандами: блокирование связывания факторов инициации или нарушение аккомодации инициаторной тРНК (рис. 1: i.6–i.9). |
| Рибосом-направленные ингибиторы элонгации (кроме веществ, вызывающих ошибки декодирования) | Анизомицин, гомохаррингтонин, трихотецины, квассиноиды, амикумацин A, циклогексимид, эметин, лиссоклимид, гигромицин B, тетраценомицин X и другие | Большая и разнообразная по химическому строению и механизмам действия группа. Могут действовать на транспептидацию, транслокацию, вызывать преждевременную терминацию или блокировать пептидный тоннель. Как правило, связываются с функциональными сайтами рибосомы. Эти сайты вместе с избранными ингибиторами, присоединенными к рибосоме, можно изучить на рис. 5. Интересно, что некоторые ингибиторы элонгации, действующие на ее самые начальные стадии, часто путают с ингибиторами инициации. Самым известным таким ингибитором является гомохаррингтонин (рис. 2). Все ингибиторы, представленные на рисунке 5, кроме TC007 и паромомицина, относятся именно к данному типу (рис. 1: e.3, e.5, e.6). |
| Вещества, вызывающие ошибки декодирования | Аминогликозиды (преимущественно с 2-DOS кольцом) и ряд других ингибиторов [6] | Основное место связывания таких веществ на эукариотической рибосоме — декодирующий центр малой субъединицы (спираль h44, см. рис. 5). Это связывание вызывает стабилизацию той конформации, которую рибосома должна принимать при наличии «правильной» аминоацил-тРНК в А-сайте. В результате реакция по переносу остатка аминокислоты может произойти, даже если там находится не соответствующая кодону тРНК, что вызывает ошибки декодирования, а также «проскок» стоп-кодона (подробнее это описано ниже на примере аталурена) — рис. 1: e.4. |
| Рибосомные ингибиторы, влияющие на терминацию | Аминогликозиды, гиролин | Совсем небольшая группа ингибиторов. У эукариот вещества, специфично блокирующие собственно терминацию (высвобождение полипептида), изучены плохо. Поэтому список ингибиторов t.1 в основном представлен веществами из предыдущего списка (e.4), т.к. их влияние на точность декодирования сказывается в том числе и на узнавании стоп-кодона, что вызывает его «проскок». Подтвержденным ингибитором высвобождения пептида у эукариот является, пожалуй, пока только гиролин (рис. 1: t.1, t.2). |
| Ингибиторы рибосомного рециклинга | Некоторые аминогликозиды, бацифелацин и неоквассин | Пока что веществ, которые бы специфично действовали на эту стадию, не обнаружено, но, возможно, это просто вопрос времени. Механизмы рециклинга и вовлеченные в него факторы сильно различаются у эукариот и бактерий, а у архей эта стадия изучена особенно плохо (рис. 1: r.1). |
Если классифицировать по сайтам связывания, то выделяют: ингибиторы пептидилтрансферазного центра; ингибиторы транслокации, узнающие E-сайт; ингибиторы, связывающиеся в пептидном тоннеле; ингибиторы, взаимодействующие с декодирующим центром; ингибитор, связывающийся с ГТФаза-активирующим центром (пока достоверно описан только один такой пример).
Пока не так много веществ этого типа допущены до практического применения (самое известное из них — гомохаррингтонин (рис. 2)), но их число постепенно растет. Клинические и доклинические испытания проходили, например, такие ингибиторы пептидилтрансферазного центра, как ликорин, нарциклазин и бруцеантин, а ингибитор транслокации эметин используется как антигельминтное и противомалярийное средство.
Интересные случаи применения
Гомохаррингтонин. Рибосом-направленные ингибиторы элонгации
Гомохаррингтонин — ингибитор пептидилтрансферазного центра в виде полусинтетического аналога омацетаксина мепесукцината (продаваемого под торговой маркой Synribo; рис. 2) активно применяется для лечения хронического миелоидного лейкоза, а также проходит испытания в терапии ряда других онкологических заболеваний. Кроме того, его широко используют в научной работе: его способность прекращать трансляцию новоинициировавших рибосом (при этом не трогая рибосомы, которые уже успели синтезировать несколько пептидных связей) применяется для картирования старт-кодонов в мРНК.
Рисунок 2. «Синрибо». Применяется для лечения хронического миелоидного лейкоза у людей, лечение которых ингибиторами тирозинкиназ не дало желаемого эффекта. Одобрен одновременно как американским (FDA), так и европейским (EMA) медико-биологическим агентствами.
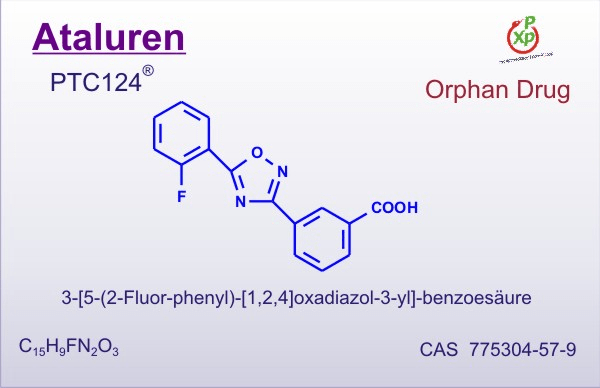
Аталурен и гентамицин. Вещества, вызывающие ошибки декодирования
Рисунок 3. Аталурен. Индуцирует «проскакивание» стоп-кодонов. Лекарство применяется для лечения людей с генетическими заболеваниями, вызванными появлением преждевременного стоп-кодона в важных генах (нонсенс-мутациями). В том числе зарегистрирован и в России. К сожалению, из-за очень высокой цены — от пяти до семи тысяч евро за упаковку, которой хватит на месяц, — не все могут получить доступ к этому лечению.
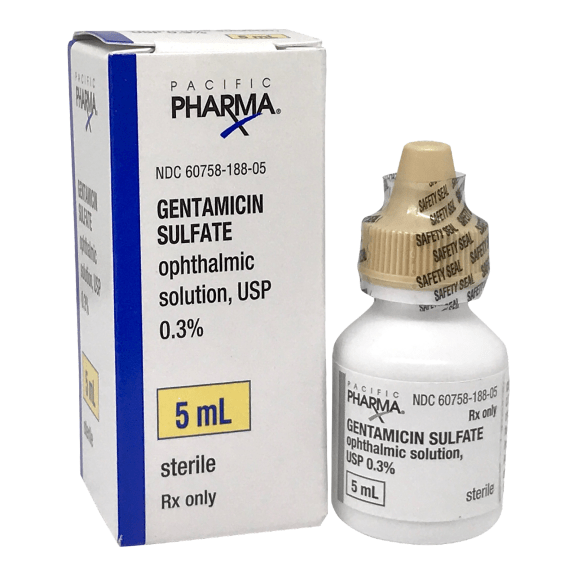
Рисунок 4. Гентамицин. Пока что препарат прошел клинические испытания только как антибиотик, однако у его производных есть потенциал и в терапии генетических заболеваний. Препарат, продаваемый в аптеках, представляет собой смесь более четырех похожих веществ. Его стоимость куда ниже, чем у аталурена: купить тюбик мази для наружного применения можно за 40 рублей. Однако в нынешнем виде гентамицин нельзя принимать в дозах, достаточных для устранения эффектов нонсенс-мутаций: из-за воздействия на рибосомы митохондрий он имеет побочные эффекты в виде нефро- и ототоксичности.
Более 10% генетических заболеваний вызвано однонуклеотидными мутациями, которые привели к появлению преждевременного стоп-кодона в кодирующей части какого-либо важного гена (такие мутации называют нонсенс-мутациями). К примеру, нонсенс-мутации в гене белка дистрофина могут вызывать миодистрофию Дюшенна. Интересно, что механизм терминации на таком случайно возникшем, не прошедшем эволюционный отбор стоп-кодоне несколько отличается от нормального. Это связано с тем, что получившийся «преждевременный» сигнал терминации чаще всего находится далеко от 3′-конца мРНК и расположен не в последнем экзоне (как «настоящие» стоп-кодоны), а также лишен нужного нуклеотидного контекста. В клетке действует специальная защитная система, которая обнаруживает «неправильную» терминацию на таком стоп-кодоне и отправляет транскрипты с нонсенс-заменой на деградацию. Однако примерно в одном из 100–10000 случаев (в зависимости от условий) рибосома проскакивает стоп-кодон, вместо терминации вставляя в пептид какую-либо аминокислоту и продолжая синтез [10], [11]. Долю таких сквозных прочтений можно увеличить с помощью специальных ингибиторов, самыми известными из которых являются аталурен и аминогликозиды, к коим относится гентамицин (рис. 4). Несмотря на то, что сквозные прочтения могут вызывать несколько классов веществ, обычно эта активность ассоциируется с самым большим классом — аминогликозидами. Эти вещества сильнее действуют на преждевременные стоп-кодоны, чем на «правильные», благодаря чему они могут иметь потенциал в терапии заболеваний, вызываемых нонсенс-мутациями. Однако аминогликозиды известны своей токсичностью — ведь они, помимо индукции сквозного прочтения, еще и снижают точность работы рибосомы. Из веществ неаминогликозидной природы, действующих аналогичным образом, лучше всего изучен аталурен (рис. 3), однако он также не очень хорошо показал себя в клинических испытаниях; более того, в некоторых работах приведены аргументы в пользу того, что это вещество может и вовсе не работать так, как заявлено, а его эффекты в экспериментах были связаны с влиянием на стабильность белка-репортера. Поэтому поиски индукторов ошибок декодирования, приемлемых для терапии наследственных заболеваний, продолжаются.
Чтобы понять, как именно ингибиторы могут подавлять активность рибосомы, полезно вспомнить ее общее строение. Это удобно сделать с помощью интерактивного аплета (см. рис. 5).
Рисунок 5. Пристальный взгляд на эукариотическую рибосому. В верхней кнопочной панели можно изучить структурные элементы рибосомы. Для того чтобы узнать о структурном элементе или сайте связывания, наведите курсор на кнопку. В нижней панели можно найти распространенные ингибиторы, которые действуют на разные части эукариотической рибосомы, визуализированные в предыдущем разделе. В виде на лиганд взаимодействующие основания выделены оранжевым. Встроенный в статью этот апплет очень маленький, поэтому рекомендуем открыть полноэкранную версию.
Для показа структурных элементов использована структура дрожжевой рибосомы, полученная методом криоэлектронной микроскопии группой Р. Бекманна (6SNT). Для визуализации используется веб-плагин MolStar.
Ингибиторы трансляционных факторов
Трансляционные факторы — белки, помогающие рибосоме реализовывать разные этапы трансляционного цикла. Чаще всего эти факторы жизненно необходимы для нормального синтеза белка в клетках или митохондриях/пластидах, которые, как правило, тоже имеют свой трансляционный аппарат.
Эта группа веществ взаимодействует с факторами в растворе, блокируя их активность или препятствуя присоединению к рибосоме (во втором случае они могут контактировать не только с фактором, но и с рибосомой, что приводит к неоднозначности в классификации: иногда их относят к ингибиторам рибосомы).
Ингибиторы факторов инициации трансляции
Инициация трансляции в эукариотических клетках устроена сложнее, чем у бактерий: факторов инициации здесь больше, и многие из них являются эукариот-специфичными. Поэтому и набор мишеней для ингибиторов довольно разнообразен. Со всем многообразием факторов инициации и их набором у трех доменов живого удобно ознакомится в таблице 2.
Наиболее перспективными с точки зрения применения в клинике блокаторами этой стадии являются, пожалуй, ингибиторы РНК-хеликазы eIF4A, которые демонстрируют яркую антивирусную активность. В частности, два вещества, относящиеся к семейству рокаглатов, — сильвестрол и зотатифин — в данный момент проходят клинические испытания на больных COVID-19 [12], [13]. Вообще, биосинтез белка является «ахиллесовой пятой» многих вирусов, поскольку большинству клеток обычно не нужно синтезировать белки в таких количествах, как при вирусной инфекции, и незараженная клетка может безболезненно пережить невысокие концентрации трансляционных ингибиторов, которые убьют инфицированную или просто заблокируют размножение вируса.