желудочковая эктопическая активность не обнаружена что это такое
Насколько опасна желудочковая экстрасистолия? Интервью с заведующим отделением хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции ФГБУ «НМИЦ ТПМ» Минздрава России Алексеем Владимировичем Тарасовым.
Желудочковая экстрасистолия (ЖЭС) — разновидность нарушения ритма сердца, проявляется преждевременными сокращениями сердца, активация которых происходит из миокарда желудочков.
Об экстрасистолиях мы поговорим с заведующим отделением хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции ФГБУ «НМИЦ ТПМ» Минздрава России Алексеем Владимировичем Тарасовым.
Как часто Вы в своей практике сталкиваетесь с экстрасистолиями?
Врачи ежедневно сталкиваются с этим диагнозом. Экстрасистолии диагностируются у 50-70% всех пациентов с нарушением ритма, с ишемической болезнью сердца и сердечной недостаточностью.
Расскажите поподробнее о причинах возникновения ЖЭС
ЖЭС — это всегда вторичное нарушение ритма сердца, а, значит, есть какая-то первопричина. Вот ее надо найти врачу, и на нее воздействовать.
Причины могут быть разные: от стресса и наличия вредных привычек – курения, алкоголя, переедания, до патологий сердечно-сосудистой системы – ИБС, стенокардия, гипертония, кардиомиопатия, пороки сердца, миокардит. Также причина может быть в патологиях других внутренних органов – легких, желудочно-кишечного тракта, онкологических заболеваниях.
Насколько желудочковая экстрасистолия опасное заболевание?
Мы никогда не говорим пациенту, что его жизни что-то угрожает, пока не проведем всестороннюю диагностику и не выявим первопричину заболевания. Бывают экстрасистолы безопасные, которые не стоит даже начинать лечить, бывают те, которые требуют немедленных действий!
Какая диагностика ЖЭС?
Главное — понять, угрожает ли экстрасистолия жизни пациента, может ли привести к самому грозному осложнению — внезапной сердечной смерти!
Сначала мы фиксируем жалобы пациента, потом направляем на функциональные исследования сердца. В первую очередь, на ЭКГ в 12 отведениях, затем на суточное холтеровское мониторирование, УЗИ сердца. Для исключения коронарной патологии — нагрузочные тесты. В зависимости от полученных результатов, можем назначить КТ, МРТ, гастроскопию, анализы крови, внутрисердечное электрофизиологическое исследование или генетическое обследование.
То есть, не всем пациентам показано лечение? Расскажите подробнее
Не каждая ЖЭС требует коррекции. Иногда, наоборот, не стоит ее трогать, так как терапия может нанести еще больший вред здоровью. В нашем центре были такие случаи. Не раз мы отменяли антиаритмическую терапию, назначенную другим врачом и отмечали положительную динамику.
Выбор тактики лечения зависит от того, есть ли у пациента органические поражения сердца или оно структурно нормальное.
В лечении мы добиваемся трех целей: уменьшения симптомов, устранения гемодинамических нарушений, улучшения прогноза.
Но наша ключевая цель — профилактика внезапной сердечной смерти. Еще раз подчеркну, главное — определить, имеется ли у пациента на фоне экстрасистолии риск внезапной сердечной смерти!
Какие подходы и методики лечения применяются в вашем отделении?
В самом начале нашей беседы я говорил и сейчас акцентирую на этом внимание, что ЖЭС имеет вторичную природу. Поэтому в начале лечения важно определить первичное заболевание и воздействовать на него.
Далее, это назначение лекарственных препаратов, в том числе антиаритмических, седативных, препаратов калия, магния и др.
При неэффективности лекарственной терапии – радиочастотная аблация или имплантация кардиовертер-дефибриллятора, если аритмия прогностически опасная.
Если нет поражения сердца, пациентам рекомендуется смена образа жизни. Исключение перееданий, тяжелой пищи, алкоголя, курения. Иногда экстрасистолия может уйти даже после отдыха, поездки в отпуск.
А если есть поражение сердца?
Здесь сложнее. У таких пациентов происходят изменения электрофизиологических свойств миокарда, потеря электрической стабильности миокарда, электролитный дисбаланс в миокарде (потеря кардиомиоцитами калия, магния), гиперкатехоламинемия. Главное — назначить бета-адреноблокаторы, так как они выполняют «защитную» функцию от электрической нестабильности у таких больных.
В зависимости от патологии и опасности аритмии мы можем рекомендовать им хирургическое лечение.
В заключении расскажите немного о своем отделении
У нас в отделении хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции накоплен большой опыт в лечении таких пациентов.
В работе мы опираемся на доказательную медицину, национальные и международные рекомендации, прибегаем к консультациям научного и профессорско-преподательского состава нашего Центра.
У нас есть все необходимые условия для быстрой диагностики, качественного лечения и наблюдения пациентов.
По вопросам отбора пациентов для стационарного лечения и высокотехнологичной помощи, консультаций, по любым вопросам относительно работы отделения:
+7 (499) 553-68-79 (зав. отделением Тарасов Алексей Владимирович)
По вопросам состояния госпитализированных пациентов, общение с лечащими врачами:
+7 (499) 553-68-97 (после 14:00) ординаторская
Отдел организации платных медицинских услуг и госпитализации:
Выявление нарушений сердечного ритма при помощи холтеровского мониторирования ЭКГ: всегда ли исследование информативно?
Аксельрод А.С., заведующая отделением функциональной диагностики
Клиники кардиологии ММА им. И.М. Сеченова
Каждый практикующий кардиолог согласится, что ощущение перебоев в работе сердца является одной из самых частых жалоб пациентов кардиологического стационара и кардиологического поликлинического отделения. При этом даже самый опытный врач никогда не будет полностью уверен, какие именно нарушения сердечного ритма стоят за этими жалобами. Именно поэтому на сегодняшний день суточное мониторирование ЭКГ по Холтеру по-прежнему является обязательным исследованием у таких пациентов.
При выявлении нарушений ритма стоит обратить внимание на три основных вопроса:
• какова минимальная и максимальная длительность мониторирования ЭКГ для регистрации нарушений ритма?
• двух-, трех- или двенадцатиканальные регистраторы (мониторы) ЭКГ – что выбрать для оценки эктопической активности?
• каков минимальный и достаточный перечень программных возможностей?
Продолжительность мониторирования ЭКГ: как долго?
Этот вопрос задается наиболее часто. Наиболее правильным является мониторирование ЭКГ не менее 24 и не более 72 часов. При этом можно использовать как
24-часовой (чаще и предпочтительнее), так и 72-часовой регистратор. При отсутствии нарушений ритма за первые сутки после 30-минутного отдыха пациента проводится повторное мониторирование. При отсутствии значимых нарушений ритма за вторые сутки регистрации мониторирование продолжается до 72 часов. В дальнейшем повторная суточная регистрация ЭКГ производится на усмотрение лечащего врача.
Важным является также вопрос необходимости 72-часового регистратора. Такой регистратор может быть удобен, если пациент описывает связь ощущений перебоев в работе сердца с конкретными стереотипными физическими усилиями при длительных переездах, т.е. в ситуации, когда больной не может вернуться в клинику через 24 часа.
Если у пациента с жалобами на перебои в работе сердца нарушения ритма не выявлены в течение 3 суток мониторирования ЭКГ, стоит попытаться их индуцировать во время нагрузочного ЭКГ теста.
Выбор мониторов для анализа нарушений ритма.
При покупке двухканального регистратора дополнительных вопросов при анализе суточной ЭКГ, как правило, не возникает. Некоторое преимущество в редких случаях имеют трехканальные регистраторы: наличие дополнительного канала позволяет более четко дифференцировать желудочковые и суправентрикулярные аберрантные нарушения ритма.
Использование двенадцатиканальных регистраторов для выявления нарушений ритма не является целесообразным: исследование становится менее комфортно, но наличие отведений не вносит дополнительной информации о нарушениях сердечного ритма.
Использование двенадцатиканального монитора оправдано лишь в том случае, когда возникает необходимость оценить динамику сегмента ST и связать нарушения сердечного ритма с эпизодами ишемии миокарда.
Необходимые возможности программного обеспечения.
Правильный выбор возможностей программного обеспечения позволяет значительно облегчить и ускорить анализ холтеровской регистрации. Кроме того, врач, имеющий весь необходимый перечень программных возможностей, будет чувствовать себя гораздо увереннее и всегда будет знать, что ничего не пропустил во время анализа регистрации. Именно поэтому к выбору возможностей программного обеспечения необходимо подойти серьезно.
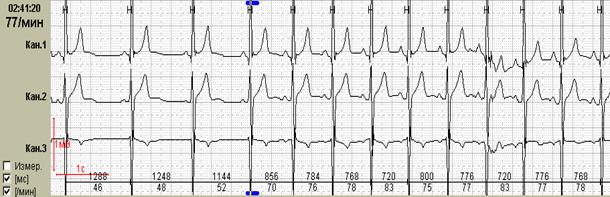
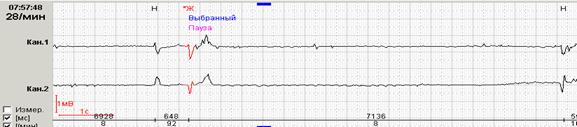
Нередко ощущения перебоев в работе сердца возникают у подростков и лиц молодого возраста с выраженной синусовой аритмией. При этом мы обычно обращаем внимание на ее выраженность и связь с фазами дыхания, которая наиболее отчетливо будет видна при использовании как стандартного выделения фрагмента для печати (рис.1, А), так использования «обзора ЭКГ» (рис. 1, Б).
Рис.1. Пациент К., 17 лет. Дыхательная аритмия в ночное время: стандартное выделение фрагмента для печати (А) и использование «обзора ЭКГ» (Б).
Именно «обзор ЭКГ» позволяет четко дифференцировать дыхательную и недыхательную синусовую аритмию с пароксизмальными суправентрикулярными нарушениями ритма: можно увидеть паузы после пароксизмов ускоренных суправентрикулярных ритмов и стереотипные периоды «гармошкообразного» рисунка с постепенным началом и постепенным окончанием при дыхательной аритмии, как это было представлено на рисунке 1.
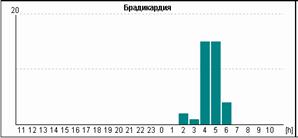
Синусовая брадикардия (правильный синусовый ритм со снижением ЧСС менее 15% от возрастной нормы, что составляет для взрослых менее 60 в минуту) регистрируется во
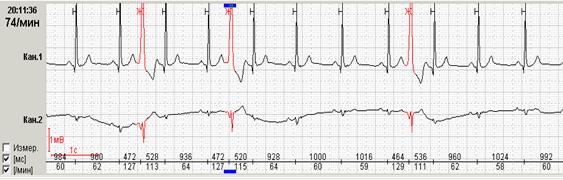
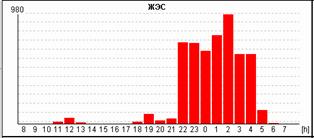
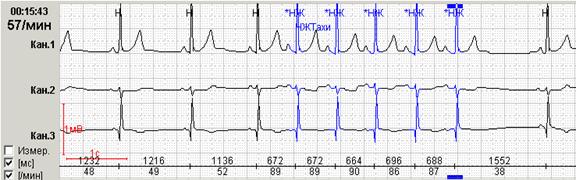
У пациентки Н. на фоне блокированных предсердных экстрасистол выявлена эктопическая желудочковая активность. Особенно важно, что желудочковые экстрасистолы регистрируется именно ночью и только на фоне указанных эпизодов. Взаимосвязь этих событий крайне важна для правильного подбора терапии, поскольку проясняет механизм эктопической желудочковой активности. Именно поэтому предпочтительно, чтобы Ваше программное обеспечение позволяло автоматически построить графики распределения событий по часам.
Некоторые программы вместо графика распределения событий по часам предоставляют пользователям таблицу распределения по часам. На наш взгляд, такая таблица является гораздо менее удобной и наглядной и не позволяет врачу «с первого взгляда» оценить преобладание выявленных нарушений в то или иное время суток.
Важной является также возможность изменения вольтажа полученного ЭКГ-сигнала. Такая возможность особенно необходима, если регистрируется слабо
выраженный, низкоамплитудный зубец Р. Так, например, при смене положения тела в ночное время изменение вольтажа может облегчить диагностику феномена миграции водителя ритма по предсердиям и смены источника автоматизма (рис. 3).
Рис. 3. Пациент А., 77 лет: смена источника автоматизма (короткий эпизод нижнепредсердного ритма из 3 сокращений).
Увеличение общей амплитуды ЭКГ-сигнала приводит к более отчетливой визуализации зубца Р и, следовательно, достоверной диагностике описанных изменений. Кроме того, увеличение вольтажа важно при дифференциальной диагностике пароксизмальных суправентрикулярных нарушений ритма. Так, на рисунке 4, представлена хаотическая предсердная тахикардия с наложившимися на зубцы Т зубцами Р. При отсутствии возможности увеличения вольтажа врачом распечатанные фрагменты тахикардии будут гораздо менее наглядными и вызовут большее количество вопросов у других врачей.
Рис. 4. Больная У., 75 лет: пароксизм хаотической предсердной тахикардии
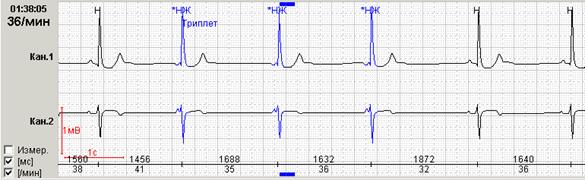
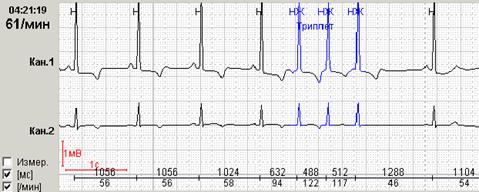
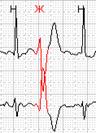
Обязательной является также возможность выделения цветом нарушений ритма различной топографии. На рисунке 5 представлены суправентрикулярные (выделены синим) и желудочковые (выделены красным) групповые экстрасистолы.
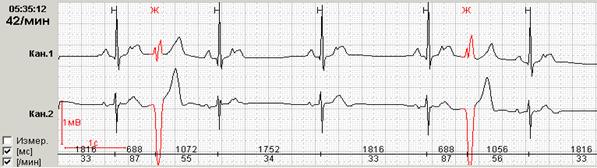
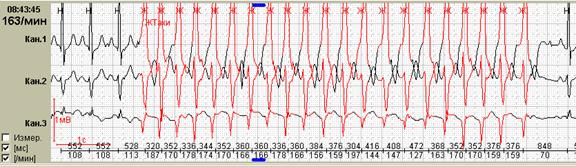
Нередко в холтеровской регистрации встречаются ранние экстрасистолы двух видов: с коротким интервалом сцепления без наслоения на предыдущий зубец Т, а также с коротким интервалом сцепления с наслоением на нисходящее колено зубца Т, т.е. классические экстрасистолы типа R на Т. Способность программ выделять ранние желудочковые экстрасистолы (особенно с классификацией в отдельную группу «R на Т») также значительно облегчают работу врача: используя ее, можно быстро просмотреть запись и подсчитать количество таких экстрасистол.
Рис. 6. Ранние желудочковые экстрасистолы.
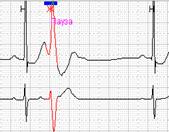
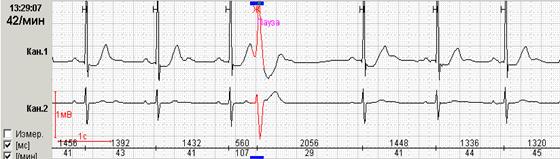
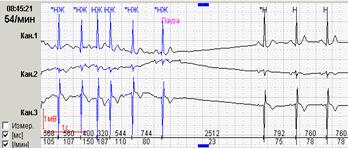
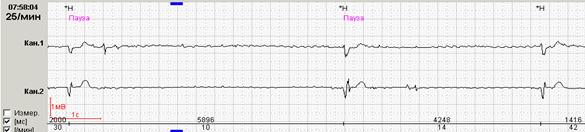
Если ранние желудочковые экстрасистолы возникают на фоне синусовой брадикардии, то последующая компенсаторная пауза может превышать 2 секунды (рис. 7А). При этом подсчет RR-пауз в течение суток и график их распределения по часам (рис. 7Б) стоит отразить в заключении и распечатать стереотипные фрагменты.
Рис. 7. Ранняя желудочковая экстрасистола «R на Т» на фоне синусовой брадикардии у пациента с ишемической болезнью сердца: А – стереотипный фрагмент регистрации; Б – график распределения таких фрагментов в течение суток с выраженным преобладанием в ночные часы.
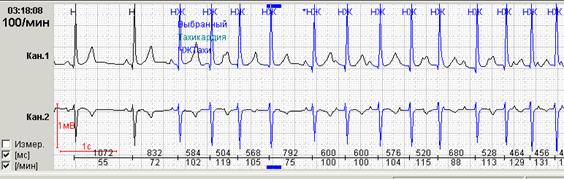
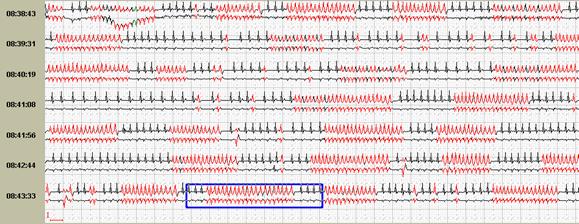
Способность программы при первичном автоматическом анализе выявлять эктопические пароксизмальные нарушения сердечного ритма и производить их количественный подсчет является одной из самых главных возможностей. При их значительном количестве в течение суток имеет большое значение количественный подсчет пароксизмов до и после лечения. Именно поэтому приобретение программного обеспечения без возможности выявления и/или количественного подсчета пароксизмальных нарушений ритма крайне нежелательно (рис.8).
Рис. 8. Больная Г., 60 лет, страдает аритмогенной дисплазией правого желудочка: во время холтеровского мониторирования зарегистрированы частые пароксизмы правожелудочковой тахикардии на фоне аритмогенной дисплазии правого желудочка: А-стереотипные фрагменты желудочковой тахикардии; Б-опция «обзор ЭКГ» наглядно иллюстрирует частоту пароксизмов.
Кроме того, для пациентов с пароксизмальными эктопическими нарушениями ритма крайне важной является возможность выявления пауз, выведение их на экран и разметка во фрагменте абсолютного значения пауз с их количественным подсчетом. Особенности «выхода» из очередного пароксизма – через значимые или незначимые паузы – нередко предопределяют особенности клинического течения заболевания с развитием так называемых «аритмогенных синкоп». Так, на представленном ниже рисунке 9, короткий пароксизм ускоренного суправентрикулярного ритма заканчивается незначимым удлинением RR-интервала до 1552 мсек, а у больного с пароксизмами фибрилляции предсердий пауза превышает 2 секунды и при нарастании этого значения может стать причиной синкопального состояния.
Рис. 9. Короткий незначимый пароксизм ускоренного суправентрикулярного ритма у пациентки с гипертонической болезнью (А) и больного с идиопатической пароксизмальной фибрилляцией предсердий (Б).
Рис. 10. Гемодинамически значимые паузы у пациента с синдромом Фредерика. Переход ФП в идиовентрикулярный ритм через RR-паузу=7.14 сек (А), далее (Б) – идиовентрикулярный ритм с паузами до 5.9 сек.
Большинство программ, представленных различными фирмами-производителями, предоставляют возможность врачу отредактировать в ручном режиме количество и продолжительность как RR-пауз, так и максимального RR-интервала. Возможность такой редакции является крайне полезной при повторном мониторировании одного и того же пациента (например, при динамическом наблюдении больного с мерцательной аритмией, принимающего β-адреноблокатор).
Программное обеспечение также должно давать врачу возможность установить абсолютное значение RR-интервалов, которые будут называться паузами. Это важно, поскольку понятие «пауза» будет различаться у взрослых и детей. У взрослых как на фоне синусового ритма, так и на фоне фибрилляции/трепетания предсердий паузами являются RR-интервалы более 2 секунд. У детей абсолютные значения пауз зависят от возраста.
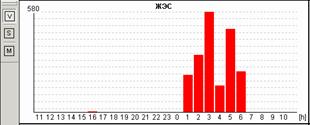
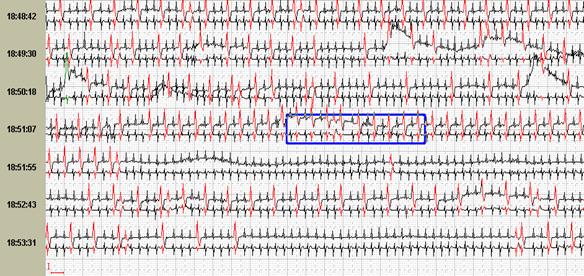
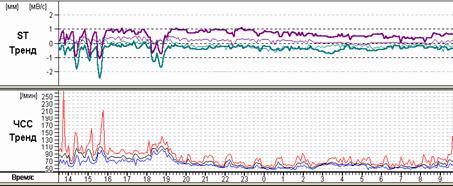
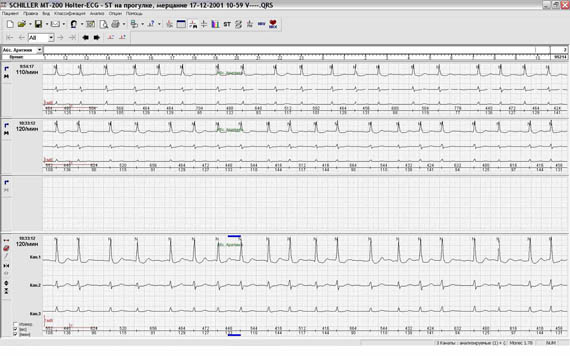
Сопоставление различных возможностей графического изображения друг с другом нередко существенно меняют взгляд лечащего врача на тактику ведения пациента. Так, например, на рисунке 11 представлены различные экраны программы, расширяющие представления о генезе имеющихся нарушений ритма. Стереотипные фрагменты аллоритмии (А), отчетливо видной и в «обзоре ЭКГ» (Б), по времени четко соответствуют периодам ходьбы, описанным в дневнике пациентки. При этом можно видеть ишемическую динамику сегмента ST по трендам (В) и преобладание желудочковой экстрасистолии в периоды бодрствования на графике распределения по часам (Г).
Рис. 11. Больная А., 75 лет. Диагноз: стенокардия напряжения II функционального класса. Представлены стереотипные фрагменты желудочковой бигеминии (А), их большое количество в «обзоре ЭКГ» (Б), тренды динамики сегмента ST, ЧСС (В) и график распределения по часам желудочковой экстрасистолии (Г).
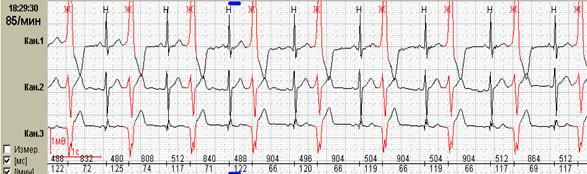
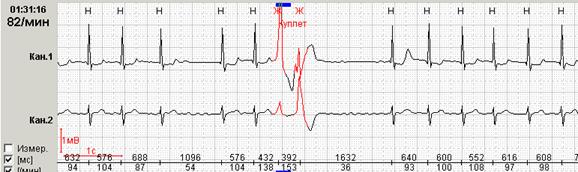
Рис. 12. Больной Н., 68 лет: желудочковый куплет на фоне фибрилляции предсердий.
Нередко Ваше программное обеспечение в автоматическом режиме выявляет фоновую фибрилляцию и/или трепетание предсердий (как и имеющиеся на фоне синусового ритма пароксизмы). Тем не менее, врачу стоит в обязательном порядке проверить в «обзоре ЭКГ», все ли пароксизмы выявлены при автоматическом анализе. В настоящее время практически все существующие программы не способны на полное автоматическое выявление как фоновой мерцательной аритмии, так и суправентрикулярных пароксизмов. К сожалению, не всегда декларируемые производителем возможности программы соответствуют реальности на практике.
Рис. 13. Программа четко визуализирует мерцательную аритмию
В заключении хочется напомнить, что именно нарушения сердечного ритма являются наиболее частым показанием для проведения холтеровского мониторирования ЭКГ. Поэтому при выборе минимальных и оптимальных возможностей программного обеспечения Вам стоит изучить предлагаемое программное обеспечение особенно внимательно.
Желудочковая эктопическая активность не обнаружена что это такое
К началу XXI века распространенность артериальной гипертонии (АГ) в нашей стране приобрела характер эпидемии. Артериальное давление (АД) повышено у 40 % взрослого населения Российской Федерации [4, 5]. АГ является одним из главных модифицируемых факторов риска сердечных и церебральных «катастроф» [8] и одной из ведущих причин смертности и инвалидизации населения.
В настоящее время прилагается много усилий для диагностики и лечения АГ. Это вполне обоснованно, так как АГ страдает в основном трудоспособное население. Существенно меньшее внимание уделяется лицам с высоким нормальным артериальным давлением (ВНАД) – состоянием, когда систолическое АД (САД) находится в пределах 130–139 мм рт.ст. и/или диастолическое АД (ДАД) в пределах 85–89 мм рт.ст. Являясь формально нормальным АД, ВНАД ассоциируется с семикратным повышением риска развития сердечно-сосудистых осложнений по сравнению с таковым при оптимальном АД [9]. Пациенты с ВНАД тем не менее представляют собой неоднородную в прогностическом отношении группу, из которой происходит пополнение рядов больных АГ. Поэтому важным в практическом отношении является вопрос выявления предикторов трансформации ВНАД в АГ. Выделив такие предикторы, мы могли бы a priori отнести пациента с ВНАД к группе высокого или низкого риска развития АГ и, в частности, определить, показана или не показана данному пациенту превентивная фармакотерапия.
Материал и методы исследования
Данная работа является фрагментом продольного проспективного обсервационного исследования спонтанной трансформации ВНАД в АГ. В исследование включено 122 человека, у которых было констатировано ВНАД. Констатацию производили, если во время двух визитов с интервалом 7–10 дней при офисном измерении АД были получены результаты (САД 130–139 и ДАД ≤ 89) или (САД ≤ 139 и ДАД 85–89) мм рт.ст. Средний возраст обследуемых составлял 43,8 ± 4,7 лет, 62 мужчины и 60 женщин. Все включенные лица вели обычный образ жизни, не были субъективно мотивированы на какое-либо медикаментозное лечение, у пациентов отсутствовали ассоциированные клинические состояния, требующие обязательного проведения фармакотерапии.
После получения информированного согласия пациента на включение в исследование на начальном этапе каждому обследуемому было проведено холтеровское мониторирование электрокардиограммы (ХМ ЭКГ) в течение 24 часов с использованием системы МЭКГ-НС-02 («ДМС Передовые Технологии», Москва), в ходе которого определяли, в частности, суточное количество желудочковых (ЖЭС) и суправентрикулярных (СВЭС) экстрасистол. При наличии ЖЭС фиксировали рассчитанные системой средние показатели турбулентности сердечного ритма (ТСР), а именно начало (ТО) и наклон (TS) турбулентности [7].
На конечном этапе, спустя 5 лет, у каждого обследуемого оценивали уровень АД. Для этого в течение двух визитов с интервалом 7–10 дней проводили офисное измерение АД, на основании которого констатировали два варианта эволюции состояния пациента:
1) сохранение уровня АД, соответствующего высокому нормальному – при цифрах САД и ДАД, удовлетворяющих вышеприведенному условию;
2) развитие АГ – при САД ≥ 140 мм рт.ст. и/или ДАД ≥ 90 мм рт.ст. Учитывая значительную продолжительность периода наблюдения, из исследования по разным причинам выбыли 22 человека. Таким образом, в статистический анализ были включены 100 человек (средний возраст на начало проекта 43,1 ± 4,6 лет, 52 женщины). Статистическую обработку (расчет точного критерия Фишера) проводили с использованием пакета Statistica 8.0 (StatSoft, США).
Результаты исследования и их обсуждение
В результате исследования были получены следующие результаты. Из 100 человек с ВНАД через 5 лет наблюдения у 80 была констатирована АГ (у 67 пациентов 1-й степени, у 13 – 2-й степени), у 20 – уровень АД по-прежнему соответствовал высокому нормальному. Таким образом, включенные в исследование ретроспективно были разделены на две группы: I (n = 80, с развившейся впоследствии АГ) и II (n = 20, с неразвившейся АГ).
Предикторами трансформации ВНАД в АГ можно считать такие признаки, которые при априорном исследовании в I группе выявляются достоверно чаще, чем во II. Задача усложняется в связи с тем, что некоторые из изучаемых нами признаков (суточное количество ЖЭС и СВЭС) имеют количественное измерение, то есть, иными словами, являются градуированными. При этом для каждой градации признака частота встречаемости в группах в общем может различаться. В связи с данным фактом поставленная задача распадается на две подзадачи:
1) определить, можно ли с помощью данного признака прогнозировать трансформацию ВНАД в АГ, иными словами, является ли признак предиктором этой трансформации;
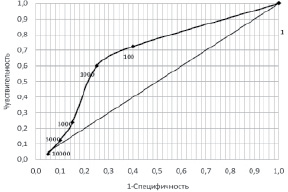
2) какую величину количественного признака следует считать оптимальным граничным значением, то есть при какой величине признака различие между частотой встречаемости признака в I и II группах имеет наибольшую статистическую значимость, а чувствительность и специфичность – максимальные значения.
Первая подзадача решается просто: сопоставляется частота встречаемости признака в I и II группах (νI и νII), при наличии статистически значимых различий в частоте делается вывод о том, что данный признак может быть предиктором трансформации ВНАД в АГ. При этом если νI > νII, мы говорим о положительной прогностической значимости признака, а если νI 0,05
Примечания: есть – количество лиц данной группы с количеством ЖЭС за сутки не ниже приведенного граничного значения (т.е. условие выполняется). Нет – количество лиц данной группы с количеством ЖЭС за сутки ниже приведенного граничного значения (т.е. условие не выполняется). Чувствительность в данном случае отражает способность теста прогнозировать трансформацию ВНАД в АГ и равна отношению количества лиц с развившейся АГ и выполненным условием (для каждого граничного значения) к количеству лиц с развившейся АГ (80). Специфичность в данном случае отражает способность теста прогнозировать отсутствие трансформации ВНАД в АГ и равна отношению количества лиц с неразвившейся АГ и невыполненным условием (для каждого граничного значения) к количеству лиц с неразвившейся АГ (20). ПЦПР – прогностическая ценность положительного результата, ПЦОР – прогностическая ценность отрицательного результата. ОППР – отношение правдоподобия положительного результата, ОПОР – отношение правдоподобия отрицательного результата. р отражает достоверность (точный критерий Фишера – ТКФ, двусторонний вариант) различий (для каждого граничного значения) между долями лиц с выполненным условием в группе с трансформацией ВНАД в АГ (νI) и группе с неразвившейся АГ (νII).
Рис. 1. ROC-кривая для количества желудочковых ЭС за сутки (по данным ХМ ЭКГ). Точки на кривой – граничные значения количества ЖЭС
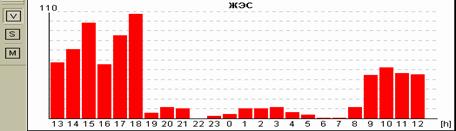
При изучении суправентрикулярной эктопической активности были получены следующие данные. В I группе у 13 человек было зарегистрировано менее 100 СВЭС в сутки, у 35 человек – от 100 до 999, у 25 – от 1000 до 2999, у 4 – от 3000 до 4999, у 3 – от 5000 до 9999. Во II группе у 4 человек было зарегистрировано менее 100 СВЭС в сутки, у 7 человек – от 100 до 999, у 7 – от 1000 до 2999, у 1 – от 3000 до 4999, у 1 – от 5000 до 9999. Десять тысяч и более СВЭС за сутки ни у кого из испытуемых зарегистрировано не было. Для оценки возможности прогнозирования трансформации ВНАД в АГ при помощи признака «суправентрикулярная эктопическая активность с количеством СВЭС ≥ Х за сутки» и определения оптимального значения Х был проведен анализ, результаты которого представлены в табл. 2 и на рис. 2.
Распределение пациентов из групп АГ и ВНАД по количеству суправентрикулярных ЭС за сутки (данные ХМ ЭКГ)