Экстракапсулярное распространение опухоли что это
ТАКТИКА ЛЕЧЕНИЯ ЛОКАЛЬНО-РАСПРОСТРАНЕННОГО (Т3) РАКА ПРОСТАТЫ
Важность дифференциации определяется разными путями лечения: если стадия Т2 дает возможность выполнять радикальную простатэктомию, то при Т4 необходима уже андрогендепривационная терапия.
По современной классификация опухоль Т3 охватывает 2 субгруппы:
Точная дифференциация этих субгрупп клинически невозможна, однако вполне доступна при гистологическом изучении удаленного органа. Применение радикальных методов лечения является без сомнения показанным пациентам с Т3 стадией и фактически локализованным раком простаты (\сверхстадия\ при Т2), в то время как больные с клинически распознанным системным заболеванием должны лечиться иными подходами.
Оптимальная терапия для пациентов с клинически локально прогрессирующим раком простаты окончательно не определена, тактика лечения этих больных вызывает оживленную дискуссию. Многие спорные вопросы относительно выбора того или иного метода остаются нерешенными.
Методами выбора в лечении локально-прогрессирующего рака простаты являются радикальная простатэктомия, наружная лучевая терапия, гормонотерапия (немедленная или отсроченная), а также т.н. \бдительное наблюдение\. Во многих случаях используется мультимодальный принцип лечения. Радикальной простатэктомией можно в клинической стадии Т3 достичь высокой опухоль-специфической выживаемости. Предпосылками для этого является хорошая селекция пациентов. При этом можно достичь опухоль-специфическую выживаемость для стадии рТ3 такую же, как и при опухолях рТ2.
Наличие после радикальной простатэктомии морфологически доказанных лимфогенных метастазов, диктует необходимость проведения комбинированной адъювантной гормонотерапии, что удлиняется продолжительность жизни. Такое лечение можно не проводить в стадии рТ3 без поражения лимфатических узлов.
Спорным остается выбор адекватной и наиболее эффективной терапии для пациентов со стадией рТ3. В наиболее \выгодном положении\ находятся те пациенты, у которых простатическая капсула анатомически частично перфорирована, что ведет к возможному периневральному распространению опухоли. В этих ситуациях экстракапсулярное распространение вероятно является не более важным, чем объем количества проникшей за пределы органа массы.
До недавнего времени в клинической практике для лечения этой формы рака традиционно применялась локальная лучевая терапия в комбинации с гормональной. Исключение составляют молодые пациенты с предполагаемой продолжительностью жизни более 10 лет, у которых проводится радикальная простатэктомия. Однако в последующем выбор лечения статистически определялся современными направлениями и зависел от величины значений ПСА, клинической стадии, шкалы Глиссона. Подобная оценка имела только вероятность выживания и не могла определять прогноз в каждом отдельном наблюдении. Разумеется, выбор адекватного вида лечения определяется правильностью выяснения распространенности опухоли.
Достоверность ректального пальцевого исследования в отношении определения стадии довольно низка. У 9-27% больных, оперированных по поводу рака простаты с клинической стадией Т3, на самом деле оказывается стадия рТ2. Трансректальная УЗИ, МРТ и другие визуализирующие способы дают мало клинически ценной информации о подтверждении данных ректальной пальпации.
Согласно многим исследованиям, метастазирование при значениях ПСА 90% в неблагоприятных и 7; позитивного хирургического края.
Проводимая неоадъювантная гормонотерапия перед наружной лучевой терапией значительно увеличивает выживаемость при локально-прогрессирующем раке простаты в группе со шкалой Глисона 2-6. В одном из исследований, включившем 456 больных со сроком наблюдения в течение 5-6 лет, после неоадъювантной гормонотерапии продолжительность жизни значительно увеличилась [16]. Гормонотерапия начинается за 2 месяца до лучевой терапии и продолжается во время терапии. Авторы рекомендуют неоадъювантную гормонотерапию как стандартное лечение в субгруппе с локально-прогрессирующим раком простаты с благоприятной шкалой Глисона
Клиническая и морфологическая классификация рака предстательной железы
Глава 2. Клиническая и морфологическая классификация рака предстательной железы
Основными диагностическими критериями рака предстательной железы является структурный атипизм: компактное расположение опухолевых ацинусов, беспорядочный их рост с инфильтрацией стромы органа. В строме опухоли происходит гибель эластических волокон, отмечается инфильтрация опухолью прилежащей ткани, инвазия в периневральные и периваскулярные лимфатические щели.
В настоящее время наиболее широкое применение нашла гистологическая классификация Глисона, так как она во многом отвечает требованиям клиники при выборе тактики лечения и прогноза заболевания (рис. 1).
Рис. 1. Гистологическая классификация рака предстательной железы по Глисону
Классификация Глисона основана на степени дифференцировки железистых структур опухоли. Опухоль по показателю Глисона 1 образую практически нормальные железы, структура которых по мере увеличения показателя Глисона утрачивается, и при показателе 5 опухоль характеризуется недифференцированными клетками. Чем больше утрачена дифференцировка тканей, тем хуже прогноз у данного больного.
По классификации Глисона степень дифференцировки опухоли разделяется на пять градаций:
Таблица 9. Классификация по градации Глисона.
| Число баллов по Глисону | Гистологические особенности | Вероятность местного распрoстранение опухоли в течение 10 лет |
| менее 4 | Высокодифференцированный рак | 25% |
| от 5 до 7 | Умеренно дифференцированный рак | 50% |
| более 7 | Низкодифференцированный рак | 75% |
Необходимо сравнение показателя Глисона поданным биопсии и результатам, полученным после радикальной простатэктомии, чтобы знать, насколько точна наша дооперационная диагностика. По данным Epstein I (1997) на материале 499 биопсий соответствие в пределах одной суммы по Глисону встречается от 74% до 94% случаев, (см. табл. 10).
Таблица 10. Корреляция показателя Глисона по данным биопсии и радикальной простатэктомии.
| Показатель Глиссона по данным биопсии | Показатель Глисона по данным радикальной простатэктомии | |||
| 2-4 | 5-6 | 7 | 8-10 | |
| 2-4 | 0 | 5 | 1 | 0 |
| 5-6 | 3 | 225 | 125 | 4 |
| 7 | 0 | 16 | 91 | 13 |
| 8-10 | 0 | 0 | 3 | 13 |
Как указывает автор, сумма Глисона является также наиболее мощным фактором для предсказания прогрессирования после радикальной простатэктомии. Опухоли с показателем Глисона от 8 до 10 имеют мрачный прогноз. Если при этом выявляются региональные метастазы, то пропадает смысл в простатэктомии, хотя она технически выполнима. Все сказанное иллюстрируется таблицей 11. Как видно из таблицы, при показателе Глисона 8-10 в несколько раз ухудшаются все прогностические факторы.
Таблица 11. Корреляция показателя Глисона с выявленной патологией после радикальной простатэктомии.
| Выявленная патология | Показатель Глисона | |||
| 5 | 7 | 8-10 | ||
| Прорастание капсулы простаты | 16% | 24% | 62% | 85% |
| По краям простаты не удаленные раковые клетки | 20% | 29% | 48% | 59% |
| Средний объем опухоли | 2.2 | 2.7 | 5.1 | 4.0 |
| Инвазия в семенные пузырьки | 1% | 4% | 17% | 48% |
| Метастазы в лимфатических узлах | 1% | 2% | 12% | 24% |
Международная классификация рака предстательной железы по системе TNM (1997 год).
Международная классификация РПЖ по системе TNM
Классификация рака простаты
Классификация рака простаты может быть потенциально полезной для выбора метода лечения рака простаты и определения прогноза заболевания. Классификация рака простаты может проводиться несколькими путями: основываясь на распространенности злокачественного процесса, гистологической шкале Глисона, клинической картине и др.
Классификация рака простаты по распространенности опухолевого процесса
Классификация рака простаты по системе TNM (классификация стадий развития опухолей) – стандартная система, позволяющая врачу описать распространенность злокачественного процесса предстательной железы. Классификация стадий развития рака была разработана Американским объединенным комитетом по изучению рака.
Классификация по Т категории
Выделяют четыре Т категории для описания классификации локального распространения ракового процесса, от Т1 до Т4. Эти категории также в свою очередь имеют подразделы.
Т1: опухоль не определяется при пальцевом ректальном исследовании и не определяется при диагностических манипуляциях, например, УЗИ.
Т2: Врач может определять злокачественное образование при пальцевом ректальном исследовании или ультразвуковом исследовании простаты, но при этом опухоль находится в пределах предстательной железы.
Т3: Опухоль растет и распространяется за пределы простаты и может поражать семенные пузырьки.
Т4: Опухоль прорастает в другие ткани, окружающие простату помимо семенных пузырьков, например, уретральный сфинктер, прямую кишку, мочевой пузырь, и/или стенку таза.
Категория N
Категория N определяет распространение опухоли на регионарные, рядом расположенные лимфатические узлы.
NХ: Невозможно оценить состояние регионарных лимфатических узлов. N0: Регионарные лимфатические узлы не затронуты опухолевым процессом. N1: Рак простаты затрагивает один или более регионарных лимфатических узлов.
Категория М
Категория М определяет наличие или отсутствие метастазирования рака простаты в отдаленные ткани и органы. Наиболее часто метастазирование раковых клеток происходит в кости скелета, отдаленные лимфатические узлы, реже легкие и печень.
МХ: Определить наличие метастазов невозможно из-за недостаточности данных. М0: Отдаленные метастазы отсутствуют. М1: Рак простаты распространяется за пределы регионарных лимфатических узлов.
Например, рак простаты T2N0M0 означает наличие у мужчины опухоли, локализованной в пределах простаты, без поражения регионарных лимфатических узлов и метастазов.
Гистологическая классификация рака простаты
Гистологическая классификация рака простаты позволяет установить степень опухолевого процесса или ее агрессивность. В настоящее время в классификации применяется международная шкала Глисона, базирующаяся на результатах микроскопического исследования тканей простаты, полученных при биопсии. Более подробную информацию вы найдете в статье «Степени рака простаты».
Классификация прогностических факторов
Разработанная в 1998 году, классификация рака простаты Дамико помогает определить агрессивность опухоли, отражающую риск распространения и рецидива заболевания после локального лечения. Согласно этой классификации пациент может относиться к одной из трех групп: группа низкого, среднего и высокого риска. Определение принадлежности к той или иной группе основывается на следующих показателях: уровень простата-специфического антигена (ПСА) в крови, степень рака простаты по шкале Глисона, классификация рака по системе ТNM.
Группа низкого риска:
Группа среднего риска:
Группа высокого риска:
График (номограммы) Партина
График Партина – это шкалы, а точнее математические модели учитывающие значение уровня ПСА, результат биопсии по шкале Глисона и клиническую стадию рака простаты и позволяющие прогнозировать дальнейшая прогрессия заболевания. Номограммы составлялись на основании данных о мужчинах, проходивших лечение по поводу рака простаты. Впервые графики Патина были опубликованы в 1993 году. В 2001 году шкалы были модифицированы с учетом новых данных о 5079 мужчинах с локализованным раком простаты, проходивших лечение за период с 1994 по 2000 год.
Итак, еще раз повторим, что график Партина учитывают уровень ПСА, степень рака простаты по шкале Глисона и клиническую стадию рака простаты. По уровню ПСА выделяют следующие категории от 0 до 10, и более 10.0 нг/мл. Баллы шкалы Глисона группируются в три категории от 2 до 4, от 5 до 6, или от 8 до 10.
Ниже представлены модифицированные номограммы Партина, опубликованные в 2001 году и до сих пор не потерявшие своей актуальности в определении вероятности дальнейшей прогрессии рака простаты.
Пример пользования графиком Партина. Мужчина с уровнем ПСА 2,7 нг/мл, степенью рака 3+3=6 по шкале Глисона, клинической стадией Т1с (опухоль не определяемая при ректальном пальцевом исследовании). В таблице №1 необходимо в колонке ПСА выбрать диапазон от 2,4-6,0, а степень по шкале Глисона 5-6. На пересечении выбранных параметров находятся четыре строки, благодаря которым возможно прогнозирование распространения рака простаты: вероятность развития опухоли, ограниченной пределами предстательной железы составляет 92% (от 82% до 98), вероятность экстракапсулярного роста, т.е. за пределы капсулы предстательной железы равна 8% (от 2% до 18%). Поражение семенных пузырьков или лимфатических маловероятно.



В настоящее время существуют компьютерные программы, облегчающие использование номограмм Партина. Необходимо лишь ввести данные уровня ПСА, индекс шкалы Глисона и стадию рака в соответствующие ячейки, после чего автоматически будет получен прогноз.
Вероятность прогноза 95%.
Номограммы Каттана
Номограммы Каттана – это еще одна математическая модель, позволяющая доктору прогнозировать результаты лечения рака простаты. Номограммы Каттана основаны на результатах работы группы людей под руководством М. Каттана и П. Скардино. Информация для создания номограмм собиралась не только в клиниках США, но и медицинских центрах других стран, таких как Австралия, Германия, Норвегия и др. Впервые данные номограммы были опубликованы в 1999 году.
Шкалы Каттана позволяют врачу получить ответы на следующие вопросы:
Пример классической предоперационной номограммы Каттана.
Данная номограмма позволяет предположить вероятность рецидива рака простаты после радикальной простатэктомии.
Рак предстательной железы: диагностика и результаты хирургического лечения локализованных и местнораспространенных форм
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Военно-медицинская академия, Санкт-Петербург
Р ак предстательной железы (РПЖ) является большой социальной и медицинской проблемой. В 1999 г. в США было зарегистрировано более 179 тыс новых случаев РПЖ и 37 тыс человек умерло от РПЖ [2]. РПЖ является самым частым злокачественным новообразованием, встречающимся у мужчин в США, занимает второе место в списке смертей от рака и составляет 29% среди всех диагностированных новообразований. В России сведения противоречивы из–за отсутствия скрининговых программ. Введение подобных программ в США и других странах привело к повышению числа выявляемых случаев РПЖ, которые можно лечить радикально [4].
РПЖ характеризуется непредсказуемостью клинического течения. Некоторые опухоли остаются латентными многие годы, а некоторые быстро прогрессируют в некурабельные метастатические заболевания [13]. Лечение пациентов с локализованным РПЖ является центральным вопросом для практикующих урологов. В течение 10 лет увеличилась не только частота РПЖ, но и возросли возможности различных способов лечения. В настоящее время пациент и его врач могут выбирать между хирургическим лечением – радикальной простатэктомией (РПЭ), наружной лучевой терапией, брахитерапией, криоаблацией, андрогенной блокадой и комбинацией этих методов.
| Безрецидивная выживаемость после РПЭ у пациентов с негативными хирургическими краями составляет 80%. |
Наиболее частым выбором радикального лечения у мужчин с локализованным РПЖ являются РПЭ или лучевая терапия. РПЭ выбирают 30–60% пациентов с клинически локализованным РПЖ, и тем самым они получают шанс излечиться. К сожалению, от 29 до 59% клинически локализованных опухолей, удаляемых посредством РПЭ, имеют экстрапростатическое распространение при послеоперационном изучении и не могут быть излечены полностью одной лишь РПЭ. Необнаруженная экстракапсулярная опухолевая экстензия может привести к ее неполному иссечению и повышает риск рецидивирования [5].
Диагностика и стадирование РПЖ
Современные методы локального стадирования включают пальцевое ректальное исследование (ПРИ), определение простатического специфического антигена (ПСА), трансректальное УЗИ, секстантную биопсию, компьютерное аксиальное сканирование и эндоректальное ядерно–магнитнорезонансное (ЯМР) исследование. Недостаточная чувствительность этих методов приводит к недооценке стадии почти в 50% случаев.
Первое исследование, анализирующее края резекции при РПЭ, было опубликовано в 1983 г. Однако многочисленные материалы трудносопоставимы среди клиник, так как представлены бригадами с различной техникой и в разные периоды. Примерно половина мужчин, подвергшихся РПЭ при клинически локализованном РПЖ, имели экстракапсулярную экстензию при патоморфологическом изучении. При этом 5,9% имели позитивные л/узлы, 7,8% – метастазы, 15,6% вовлечение семенных пузырьков [1].
Частота позитивных краев (ПК) при РПЭ варьирует от 16 до 46%. Совершенно очевидно, что главную роль в этих вариациях играют:
• различие в хирургической технике;
• метод подготовки образцов удаленной ПЖ.
В развитых странах происходит существенное изменение структуры пациентов. С 1988 по 1992 гг. только 1,4% кандидатов для РПЭ имели Т1с (непальпируемое заболевание, выявленное при биопсии). В последний год, по данным клиники Johns Hopkins, 46% мужчин имели Т1с. Эти изменения нехарактерны для России, так как, по данным клиники урологии Военно–медицинской академии, 87% пациентов имеют пальпаторные изменения на момент выполнения биопсии простаты (стадия Т2а и более). Непальпируемая опухоль ассоциируется с низкой патологической стадией, малой частотой ПК и меньшим объемом опухоли в сравнении с пальпируемой. Это, как правило, сочетается с более благоприятными исходами.
Традиционными показаниями для РПЭ являются:
• клинически локализованные формы РПЖ Т1b; T1с; T2, в некоторых случаях Т3;
• ожидаемая продолжительность жизни более 10 лет;
• возраст не более 70–72 лет.
Технические различия в выполнении РПЭ
Снижение позитивных хирургических краев может быть обусловлено модификацией хирургической техники. Термин «анатомический подход при РПЭ», заменяется на «нервосохраняющий». Эти изменения в номенклатуре показывают, что решение сохранить или резецировать заднелатеральные сосудисто–нервные пучки (СНП) принимается индивидуально от случая к случаю и основано на пред– и интраоперационных находках. Техника широкого иссечения СНП не была частью стандартной РПЭ. С дальнейшим улучшением понимания перипростатической анатомии стала возможной более тщательная и точная диссекция апикальной части простаты, что уменьшило вероятность позитивного края на этой стороне.
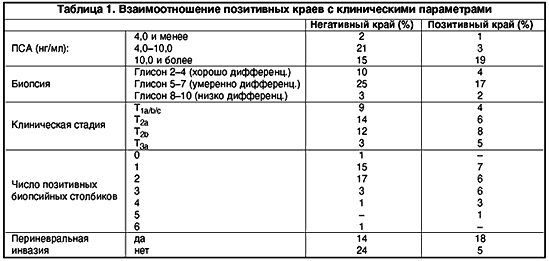
В настоящее время анатомический подход к РПЭ предлагается пациентам с пальпируемыми латеральными очагами, частично в апексе железы, выявленными в предоперационном периоде. В этих случаях прибегают к широкому иссечению одного или обоих СНП. Все мужчины, которые не были потентны до операции, также подвергаются широкой эксцизии обоих СНП. У пациентов с протяженной капсулярной пенетрацией, широкое иссечение СНП ассоциируется с низкой вероятностью позитивных краев в сравнении со случаями, когда эта процедура не выполнялась. По данным клиники Baylor, позитивный хирургический край наиболее часто встречается заднелатерально, в области СНП. Поэтому они модифицировали хирургическую технику и начали резецировать весь или часть СНП более часто. Это привело к снижению частоты ПК на протяжении 1987–90 гг. с 24% до 19%. Опасным является дополнительное иссечение и удаление тканей апикальной области, так как оно приводит к увеличению риска послеоперационного недержания мочи. В клинике урологии ВМА при выполнении 61 радикальной простатэктомии, техника операции (би– или монолатеральное сохранение СНП и пубопростатических связок, объем апикальной резекции) определялась в соответствии с предварительными биопсийными находками. При нахождении злокачественных клеток в двух биопсийных столбиках одной доли, один из которых был выполнен опухолью на всем протяжении, СНП на стороне поражения иссекался. При локализации опухолевых клеток в 3–х биопсийных столбиках производили билатеральное иссечение пучков. Материалы предоперационной биопсии сопоставляли с патологическими находками при изучении удаленной предстательной железы. Частота экстракапсулярной экстензии и позитивных хирургических краев возрастала с увеличением числа позитивных биопсийных столбиков и объема опухолевых клеток в них (табл. 1.)
Влияние ПК на прогрессию РПЖ после РПЭ
Безрецидивная выживаемость для пациентов с негативными хирургическими краями составляет 80%. У пациентов с ПК – от 42 до 64% в течение 5 лет. Только два института имеют 10–летние наблюдения. У пациентов с негативными краями из клиники Hopkins – 74,8% в сравнении с 41,9% у пациентов с ПК. Данные из клиники Duke свидетельствуют о 10–летней безрецидивной выживаемости у 38%.
Безрецидивная выживаемость для пациентов с негативными хирургическими краями составляет 80%. У пациентов с ПК – от 42 до 64% в течение 5 лет. Только два института имеют 10–летние наблюдения. У пациентов с негативными краями из клиники Hopkins – 74,8% в сравнении с 41,9% у пациентов с ПК. Данные из клиники Duke свидетельствуют о 10–летней безрецидивной выживаемости у 38%.
Расхождения между ПК и прогрессией
1. Негативный край и степень злокачественности низка;
2. Позитивный край или степень злокачественности высока;
3. Сочетание ПК и высокой степени злокачественности.
Биохимический и клинический рецидивы после РПЭ
Неудачное радикальное лечение определяется биохимически, как повышенный уровень сывороточного ПСА (> 0,25 нг/мл) при локальном рецидиве или дистантном метастазировании. Биохимический рецидив может быть результатом неполного иссечения опухоли или ростом микрометастазов. В серии Partin et al. вероятность рецидива была прямопропорциональна повышению клинической и биохимической стадии, предоперационному уровню ПСА и сумме Глисона. При ПСА > 10нг/мл частота рецидивирования была 44% в сравнении с 17% при ПСА от 4 до 10нг/мл. Предикторами рецидива являются истинная патологическая стадия, вовлечение ЛУ и семенных пузырьков, сумма Глисона при биопсии, сывороточный ПСА и клиническая стадия при пальцевом ректальном исследовании. Они могут быть использованы для определения вероятности рецидивирования после РПЭ или отбора пациентов для адъювантной терапии [12].
Пациентов после РПЭ можно распределить по прогнозу на 3 группы:
1. Плохой прогноз – вовлечение семенных пузырьков или лимфоузлов или обширная экстракапсулярная пенетрация с суммой Глисона >7;
2. Умеренный – орган-ограниченный рак или незначительная экстракапсулярная пенетрация с суммой Глисона 7 или обширная экстракапсулярная пенетрация с суммой Глисона 6;
Современная хирургическая техника дает возможность полностью удалять экстракапсулярные формы РПЖ у пациентов в стадии Т3N0M0, а также выделять пациентов группы риска, которым при необходимости может назначаться адъювантная терапия [9].
Низкое соотношение метастазирования в ЛУ показывает, что рост опухоли в этой стадии еще длительное время ограничен и поэтому может быть локально излечен. В литературе описывается зависимость частоты поражения ЛУ от объема опухоли и степени ее дифференцировки. При этом отмечают, что подавляющее большинство опухолей в стадии Т3 перед операцией относят к Т2.
Следует остановиться и на комбинированных методах лечения. Так, в клинике Mayo сравнивали равноценные группы пациентов после РПЭ в сочетании с орхэктомией и после одной лишь орхэктомии. С 1967 г. по 1995 г. было оценено 1110 пациентов с позитивными ЛУ. Достигнута общая выживаемость более 10 лет для комбинированной группы (66 ±6%) в сравнении с орхэктомией (28 ±6%). Раковоспецифическая выживаемость в первой группе была выше (79 ±5%), чем в группе с орхэктомией (39 ±7%). Это ретроспективное исследование пациентов в стадии рТХN+ подтверждает, что РПЭ с ранней адъювантной орхэктомией обеспечивает существенные достижения в общей и раковоспецифической выживаемости в сравнении с одной лишь орхэктомией [8].
Теоретически хирургическая циторедукция, уменьшая объем опухоли, делает системную терапию более эффективной. В комбинации РПЭ с андрогенной аблацией 5- и 10–летняя выживаемость без прогрессии составила 80 и 76% соответственно [4]. Исследования позволили сделать вывод, что первичное локальное лечение (РПЭ) приводит к существенному увеличению выживаемости пациентов в сравнении с нелеченными подобным образом.
Эти сообщения указывают на возможность и целесообразность применения активной хирургической тактики как для «традиционных» стадий РПЖ – Т1–Т2, так и в отношении местнораспространенных процессов без вовлечения лимфоузлов (Т3N0M0). Этот опыт особенно бесценен и убедителен у молодых пациентов. Наши результаты подтверждают, что РПЭ является безопасной операцией у тщательно отобранных пациентов при наличии опытной хирургической команды. Кроме того, текущие исследования, возможно, позволят рационально использовать новые методы лечения, такие как использование аутовакцин и дендритных клеток, усиливающие циторедуктивный эффект. Окончательный же ответ на вопрос, показана ли РПЖ и при Т3, может быть дан после очень длительного наблюдения.
1. Brewster S.F., Oxley J.D., Trivella M., Abbott C.D. Preoperative p53, bcl – 2, CD44 and e–cadherin immunohistochemistry as predictors of biochemical relapse after radical prostatectomy. // J.Urol. – 1999. – Vol. 161, №4. – Р.1238–1243.]
2. Сadeddu J.A. Partin A.W., Epstein J.I., Walsh P.C. Stade D1 (T1–3, N1–3, Мо) prostate cancer: a case–controlled comparison of concervative treatment versus radical prostatectomy // Urology. – 1997. – Vol. 50.– P.251–256.
3. Carter H.B. Is sextant prostate biopsy the standard of care in the PSA era. // AUA NEWS. – September/October 1999. – Vol. – 4, – Number 5.
4. Catalona W.J., Partin A.W., Slawin K.M. A multicenter clinical trial evaluation of free PSA in differentiation of prostate cancer from benign disease.// J. Urol., part 2.– 1997.– Vol.157.– P. 111, abstract 434.
5. Editorial: new methods for predicting extracapsular extension before surgery for prostate cancer // J. Urol. – 1999. – Vol. 162, №4. – Р. 1359 – 1360.
6. Epstein J.I., CarMichael M., Walsh P.S. Adenocarcinoma of the prostate invading the seminal vesicle: definition and relation of tumor volume, grade and margins of resection to prognosis// J.Urol.– 1993.– Vol. 149.– P.1040–1046.
7. Garg S., Fortling B., Chadwick D., Robinson M.C., Hamdy F.С. Staging of prostate cancer using 3–dimensional transrectal ultrasound images: a pilot study // J. Urol. – 1999. – Vol. 162, №4. – Р. 1318 – 1321
8. Ghavamian R., Bergstralh E.J., Blute M.L., Slezak J. Radical retropubic prostatectomy plus orchiectomy versus orchiectomy alone for pTxN + prostate cancer: a matched comparison. // J.Urol. – 1999. – Vol. 161, №4. – Р.1223–1228.
9. Gilliland F.D., Hoffman R.M., Hamilton A., Albertsen P., Eley J.W., Harlan L., Stanford J.L., Hunt W.C., Potosky A. Predicting extracapsular extension of prostate cancer in men treated with radical prostatectomy: results from the population based prostate cancer outcomes study // J. Urol. – 1999. – Vol. 162, №4. – Р. 1341 – 1345.
10. Perrotti M., Han K–R., Epstein R E., Kennedy E C., Rabbani F., Badani K., Pantuck A. J., Weiss R. E., Cummings K.B. Prospective evaluation of endorectal magnetic resonance imaging to detect tumor foci in men with prior negative prostatic biopsy: a pilot study // J. Urol. – 1999. – Vol. 162, №4. – Р. 1314–1317.
11. Pound C.R., Сhristens–Barry O.W., Gurganus R.Т., Partin A.W., Walsh Р.С. Digital rectal examination and imaging studies are unnecessary in men with undetectable prostate specific antigen following radical prostatectomy // J. Urol. – 1999. – Vol. 162, №4. – Р. 1337 – 1340.
12. Richie J.P. Screening for prostate cancer. Why the controversy? // Сontemporary Urology. – 1998. – Vol. 10, №7. – P. 26 – 38.
13. Walsh P.С. Detectable PSA after surgery for prostate cancer: what I tell my patients. // AUA NEWS – September / October 1999. – Р. 25.