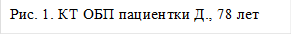Эмболизация печени при метастазах что это такое
Химиоэмболизация метастазов в печени
Кратко о методе лечения
Смысл вмешательства заключается в подведении микрокатетера к сосуду, кровоснабжающему метастаз и введении через него специальных эмболов, блокирующих кровоток. Эти эмболы пропитаны химиопрепаратом, который локально действует именно на эту опухоль.
Химиоэмболизация может значительно увеличить продолжительность жизни у пациентов с метастазами и первичным раком печени. Лечение этим методом, при условии контроля и наблюдения является эффективным у 90% пациентов с данной патологией.
Преимущества лечения в ИСЦ
В нашей клинике методика химиоэмболизации метастазов в печени выполняется по направлению онколога опытными рентгеноэндоваскулярными хирургами. Операция планируется только после детального изучения сосудистого русла печени и опухоли на предварительном качественном МСКТ исследовании сосудов.
Наши специалисты выполняют полную блокаду кровотока в метастазе, применяя доступы к узлу со всех сторон, где подходят питающие сосуды. Для этого мы выполняем КТ в сосудистом режиме после проведения химиоэмболизации и выявляем остаточное русло опухолевого новообразования. После этого проводятся повторные катетеризации сосудов опухоли и процедуры ее эмболизации.
Показания и противопоказания к методу лечения
Химиоэмболизация подразделяется на 2 вида:
Подготовка к лечению
Для планирования вмешательства пациенту необходимо установить точный диагноз и получить направление от онколога на данный вид лечения. С целью диагностики необходимо выполнить общеклинические анализы крови и мочи, анализ крови на свертываемость и биохимический. Для планирования операции необходимо выполнить качественное МСКТ артерий печени.
За день до операции пациенту следует прибыть в клинику. Пах и предплечья должны быть побриты. Врач предупреждает о возможных осложнениях и индивидуальных реакциях организма, берет информированное согласие на вмешательство и насыщает микросферы лекарственным веществом. Перед операцией пациенту предложат не завтракать и введут успокоительные и обезболивающие препараты.
Обезболивание при лечении
Как проходит метод лечения
В рентгеноперационной пациента укроют стерильным бельем, хирургическая бригада оденется в стерильную одежду. Врач обработает место пункции растворами анестетиков так, чтобы пациент находился в сознании, адекватно отвечал на вопросы, но не чувствовал боли. После этого будет выполнена пункция (прокол) в бедренной артерии, через который хирург аккуратно проведен проводник и катетер (тонкую полую трубочку для введения контраста и микроэмболов). Катетер проводится под рентгенологическим контролем непосредственно в печеночную артерию. Чем глубже и ближе к опухоли удается завести инструмент, тем более избирательным является действие микроэмболов и цитостатиков на опухолевые клетки. После полного введения препарата катетер и проводник извлекаются, в области опухоли начинаются процессы некротизирования (омертвления) тканей. Операция обычно длиться не более двух часов. Пациент переводится в палату под наблюдение медицинского персонала. В послеоперационной палате необходимо провести 2-3 дня.Обычно, проведение курса лечения проходит без серьезных осложнений, побочными эффектами могут быть тошнота, рвота, боли в месте формирования некроза. Контроль результатов лечения и выявление новых коллатералей (дополнительных сосудов опухоли или метастаза) выполняется посредством КТ контрастирования через каждые 3 месяца в течение первого года.
Возможные осложнения при лечении
Побочные эффекты химиоэмболизации связаны с механизмом ее лечебного воздействая. Прекращение кровообращения в опухолевом узле приводит к его гибели с распадом. Продукты распада могут всасываться в кровь и вызывать интоксикацию. Клинически это может проявляться повышением температуры тела, общим недомоганием по типу простудного заболевания.
Гибель опухоли вызывает воспалительную реакцию окружающих тканей и брюшины, что сопровождается болевым синдромом умеренной выраженности. Обычно для его купирования достаточно обычных обезболивающих препаратов.
В ответ на введение химиотерапевтических препаратов развивается соответствующие химиотерапии осложнения. Это может быть тошнота, рвота, выпадение волос, снижение количества лейкоцитов в крови. Однако подобные осложнения развиваются значительно реже, так как химиопрепарат вводится локально.
Повышенная температура тела может наблюдаться в течение недели после прохождения процедуры. Вполне нормальным явлением, наблюдающимся на протяжении двух-трех недель, считается повышенная физическая слабость и снижение аппетита.
Наибольшую опасность представляет инфицирование печени и повреждение ее тканей. Риск развития опасных для жизни осложнений после химиоэмболизации не превышает 1%.
Прогноз после метода лечения
Как правило, пациенты, прошедшие через процедуру химиоэмболизации, покидают стационар сразу после нормализации состояния, проявляющейся снижением болей и прекращением тошноты. Обычно это происходит к концу первых-вторых суток после операции. Для стабилизации состояния после выписки им назначают противорвотные средства, анальгетики и антибиотики, помогающие предотвратить развитие инфекции.
В послеоперационном периоде необходимо обращать внимание на показатели функции печени (обязательно сдаются биохимические анализы через 3 дня после процедуры), почек. Если процедура прошла без серьезных осложнений, то можно планировать следующий этап в ближайшее время.
Программа наблюдения после метода лечения
Мы назначаем контрольное исследование МСКТ через 10 дней после проведенной процедуры, чтобы оценить динамику изменений в метастатическом очаге и его остаточное кровоснабжение. При сохранении кровообращения в узле через добавочные сосуды мы планируем следующий этап, позволяющий выключить эти источники кровоснабжения.
После достижения хорошего ангиографического и клинического результата мы выполняем МРТ или КТ печени через 6 месяцев, чтобы отследить поведение узлов в печени. Значительное их уменьшение или исчезновение говорит о правильности выбранного препарата и хирургического подхода. При появлении признаков возобновления роста мы выполняем дополнительные процедуры химиоэмболизации.
Подобный подход позволяет долгое время контролировать онкологический процесс и обеспечивает максимальную продолжительность жизни больным с запущенным раковым процессом.
Что такое сосудистая эмболизация?
Это рентгенохирургическая процедура, которая используется и в онкологии для ухудшения кровоснабжения опухолевых тканей. Злокачественное новообразование формирует вокруг себя сеть сосудов, по которым к нему поступает кислород и питательные вещества, необходимые для размножения клеток опухоли. Эмболизация, то есть закупорка, перекрытие таких сосудов оставляет новообразование без притока крови, что ведет к постепенной остановке его роста за счет отмирания злокачественных клеток.
Как проводят эту процедуру?
Эмболизация – это малоинвазивный, то есть не связанный с масштабными хирургическими вмешательствами, метод лечения. Иногда он может даже послужить альтернативой традиционной операции.
Доступ к области, в которой находится опухоль, врачи получают через крупные сосуды человеческого тела, расположенные по соседству. Через очень небольшой разрез в тот или иной сосуд вводят катетер и медленно перемещают его к новообразованию. Вся эта процедура проходит под контролем рентгеноскопии – врач видит, куда и насколько он продвигает катетер.
По достижении сосуда, питающего опухоль, через катетер вводят эмбол – вещество или устройство, которые призваны закупорить сосуд, остановить кровообращение в нем. После этого делают несколько ангиографических снимков для того, чтобы удостовериться, что операция прошла успешно, и эмбол установлен именно там, где требовалось. Чаще всего такие вмешательства проходят под местной анестезией, но иногда, например, при эмболизации опухолей в печени, используют и общий наркоз.
Какие есть типы эмболизирующих материалов?
Наиболее эффективным способом сосудистой эмболизации в современной онкологии считается химиоэмболизация с использованием микросфер. Микросферы представляют собой полимерные частицы шарообразной формы и диаметром от 50 до 200 мкм. Их диаметр также можно подбирать в зависимости от ожидаемого размера сосудов, питающих опухоль. После введения эти частицы «застревают» в просвете сосудов, вызывая их необратимую эмболизацию. Кроме того, перед вмешательством микросферы также насыщают препаратами для химиотерапии. После закупорки сосуда они начинают высвобождать эти цитостатические лекарственные вещества и могут поддерживать их терапевтическую концентрацию до месяца.
При каких онкозаболеваниях показана сосудистая эмболизация?
Эмболизацию с использованием микросфер и одновременным применением препаратов для химиотерапии назначают при:
Каковы преимущества сосудистой эмболизации?
Как проходит сосудистая эмболизация в клинике «Анадолу»?
Специалисты нашего медицинского центра используют самые современные эмболизационные материалы, а потому этот метод онкологического лечения дает отличные результаты. Кроме того, очень многое зависит от профессионализма врачей, проводящих данную процедуру. В клинике «Анадолу» сосудистую эмболизацию выполняет целая команда высококвалифицированных специалистов: хирург-онколог, химиотерапевт, сосудистый хирург, а также интервенционный радиолог, который обеспечивает контроль введения катетера.
Эмболизация печени при метастазах что это такое
Самарский областной клинический онкологический диспансер
Эффективность химиоэмболизации печеночных артерий при метастатическом колоректальном раке
Журнал: Онкология. Журнал им. П.А. Герцена. 2012;1(2): 62-65
Воздвиженский М. О. Эффективность химиоэмболизации печеночных артерий при метастатическом колоректальном раке. Онкология. Журнал им. П.А. Герцена. 2012;1(2):62-65.
Vozdvizhenskiĭ M O. Efficiency of hepatic artery chemoembolization for metastatic colorectal cancer. P.A. Herzen Journal of Oncology. 2012;1(2):62-65.
Самарский областной клинический онкологический диспансер
Самарский областной клинический онкологический диспансер
Колоректальный рак (КРР) является одной из наиболее распространенных форм рака среди мужчин и женщин и занимает 2-е место по смертности среди онкологических заболеваний [6]. В связи с особенностями венозного оттока КРР наиболее часто метастазирует в печень (50—80%). Наличие метастазов является плохим прогностическим признаком — медиана выживаемости при этом составляет от 14 до 19 мес при проведении химиотерапии схемами FOLFOX (5-фторурацил, лейковорин и оксалиплатин) и FOLFIRI (фолиевая кислота, 5-фторурацил, иринотекан) [8]. Целенаправленное лечение метастазов КРР в печени с использованием трансартериальной химиоэмболизации имеет потенциал снижения смертности и увеличения выживаемости. В опубликованных работах [1, 2, 5, 9] показана эффективность химиоэмболизации, но исследований, в которых оценивается влияние химиоэмболизации на выживаемость при метастазах КРР, недостаточно.
Целью настоящего исследования явился ретроспективный анализ эффективности лечения пациентов с метастазами КРР в печени с применением химиоэмболизации одной из печеночных артерий.
Материалы и методы
Исследование было одобрено этическим комитетом ГБУЗ СОКОД. Информированное согласие было получено у всех пациентов. В период с октября 2006 по июль 2011 г. выполнен 201 сеанс химиоэмболизации (в среднем по 2 у одного пациента) 130 пациентам с метастазами КРР в печени. Основными показаниями к трансартериальной химиоэмболизации были неэффективность системной химиотерапии, изолированное метастатическое поражение печени с преимущественным поражением одной доли и когда поражение печени определяло прогноз заболевания. Абсолютными противопоказаниями к химиоэмболизации были некорригируемые нарушения свертываемости крови, тяжелая тромбоцитопения или лейкопения, сердечная или почечная недостаточность в стадии декомпенсации, печеночная энцефалопатия, желтуха и/или расширение внутрипеченочных желчных протоков.
До начала лечения всем пациентам были выполнены компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) брюшной полости и органов грудной клетки, а также общий и развернутый биохимический анализы крови, коагулограмма, определен уровень раково-эмбрионального антигена (РЭА).
До и после процедуры химиоэмболизации больные получали комплексную инфузионную терапию, антибиотикопрофилактику.
У всех пациентов для доступа к общей бедренной артерии был использован метод Сельдингера. Долевую артерию печени с наибольшими по размеру метастазами катетеризировали суперселективно. Эмболизация выполнялась микросферами DC Bead (Terumo) размером 300—500 и 100—300 мкм под контролем ангиографического комплекса Innova 4100 («General Electric»). Во флакон с микросферами по рекомендованной производителем технологии вводилось 100 мг иринотекана. Для одного сеанса химиоэмболизации использовались 1—2 флакона микросфер и 100—200 мг иринотекана или 50—100 мг доксорубицина. Объем вводимой эмульсии в каждой процедуре зависел от размера доли печени и ее кровоснабжения и составил от 3 до 20 мл. Эта схема химиоэмболизации была использована без изменений у всей когорты пациентов.
Клиническая оценка включала анализ КТ или МРТ брюшной полости и лабораторных данных, включающих общий и развернутый биохимический анализы крови, коагулограмму. Уровень РЭА определялся через 1 мес после химиоэмболизации и затем каждые 3 мес. При ответе опухоли на лечение или стабилизации процесса проводили повторную химиоэмболизацию. Ответ на каждый курс лечения определяли по критериям «оценки ответа солидных опухолей» (RECIST) [7]. Частичным ответом считали уменьшение размера печеночных метастазов, по меньшей мере, на 30%, прогрессирование определялось как увеличение опухолевого очага минимум на 20% и/или появление новых метастазов, стабилизация — как отсутствие изменений размера и количества метастазов.
Общую и безрецидивную выживаемость рассчитывали по методу Каплана—Мейера. Кривые выживаемости рассчитывали с момента диагностики метастазов в печени и времени начала химиоэмболизации. Анализ данных в подгруппах проводили в зависимости от количества курсов предыдущей системной химиотерапии, наличия внепеченочных метастазов на момент начала химиоэмболизации.
Результаты
Среди больных было 42 (31%) женщины и 99 (69%) мужчин. Средний возраст составил 59,6±9,6 (46—72) года. У 59 (57%) больных метастазы в печени выявлены синхронно с первичной опухолью. У остальных больных метастазы в печени были диагностированы в течение 21 мес. У 54 (45%) больных метастазы в печени были ранее резецированы, у 30 (23%) до первого цикла химиоэмболизации выполнена радиочастотная абляция метастатического очага(-ов). У 60 (46%) пациентов имелось внепеченочное распространение КРР. Метастазы определялись в лимфатических узлах, легких, надпочечниках, головном мозге и костях. У 67 (52%) пациентов проведен один курс системной химиотерапии, 36 (28%) получили два курса и 24 (18%) — от 3 до 5 курсов химиотерапии. Не было сведений о предыдущих курсах химиотерапии у 3 пациентов (см. таблицу).
В общей сложности был проведен 201 сеанс трансартериальной химиоэмболизации (от 1 до 5, в среднем по 2 у одного больного) 130 пациентам. У 6 (5,2%) пациентов наблюдался частичный ответ, у 52 (45%) — стабилизация очага в печени и у 54 (49,6%) — прогрессия. Медиана времени до прогрессирования метастазов КРР в печени после лечения составила 5 мес.
Ответ на лечение оценивался изменением уровня РЭА. У 84 (65%) пациентов отмечался повышенный уровень РЭА перед химиоэмболизацией. У 52 (40%) наблюдали снижение уровня РЭА (по меньшей мере, на 50%) после лечения, среди которых у 14 (11%) пациентов РЭА снизился до нормального уровня. У 21 (16%) больного уровень РЭА снизился менее чем на 50% и у 36 (28%) отмечено увеличение уровня РЭА. У 7 (5%) пациентов уровень РЭА после лечения определен не был.
Дата смерти не была определена у 14 из 130 пациентов. Эти пациенты были исключены из анализа выживаемости. Для оставшейся группы (116) пациентов медиана выживаемости составила 32 мес с момента установления диагноза первичной опухоли. 1-, 3- и 5-летняя выживаемость составила 94, 56 и 7% соответственно (рис. 1). 

Результаты в подгруппах анализировали в соответствии с количеством курсов системной химиотерапии до первого сеанса химиоэмболизации. Выживаемость была значительно лучше, когда химиоэмболизация была выполнена после одного или двух курсов системной химиотерапии, чем после 3—5 курсов (р=0,03). 1- и 3-летняя выживаемость со времени начала химиоэмболизации у больных после 1 курса системной химиотерапии составила 68 и 28% соответственно; после 2 курсов — 40 и 14% соответственно. После 3—5 курсов 1- и 3-летняя выживаемость снизилась до 14 и 2% соответственно.
Осложнения развились у 20 (11%) пациентов: инфаркт печени — 5, гематома в месте катетеризации — 5, абсцесс печени — 4, острый холецистит, связанный с попаданием эмболизата в пузырную артерию, — 4, лейкопения 1—2-й степени — 3. Послеоперационная летальность не наблюдалась.
Обсуждение
Данные представленного ретроспективного анализа показывают, что химиоэмболизация печеночной артерии обеспечивает локальный контроль заболевания и улучшает выживаемость.
Считается, что единственным на сегодняшний день радикальным методом лечения метастазов КРР является резекция печени с 5-летней выживаемостью 27—60% [6]. Однако резекция возможна только у небольшого количества (15—25%) таких пациентов. По мнению ряда авторов, трансартериальная химиоэмболизация может быть использована в качестве второй линии терапии после резекции для лечения рецидивных и/или нерезектабельных метастазов [9]. Такая ситуация наблюдалась у 52 (45%) больных, включенных в настоящее исследование, у которых ранее была выполнена резекция печени.
В настоящее время стандартом лечения для нерезектабельных метастазов КРР в печени является системная химиотерапия по схемам FOLFOX и FOLFIRI с добавлением или без добавления биологических агентов, таких как бевацизумаб и цетуксимаб. Медиана выживаемости при этом составляет 15—21 мес без биологических агентов и 20—21 мес с добавлением бевацизумаба [4, 8]. При добавлении цетуксимаба к стандартной химиотерапии медиана общей выживаемости у пациентов с метастатическим КРР и KRAS дикого типа составила 28 мес в исследовании CRISTAS и 26 мес в исследовании OPUS [10].
По данным ряда авторов [3, 5, 6, 9], медиана выживаемости составляет 29 мес с момента диагностирования метастазов КРР в печени и 8,6 мес от начала химиоэмболизации. Следует отметить, что в этих исследованиях химиоэмболизация выполнялась с интервалом от 6 до 8 нед, в отличие от 4-недельного интервала, используемого в нашем исследовании. При использовании RECIST-критериев частичный ответ отмечался у 14,7% пациентов, стабилизация в развитии метастазов у 48,2% больных и прогрессирование заболевания у 37,1% больных. В указанных работах сообщается о медиане выживаемости 38 мес с момента установления метастазов в печени и 14 мес от начала химиоэмболизации без статистически значимых различий между группами с различными комбинациями химиотерапевтических препаратов. Полученные нами результаты были сопоставимы с данными литературы. Медиана выживаемости составила 32 мес с момента установления диагноза и 16 мес с начала химиоэмболизации.
Таким образом, результаты нашего исследования показывают, что химиоэмболизация печеночных артерий обеспечивает локальный контроль заболевания в 50,2% случаев. При этом медиана выживаемости составила 32 мес с момента установления первоначального диагноза КРР, 26 мес с момента диагностики метастазов в печени и 16 мес с начала химиоэмболизации, что демонстрирует лучшие показатели выживаемости по сравнению с применением только системной химиотерапии.
Эмболизация печени при метастазах что это такое
Печень – паренхиматозный орган, наиболее часто поражаемый злокачественными новообразованиями. В структуре злокачественных новообразований печени выделяют две основные формы: первичный рак печени и метастатическое поражение. Метастатический рак печени встречается гораздо чаще первичного [4]. Среди всех первичных злокачественных новообразований печени частота ГЦР достигает 95%. ГЦР является существенной проблемой общественного здравоохранения, занимая 5-е место по распространенности, 3-е по числу летальных исходов среди злокачественных новообразований печени и 1-е место среди причин смерти у больных с циррозом печени [1].
Цирроз печени независимо от этиологии – основной фактор риска развития ГЦР. По статистике, ГЦР возникает у 3–5% больных циррозом печени, причем значительно чаще у мужчин. Нередки случаи гепатоцеллюлярной карциномы при алкогольном циррозе печени, гемохроматозе, аутоиммунном гепатите, наследственной недостаточности α1-антитрипсина, хронической HCV-инфекции, а также при некоторых редких наследственных заболеваниях (наследственная тирозинемия, нарушение обмена гликогена) [3].
Золотым стандартом лечения больных со злокачественными новообразованиями печени являются резекция печени и в более редких случаях трансплантация печени. Однако, к моменту диагностики радикальное удаление опухоли возможно лишь у 5-15 % больных. Вместе с тем, более чем у 70-90% пациентов после радикальной резекции в течение 3-5 лет развивается рецидив заболевания, из них повторную резекцию удается выполнить не более чем у 10% [5].
С целью улучшения отдаленных результатов лечения больных нерезектабельными опухолями печени в клиническую практику были внедрены рентгенэндоваскулярные методики. К ним относятся: химиоинфузия в печеночную артерию, химиоэмболизация и масляная ХЭПА, радиоэмболизация.
Питание опухолей печени на 90-95% осуществляется за счет артериальной крови, в то время как нормальная паренхима имеет двойное кровоснабжение: 70% из воротной вены и лишь 30% из печеночной артерии. Исходя из этого, окклюзия печеночной артерии, кровоснабжающей опухоль, приводит к ишемическому некрозу опухолевых клеток, оставляя сохранными здоровые гепатоциты [5].
ХЭПА микросферами основана на введении в артерии, питающие опухоль, эмболизата, состоящего из микросфер и адсорбированного на них химиопрепарата. Методика обладает следующими достоинствами: селективное воздействие на опухолевую ткань; время элиминации химиопрепарата с поверхности микросфер составляет от 1 недели до 2 месяцев в зависимости от размера микросфер; хемотоксичность практически отсутствует, так как концентрации химиопрепарата в системном кровотоке низкие, поэтому возможно одномоментное введение больших доз химиопрепарата; ишемия опухоли посредством микросфер, при этом можно регулировать ее глубину, подбирая размер микросфер [2].
Предлагаем вниманию читателей описание клинического случая ХЭПА микросферами у пациентки с неоперабельным ГЦР, проведенной в отделении рентгенохирургических методов диагностики и лечения Республиканского кардиологического диспансера г. Чебоксары.
У пациентки Д., 78 лет, в апреле 2017 года на ультразвуковом исследовании органов брюшной полости (УЗИ ОБП) было выявлено очаговое образование печени, с целью дообследования была направлена в Республиканский клинический онкологический диспансер г. Чебоксары.
Из сопутствующих заболеваний: хронический вирусный гепатит С, гипертоническая болезнь 2 ст., атеросклероз аорты, варикозная болезнь нижних конечностей.
Рентгенография легких: рентгенологических признаков онкопатологии легких не обнаружено.
Магнитно-резонансная томография головного мозга: МР-признаки кистозно-глиозных изменений в лобной доле справа. Очаги энцефаломаляции в лобно-теменных отделах с обеих сторон дисциркуляторного характера. Заместительная смешанная гидроцефалия на фоне атрофических изменений вещества головного мозга.
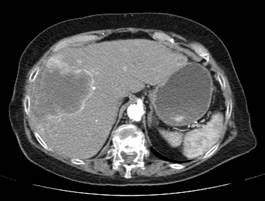
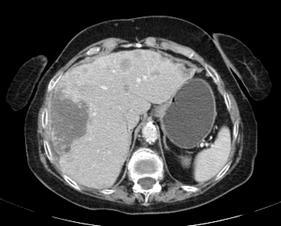
Компьютерная томография органов брюшной полости (КТ ОБП) от 19.08.2017: в правой доли печени определяется большое гиподенсное образование примерными размерами 123х57х95 мм без четких контуров, более четко выявляемое при контрастировании. Здесь же в печени определяется множество образований различных размеров до 24 мм (Рис.1).
УЗИ ОБП от 18.08.2017: Ультразвуковые признаки незначительного увеличения размеров печени на фоне диффузно-очаговых изменений (образование правой доли печени, множественные метастазы). Диффузные изменения паренхимы поджелудочной железы.
УЗИ щитовидной железы и периферических лимфатических узлов (ЛУ): Признаки очаговых образований обеих долей щитовидной железы. УЗ-патологии периферических ЛУ на момент осмотра не выявлено.
УЗИ органов малого таза: УЗ-образование в проекции левого яичника, свободная жидкость в позадиматочном пространстве.
Эзофагогастродуоденоскопия: Варикозное расширение вен пищевода 1 степени (в виде флебэктазии). Недостаточность кардии 2 степени. Дуодено-гастральный рефлюкс.
Колоноскопия: Дивертикулы сигмовидной кишики.
Эхокардиография: Атеросклеротические изменения стенок аорты с переходом на створки аортального клапана (АоК). Кальциноз АоК степени. Регургитация на АоК 0-1 степени. Увеличение массы миокарда левого желудочка.
Электрокардиография: Синусовый ритм 70 в минуту, нормальное положение электрической оси сердца.
Маммография: Сосудистые кальцинаты обеих молочных желез.
Гистологическое исследование от 21.08.2017: Гистологическая картина наиболее соответствует псевдожелезистому варианту гепатоцеллюлярной карциномы.
Биохимический анализ крови от 15.08.2017: С-реактивный белок – 25 мг/л, аланинаминотрансфераза- 12,5 ЕД/л, аспартатаминотрансфераза – 27,9 ЕД/л, щелочная фосфатаза- 156,6 Ед/л, гаммаглутамилтрансфераза – 88,8 Ед/л, билирубин прямой – 6,2 мкмоль/л, билирубин общий – 17,4 мкмоль/л, альбумин – 42,7 г/л, креатинин – 59,4 мкмоль/л, мочевина – 6,7 ммоль/л, общий белок – 77 г/л, глюкоза – 7,65 ммоль/л.
Антитела к НCV – положительные, HBsAg – не обнаружены.
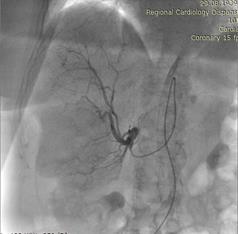
После проведенных обследований был выставлен диагноз: ГЦР печени Т3aN0M0, стадия 3а. Пациентка была направлена на оперативное лечение: ХЭПА гепасферами с доксирубицином 50 мг сначала правой, затем левой печеночной артерии.
Через 6 недель выполнена химиоэмболизация левой печеночной артерии аналогичным способом.
Выполнена контрольная КТ ОБП от 05.12.17: В структуре печени сохраняются множественные диффузные гиподенсные очаги (№15-20), более в правой доле печени – с наличием массивного узла в С5, С6, С8 сегментах размерами 102х70 мм, округлой овальной формы (Рис.6).
Рентгенэндоваскулярная химиоэмболизация артерий печени является методом выбора лечения больных с неоперабельным ГЦР и характеризуется малой инвазивностью, высокой селективностью воздействия и низкой печеночной и системной токсичностью. Данный метод позволяет добиться стабилизации или регресса опухолевого процесса, а также улучшить показатели выживаемости пациентов с нерезектабельным первичным раком печени.