Фибромускулярная гиперплазия желудка что это
Фовеолярная гиперплазия и кишечная метаплазия
Вопрос:
Здравствуйте, доктор. Около месяца мучили боли в районе желудка. Обратился к гастроэнтерологу. Сдал анализы крови (норма), кала (норма), УЗИ брюшной полости (не выявлено патологий), видеоколоноскопия (органической патологии не выявлено), ФГДС (хронический гастрит, дуоденопатия, НР++).
Назначены «Улькавис» по 2 шт. 2 раза в день, «Нольпаза» 20 мг 2 раза в день, «Необутин 200» 3 раза в день. Дробное питание и диета. Сказали, приходить повторно колоноскопию через год и меньше нервничать. Какое-то время поболело и прошло. Через три месяца по своей инициативе сходил на ФГДС с биопсией (платно, без направления). Врач сказал, что он ничего криминального не видит и взял 1 кусочек биопсии из антрума по малой кривизне. Спустя неделю пришёл результат биопсии: хронический гастрит без атрофии желёз умеренной выраженности и незначительной активности, очаговая фовеолярная гиперплазия и кишечная метаплазия (до 10% биоптата). НP (-).
Меня напрягают слова «фовеолярная гиперплазия» и «кишечная метаплазия». Нужно ли сейчас идти к врачу в свете новых обстоятельств или через год, как она велела. Соблюдаю диету, ничего не болит. Спасибо.
Ответ:
Приезжайте к нам в институт пластической хирургии и косметологии на консультацию и выполнение хромоскопии и биопсии OLGA/OLGIM.
Фибромускулярная гиперплазия желудка что это
Нейроэндокринные опухоли желудка (НЭО) – согласно классификации ВОЗ, определяются как опухоли диффузной эндокринной системы. В прошлом они составляли 2–3 % всех гастроинтестинальных карциноидов и 0,3 % всех желудочных неоплазий. Согласно последним эпидемиологическим данным доля НЭО желудка в структуре НЭО ЖКТ составляет от 5 % (в Канадских исследованиях) до 23 % (в Австрийских) [5]. Такие различные колебания обусловлены разным подходом в диагностике НЭО в различных странах и в разнообразии клинико-анатомических особенностей, что диктует целесообразность в поиске новых диагностических признаков. В зависимости от клинико-патологических признаков, стадии процесса, НЭО имеют очень различное поведение, варьируясь от индолентных форм до жизнеугрожающих [3].
В слизистой оболочке желудка (СОЖ) идентифицировано 8 типов эндокринных клеток закрытого и открытого типов: G, продуцирующие гастрин, ECL, гистаминсохраняющие, – наиболее многочисленная группа, P/D1, содержащие грелин и обестатин; D, секретирующие соматостатин; ЕС (желудочные и кишечные), вырабатывающие серотонин, и А, содержащие глюкагон. Имеются определенные закономерности в распределении эндокринноцитов в СОЖ – антральные и прилежащие пилорические железы – зона расположения G, D, EC, A клеток; фундальные – ECL, P/D1, EC, D; в очагах кишечной метаплазии превалируют EC клетки кишечного типа.
Соответственно классификациям ВОЗ гастроэнтеропанкреатические НЭО делятся на хорошо дифференцированные (типы I, II, III ECL – клеточные и не ECL-клеточные) и плохо (низко) дифференцированные эндокринные карциномы (PDECs) [8]. Все НЭО 1 типа ведут себя как доброкачественные опухоли. НЭО 2,3 типов часто имеют признаки злокачественности и приводят больных к смерти. Отмечены переходы от высоко- до умеренно- и низкодифференцированных опухолей [6].
Наиболее частыми НЭО являются ECL-клеточные опухоли (I–III типов).
Хорошо дифференцированные желудочные опухоли (тип I ECL-клеточные НЭО) представляют большую часть эндокринных опухолей желудка, встречаются чаще у женщин (соотношение М:Ж – 1:2,5). Опухоли развиваются менее чем у 1 % больных, на фоне гипергастринемии, вызванной хроническим атрофическим гастритом, типа А или хеликобактерным. Больные, имеющие I тип ECL-клеточных НЭО, также страдают пернициозной анемией или другими аутоиммунными заболеваниями. Опухоли такого типа обычно малы, часто множественны, состоят из относительно мономорфных клеток, группирующихся в кластеры или трабекулы. Большинство опухолей располагается в СО, очень редко отмечается инвазия в более глубокие отделы желудочной стенки. Постоянно при этом наблюдается ECL-клеточная гиперплазия и дисплазия в окружающей СОЖ. Тип II ECL-клеточных опухолей составляет 6–8 % всех эндокринных опухолей желудка, соотношение мужчин и женщин 1:1. Они развиваются у больных с гипергастринемией, вызванной гастрин-продуцирующими опухолями, вызывающими развитие синдрома Золлингера – Эллисона (ЗЭС). Такие опухоли могут сопровождаться или не сопровождаться синдромами МЭН 1 типа. Желудочные опухоли обычно множественные, связаны с гиперплазией ECL клеток с дисплазией или без нее. В противоположность опухолям I типа в окружающей СО желудка нет хронического атрофического гастрита типа А. Опухоли II типа локализуются обычно в области тела и фундуса, но могут располагаться и в антральном отделе. Эти опухоли более часто злокачественны. Больные с синдромом МЭН 1 типа и СЗЭ в 20–30 % имеют риск развития НЭО II типа, в то время как при спорадических СЗЭ риск возникновения составляет 0–1 %.
Тип III ECL клеточных опухолей часто называют «спорадическими», так как считается, что ему не предшествует какая-либо патология желудка, нет связи с гипергастринемией. Они составляют 13–23 % всех гастроинтестинальных НЭО, чаще встречаются у мужчин (соотношение М:Ж – 2,8:1). Они обычно солитарны, но описаны также и множественные опухоли. К моменту диагностики имеют большие размеры и нередко – метастазы. Это наиболее злокачественный вариант из трех типов ECL клеточных опухолей. Даже мельчайшие эндокринные опухоли III типа могут метастазировать. Многие авторы рассматривают их как высокодифференцированные нейроэндокринные раки [1].
Четвертая группа – плохо дифференцированные нейроэндокринные карциномы, делятся по аналогии с опухолями легких на мелко- и крупноклеточные варианты.
Предопухолевыми процессами для ECL клеточных новообразований являются ECL клеточная гиперплазия и дисплазия. Однако гиперплазия эндокринных клеток выявляется не только при НЭО, но и при других эпителиальных опухолях желудка [4].
Диагностика НЭО СО желудка базируется, главным образом, на результатах гистологического исследования биопсированного материала. Однако, ввиду того, что эти новоообразования часто располагаются в глубоких отделах слизистой оболочки, в биоптаты попадает не опухолевая ткань, а окружающая СОЖ, что затрудняет своевременное распознавание этих неоплазм. В анамнезе таких пациентов часто имеются указания на неоднократное проведение биопсий СОЖ, тем не менее правильный диагноз нередко ставится лишь после гистологического исследования операционного материала. Изменения СОЖ при НЭО этого органа не могут считаться достаточно полно изученными, в то же время они отражают влияние продуцируемых опухолевыми клетками биологически активных веществ на экзокринные элементы СО. Наиболее подробно изучены изменения СОЖ при гастриномах и серотониномах, но они не описаны при ECL клеточных опухолях. Однако литературные данные свидетельствуют, что при динамическом наблюдении за развитием НЭО I типа, на фоне хронического атрофического гастрита в условиях гиперпластических и диспластических изменений ECL клеток, в СО тела желудка часто выявляются гиперпластические полипы [10]. Какие-либо особенности строения их по сравнению с другими отделами желудка не отмечены. Остается неясным вопрос – случайным или закономерным является их развитие при ECL-клеточных неоплазмах. В то же время правильная оценка изменений СОЖ, обусловленных дисгормональными нарушениями при НЭО, позволит заподозрить и диагностировать эти новообразования в более ранние сроки.
Определенные трудности вызывает также определение цитогенеза НЭО. Большинство из них сочетают в себе несколько типов клеток и продуцируют не только гормоны, но и про-гормоны и другие вещества, что не всегда позволяет выявить их при иммуногистохимическом исследовании. Но анализируя изменения окружающей СОЖ и проводя тщательный клинико-анатомический анализ, возможно определить цитогенез НЭО.
Цель исследования. Изучить изменения СО при НЭО желудка различного цитогенеза и степени дифференцировки.
Материалы и методы. Исследованы биоптаты слизистой желудка и операционный материал (эндоскопически иссеченные опухоли и резецированные отделы желудка) 28 больных с НЭО желудка. Кусочки опухолей и СОЖ из различных отделов по обычной методике заливались в парафин. Гистологические срезы окрашивались гематоксилином-эозином, алциановым синим в сочетании с PAS-реакцией. Для выявления нейроэндокринных элементов и пролиферативного индекса использовались ИГХ методики с антителами к хромогранину А (Thermo scientific, разведение 1:400), синаптофизину (клон SP11, Thermo scientific, разведение 1:100), NSE (клон V1-H14, DBS, разведение 1:75), Ki-67 (клон SP6, Thermo scientific, разведение 1:200).
Клинически НЭО при эндоскопическом исследовании чаще всего расценивались как «полипоз» (15 наблюдений) или «опухоли» (6). Правильный диагноз после первой биопсии был поставлен лишь в 25 % наблюдений, после повторных биопсий – еще в 28,5 %, в остальных случаях – лишь после исследования операционного материала. 26 раз в разные сроки до окончательного установления диагноза больным удаляли и гистологически выявляли гиперплазиогенные железистые полипы. У 13 больных нейроэндокринные опухоли были множественными, сочетаясь с выраженной гиперплазией эндокринноцитов в сохранившихся железах, нередко с формированием микроопухолей в разных участках слизистой оболочки.
G-клеточные опухоли располагались в антро-пилорическом отделе, сопровождались развитием пептических эрозий и язв СО желудка, осложняющихся кровотечениями, не поддающимися лечению обычными методами. В фундальном отделе у всех больных имелась выраженная гиперплазия и гипертрофия обкладочных клеток, что, наряду с клинической картиной (повышение уровня гастрина в крови, рецидивирующие язвы СО с кровотечениями и перфорацией) являлось подтверждением секреции опухолевыми клетками гастрина.
ЕС-клеточные опухоли возникали на фоне атрофического гастрита с типичной классической кишечной метаплазией СО. В цитоплазме опухолевых клеток имелась грубая зернистость, интенсивно окрашивающаяся с антителами к хромогранину и дающая слабо выраженную или даже отрицательную реакцию с антителами к синаптофизину. В очагах кишечной метаплазии выявлялись типичные кишечные энтерохромаффинные клетки открытого типа с длинными цитоплазматическими отростками, распространящимися в просвет желез.
В одном наблюдении D-клеточных опухолей, развившихся на фоне МЭН I типа, протекающих с явлениями синдрома «соматостатиномы» (ожирение, диабет, желчнокаменная болезнь), имелась выраженная атрофия СО фундального отдела с полным отсутствием специализированных желез и кишечной метаплазией, диффузной и очаговой гиперплазией эндокринноцитов с новообразованием огромного количества нейроэндокринных опухолей разных размеров – от микроскопических до 3–5–8 мм диаметром, занимающих всю поверхность СО фундального отдела. При электронной микроскопии в цитоплазме опухолевых клеток обнаружены типичные соматостатиновые гранулы.
Все ЕСL-клеточные опухоли располагались в зоне фундальных желез (тело, дно желудка), состояли из относительно мономорфных клеток, формирующих тяжи, трабекулы, железисто-подобные структуры. При всех ЕСL- клеточных опухолях постоянно отмечалась своеобразная гиперплазия покровно-ямочного и железистого эпителия СО. Эпителиальные клетки были резко увеличены в размерах за счет накопления в цитоплазме крупных скоплений слизи («глобулей»), размеры которых варьировали. Эти изменения соответствовали понятиям «глобоидная гиперплазия», «глобоидная метаплазия», «глобоидная дисплазия», отличающимся между собой числом и размерами «глобулей». В случаях «глобоидной гиперплазии» в цитоплазме обнаруживались многочисленные вакуоли слизи, не обнаруживаемые в цитоплазме обычных цилиндрических клеток покровно-ямочного и железистого эпителия; при «глобоидной метаплазии» в цитоплазме формировались две-три крупные вакуоли, деформирующие клетку. При глобоидной «дисплазии» цитоплазма содержала одну крупную вакуоль, которая оттесняла ядро к периферии, сдавливая его, что придавало сходство клетке с перстнем, так в эпителиальном пласте возникали перстневидные клетки.
Такие клетки то полностью замещали фовеолярный эпителий, то формировали гиперплазиогенные полипы над опухолями. Слизь в этих клеточных элементах имела различный характер – то была резко PAS положительной, то смешанной желудочно-кишечной. На этом фоне появлялись очень крупные бокаловидные клетки, то с кишечной алцианофильной, то со смешанного характера слизью. В 3 случаях низкодифференцированных нейроэндокринных и смешанных адено-нейроэндокринных карцином в опухолях на фоне таких изменений возникали очаги перстневидно-клеточного рака.
Аналогичные изменения возникали не только над опухолевыми элементами, но и в пограничных отделах СОЖ при хроническом гастрите с частичной атрофией фундальных желез и замещении обкладочных и главных клеток псевдопилорическими железами, постоянно сочетаясь с гиперплазией ЕСL клеток в базальных отделах. Гиперплазированный фовеолярный эпителий распространялся экзофитно вверх, формируя папиллярные структуры, и эндофитно вниз, принимая штопорообразный вид, параллельно в шейках желез отмечалась резко выраженная пролиферация низкодифференцированных клеток, отчетливо выявляемая при помощи маркера Ki-67.
Обсуждение результатов. Ранее нами при изучении фоновых и предраковых процессов в СОЖ при раках различного генеза было показано, что при эндокринноклеточных раках чаще, чем при других формах, встречается гиперплазия и выраженная гиперсекреция покровно-ямочного эпителия, c формированием полипов, и псевдопилорическая метаплазия фундальных желез, сочетающаяся с выраженной гиперплазией эндокринноцитов в этих зонах [1,2]. Термин «глобоидная» гиперплазия эпителия СОЖ был выделен по аналогии с подобными изменениями в нейронах при болезни накопления – энцефалопатии Краббе (нейрональная «глобоидная» энцефалопатия). Внимание к так называемой «глобоидной» метаплазии и дисплазии СОЖ желудка было привлечено после того, как ее обнаружили в отделах, пограничных к очагам перстневидно-клеточного рака (ПКР) [7]. На нашем материале во всех наблюдениях ЕСL-клеточных опухолей подобные изменения с формированием перстневидных клеток отмечены в покровно-ямочном и железистом эпителии в пограничных отделах СОЖ. В 3 случаях низкодифференцированных нейроэндокринных и смешанных адено-нейроэндокринных карцином на фоне ГД возникали очаги перстневидно-клеточного рака. Таким образом, ГД может встречаться как предопухолевый процесс при различных видах диффузного рака.
Выводы
Фибромускулярная гиперплазия желудка что это
Изучение заболеваний желудочно-кишечного тракта, в частности желудка и двенадцатиперстной кишки, является основой узкого направления медицины – гастроэнтерологии. Причин возникновения заболеваний желудка множество: неправильное питание, стрессы, нарушение режима труда и отдыха, воздействие вредных веществ, активность бактерий Helicobacter pylori и т.д. [1–3]. Желудок – важный орган, отвечающий за общее состояние организма, из-за желудочных состояний страдают все системы. Поэтому важно знать причины болезней желудка, основные его заболевания. Если рассматривать заболевания желудка с ракурса онкологии, то предвестниками данной патологии могут стать часто встречающиеся в повседневной практике гастроэнтерологов язвенная болезнь желудка, острый и хронический гастрит, дуоденогастральный рефлюкс, полипы, а также эрозия желудка. В ходе мониторинга пациентов стационарного и амбулаторного лечения данная группа заболеваний желудочно-кишечного тракта занимает лидирующее положение среди расстройств, которые в совокупности различных факторов окружающей среды, а также индивидуальных особенностей чаще других приводят к канцерогенной активности. Любое предраковое заболевание развивается поэтапно с нарастанием и углублением отрицательных изменений, происходящих в желудке. На некоторых стадиях любой процесс полностью обратим, то есть болезнь излечима. По мере углубления деструкции возможность обратимости снижается, наступает стойкая хронизация процесса, а болезнь становится неизлечимой. Переходу в предрак или рак способствуют наиболее глубокие стадии, когда болезнь развивается внутри клеток. Гастрит – это одно из наиболее распространенных желудочно-кишечных заболеваний воспалительного или воспалительно-дистрофического характера, поражающих слизистую оболочку желудка [4]. В связи со множеством разновидностей этой болезни термин «гастрит» является собирательным и служит для обозначения различных по происхождению воспалительных и дистрофических изменений в слизистой этого органа. Гастриты классифицируют по нескольким показателям – по типу, локализации воспалительного процесса, этиологическому фактору, эндоскопической картине, морфологическим изменениям слизистой оболочки желудка. Все эти показатели очень важны для диагностики и выбора способа лечения заболевания. Особого внимания заслуживает атрофический гастрит – длительно текущая форма хронического заболевания, при которой происходят деструктивные изменения в слизистой оболочке желудка. В результате патологического процесса ее площадь и количество функционирующих клеток резко уменьшаются. Многие специалисты считают [5–7], что этот подвид хронического гастрита является предраковым состоянием, как следствие угроза развития злокачественного процесса очень велика. При атрофическом гастрите запускается механизм перерождения нормальных клеток желудка; главные и добавочные клетки, принимающие участие в выработке пепсиногена и хлороводородной кислоты – основных составляющих желудочного сока, перестают функционировать в оптимальном режиме. Вместо него добавочные клетки желудка в большем объеме начинают продуцировать мукополисахариды – слизь. В результате резко снижается кислотность желудочного сока. То, что клетки меняют свою специализацию и перестают выполнять основную функцию, свидетельствует о том, что в организме есть сбой в системе гормональных, иммунных, ферментных и прочих регуляторов физиологических процессов. Язвенная болезнь желудка является одной из основных причин заболеваемости и смертности среди более семи миллионов ежегодно диагностируемых патологий желудочно-кишечного тракта [8]. Диагностика язвенной болезни желудка и двенадцатиперстной кишки предполагает наличие таких симптомов, как потеря веса, перенасыщенность, боли в эпигастральной области, чувство переполнения, вздутие живота, тошнота. К сожалению, наличие данных симптомов также вписывается в клиническую картину гастроэзофагеальной рефлюксной болезни, диспепсии и гастрита, в связи с чем диагностирование язвенной болезни желудка затруднено. Бессимптомное протекание данной патологии часто не позволяет провести диагностику на ранних стадиях развития болезни, заболевание остается незамеченным вплоть до клинических проявлений, а именно кровотечений желудочно-кишечного тракта [9]. Слизистая оболочка желудка выстлана одним слоем эпителиальных клеток, который поддерживается тонкими элементами рыхлой соединительной ткани, покрытой тонким слоем гладких мышечных волокон. У многих людей желудочный эпителий, помимо собственных кислых и ферментативных выделений желудка, подвергается воздействию Helicobacter pylori. Маленькие грамотрицательные палочки Helicobacter pylori обладают уникальной приспособленностью к колонизации желудка человека [10]. Наличие данных микроаэрофильных микроорганизмов приводит к возникновению ряда субклинических и клинических показателей, которые зависят от свойств заражающего штамма, хозяина и окружающей среды [11]. Ряду пациентов с язвенной болезнью желудка или развивающейся лимфомой желудка, которые ранее подвергались лечению с использованием нестероидных противовоспалительных препаратов, показана эрадикационная терапия. Но нельзя игнорировать тот факт, что данная терапия может ухудшить гастроэзофагеальную рефлюксную болезнь и увеличить риск развития рака пищевода [12]. Желудочные полипы представляют собой аномально растущую массу клеток, которые образуются на слизистой оболочке желудка. Наличие данной патологии является редкостью, и чаще всего заболевание протекает бессимптомно [13]. Большие полипы вызывают кровотечение, анемию, боль в животе или редко могут приводить к обструкции из-за своей локализации. Только определенные типы полипов способны обладать канцерогенной активностью и увеличивать риск развития онкологии в будущем, и в зависимости от этого выбирается дальнейшая стратегия лечения, которая может включать как хирургическое удаление полипа, так и мониторинг его изменений, и консервативное лечение [14].
Оценка морфологической структуры клеток возможна с помощью цитологического исследования, которое широко применяют в клинической практике как исключительно чувствительный, точный, эффективный метод диагностики злокачественных опухолей и ряда неопухолевых поражений всех органов пищеварительной трубки у больных с симптомами заболевания органов ЖКТ, а также при скрининге в группах высокого риска по развитию рака этих органов [15]. Микроскопически злокачественные клетки выстилают желудочные железы и крипты и представляют собой эпителиальные клетки, прорывающиеся через базальную мембрану и вторгающиеся в подслизистую оболочку и мышечный слой. Отдельные клетки теряют свою дифференцированность по отношению к соседним клеткам и представлены многочисленными митотическими фигурами [16]. Для предупреждения развития онкологических заболеваний важно раннее выявление таких состояний, а также их качественное обследование. Внедрение и максимальное использование современной эндоскопической техники значительно расширило возможности цитологической диагностики органов ЖКТ и, более того, открыло перспективы применения метода, поскольку цитологический материал пригоден для проведения имеющих неоценимое дифференциально-диагностическое значение иммуноморфологических, молекулярно-биологических и генетических исследований [17, 18].
Провести сравнительный анализ и выявить характерные морфологические цитологические признаки при различных доопухолевых заболеваниях желудка.
Материал и методы исследования
Результаты исследования и их обсуждение
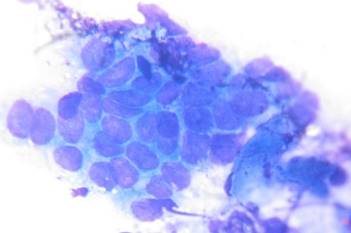
Рис. 1. Клетки покровно-ямочного эпителия с признаками гиперплазии
В случаях кишечной метаплазии в мазках-отпечатках обнаруживались высокие клетки цилиндрической, призматической или бокаловидной формы (рис. 2).
Рис. 2. Клетки покровно-ямочного эпителия с признаками кишечной метаплазии по тонкокишечному типу
Наблюдаются ядра больших и средних размеров, их расположение в клетках эксцентричное, окрашены интенсивно. Цитоплазма характеризуется базофильной окраской, у ядра и апикальной части почти прозрачная, широкая в апикальной части и узкая, более вытянутая в базальной. В исследуемых тканях имеются скопления лимфоидных элементов, а также плазматические клетки и сегментоядерные нейтрофилы. Эндоскопическая картина заживающей язвы характеризуется уменьшенной гиперемией слизистой оболочки, отсутствием некротических тканей и гнойных масс. Исчезает глубина язвы, воспаленные края язвы сглаживаются, формируется «красный рубец» – гиперемированная ткань слизистой оболочки, которая впоследствии после втяжения стенок формирует соединительнотканный «белый рубец» [23, 24]. Микроскопическое строение слизистой оболочки зависит от периода развития язвы. В цитологических мазках определяли десквамированные клетки эпителия, лейкоциты и эритроциты, фибробласты, гистиоциты, плазматические клетки и лимфоциты. Непосредственно по краю хронической язвы слизистая оболочка желудка подвергается значительному утолщению за счет интенсивной пролиферации ямочного эпителия. В цитологических препаратах можно найти все упомянутые выше клеточные элементы. В материале, полученном с краев хронической язвы, обычно обнаруживали полиморфные, различной степени зрелости клетки покровно-ямочного эпителия. Преобладание незрелых крупных клеток с большими ядрами и базофильной цитоплазмой может свидетельствовать об интенсивной пролиферации эпителия. В период обострения язвы в большом количестве встречаются дегенеративно измененные эпителиальные клетки без четких границ с укрупненными ядрами. Рисунок хроматина в них разреженный, в виде грубых волокон. В связи с большим клеточным распадом и явлениями цитолиза в материале, особенно полученном со дна язвы, можно видеть много «голых» ядер. В этих препаратах преобладали сегментоядерные лейкоциты и в значительном количестве встречаются элементы грануляционной ткани. В период рубцевания язвы в мазки попадают очень полиморфные клетки гистиоцитарного типа, которые бывает трудно отличить от атипических эпителиальных клеток [25]. В ходе эндоскопического исследования полипов оценивались количество, форма, размеры, поверхность, цвет, консистенция, воспалительные процессы и локализация новообразований. Цитологические препараты характеризовались большим количеством пластов и скоплений покровно-ямочного эпителия. При аденоматозных полипах встречаются также и железистоподобные структуры. По сравнению с цитологическими описаниями гастритов при этих заболеваниях отмечалось преимущество незрелых клеток, ядра светлые, укрупнены, рисунок хроматина нежно-сетчатый. Клетки эпителия желез и лимфоидные элементы определяются в небольшом количестве. В случаях грануляционных полипов с обильными воспалительными инфильтратами в их строме в цитологические препараты могут попадать в значительном количестве нейтрофильные лейкоциты.
В ходе проведенных исследований выявлены изменения в составе и морфологии клеток слизистой оболочки желудка, которые наблюдаются при гастрите, полипозе и язве, не являются строго специфическими. При всех этих заболеваниях может определяться различная степень пролиферации покровно-ямочного эпителия: в одних наблюдениях отмечается только незначительный полиморфизм эпителиальных клеток, в других – явно преобладают молодые элементы с некоторыми признаками атипии. Для установления диагноза необходимо применять дополнительные методы исследования, так как на основании только цитологических данных не представляется возможным диагностировать эти процессы.