Финастерид или финаст что лучше
Сравнение эффективности дутастерида и финастерида в лечении доброкачественной гиперплазии предстательной железы
В статье представлены результаты открытого проспективного исследования, проведенного в условиях амбулаторного приема урологом поликлиники с целью оценки клинической эффективности и экономической целесообразности применения дутастерида и финастерида в лечении пациентов с доброкачественной гиперплазией предстательной железы. Несмотря на довольно большое количество публикаций по данной теме, актуальность исследования обусловливает тот факт, что большинство больных доброкачественной гиперплазией предстательной железы – пенсионеры, вынужденные выбирать эффективное, но в то же время доступное лекарство.
В статье представлены результаты открытого проспективного исследования, проведенного в условиях амбулаторного приема урологом поликлиники с целью оценки клинической эффективности и экономической целесообразности применения дутастерида и финастерида в лечении пациентов с доброкачественной гиперплазией предстательной железы. Несмотря на довольно большое количество публикаций по данной теме, актуальность исследования обусловливает тот факт, что большинство больных доброкачественной гиперплазией предстательной железы – пенсионеры, вынужденные выбирать эффективное, но в то же время доступное лекарство.
Дутастерид и финастерид – препараты для лечения доброкачественной гиперплазии предстательной железы из группы блокаторов 5-альфа-редуктазы. Дутастерид подавляет активность изоферментов 5-альфа-редуктазы первого и второго типа, ответственных за превращение тестостерона в дигидротестостерон – основной андроген, ответственный за развитие гиперплазии железистой ткани простаты [1]. Финастерид – специфический ингибитор 5-альфа-редуктазы второго типа и соответственно тоже подавляет образование дигидротестостерона [2]. Известно, что 5-альфа-редуктаза первого типа экспрессируется в небольших количествах и малоактивна в предстательной железе, но обеспечивает основную долю активности фермента в других тканях, например коже и печени. А 5-альфа-редуктаза второго типа экспрессируется и действует в основном в простате.
Лечебный эффект препаратов развивается постепенно в течение 6–12 месяцев. Продолжительное лечение финастеридом снижает концентрацию дигидротестостерона в крови примерно на 70%, а дутастеридом – на 95%, однако концентрация обоих препаратов в предстательной железе одинакова – около 85–90% [3].
Результаты применения и финастерида, и дутастерида, по данным литературы, в целом положительные. Однако не ясно, насколько целесообразно в реальной клинической практике использовать дутастерид, более современный и дорогостоящий по сравнению с финастеридом.
Сравнение клинической эффективности и экономической целесообразности применения дутастерида и финастерида в лечении больных доброкачественной гиперплазией предстательной железы.
Открытое проспективное исследование проведено с 10.09.2015 по 10.09.2016 в условиях амбулаторного приема урологом поликлиники городской клинической больницы № 11 (Рязань).
В исследовании приняли участие 25 больных доброкачественной гиперплазией предстательной железы первой-второй стадии, не подлежащих хирургическому лечению. Все пациенты были проинформированы о вариантах возможного лечения и подписали добровольное информированное согласие.
Пациенты были разделены на две группы: основную и контрольную. В основной группе (n = 11) назначалась комбинация альфа-1-адреноблокатора тамсулозина и ингибитора 5-альфа-редуктазы второго поколения дутастерида 0,5 мг один раз в день. Контрольная группа (n = 14) получала стандартное сочетание альфа-1-адреноблокатора тамсулозина с ингибитором 5-альфа-редуктазы первого поколения финастеридом 5 мг один раз в день.
Эффективность терапии оценивалась на основании выраженности симптомов нижних мочевых путей по Международной шкале оценки симптомов заболеваний предстательной железы (International Prostate Symptom Score – IPSS), пальцевого ректального исследования, уровня простатического специфического антигена в крови, трансабдоминального ультразвукового исследования с определением объема простаты и объема остаточной мочи. Пациенты обследовались при первичном обращении и через шесть месяцев от начала лечения, когда оценивались результаты терапии.
В большинстве случаев препараты переносились хорошо, однако один пациент из основной группы выбыл в связи с побочным эффектом, развившемся на фоне применения дутастерида.
Результаты и их обсуждение
В обеих группах наблюдалось сопоставимое уменьшение объема предстательной железы (в среднем на 13,2 и 11,1 см 3 соответственно) и количества остаточной мочи (на 30,3 и 42,3 мл соответственно) – после лечения данный параметр в обеих группах оказался в пределах нормы (табл. 1 и 2). При оценке выраженности симптомов нижних мочевых путей тоже отмечалась положительная динамика – суммарный балл по шкале IPSS уменьшился с 17,5 до 12,3 в группе дутастерида и с 16,2 до 10,9 в группе финастерида. Показатели лечения в обеих группах были оценены как сопоставимые, положительные. В связи с малой выборкой дополнительная статистическая обработка материала не проводилась.
Финастерид и дутастерид оказывают сравнимый эффект. Дутастерид 0,5 мг принимается по одной капсуле ежедневно, финастерид 5 мг – по одной таблетке также ежедневно. Курс лечения обоими препаратами длительный, не менее шести месяцев. Применение как дутастерида, так и финастерида позволяет снизить объем простаты и остаточной мочи, уменьшить выраженность симптомов (по IPSS), улучшить самочувствие пациентов. Однако дутастерид в среднем в пять – семь раз дороже финастерида, поэтому использование дутастерида (по результатам данной работы) представляется экономически нецелесообразным.
Лечение выпадения волос медикаментозными препаратами
Миноксидил
Миноксидил – это препарат для волос, который относится к сосудорасширяющим средствам, хорошо останавливающим выпадение и увеличивающим интенсивность роста новых волосяных стержней. Миноксидил, например, является основным компонентом препарата «Рогейн» или «Регейн», который активно применяется для избавления от андрогенной алопеции и лечения волосяного покрова. Среди препаратов, куда так же входит Миноксидил – эвкапил, прокопил, алерана. Использует его в качестве добавок многие косметические линии, выпускающие шампуни для укрепления волос.
Миноксидил непосредственно воздействует на волосяные фолликулы, активирует питание клеток за счет расширения сосудов и улучшения кровотока. Для удобства использования, «Рогейн» выпускается в виде спрея и пенки для волос.
Миноксидил активно используется для лечения облысения у женщин. Как правильно, используется препарат с 2% концентрацией. В свою очередь, «Регейн» для мужчин имеет 5% процентную концентрацию раствора. Средство особенно эффективно на начальных стадиях выпадения при агрессивно протекающих процессах, и дает менее выраженные результаты при значительной площади облысения.
Особенности применения
Механизм воздействия Миноксидила таков, что визуально восстанавливается густота волос при регулярном, длительном применении. Если говорить о частоте применения, то препарат «Регейн» следует использовать дважды в сутки. Первые ощутимые результаты можно обнаружить уже спустя 2-3 месяца использования.
«Рогейн» интенсивно воздействует на волосяные луковицы, но не удаляет причины возникновения андрогенной алопеции, которые заключаются в неблагоприятном, повреждающем действии продуктов распада тестостерона на волосяные луковицы. Если остановить использование препарата, то волосы становятся настолько тонкими, что приобретают вид легкого пушка. В результате формируется лысина. Именно поэтому прекращать использовать средство не рекомендуется.
Эффективность Миноксидила для лечения волос доказывают многочисленные отзывы, как пациентов, так и лечащих врачей. Например, у 30% пациентов, применявших «Регейн», наблюдалось полная остановка выпадения и восстановление густоты волосяного покрова. Чтобы добиться подобных результатов, нужно использовать «Регейн» от 1 года и больше, с учетом характера и интенсивности проблемы.
Побочные явления
Препарат Миноксидил, согласно инструкции производителя, рекомендуется использовать постоянно, чтобы остановить выпадение, активировать интенсивность роста волос, избавиться от облысения. Если прервать лечение, новые волосы, выросшие после начала применения средства, в течение 3-6 месяцев начинают выпадать.
Для лучших и быстрых результатов Миноксидил можно применять совместно и другими средствами для восстановления волос, например, массажами, маской для волос от выпадения и специальными медикаментами.
Миноксидил хорошо переносится, но имеет некоторые побочные эффекты:
При образовании негативных последствий после приема препарата следует немедленно показаться трихологу.
Финастерид
Еще одним эффективным средством лечения алопеции считается препарат Финастерид (или пропеция). Финастерид специально разработан для лечения волос у мужчин, в том числе лечение мужского облысения. Это единственное специализированное средство против андрогенетической алопеции, которое эффективно помогает остановить выпадение волос.
Инструкция по применению Финастерида:
Достоинства Финастерида в лечении выпадения волос
Побочные действия
При приеме препарата могут наблюдаться некоторые негативные последствия – крапивница, нарушение потенции, отечность лиц, губ. При образовании побочных эффектов прием препарата нужно остановить и показаться доктору.
Следует помнить, что Финастерид – препарат для мужчин, поэтому он не используется для лечения женского выпадения волос.
Заместитель Главного Врача, врач-трихолог
Квалификация
В 2012 году окончила ДонНМУ им.Горького по специальности «Стоматология».
С 2007-2011 года посещает кружок по специальности «Хирургия» на базе кафедры «Оперативная хирургия» ДонНМУ.
Клиническая Ординатура по специальности «Хирургия» на базе ФГБУ им. Бурназяна по специальности «Стоматология хирургическая».
В 2018 году курс профессиональной переподготовки на базе Учебного Центра Дополнительного профессионального образования «Образовательный стандарт» по специальности «Организация здравоохранения и общественное здоровье».
Соискатель ученой степени кандидата медицинских наук.
Дипломированный специалист, постоянный участник международных и российских тематических профессиональных семинаров, форумов, конгрессов по вопросам эстетической медицины.
Современные возможности медикаментозного лечения доброкачественной гиперплазии ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
К числу наиболее распространенных урологических заболеваний у пациентов пожилого возраста относится доброкачественная гиперплазия предстательной железы (ДГПЖ) [2].
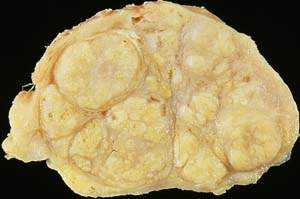 |
| Рисунок 1. Доброкачественная гиперплазия предстательной железы (макропрепарат) |
К числу наиболее распространенных урологических заболеваний у пациентов пожилого возраста относится доброкачественная гиперплазия предстательной железы (ДГПЖ) [2]. Около 80% мужчин старше 80 лет страдают этим заболеванием. Другая статистика свидетельствует, что из всех заболеваний, которым подвержены мужчины старше 50 лет, на долю доброкачественной гиперплазии простаты приходится 36% [1]. Эти сведения настолько общеизвестны, что ухудшение качества мочеиспускания часто рассматривается как естественное явление.
Клинически данное заболевание проявляется различными симптомами, связанными с нарушением пассажа мочи по нижним мочевым путям. При значительно выраженной инфравезикальной обструкции, как правило, прибегают к хирургическому вмешательству. Оперативное лечение по поводу ДГПЖ показано 30% больных в возрасте от 50 до 80 лет [4]. Однако в последние годы все большую популярность завоевывает медикаментозная терапия доброкачественной гиперплазии предстательной железы. Это, с одной стороны, объясняется вполне логичным желанием врача и пациента по возможности избежать операции, с другой — развитием представлений о патогенезе расстройств мочеиспускания при доброкачественной гиперплазии предстательной железы.
До недавнего времени патогенез расстройств мочеиспускания при доброкачественной гиперплазии предстательной железы рассматривали с позиции классических представлений о механической инфравезикальной обструкции и развитии вторичных структурно-функциональных изменений детрузора (компенсация, декомпенсация). За последние два десятилетия получены принципиально новые данные о природе повышенного внутриуретрального сопротивления. Его перестали отождествлять исключительно с механическим сдавлением шейки мочевого пузыря и задней уретры. Обнаружен динамический компонент обструкции, который состоит в повышении тонуса указанных анатомических структур за счет активности a-адренорецепторов. Появились также иные трактовки происхождения ирритативных симптомов. Их считают проявлением первичного нестабильного мочевого пузыря и не связывают напрямую с обструкцией [5].
Результаты нашей работы свидетельствуют, что при ДГПЖ клиническая симптоматика развивается вследствие недостаточности энергетического метаболизма и гипоксии детрузора в условиях повышенного уретрального сопротивления [3]. Об этом свидетельствуют:
Причины нарушений энергетического метаболизма и функций детрузора крайне многообразны. В частности, к таким нарушениям могут привести повышение активности симпатической нервной системы, расстройства органного кровообращения, авитаминоз (группа В), хронические заболевания дыхательной и сердечно-сосудистой систем, влияние приема ряда фармакологических препаратов, угнетающих дыхательную цепь, и, естественно, обструктивные нарушения уродинамики и т. д. Весьма важно, что нарушения гипоксического характера в гладкомышечной ткани могут иметь и первичный митохондриальный генез (первичные нарушения энергетического метаболизма детрузора [3].
Необходимо отметить, что у больных ДГПЖ в нижнем отделе мочевого тракта протекают два параллельных процесса — формирование уретральной обструкции и нарушение энергетического метаболизма детрузора (митохондриальная недостаточность).
Подобное представление патогенеза расстройств мочеиспускания открывает широкие возможности для фармакотерапии. Сокращения и расслабления детрузора можно достичь с помощью средств метаболической терапии, прямого улучшения снабжения детрузора кислородом и т. д. Наиболее значимые расстройства основных функций мочевого пузыря все же опосредованы расстройствами кровообращения. И если процесс обратим, то до или после хирургического вмешательства можно существенно влиять на функциональное состояние мочевого пузыря с помощью вазоактивных препаратов, к которым в первую очередь относятся a1-адреноблокаторы.
При определении критериев отбора пациентов для медикаментозной терапии ДГПЖ мы воспользовались рекомендациями IV Международного консультативного комитета по ДГПЖ.
Основу настоящего исследования составили собственные клинические наблюдения за 1724 пациентами (средний возраст 61,4 года), страдающими ДГПЖ и получавшими различные варианты медикаментозного лечения. Нами применялись препараты всех групп, использующихся в настоящее время для лечения ДГПЖ: a-адреноблокаторы, блокаторы 5-a-редуктазы, препараты растительного происхождения и их комбинации. Схемы проведенного лечения и характеристика групп пациентов приведены в табл. 1.
Из наиболее многочисленной и популярной сегодня группы препаратов для медикаментозного лечения ДГПЖ — селективных a-адреноблокаторов мы использовали альфузозин, теразозин, доксазозин и тамсулозин. Общее число пациентов, получавших a-адреноблокаторы, составило 1408. Финастерид был взят нами как классический представитель блокаторов 5-a-редуктазы. Из препаратов растительного происхождения мы использовали пермиксон и таденан.
В пяти группах общей численностью 1305 человек проводилась терапия селективными a-адреноблокаторами в течение длительного периода времени по стандартным схемам и в стандартных дозах. Результаты лечения приведены в табл. 2.
Улучшение качества мочеиспускания отметили в среднем 86,74% пациентов. Суммарный балл I-PSS сократился на 38,68% к окончанию первого года лечения и на 43,4% к окончанию курса терапии. Балл QOL уменьшился на 29,04% и 35,58% соответственно. Максимальная скорость потока мочи увеличилась на 45,25% к окончанию первого года лечения и стабилизировалась на достигнутом уровне. Количество остаточной мочи сократилось в среднем на 57,6%. Процент пациентов, по тем или иным причинам выбывших из исследования, был тождествен во всех группах и равнялся 14,38%.
Особо следует остановиться на препарате тамсулозин (омник, Yamanouchi) — пока единственном простатселективном a1А-адреноблокаторе на отечественном рынке. Этот препарат обладает рядом свойств, которые позволяют его использовать в различных функциональных тестах. Прежде всего это возможность назначения единой терапевтической дозы (один раз в сутки по 0,4 мг). А отсутствие выраженного влияния на артериальное давление и сердечную деятельность избавляет от необходимости титрования дозы. Мы согласны с рядом авторов, которые считают возможным применение коротких курсов терапии тамсулозином в качестве прогностических тестов эффективности лечения a1-адреноблокаторами, что может иметь решающее значение при выборе того или иного метода медикаментозного лечения ДГПЖ [4].
Части больных (группа А5) проведена проверка возможности разрешения острой задержки мочеиспускания (ОЗМ) приемом альфузозина по 5 мг два раза в сутки. Эта терапия проводилась пациентам с впервые возникшей ОЗМ и отсутствием симптомов нарушения мочеиспускания в анамнезе. Положительный эффект был достигнут у 8 из 14 пациентов (57,1%), которым параллельно приему альфузозина производилось кратковременное (трое суток) дренирование мочевого пузыря катетером. Единовременный прием суточной дозы альфузозина (10 мг) способствовал восстановлению самостоятельного мочеиспускания лишь у одного из четырех пациентов, которым проводилась подобная терапия. Вероятно, это объясняется гипотонией детрузора, усугубляющейся в ситуации длительного перерастяжения мочевого пузыря на фоне задержки мочеиспускания.
Для изучения эффективности и безопасности комбинированной медикаментозной терапии ДГПЖ препаратами разных групп, а также для уточнения целесообразности проведения терапии нами были созданы три группы.
В первой группе (К1) пациенты получали проскар по 5 мг/сут. параллельно с приемом теразозина по 5-10 мг/сут. Обращало на себя внимание значительное повышение показателей максимальной скорости потока мочи (+40%), характерное для группы монотерапии a-адреноблокаторами, и постепенное, на протяжении курса лечения, снижение объема предстательной железы (-20,4%), характерное для группы монотерапии финастеридом. Очевидно, что положительные изменения показателей мочеиспускания в этой группе являются следствием воздействия обоих препаратов. Тем не менее процент выбывших пациентов в этой группе был крайне высоким — 32,3%. Основной причиной прекращения комбинированной терапии ДГПЖ пациенты называли неприемлемо высокую стоимость лечения.
В третьей группе комбинированной терапии (К3) лечение проводилось финастеридом по 5 мг/сут. в сочетании с пермиксоном по 160 мг два раза в сутки. Через два года после начала лечения 50% пациентов покинули группу, приводя причиной отказа от дальнейшей терапии высокую стоимость лечения при отсутствии быстрого улучшения качества мочеиспускания. При сравнении полученных данных с результатами в других группах очевидно, что эффективность лечения в третьей существенно ниже.
Таким образом, эффективность медикаментозной терапии больных ДГПЖ при соблюдении показаний и противопоказаний к ее назначению, правильном выборе препарата и схемы его назначения высока и достигает в среднем 80,2%. При этом эффективность монотерапии a-адреноблокаторами составляет 86,7%, блокаторами 5a-редуктазы — 69,4%, препаратами растительного происхождения — 69,3% и при комбинированной терапии — 95,45%. Комбинированная медикаментозная терапия a-адреноблокаторами в сочетании с блокаторами 5a-редуктазы эффективнее монотерапии этими препаратами. С целью снижения стоимости лечения возможен переход на монотерапию блокаторами 5a-редуктазы после достижения выраженного регресса обструктивной симптоматики. Медикаментозная терапия a-адреноблокаторами является эффективным способом консервативного лечения острой задержки мочеиспускания. Терапия должна проводиться на фоне кратковременного (трое суток) дренирования мочевого пузыря уретральным катетером.
Литература
1. Гориловский Л. М. Эпидемиология и факторы риска развития доброкачественной гиперплазии предстательной железы. В кн.: Доброкачественная гиперплазия предстательной железы / Под ред. Н. А. Лопаткина. М., 1997, с. 10-18.
2. Лопаткин Н. А., Перепанова Т. С. Клинический опыт лечения больных доброкачественной гиперплазией предстательной железы a1-адреноблокатором альфузозином // Урол. и нефрол., 1997, № 5, с. 14-17.
3. Лоран О. Б., Вишневский Е. Л., Вишневский А. Е. Лечение расстройств мочеиспускания у больных доброкачественной гиперплазией простаты a-адреноблокаторами. Монография. М., 1998.
4. Сивков А. В. Медикаментозная терапия доброкачественной гиперплазии предстательной железы. В кн.: Доброкачественная гиперплазия предстательной железы / Под ред. Н. А. Лопаткина. М., 1997, с. 67-83.
5. McConnell J. D. Prostatic growth: new insights into hormonal regulation // Br. J. Urol. 1995. Vol.76.(suppl.1). P. 5-10.
Постфинастеридный синдром: наши представления сегодня
Полный текст:
Аннотация
Ингибиторы 5-α редуктазы являются эффективной и часто используемой терапией при доброкачественной гиперплазии предстательной железы. Однако возникают вопросы, связанные с профилем безопасности данной группы препаратов. Постфинастеридный синдром — противоречивый синдром, связанный с совокупностью сексуальных, соматических и психических симптомов, развивающийся во время или после прекращения прием финастерида и сохраняющийся после его отмены. Учитывая общность механизмов действия финастерида и дутастерида, можно предположить, что термин «постфинастеридный синдром» распространяется на всю группу ингибиторов 5-α редуктазы. На сегодняшний день нет однозначного понимания причин и патофизиологических механизмов развития этого состояния. Неоднозначные результаты завершённых исследований по изучению психологических, метаболических и сексуальных нарушений при приёме ингибиторов 5-α редуктазы говорят о возможности рассмотрения данного феномена как одного из представителей «загадочных болезней», носящих исключительно психосоциальную природу. Кроме того, отсутствие понимания причин и механизмов посфинастеридного синдрома, демонстрируют необходимость проведения дополнительных исследований в этом направлении с учётом погрешностей предыдущих работ.
Конфликт интересов. Александр A. Галушкин и Дмитрий Г. Лихих являются сотрудниками фармацевтической компании АО «ГлаксоСмитКляйн Трейдинг», Михаил И. Коган заявляет об отсутствии конфликта интересов.
Ключевые слова
Для цитирования:
Галушкин А.А., Лихих Д.Г., Коган М.И. Постфинастеридный синдром: наши представления сегодня. Вестник урологии. 2020;8(2):50-54. https://doi.org/10.21886/2308-6424-2020-8-2-50-54
For citation:
Galushkin A.A., Likhikh D.G., Kogan M.I. Post-finasteride syndrome: our current knowledge. Vestnik Urologii. 2020;8(2):50-54. (In Russ.) https://doi.org/10.21886/2308-6424-2020-8-2-50-54
Введение
Постфинастеридный синдром (ПФС) — синдром, связанный с совокупностью сексуальных, соматических и психических симптомов, развивающихся во время или после прекращения приёма финастерида и сохраняющийся после его отмены [1]. Учитывая общность механизмов действия финастерида и дутастерида, есть предположение, что термин ПФс может распространяться на всю группу ингибиторов 5-а редуктазы (5-АРИ).
ПФС включает следующие симптомы [1]:
Истинная распространённость ПФС неизвестна. В основном, сообщения о ПФС исходят из неконтролируемых исследований низкого научного качества. На сегодняшний день, согласно данным сайта www.propeciahelp.com, имеется более 1 000 пациентов, страдающих ПФС [2].
В настоящее время нет однозначного понимания причин и патофизиологических механизмов развития ПФС.
Исследование механизмов патогенеза ПФС выявило влияние ингибирования фермента 5-а редуктазы на концентрацию нейроактивных стероидов, таких как тетрагидропрогестерон (ал- лопрегнанолон), изопрегнанолон, прегнанолон, прогестерон, дегидроэпиандростерон, и снижение чувствительности А-подтипа рецепторов к у-аминомаслянной кислоте (ГАМК) 3. Поскольку считается, что нейростероиды обладают анксиолитическим, антидепрессивным действием, а также улучшают когнитивные функции и играют роль в нейропротекции, теоретически можно предположить отрицательное действие применения 5-АРИ на психические функции. Кроме того, было выявлено снижение допами- нергической передачи сигналов, а ведь допамин является одним из основных нейротрансмиттеров, определяющих сексуальное поведение [7]. Нужно отметить, что данные изменения имели место у крайне малого числа пациентов, принимающих 5-АРИ, что может свидетельствовать о роли эпигенетических механизмов, которые не изучены при ПФС. Стоит сказать также, что вышеуказанные результаты были получены в пилотных исследованиях с малой выборкой и клиническая значимость этих находок в полной мере не известна.
С целью связать выявленные биохимические изменения с клиническими проявлениями ПФС были проведены фармако-эпидемиологические исследования, которые показали возможное влияние 5-АРИ на увеличение частоты развития депрессии [8], сахарного диабета 2 типа [9], но вместе с тем не выявили влияния на частоту суицидов [8] и возникновения эректильной дисфункции [10, 11]. Необходимо отметить, что данные исследования являлись ретроспективными, популяционными, что снижает их ценность. Кроме того, в исследованиях изучали влияние 5-АРИ при их применении и не рассматривали нежелательные явления развивающиеся после отмены терапии.
Психические нарушения
В популяционном ретроспективном исследовании с участием 186 000 пациентов старше 65 лет, проведённом в Онтарио, Канада (W. Blayne et al., 2017) выявлено, что приём 5-АРИ не влиял на частоту самоубийств (ОШ 0,88; 95 % Cl 0,531,45), однако увеличивал число эпизодов нанесения себе увечий в первые 18 месяцев (ОШ 1,88; 95 % Cl 1,34-2,64) и новых случаев депрессии на протяжении всего исследования (ОШ 1,94; 95 % Cl 1,73-2,16). При этом авторы отмечают возможность влияния тяжести симптомов нижних мочевых путей (СНМП) на частоту возникновения эпизодов нанесения увечий или депрессивных состояний. В таком случае логично предположить, что частота назначения 5-АРИ была выше у пациентов с более тяжёлыми СНМП. В исследовании отсутствовал контроль приёма назначенной терапии, а также изначального психического состояния пациентов. В заключении делается вывод о том, что абсолютный риск самоповреждений и депрессии был крайне низким (17 случаев нанесения увечий себе и 237 случаев депрессии на 100 000 пациентов), вместе с тем потенциальные выгоды применения 5-АРИ превышают риски для большинства пациентов [8]. Нужно отметить, что предыдущие исследования также показали противоречивые данные о влиянии 5-АРИ на возникновение психических расстройств 15.
Влияние на метаболизм
Ранние исследования по влиянию 5-АРИ на метаболические нарушения в большинстве своём были малочисленными, экспериментальными и указывали на большую значимость дута- стерида в развитии сахарного диабета 2 типа, стеатоза печени 18. Одним из последних и наиболее крупных исследований в этой области была работа L. Wei et. al. (2019), в которой анализировались две крупные базы данных пациентов Великобритании и Тайвани [9]. Популяционное исследование проанализировало две когорты пациентов общей численностью 146 983 человека и показало увеличение частоты развития новых случаев сахарного диабета 2 типа как среди пациентов, получавших либо дутастерид, либо финастерид по сравнению с пациентами получавшими тамсулозин в качестве монотерапии в двух различных популяциях. При этом абсолютное число случаев развития сахарного диабета 2 типа среди пациентов, получавших 5-АРИ, было не большим (всего 1 573 новых случаев у 44 450 пациентов, применявших финастерид или дутастерид на протяжении 5 лет наблюдения). Помимо статистических недостатков когортных исследований, стоит отметить взаимосвязь между выраженностью СНМП при доброкачественной гиперплазии предстательной железы (ДГПЖ) и тяжестью метаболических нарушений, а также отсутствие контроля за применением терапии пациентами.
Эректильная дисфункция
В последнее время активно обсуждается влияние применения 5-АРИ на эректильную функцию. Рандомизированные клинические исследования с плацебо-контролем показали наличие эректильной дисфункции у 7-9 % пациентов в группе применения 5-АРИ в качестве монотерапии или комбинации с тамсулозином в сравнении с 5 % в группе монотерапии тамсулозином. Однако, начиная со второго года, эректильная дисфункция в группе приёма 5-АРИ в составе комбинации с тамсулозином или монотерапии снижалась и статистически не различалась с группой пациентов, находящихся на монотерапии тамсулозином [20]. Учитывая отсутствие данных о частоте эректильной дисфункции до начала исследования, а также возможность эффекта «ноцебо», связанного с необходимостью информировать пациентов о всех возможных нежелательных явлениях в ходе клинического исследования, возникла необходимость в специальных исследованиях для понимания истинного риска возникновения эректильной дисфункции при применении 5-АРИ. В результате проведённого K.W. Hagberg et al. в 2016 г. когортного исследования с анализом «случай-контроль» и участием 71 849 пациентов без факторов риска эректильной дисфункции не было выявлено значимого влияния на частоту возникновения эректильной дисфункции у пациентов, получающих 5-АРИ как в монотерапии, так и в комбинации с альфа-блокатором. Тогда как была выявлена положительная корреляция между возникновением эректильной дисфункции и длительностью течения ДГПЖ вне зависимости от проводимой терапии [10]. Учитывая ограничения когортных исследований, в 2018 г. c.G. Roehrborn et al. опубликовали результаты проспективного РКИ с плацебо-контролем среди 489 сексуально активных мужчин, которые показали, что даже в течение первого года терапии дутастеридом и тамсулози- ном не было получено значимой разницы в развитии эректильной дисфункции по сравнению с плацебо [11].
Учитывая статистические ограничения приведённых выше исследований, не все специалисты поддерживают теорию возникновения ПФС, основанную на изменении концентрации нейроактивных пептидов, некоторые сомневаются в наличии данной патологии в целом. Учитывая, что ПФС в более чем половине случаев развивается у пациентов с психическими нарушениями в анамнезе [21] данный феномен может относиться к группе «загадочных болезней», таких как болезнь амальгамы, множественная химическая чувствительность, болезнь Моргеллонов или болезнь Коро [2]. прежде всего, данное мнение связано с разнородностью симптомов у пациентов с ПФС, а также отсутствием идентичных биохимических изменений у данной группы больных. Кроме того, пики обращения с симптомами ПФС совпадают с активностью обсуждения данного феномена в средствах массовой информации (СМИ), а пациенты проявляют крайнюю настойчивость и обеспокоенность симптомами. Косвенным подтверждением этому является то, что несмотря на использование финастерида с 1992 г., пик распространённости ПФС пришёлся на период с 2011 по 2014 гг. (количество сообщении возросло в 4 раза), что, возможно, было связано с публикацией в 2008 г. в 17 странах (включая Великобританию и США) предупреждения о возможности развития депрессии и/или сексуальных расстройств у пациентов, применяющих финастерид, что в 2012 г. привело к активным обсуждениям этой проблемы в СМИ, а также появлению предупреждения о данных нежелательных явлениях в инструкции по применению финастерида в 2014 г. в США [1].
Заключение
Резюмируя все вышесказанное, можно сделать вывод о том, что ПФС является недостаточно изученным и противоречивым явлением, основанным в большей степени на спорадических случаях развития гетерогенных симптомов после отмены финастерида. Данный феномен требует дополнительных исследований со специально разработанным дизайном для определения истинной распространённости состояния, факторов риска, патогенетических механизмов, учитывая концентрации нейропептидов, а также психический, метаболический и сексуальный профили пациента до применения 5-АРИ.
Список литературы
1. Gray SL, Semla TP. Post-finasteride syndrome. BMJ. 2019;366:l5047. https://doi.org/10.1136/bmj.l5047
2. Trüeb RM, Régnier A, Dutra Rezende H, Gavazzoni Dias MFR. Post-Finasteride Syndrome: An Induced Delusional Disorder with the Potential of a Mass Psychogenic Illness? Skin Appendage Disord. 2019;5(5):320‒326. https://doi.org/10.1159/000497362
3. Melcangi RC, Santi D, Spezzano R, Grimoldi M, Tabacchi T, Fusco ML, Diviccaro S, Giatti S, Carrà G, Caruso D, Simoni M, Cavaletti G. Neuroactive steroid levels and psychiatric and andrological features in post-finasteride patients. J Steroid Biochem Mol Biol. 2017;171:229‒235. https://doi. org/10.1016/j.jsbmb.2017.04.003
5. Caruso D, Abbiati F, Giatti S, Romano S, Fusco L, Cavaletti G, Melcangi RC. Patients treated for male pattern hair with finasteride show, after discontinuation of the drug, altered levels of neuroactive steroids in cerebrospinal fluid and plasma. J Steroid Biochem Mol Biol. 2015;146:74‒79. https://doi.org/10.1016/j.jsbmb.2014.03.012
6. Giatti S, Diviccaro S, Panzica G, Melcangi RC. Post-finasteride syndrome and post-SSRI sexual dysfunction: two sides of the same coin? Endocrine. 2018;61(2):180‒193. https://doi.org/10.1007/s12020-018-1593-5
7. Soggiu A, Piras C, Greco V, Devoto P, Urbani A, Calzetta L, Bortolato M, Roncada P. Exploring the neural mechanisms of finasteride: a proteomic analysis in the nucleus accumbens. Psychoneuroendocrinology. 2016;74:387‒396. https://doi.org/10.1016/j.psyneuen.2016.10.001
8. Welk B, McArthur E, Ordon M, Anderson KK, Hayward J, Dixon S. Association of Suicidality and Depression With 5α-Reductase Inhibitors. JAMA Intern Med. 2017;177(5):683‒691. https://doi.org/10.1001/jamainternmed.2017.0089
9. Wei L, Lai EC, Kao-Yang YH, Walker BR, MacDonald TM, Andrew R. Incidence of type 2 diabetes mellitus in men receiving steroid 5α-reductase inhibitors: a populationbased cohort study. BMJ. 2019;365:l1204. https://doi.org/10.1136/bmj.l1204
10. Hagberg KW, Divan HA, Persson R, Nickel JC, Jick SS. Risk of erectile dysfunction associated with the use of 5-α reductase inhibitors for benign prostatic hyperplasia or alopecia: population-based studies using the Clinical Practice Research Datalink. BMJ. 2016;354:i4823. https://doi.org/10.1136/bmj.i4823
11. Roehrborn CG, Manyak MJ, Palacios-Moreno JM, Wilson TH, Roos EPM, Santos JC, Karanastasis D, Plastino J, Giuliano F, Rosen RC. A prospective randomised placebocontrolled study of the impact of dutasteride/tamsulosin combination therapy on sexual function domains in sexually active men with lower urinary tract symptoms (LUTS) secondary to benign prostatic hyperplasia (BPH). BJU Int. 2018;121(4):647‒658. https://doi.org/10.1111/bju.14057
12. Thompson IM, Goodman PJ, Tangen CM, Lucia MS, Miller GJ, Ford LG, Lieber MM, Cespedes RD, Atkins JN, Lippman SM, Carlin SM, Ryan A, Szczepanek CM, Crowley JJ, Coltman CA Jr. The influence of finasteride on the development of prostate cancer. N Engl J Med. 2003;349(3):215‒224. https://doi.org/10.1056/NEJMoa030660
13. Moinpour CM, Darke AK, Donaldson GW, Cespedes D, Johnson CR, Ganz PA, Patrick DL, Ware JE Jr, Shumaker SA, Meyskens FL, Thompson IM Jr. Health-related qualityof-life findings for the prostate cancer prevention trial. J Natl Cancer Inst. 2012;104(18):1373‒1385. https://doi.org/10.1093/jnci/djs359
14. Unger JM, Till C, Thompson IM Jr, Tangen CM, Goodman PJ, Wright JD, Barlow WE, Ramsey SD, Minasian LM, Hershman DL. Long-term Consequences of Finasteride vs Placebo in the Prostate Cancer Prevention Trial. J Natl Cancer Inst. 2016;108(12):djw168. https://doi.org/10.1093/jnci/djw168
15. Pietrzyk B, Olszanecka-Glinianowicz M, Owczarek A, Gabryelewicz T, Almgren-Rachtan A, Prajsner A, Chudek J. Depressive symptoms in patients diagnosed with benign prostatic hyperplasia. Int Urol Nephrol. 2015;47(3):431‒440. https://doi.org/10.1007/s11255-015-0920-5
16. Altomare G, Capella GL. Depression circumstantially related to the administration of finasteride for androgenetic alopecia. J Dermatol. 2002;29(10):665‒669. https://doi.org/10.1111/j.1346-8138.2002.tb00200.x
17. Irwig MS. Depressive symptoms and suicidal thoughts among former users of finasteride with persistent sexual side effects. J Clin Psychiatry. 2012;73(9):1220‒1223. https://doi.org/10.4088/JCP.12m07887
18. Traish A, Haider KS, Doros G, Haider A. Long-term dutasteride therapy in men with benign prostatic hyperplasia alter glucose and lipid profiles and increases the severity of erectile dysfunction. Horm Mol Biol Clin Investig. 2017;30(3):/j/ hmbci.2017.30.issue-3/hmbci-2017-0015/hmbci-2017-0015. xml. https://doi.org/10.1515/hmbci-2017-0015
19. Livingstone DE, Barat P, Di Rollo EM, Rees GA, Weldin BA, Rog-Zielinska EA, MacFarlane DP, Walker BR, Andrew R. 5α-Reductase type 1 deficiency or inhibition predisposes to insulin resistance, hepatic steatosis, and liver fibrosis in rodents. Diabetes. 2015;64(2):447‒458. https://doi.org/10.2337/db14-0249
20. Roehrborn CG, Siami P, Barkin J, Damião R, Major-Walker K, Nandy I, Morrill BB, Gagnier RP, Montorsi F; CombAT Study Group. The effects of combination therapy with dutasteride and tamsulosin on clinical outcomes in men with symptomatic benign prostatic hyperplasia: 4-year results from the CombAT study. Eur Urol. 2010;57(1):123‒131. https://doi.org/10.1016/j.eururo.2009.09.035
21. Ganzer CA, Jacobs AR. Emotional Consequences of Finasteride: Fool’s Gold. Am J Men’s Health. 2018;12(1):90‒95. https://doi.org/10.1177/1557988316631624
Об авторах
Александр Алексеевич Галушкин – к.м.н; научный медицинский эксперт в области урологии, антимикробной и химиотерапии компании

