Флемоклав и азитромицин в чем разница при пневмонии
Антибиотики нового поколения: за и против
Антибиотики – это вещества биологического или полусинтетического происхождения. Применяются в лечебной практике для борьбы с болезнетворными микробами, вирусами. До появления этих медпрепаратов статус неизлечимых болезней был у брюшного тифа, дизентерии, пневмонии, туберкулеза. Сегодня лечение заболеваний инфекционного характера возможно с применением 1-6 поколения антибиотиков.
На этот момент фармакологическая индустрия выпускает более 2000 разновидностей лекарственных средств подобного типа. Медики описали действие около 600 позиций, а во врачебной практике используются порядка 120-160 препаратов.
Важно! При любом заболевании принимать антибиотики рекомендуется после консультации с врачом. В противном случае может развиться антибиотикорезистентность (снижение чувствительности патогенных микроорганизмов к антибактериальным средствам).
Классификация антибиотиков
Все антибактериальные средства можно разделить на 5 категорий по характеристикам и спектру применения. Рассмотрим эту классификацию подробнее:
Спектр действия
Различают антибактериальные средства:
По составу
Антибактериальные препараты делят на 6 групп:
Поколения препаратов. У передовых антимикробных препаратов насчитывается уже шесть генераций. Например, пенициллин был первым средством природного происхождения, тогда как третья или шестая генерация – это уже улучшенная версия, которая включает в состав сильнейшие ингибиторы. Зависимость прямая: чем новее генерация, тем эффективнее воздействие препаратов на патогенную микрофлору.
По способу приема. Пероральные – принимают через рот. Это различные сиропы, таблетки, растворимые капсулы, суспензии. Парентеральные – вводятся внутривенно или внутримышечно. Они быстрее дают эффект, чем пероральные лекарства. Ректальные препараты вводятся в прямую кишку.
Важно! Принимать антибиотики допускается только после консультации с врачом, иначе разовьется антибиотикорезистентность.
Антибактериальные средства нового поколения
Отличие последних генераций антибиотиков от их ранних версий в более совершенной формуле действующего вещества. Активные компоненты точечно устраняют только патологические реакции в клетке. Например, кишечные антибиотики нового поколения не нарушают микрофлору ЖКТ. При этом они борются с целой «армией» возбудителей инфекций.
Новейшие антибактериальные препараты делятся на пять групп:
Рассмотрим несколько известных противомикробных средств импортного и российского производства.
Амоксициллин – импортный противомикробный препарат из группы пенициллинов. Используется во врачебной практике для лечения бактериальной инфекции. Эффективен при кишечных инфекциях, гайморите, ангине, болезни Лайма, дизентерии, сепсисе.
Авелокс – медпрепарат последней генерации из группы фторхинолонов. Отличается сильнейшим воздействием на бактериальные и атипичные возбудители. Не вредит почкам и ЖКТ. Используется при острых, хронических заболеваниях.
Цефалоспорины – антибиотики третьего поколения. К этой группе относят Цефтибутен, Цефтриаксон и другие. Используются для лечения пиелонефрита, пневмонии. В целом это безопасные средства с малым количеством побочных действий. Однако их нужно принимать только после консультации с врачом. Медпрепаратов много, а какой именно выбрать – порекомендует специалист.
Дорипрекс – импортный противомикробный препарат синтетического происхождения. Показал хорошие результаты при лечении пневмонии, запущенных интраабдоминальных инфекций, пиелонефритах.
Инваз – антибактериальное средство из группы карбапенемов. Выпускается в ампулах для парентерального способа применения. Показывает быстрый эффект при лечении бактериальных расстройств кожи, мягких тканей, инфекциях мочевыводящих путей, пневмонии, септицемиях.
Аугметин – полусинтетический пенициллин третьей генерации с добавлением усиливающих ингибиторов. Педиатрами признается лучшим комплексным медпрепаратом для лечения детских гайморита, бронхита, тонзиллита и других инфекций дыхательных путей.
Цефамандол – антибактериальное средство российского производства. Относится к группе цефалоспоринов третьего поколения. Используется для лечения кишечных инфекций, возбудителей инфекций половых органов. Как противомикробное средство обширного диапазона воздействия применяется при простудных заболеваниях.
Лучшие антибактериальные препараты широкого диапазона действия
Противомикробные средства новой генерации обычно синтезируют из природного сырья и стабилизируют в лабораториях. Это помогает усилить эффект лекарства на патогенную микрофлору.
Какие препараты самые сильные? Врачи относят к таким антибактериальные средства широкого спектра воздействия. Приведем ниже краткий список препаратов по названиям:
Резюме
Мы рассмотрели российские и импортные антибиотики широкого спектра действия, кратко описали классификацию препаратов. Ответим на вопрос: какие антибактериальные средства выбрать?
Важно понимать, противомикробные лекарства для обширного применения обладают токсичностью, поэтому негативно влияют на микрофлору. Кроме того, бактерии мутируют, а значит препараты теряют свою эффективность. Поэтому антибактериальные средства с новейшей структурой будут в приоритете, чем их ранние аналоги.
Самолечение антибиотиками опасно для здоровья. При инфекционном заболевании первым делом нужно обратиться к врачу. Специалист установит причину болезни и назначит эффективные антибактериальные средства. Самолечение «наугад» приводит к развитию антибиотикорезистентности.
Врач рассказал, как защититься от бактериальной пневмонии при коронавирусе
Разбираемся, что реально помогает и нужно ли при Covid-19 сразу пить антибиотики
Считается, что главная угроза при коронавирусе это поражение легких. Каким образом происходит ковидное поражение, в какой момент процесс осложняется бактериальной пневмонией? Как отличить одно от другого, есть ли способ защитить себя заранее и не допустить перехода COVID-19 в пневмонию, kp.ru рассказал кандидат медицинских наук, врач-пульмонолог Сеченовского университета Владимир Бекетов.
Первое, что важно уяснить, говорит эксперт, это то, что новая коронавирусная инфекция – это инфекция вирусная и входит в группу острых респираторных вирусных инфекций. Особняком в этой группе стоит только грипп. А значит, что для COVID-19, как и для всех респираторных вирусных инфекций, поражающих верхние дыхательные пути и легкие, характерен следующий феномен. Иммунная защита в легких ослабевает. Поэтому становится возможным присоединение вторичной бактериальной супер-инфекции примерно на 5 – 9 день течения любого острого респираторного вирусного заболевания.
РИСКИ ВОЗНИКНОВЕНИЯ ПНЕВМОНИИ
Риск присоединения бактериальной инфекции при заболевании COVID-19 увеличивается, если пациент попадает в стационар и при этом имеет хроническую патологию верхних и нижних дыхательных путей (например, ХОБЛ – хроническая обструктивная болезнь легких) или сердечную недостаточность.
КАК РАЗВИВАЕТСЯ ПНЕВМОНИЯ
В условиях, сниженной дыхательной и двигательной активности, когда слизь по бронхам движется меньше, на фоне интоксикации организма и снижения иммунитета, бактерии из носоглотки спускаются в нижние отделы дыхательного тракта и могут начать там размножаться.
Таким образом, может быть вызван сначала бактериальный бронхит, потом и бронхопневмония с переходом в пневмонию. Развитию бактериальной пневмонии может способствовать и длительное нахождение пациента на аппарате ИВЛ. Не смотря на соблюдение всех строжайших мер обеззараживания аппараты ИВЛ являются факторами риска возникновения вентилятор-ассоциированных пневмоний.
ДЕЙСТВИТЕЛЬНО ЛИ ПНЕВМОНИЯ ИДЕТ СЛЕДОМ ЗА COVID-19
По словам эксперта, на сегодняшний день ряд авторитетных медицинских ассоциаций выпустили меморандумы и открытые письма с призывами к коллегам уменьшить применение антибиотиков в ходе лечения COVID-19, потому что антибиотики не дают пользы, но приносят в данном случае вред, вплоть до токсического поражения печени и развития антибиотико-ассоциированной диареи.
Сам феномен вторичной бактериальной пневмонии при коронавирусе переоценен, продолжает эксперт. Подобные процессы развиваются в основном у пациентов с сердечной недостаточностью, а для них действуют меры повышенной предосторожности, ограничения в передвижении, рекомендации по самоизоляции и лечению на дому.
ВАЖНО!
Как обезопасить себя от пневмонии?
1. Вакцинироваться от пневмококка
Самая частая причина внебольничной пневмонии – это пневмококковая инфекция. Вакцинация от пневмококка дает иммунитет на 5 – 10 лет, если вы провакцинировались 13-валентной вакциной, то она гарантирует пожизненный иммунитет. Стафилококк, стрептококк и гемофильная палочка – эти бактерии чаще всего являются причинами вторичных бактериальных пневмоний.
2. Увлажнять воздух
Увлажнение воздуха в помещении достоверно снижает риски возникновения в бронхах слизистых гнойных пробок, которые ведут к закупориванию бронхов, к образованию в бронхах сухой мокроты и развитию там инфекции. Поэтому, если влажность воздуха будет выше 40%, то есть шансы на то, что бактериальная пневмония развиваться не будет. Важно понимать, что бытовые увлажнители воздуха нужно вовремя чистить.
НОВЫЕ ФТОРХИНОЛОНЫ: новые возможности лечения внебольничной пневмонии
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетлив
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетливая тенденция к увеличению смертности от пневмонии во всех развитых странах мира. Причина может быть связана прежде всего с ростом резистентности основных возбудителей внебольничных инфекций дыхательных путей ко многим антибактериальным препаратам. Этим объясняется интерес клиницистов к новым антибактериальным средствам, к которым отмечается меньший уровень резистентности бактерий.
Этиология внебольничной пневмонии непосредственно связана с нормальной микрофлорой «нестерильных» верхних отделов дыхательных путей (полости рта, носа, рото- и носоглотки). Из множества видов микроорганизмов, колонизующих верхние отделы дыхательных путей, лишь некоторые, обладающие повышенной вирулентностью, проникая в нижние дыхательные пути, способны вызывать воспалительную реакцию даже при минимальных нарушениях защитных механизмов. Такими типичными бактериальными возбудителями внебольничной пневмонии являются следующие перечисленные ниже микроорганизмы.
Streptococcus pneumoniae — самый частый возбудитель внебольничной пневмонии у лиц всех возрастных групп (30-50%). Наиболее остро в настоящее время стоит проблема распространения среди пневмококков пенициллинрезистентных штаммов. В некоторых странах частота устойчивости пневмококков к пенициллину может достигать 60%. Масштабных исследований распространения резистентности пневмококков к пенициллину в нашей стране не проводилось. По данным локальных исследований в Москве, частота устойчивых штаммов составляет 2%, штаммов с промежуточной чувствительностью — около 20%. Устойчивость пневмококков к пенициллину связана не с продукцией β-лактамаз, а с модификацией мишени действия антибиотика в микробной клетке — пенициллинсвязывающих белков, поэтому ингибитор-защищенные пенициллины в отношении этих пневмококков также неактивны. Устойчивость пневмококков к пенициллину обычно ассоциируется с устойчивостью к цефалоспоринам I-II поколений, макролидам, тетрациклинам, ко-тримоксазолу.
Haemophilus influenzae — второй по частоте возбудитель (10-20%), особенно у лиц, страдающих хроническими обструктивными болезнями легких, а также у курильщиков; высокой природной активностью в отношении гемофильной палочки обладают аминопенициллины, амоксициллин/клавуланат, цефалоспорины II-IV поколений, карбапенемы, фторхинолоны. Основной механизм резистентности H. influenzae связан с продукцией β-лактамаз.
Staphylococcus aureus — нечастый возбудитель пневмонии (около 5%), наиболее опасен для пожилых людей, наркоманов, алкоголиков, после перенесенного гриппа. Препаратами выбора при стафилококковых пневмониях являются оксациллин, также активны амоксициллин/клавуланат, цефалоспорины, фторхинолоны.
Klebsiella pneumoniae — редкий возбудитель внебольничной пневмонии (менее 5%), встречается, как правило, у больных с тяжелыми сопутствующими заболеваниями (сахарный диабет, застойная сердечная недостаточность, цирроз печени и др.). Наиболее высокой природной активностью в отношении этого возбудителя обладают цефалоспорины III-IV поколений, карбапенемы, фторхинолоны.
Определенное значение в этиологии пневмонии имеют также два других микроорганизма, характеризующихся особыми биологическими свойствами и внутриклеточной локализацией в макроорганизме — Micoplasma pneumoniae и Chlamidia pneumoniae. В отношении этих микроорганизмов клинически неэффективны все β-лактамные антибиотики. Наибольшей природной активностью обладают макролиды и тетрациклины, несколько менее активны ранние фторхинолоны.
В настоящее время в качестве основных средств стартовой терапии внебольничной пневмонии в амбулаторной практике обычно рекомендуются аминопенициллины (ампициллин, амоксициллин), защищенные аминопенициллины (амоксициллин/клавуланат), пероральные цефалоспорины II поколения (цефуроксим аксетил), макролиды (эритромицин, кларитромицин, рокситромицин, азитромицин, спирамицин, мидекамицин). При тяжелом течении пневмонии у госпитализированных больных целесообразно применение парентеральных цефалоспоринов III поколения или фторхинолонов. Клиническая эффективность всех указанных препаратов примерно одинакова, однако при лечении внебольничной пневмонии ни один из этих антибиотиков не может считаться идеальным.
Аминопенициллины характеризуются высокой природной активностью в отношении S. pneumoniae (амоксициллин более высокой, чем ампициллин), однако о проблемах, связанных с возрастающим распространением пенициллинрезистентных пневмококков, упоминалось выше. Имеются данные, что амоксициллин пока сохраняет клиническую эффективность в отношении штаммов пневмококка с промежуточной чувствительностью, а также в отношении устойчивых штаммов. Однако можно предположить снижение клинической эффективности амоксициллина при выделении штаммов пневмококка с высоким уровнем резистентности. Аминопенициллины неэффективны при пневмонии, вызванной S. aureus и K. pneumoniae.
Назначение амоксициллина/клавуланата и цефуроксима аксетила предусмотрено большинством международных и отечественных стандартов лечения внебольничной пневмонии ввиду высокой активности против пневмококков, гемофильной палочки, стафилококков. Однако в отношении пенициллинрезистентных пневмококков мы сталкиваемся с теми же проблемами, что и у аминопенициллинов.
Следует подчеркнуть, что все пенициллины и цефалоспорины неактивны в отношении микоплазм, а также хламидий, и поэтому клинически неэффективны при атипичных пневмониях.
Макролидные антибиотики проявляют высокую природную активность в отношении пневмококков, стафилококков, микоплазм, хламидий и низкую — в отношении гемофильной палочки. Однако в последние годы во всех регионах мира, в том числе и в нашей стране, отмечается неуклонная тенденция повышения устойчивости пневмококков к макролидам. Резистентность пневмококков обычно ассоциируется с неуспехом терапии макролидами. Следует отметить, что новые полусинтетические макролиды не имеют преимуществ перед эритромицином, когда речь идет об устойчивых штаммах пневмококков. В последние годы значение макролидов при внебольничной пневмонии пересматривается. По всей видимости, эти препараты могут быть рекомендованы только в случае нетяжелой пневмонии при подозрении на атипичную этиологию.
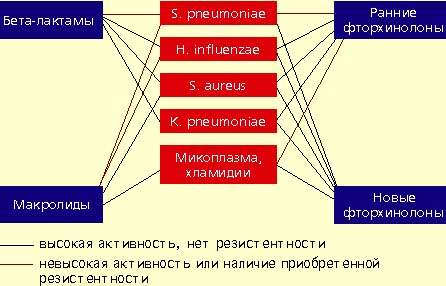 |
| Антимикробная активность бета-лактамов, макролидов и фторхинолонов в отношении наиболее значимых возбудителей внебольничной пневмонии |
Фторхинолоны обладают широким спектром антимикробной активности. Эти препараты проявляют природную активность в отношении практически всех потенциальных возбудителей внебольничной пневмонии. Однако применение ранних фторхинолонов (ципрофлоксацин, офлоксацин, пефлоксацин) при внебольничной пневмонии было ограничено из-за их слабой природной активности в отношении основного возбудителя пневмонии — S. pneumoniae. Значения минимальных подавляющих концентраций (МПК) ранних фторхинолонов в отношении пневмококков составляют от 4 до 8 мкг/мл, а их концентрация в бронхолегочной ткани значительно ниже, что недостаточно для успешной терапии. Описаны случаи, когда терапия фторхинолонами при пневмококковой пневмонии не приносила успеха.
Определенные перспективы лечения внебольничной пневмонии связаны с появлением в последние годы препаратов нового поколения фторхинолонов, которые характеризуются более высокой активностью в отношении S. pneumoniae. Современная классификация фторхинолонов представлена в таблице.
Первым препаратом нового поколения фторхинолонов является левофлоксацин, представляющий собой левовращающий изомер офлоксацина. Левофлоксацин характеризуется более высокой активностью против пневмококков (МПК = 2 мкг/мл) по сравнению с офлоксацином и ципрофлоксацином, причем препарат сохраняет активность и в отношении пенициллинрезистентных штаммов S. pneumoniae. Левофлоксацин — это первый и пока единственный антибактериальный препарат, который официально рекомендован в США для лечения пневмонии, вызванной пенициллинрезистентными пневмококками. Среди новых фторхинолонов только левофлоксацин выпускается в двух лекарственных формах — для приема внутрь и для внутривенного введения. Поэтому левофлоксацин может применяться не только в амбулаторной практике, но и при тяжелых пневмониях у госпитализированных больных. В большом количестве клинических исследований показана высокая эффективность левофлоксацина при внебольничной пневмонии в дозе 500 мг, вводимой однократно в сутки. К несомненным достоинствам левофлоксацина можно отнести его хорошую переносимость.
Вторым препаратом нового поколения фторхинолонов, внедренным в клиническую практику, был спарфлоксацин. Он зарегистрирован в нашей стране и выпускается только в пероральной форме. Однако наряду с доказанной высокой клинической эффективностью следует отметить ряд нежелательных эффектов, отмеченных при его применении. Прежде всего речь идет о существенной фототоксичности спарфлоксацина (т. е. повышенной чувствительности кожи к ультрафиолету); по некоторым данным, частота возникновения этого нежелательного явления составляет более 10%. Фототоксичность характерна для всех препаратов класса фторхинолонов, однако при использовании других препаратов этой группы (например, левофлоксацина, офлоксацина, ципрофлоксацина) это побочное явление возникает гораздо реже. К другим достаточно серьезным нежелательным явлениям, связанным с приемом спарфлоксацина, относится удлинение интервала QT на ЭКГ, что может сопровождаться появлением желудочковых аритмий, иногда опасных для жизни. Клиническое значение этого феномена до конца не ясно, однако известен факт отзыва с рынка препарата этого класса (грепафлоксацина) именно по данной причине. Таким образом, спарфлоксацин, по всей видимости, не может быть рекомендован для рутинного применения в амбулаторной практике при пневмонии, учитывая наличие других, более безопасных препаратов этой группы.
Последним зарегистрированным в нашей стране новым фторхинолоном является моксифлоксацин. Пока он существует только для перорального приема, однако в следующем году ожидается появление в клинической практике парентеральной лекарственной формы. Моксифлоксацин характеризуется очень высокой природной активностью в отношении пневмококков (МПК = 0,25 мкг/мл), в том числе пенициллинрезистентных штаммов, а также более высокой активностью (по сравнению с ранними фторхинолонами) в отношении микоплазм и хламидий. Моксифлоксацин в суточной дозе 400 мг (однократно) показал высокую клиническую эффективность и хорошую переносимость при внебольничной пневмонии. В контролируемых исследованиях не отмечено клинически значимого удлинения интервала QT и существенной фототоксичности.
Ряд перспективных препаратов нового поколения фторхинолонов в настоящее время проходят стадию клинического изучения. В 2001 году ожидается разрешение клинического применения в России еще двух препаратов этой группы — гемифлоксацина и гатифлоксацина.
Ответы на вопросы
Стенограмма лекции
Общая продолжительность: 10:32
Оксана Михайловна Драпкина, секретарь межведомственного Научного Совета по терапии РАМН, доктор медицинских наук, профессор:
— Вот у нас сколько вопросов!
Владимир Кириллович Таточенко, доктор медицинских наук, профессор:
Очень рады. Спасибо!
Как вы относитесь к одновременному назначению антибиотиков и бактериофагов?
Я никогда бактериофаги не применял. Во время войны мальчишки нам давали бактериофаги, но мы все равно болели дизентерией. Никаких доказательств эффективности бактериофагов не опубликовано. Если вы даете антибиотики, не надо давать больше ничего.
Как вы считаете, с чем связано довольно длительное (несколько десятков лет) сохранение чувствительности к амоксициллину и амоксиклаву?
Оксана Драпкина: Несколько лет она сохраняется.
Владимир Таточенко: Никто не знает, почему стрептококк сохраняет чувствительность (к пенициллину тоже), но хорошие препараты. Очень хорошие препараты, которые действуют, видимо, не на один субстрат бактериальной клетки.
Имеет ли клиническое значение способность макролидов подавлять образование микробных биопленок (в том числе при инфекции выраженной синегнойной палочки)?
Вы знаете, что при муковисцидозе длительное применение макролидов (эритромицина, кларитромицина) рекомендуется как будто бы именно с точки зрения нарушения микробного биофильма синегнойной палочки. Я давно занимаюсь муковисцидозом. Настолько тяжелое заболевание, что даже если какой-то отдаленный шанс на то, что это помогает, надо применять.
Хотя я знаю, что некоторые это оспаривают. Но мы рекомендуем при стойкой синегнойной колонизации или инфекции применять длительно макролиды.
Чем отличается флемоксин солютаб от флемоклава солютаба? Что лучше у детей?
И то и другое лучше. Флемоксин солютаб – это амоксициллин, а флемоклав солютаб – это амоксициллин клавуланат. Я говорил, они имеют свои показания. Они оба лучшие. Мы применяем и те и другие. Они имеют определенный привкус, который дети любят. Флемоклав, например, имеет вкус крем-брюле, насколько я понимаю. Так что если кто любит крем-брюле – особенно.
Насколько необходимо и правильно с первого дня приема антибиотика применять пробиотические препараты?
Не нужно их применять, потому что мы сейчас не пользуемся длительными курсами антибиотиков. Конечно, если человек или ребенок получает месяцами антибиотики, нужно посмотреть его кишечную флору. Во всех остальных случаях это совершенно лишнее назначение, которое ничего не прибавляет.
Когда начинать применять антибиотики при ОРВИ? Нужны ли они вообще и в какой ситуации?
Они не нужны при ОРВИ, если вы исключили отит, стрептококковый тонзиллит, поражение нижних дыхательных путей (пневмонию). Они не нужны ни сначала, ни в конце, ни в середине.
ЛОР-врачи очень часто назначают антибиотики после высевов из зева на аденоидит, тонзиллит. Насколько это оправдано при неострых процессах?
Мне очень трудно сказать, что они высевают. Дело в том, что если они высевают стрептококк и у ребенка есть какие-то признаки воспаления, это оправдано. Считается, что просто носительство стрептококка при нормальной глотке, миндалинах… Просто высев не подлежит лечению.
Но я должен сказать, что у некоторых групп детей (с Северного Кавказа) мы очень часто находим стрептококк. Гораздо чаще, чем у московских детей. При этом мы имеем очень высокий уровень антистрептолизина, что указывает на то, что недавно был какой-то процесс. Не грех избавиться от этого стрептококка.
Почему ЛОР-врачи назначают? Я не знаю, что они высевают. Если они высевают зеленящий стрептококк, то не нужно. Вообще в зеве, говорят, около 600 видов разных микроорганизмов. Всех их удалять не надо. Что-нибудь еще заведем.
Можно ли по содержанию микроорганизмов в выдыхаемом воздухе судить о возбудителях? Есть ли такие тесты?
Нет, таких тестов нет. Честно говоря, при пневмонии коррелирует флора высев пневмококка из зева, из плевральной полости или из крови. Но вообще, я говорю, такое количество флоры в нашем организме (особенно в дыхательных путях), что определять их не нужно ни в выдыхаемом воздухе, ни… Просто взять мазок можно.
Это все, кроме гемолитического стрептококка группы А. Сейчас есть прекрасные стрепто-тесты. Стоит, по-моему, 120 или 150 рублей. Позволяет… У нас практически стопроцентное совпадение с посевом. Мы им пользуемся. Через 10 минут ты уже знаешь, есть у ребенка стрептококк или нет. Есть стрептококк – ты его лечишь. Нет стрептококка – ты его не лечишь.
Вы были приверженцем коротких курсов антибиотиков при пневмонии и бронхите.
Я никогда не был приверженцем антибиотиков при бронхитах. Никогда не лечил и, видимо, правильно делал. Что касается коротких курсов. Вы знаете, оказывается, нельзя точно сказать, доказать строго, что короткие курсы помогают.
Но я вам могу сказать, что профессор Манеров из Новокузнецка в своей докторской диссертации апробировал двухдневный, пятидневный и одиннадцатидневный курс пенициллина при пневмококковой пневмонии. Результаты были абсолютно одинаковые.
Я считаю, что можно ограничиться назначением антибиотика в течение двух суток после падения температуры. Сколько это будет? Наверное, будет 3-4 дня при большинстве пневмоний. Сейчас появляются работы (надо сказать, что педиатры в этом лидировали) у взрослых о коротких курсах лечения пневмонии. Появились новые (на новом уровне) доказательные данные о применении 3-4-дневных курсов антибиотиков у детей при пневмонии.
Когда-то мою внучку моя сноха уколола один раз пенициллином при большой нижнедолевой пневмонии. Больше она мне не сказала… Больше она ее не колола. На этом вся пневмония кончилась. Но я не советую вам проводить такие эксперименты.
Какие антибактериальные препараты и как долго лучше применять при нетяжелой ЛОР-инфекции, чтобы достичь максимального эффекта и иметь минимальные нежелательные явления?
ЛОР-инфекции бывают разные. Если говорить об отите (серьезном гнойном отите)… Я не буду сейчас говорить о так называемом катаральном отите. Идут споры, можно или нельзя их оставлять без антибиотиков. Голландцы оставляют без антибиотиков, шведы лечат всех. У голландцев вдвое больше мастоидитов: у них 4 на 100 тысяч, а у шведов 2 на 100 тысяч.
Недавно мы видели ребенка, которого в Испании не лечили от ангины. Он пришел к нам с хорошим носоглоточным абсцессом, который прорвался через наружный слуховой проход. Лечить все-таки нужно. При отитах курс лечения должен быть 7-10… У маленьких детей – 10 дней, у детей постарше можно ограничиться 7-ю днями.
Если говорить о тонзиллите стрептококковом, то ревматологи настаивают. Они правильно настаивают. Есть доказательства того, что пенициллино-терапия должна продолжаться (пенициллин в основном) 10 дней. Не меньше! Иначе значительный процесс бактериологических рецидивов.
Сейчас есть работы, которые показывают, что применение азитромицина, вильпрофена солютаба можно ограничить пятью днями. За 5 дней получается точно такой же результат в смысле бактериологического рецидива через месяц, как и 10-тидневные курсы пенициллина.
Если это острые аденоидиты, там есть высев какой-то – наверное, надо лечить антибиотиками. Но, в общем, мы не склонны лечить аденоидит антибиотиками. Лечатся антибиотиками острые отиты и острые тонзиллиты из ЛОР.
Я не говорю о синусите. Если говорить о синусите, то первые 10-15 дней его лечить не надо. Это вирусная история. Если продолжается температура, боли, затемнения, отделяемое, то его лечат так же, как отит (теми же препаратами). В литературе очень разные сроки лечения: от одной недели до трех недель. Канадцы рекомендуют (их Ассоциация) лечить три недели, а французы говорят, что лечи – не лечи, он сам проходит. Здесь надежных данных нет, но если это острый процесс, мы его лечим.
Оксана Драпкина: Спасибо огромное, Владимир Кириллович.
Владимир Таточенко: Пожалуйста.
Оксана Драпкина: Спасибо! Видите, большое количество вопросов. Все это побуждает нас просить вас снова прийти к нам. Это уже будет в декабре, но мы свяжемся тогда? Если сможете.
Владимир Таточенко: Я здесь.
Оксана Драпкина: Хорошо! Спасибо огромное!
Владимир Таточенко: Пожалуйста.


