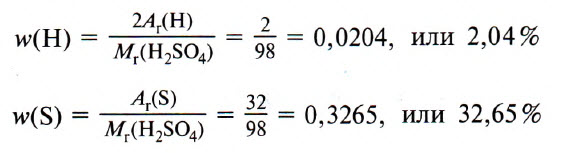как найти массовое отношение химических элементов
Урок №13. Массовая доля химического элемента в соединении
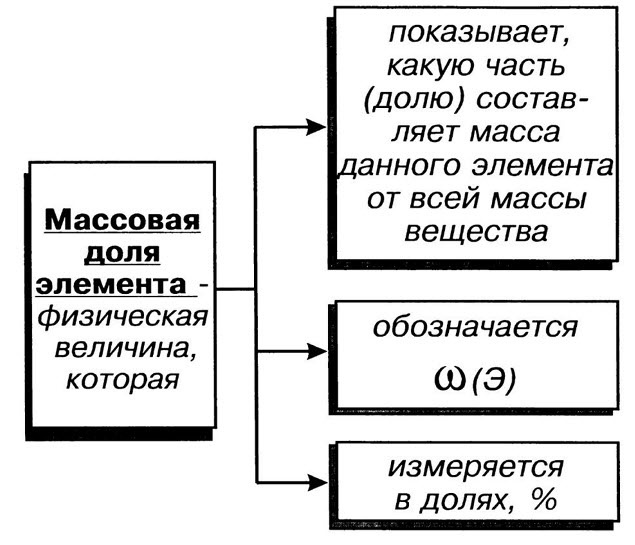
Массовая для элемента в данном веществе (w) – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества.
w – массовая доля элемента в веществе,
n – индекс в химической формуле,
Ar – относительная атомная масса,
Mr – относительная молекулярная масса молекулы вещества.
Массовые доли выражают в процентах или в долях:
w (элемента) = 20% или 0,2.
Вычислите массовые доли элементов в фосфорной кислоте, имеющей простейшую химическую формулу H 3 PO 4 , с точностью до сотых.
Дано :
Найти :
Решение :
1. Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав фосфорной кислоты
2. Вычисляем относительную молекулярную массу соединения
Mr(H 3 PO 4 ) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98
3. Вычисляем массовые доли элементов по формуле:
w (элемента) = (n· Ar(элемента) · 100%) / Mr( молекулы )
w(H) = n(H)·Ar(H)·100% / Mr(H 3 PO 4 ) = 3·1·100% / 98 = 3,06%
w(P) = n(P)·Ar(P)·100% / Mr(H 3 PO 4 ) = 1·31·100% / 98 = 31,63%
w(O) = n(O)·Ar(O)·100% / Mr(H 3 PO 4 ) = 4·16·100% / 98 = 65,31%
Сумма значений массовых долей всех элементов должна составить 100% w(H) + w(P) + w(O) = 100%
3,06% + 31,63% + 65,31% = 100%
Таким образом, массовые доли элементов в фосфорной кислоте вычислены правильно.
Как найти массовую долю вещества по формуле
В химии она рассчитывается:
Формула для нахождения такая:
Нахождение массовой доли химического элемента
Массовая доля химического элемента в веществе находится по отношению атомной массы химического элемента, умноженной на количество его атомов в этом соединении, к молекулярной массе вещества.
Например, для определения w кислорода (оксигена) в молекуле углекислого газа СО2 вначале найдем молекулярную массу всего соединения. Она составляет 44. В молекуле содержится 2 атома кислорода. Значит w кислорода рассчитываем так:
w(O) = (Ar(O) · 2 ) / Mr(СО2)) х 100%,
w(O) = ((16 · 2) / 44) х 100% = 72,73%.
w( H2O ) = ((18 · 5) / 250 ) · 100% = 36%
Нахождение массовой доли вещества в смесях и растворах
Например, растворили 10 г поваренной соли в 200 г воды. Нужно найти процентную концентрацию соли в полученном растворе.
Для определения концентрации соли нам нужна m раствора. Она составляет:
m (р-ра) = m (соли) + m (воды) = 10 + 200 = 210 (г).
Находим массовую долю соли в растворе:
Таким образом, концентрация поваренной соли в растворе составит 4,76%.
Если в условии задачи дается не m, а объем раствора, то его нужно перевести в массу. Делается это обычно через формулу для нахождения плотности:
Такую концентрацию используют чаще всего. Именно ее имеют в виду (если нет отдельных указаний), когда пишут о процентном содержании веществ в растворах и смесях.
Массовая доля примесей
В задачах часто дается концентрация примесей в веществе или вещества в его минералах. Следует обратить внимание на то, что концентрация (массовая доля) чистого соединения будет определяться путем вычитания из 100% доли примеси.
Соответственно, если написано, что в минерале содержится только 20% железа, то во все химические реакции и в химическом производстве будут участвовать именно эти 20%.
Например, для реакции с соляной кислотой взяли 200 г природного минерала, в котором содержание цинка 5%. Для определения массы взятого цинка пользуемся той же формулой:
из которой находим неизвестную m раствора:
m (Zn) = ( w · 100% ) / m (минер.)
m (Zn) = (5 · 100) / 200 = 10 (г)
То есть, в 200 г взятого для реакции минерала содержится 5% цинка.
Задача. Образец медной руды массой 150 г содержит сульфид меди одновалентной и примеси, массовая доля которых составляет 15%. Вычислите массу сульфида меди в образце.
Вначале найдем m примесей в образце руды. Для этого воспользуемся уже известной формулой:
m(примес.) = (15 · 150) / 100% = 22,5 (г).
Теперь по разности найдем количество сульфида в образце:
Вначале находим w соединения:
А теперь по ней, воспользовавшись той же формулой, что и в первом способе (формула А), найдем m сульфида меди:
m(Cu2S) = (85 · 150) / 100% = 127,5 (г).
Ответ: масса сульфида меди одновалентного в образце составляет 127,5 г.
Видео
Из видео вы узнаете, как правильно производить рассчеты по химическим формулам и как найти массовую долю.
Как найти массовое отношение химических элементов
Ключевые слова конспекта: массовая доля элемента в соединении, вычисления по химическим формулам.
Относительная атомная масса элемента ( Аr ) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а.е.м. Относительная молекулярная масса ( Мr ) вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода. Она складывается из относительных атомных масс элементов, составляющих молекулу:
Массовая доля химического элемента ( ω ) в сложном веществе показывает, какая доля от всей массы сложного вещества приходится на массу этого элемента.
Массовая доля элемента в соединении равна отношению его массы в данном веществе к относительной молекулярной массе этого вещества
Вывод химических формул,
если известны массовые доли химических элементов,
входящих в состав данного вещества
Задача. Известно, что массовые доли натрия, серы и кислорода в данном веществе соответственно составляют 29,1 %, 40,51 % и 30,38 %. Вычислите индексы в химической формуле вещества NaxSyOz
Решение. Прежде всего из условия задачи следует, что в 100 единицах массы вещества: 29,1 единицы натрия, 40,51 единицы серы и 30,38 единицы кислорода. Если каждое из этих чисел разделить на относительные атомные массы соответствующих элементов; то в таком случае находим число атомов каждого элемента в 100 единицах вещества:
29,1 : 23 = 1,265 атома Na
40,51 : 32 = 1,266 атома S
30,38 : 16 = 1,899 атома О
В результате можно определить соотношение чисел атомов в формуле вещества:
х : у : z = 1,265 : 1,266 : 1,899
Чтобы получить соотношения целых чисел; разделим все числа атомов на наименьшее из них (на 1,265):
1 : 1 : 1,5
Для того чтобы количество атомов кислорода было выражено целым числом; полученные числа атомов умножаем на два:
х : у : z = (1 • 2) : (1 • 2) : (1,5 • 2) = 2 : 2 : 3
Эти числа принимаются в качестве индексов в простейшей формуле данного вещества — Na2S203.
Конспект урока «Массовая доля элемента в соединении».
Вычисление массовых долей химических элементов в сложном веществе
Определите массовые доли химических элементов в серной кислоте H2SO4 и выразите их в процентах.
Решение
1. Вычисляем относительную молекулярную массу серной кислоты:
Mr (H2SO4) = 1 · 2 + 32 + 16 · 4 = 98
2. Вычисляем массовые доли элементов.
Для этого численное значение массы элемента (с учетом индекса) делят на молярную массу вещества:
Учитывая это и обозначая массовую долю элемента буквой ω, вычисления массовых долей проводят так:
ω(Н) = 2 : 98 = 0,0204, или 2,04%;
ω(S) = 32 : 98 = 0,3265, или 32,65%;
ω(О) = 64 : 98 =0,6531, или 65,31%
Определите массовые доли химических элементов в оксиде алюминия Al2O3 и выразите их в процентах.
Решение
1. Вычисляем относительную молекулярную массу оксида алюминия:
Mr( Al2O3) = 27 · 2 + 16 · 3 = 102
2. Вычисляем массовые доли элементов:
ω(Al) = 54 : 102 = 0,53 = 53%
ω(O) = 48 : 102 = 0,47 = 47%
Как вычислить массовую долю вещества в кристаллогидрате
Определите массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2·2H2O.
Решение
Молярная масса BaCl2·2H2O составляет:
М(BaCl2·2H2O) = 137+ 2 · 35,5 + 2 · 18 = 244 г/моль
Из формулы BaCl2·2H2O следует, что 1 моль дигидрата хлорида бария содержит 2 моль H2O. Отсюда можно определить массу воды, содержащейся в BaCl2·2H2O:
Находим массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2·2H2O.
Из образца горной породы массой 25 г, содержащей минерал аргентит Ag2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце.
Определяем количество вещества серебра, находящегося в аргентите:
n(Ag ) = m(Ag) / M(Ag) = 5,4 / 108 = 0,05 моль.
Из формулы Ag2S следует, что количество вещества аргентита в два раза меньше количества вещества серебра.
Определяем количество вещества аргентита:
n(Ag2S) = 0,5 · n(Ag) = 0,5 · 0,05 = 0,025 моль
Рассчитываем массу аргентита:
Теперь определяем массовую долю аргентита в образце горной породы, массой 25 г.
Как найти массовое отношение химических элементов
В химии массовое отношение, часто называемое «процентным составом по массе», представляет собой долю конкретной молекулы, которая состоит из составляющих ее элементов. Например, вода состоит из 11,1 процента водорода (Н) и 88,9 процента кислорода (О), что означает, что 1000-граммовый образец воды (равный 1 литру по объему) состоит из 111 г Н (0,111 × 1000 = 111) и 889 г О (0,889 × 1000).
Этот принцип порождает закон постоянного состава, выдвинутый Джозефом Прустом в 1800 году: данное соединение всегда имеет одинаковую пропорцию по массе составляющих его элементов. Например, вода всегда имеет ровно 8 грамм кислорода на каждый грамм водорода. Углекислый газ всегда содержит 2,67 г кислорода на каждый грамм углерода.
Рассчитать массовые отношения достаточно просто, если у вас есть доступ к периодической таблице (см. Ресурсы) и средства для выполнения базовой алгебры.
Допустим, вы хотите рассчитать массовое соотношение серной кислоты H2SO4.
Определить молярную массу каждого присутствующего элемента
H2SO4 содержит водород (H), серу (S) и кислород (S). Из таблицы Менделеева вы можете видеть, что молярные массы этих элементов:
O = 16,00
Шаг 2: Определите массу каждого отдельного присутствующего элемента
Есть два атома Н, один атом S и четыре атома О, поэтому у вас есть:
S = (1) (32,06 г) = 32,06 г
O = (4) (16,00 г) = 64 г
Шаг 3: Определить молярную массу соединения.
Сложите цифры, которые вы рассчитали на шаге 2:
2 + 32,06 + 64 = 98,06 г
Шаг 4: разделить массу каждого присутствующего элемента на молярную массу
Это означает разделение отдельных масс из шага 2 по результату шага 3.
Для Н, у вас есть 2 ÷ 98,06 = 0,0204 = 2,04 процента водорода
Для S у вас есть 32,06 ÷ 98,06 = 0,3269 = 32,69% серы
Для O, у вас есть 64 ÷ 98,06 = 0,6527 = 65,27 процента кислорода
Совет
Чтобы проверить свою работу, убедитесь, что ваши проценты в сумме равны 100, учитывая незначительные различия в результате округления: