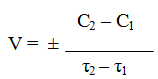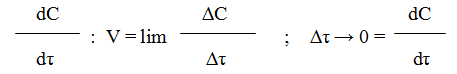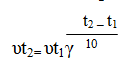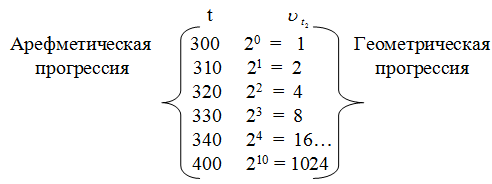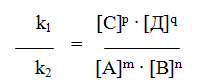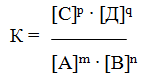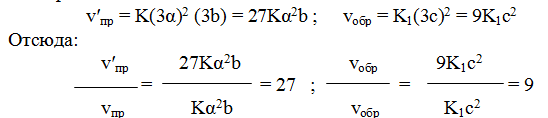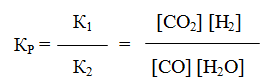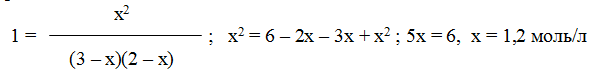как называется отношение концентраций фаз при равновесии
Условия фазового равновесия.



Фазовые равновесия: основные понятия.
I. Фаза – это совокупность гомогенных частей системы имеющих одинаковые химические, физические и термодинамические характеристики во всех своих точках. Фазы отделены друг от друга поверхностями раздела.
Системы, у которых отдельные компоненты находятся в одной
фазе и отсутствуют поверхности раздела, называются гомогенными. Например, хорошо смешивающиеся жидкости (этиловый спирт + вода), образующие истинный раствор.
Системы, состоящие из нескольких фаз, имеют поверхность
раздела и называются гетерогенными. Фазы могут отличаться как по химическому составу (например, вода + нерастворимое в воде вещество), так и по агрегатному состоянию (например: вода и лед).
Можно выделить 3 возможных случая:
1. Одно и тоже вещество образует несколько фаз в системе;
2. Одну и ту же фазу могут образовывать несколько разных веществ;
3. Разные вещества образуют в системе разные фазы.
Таким образом, число фаз в системе может, как совпадать, так и не совпадать с количеством компонентов. Число фаз обозначается буквой Ф
Ели Ф = 1, система гомогенная.
Если Ф≥ 2, система гетерогенная.
Фазовым переходом (или фазовым превращением) называется переход вещества из одного агрегатного состояния в другое, а также изменение полиморфной или аллотропной модификации.
В твердом состоянии одному и тому же веществу могут соответствовать две, три и больше форм (модификации), различающихся по внутреннему строению и свойствам. Это явление называется полиморфизмом. От полиморфизма следует отличать аллотропию – явление, когда данный элемент способен существовать в виде простых различных веществ (например: озон – аллотропное соединение кислорода).
(К = К0-Х = 3-1 = 2)
IV. Число степеней свободы (С) или вариантность – показывает сколько параметров (давление, температуру, концентрации) можно одновременно и произвольно менять (т. е. независимо друг от друга), не изменяя числа или вида фаз равновесной системы.
Между числом степеней свободы (С), числом компонентов (К) и числом фаз (Ф) существует следующая зависимость:
С = К – Ф + n
Это выражение и есть правило фаз Гиббса, которое может быть сформулировано так: число степеней свободы (С) равновесной термодинамической системы, на которую влияет некоторое число внешних факторов (n), равно количеству компонентов системы (К) минус число фаз (Ф) плюс (n).
Согласно данному правилу величина Стем больше, чем больше внешних параметров, влияющих на систему и чем больше компонентов; С увеличением числа фаз степень ее свободы уменьшается.
Условия фазового равновесия.
Если имеется двухфазная система, включающая К компонентов. Считается, что система находится в состоянии фазового равновесия относительно i – компонента, если не происходит результирующего перемещения данного компонента из одной фазы в другую. Равновесие может быть динамическим, т. е. отдельные молекулы вещества могут переходить из одной фазы в другую, но количество таких переходов в единицу времени строго одинаково.
В гетерогенной системе имеется фазовое равновесие, если между фазами существуют следующие виды равновесий:
1. термическое (равенство температур)
2. механическое (равенство давлений)
3. химическое (равенство химических потенциалов)
Однокомпонентные системы
Система содержит одно вещество, которое может находиться в разных агрегатных состояниях. Значит, К = 1, если n = 2, т. е. из двух внешних параметров на систему влияют температура и давление, тогда правило фаз имеет вид: С = 3 – Ф. Отсюда следует: если в системе одна фаза, то С = 2 (система бивариантна). Это означает, что в определенных пределах можно произвольно менять 2 параметра – и давление, и температуру – сохраняя то же фазовое состояние. Но при некоторых значениях Ри Т в системе могут образоваться 2 фазы, тогда С = 1 и система станет моновариантной, чтобы сохранить данное фазовое состояние можно изменять или Р, или Т. Если при некоторых значениях давления и температуры одновременно сосуществуют три фазы, то С = 0. система становится безвариантной. Изменение любого параметра выводит систему из данного состояния.
Так как число степеней свободы не может быть отрицательным, то в однокомпонентной системе не может одновременно присутствовать больше трех фаз.
Графическая зависимость состояния системы (и фазовых равновесий в ней) от внешних условий или от состава системы называется диаграммой состояния или фазовой диаграммой. Обычно построение производят в координатах давление – температура.
Химическое равновесие
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.
Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое» место, которые мы создали. Наглядно демонстрирую на примере:
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:
Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химическая кинетика и равновесие. Принцип Ле Шателье
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Химическая кинетика и равновесие
Однако эти реакции при стандартных условиях идут только в присутствии катализатора (платина для первой и вода для второй). Катализатор как бы снимает кинетический «тормоз» и проявляется термодинамическая природа вещества.
6.1. Понятие о скорости химических реакций. Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (в случае гомогенных реакций) или на единице поверхности раздела фаз (в случае гетерогенной реакции). Скорость реакции обычно характеризуются изменением концентрации какого-либо из исходных или конечных продуктов реакции в единицу времени и чаще всего выражают в моль/л · с.
Различают среднюю скорость химической реакции за данный промежуток времени и истинную скорость реакции в данный момент времени. Если в момент времени концентрация вещества была C1, а для момента она стала C2, то средняя скорость реакции для интервала времени τ2 – τ1 будет равна
Знак минус пишут в том случае, если концентрация вещества во времени уменьшается (исходное вещество), а знак плюс – если концентрация увеличивается (продукт реакции). Скорость реакции всегда положительна. Истинная скорость в данный момент определяется пределом, к которому стремится выражение при ∆τ → 0, т.е. первой производной от концентрации по времени:
Измерить среднюю и истинную скорость химической реакции можно, найдя зависимость изменения концентрации реагирующих веществ в системе от времени.
Об изменении концентрации веществ в системе можно судить или непосредственно, или определяя какое-либо свойство реакционной системы. Это может быть вес осадка, образующегося в ходе реакции, объем реакционной системы, давление, цвет, электропроводность и т.п.
Скорость химических реакций зависит от многих факторов, основные из которых — концентрация (давление) реагентов, температура и действие катализатора. Эти же факторы определяют и достижение равновесия в реагирующей системе.
6.2. Зависимость скорости реакции от концентрации реагентов. Чтобы атом и молекулы смогли вступить в реакцию, необходимо их столкновение друг с другом, так как силы химического взаимодействия действуют только на очень малом расстоянии. Чем больше молекул реагирующих веществ в единице объема, т.е. чем больше их концентрация, тем чаще будут происходить столкновения и тем быстрее будут идти химические реакции. Поэтому увеличение концентрации реагирующих веществ ускоряет ход химической реакции. На основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакций от концентрации реагирующих веществ: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Для реакции, протекающей по уравнению А + В = С + Д, этот закон выразится уравнением:
где: СА и СВ – молярные концентрации вещества А и В;
k – коэффициент пропорциональности, называемой константой скорости реакции.
Основной закон химической кинетики часто называют законом действующих масс. Из уравнения (1) нетрудно установить физический смысл константы скорости k; она численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1моль/л или когда их произведение равно единице.
где: m и n – коэффициенты в уравнении реакции.
Уравнение (2) является общим алгебраическим выражением закона действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам соответствующих веществ в уравнении реакции.
Основной закон химической кинетики не учитывает концентрации реагирующих веществ в твердом состоянии, ибо их концентрации постоянны и они реагируют лишь на поверхности, которая остается неизменной. Так, например, для реакции горения угля кинетическое уравнение реакции имеет вид:
где: k – константа скорости;
СС – концентрация твердого вещества;
S – площадь поверхности.
6.3.Влияние температуры на скорость реакции. Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа, согласно которому при повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2-4 раза.
Математически эта зависимость выражается соотношением
где: – скорости реакции соответственно при началом (t1) и конечной (t2) температурах;
γ – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличится скорость реакции с повышением температуры реагирующих веществ на 10 градусов.
Из этого легко вывести следующее правило: при повышении температуры в арифметической прогрессии скорость реакции возрастает в геометрической прогрессии.
Зависимость скорости реакции от температуры более точно выражается уравнением Аррениуса
6.4. Энергия активации. Быстрое изменение скорости реакции с изменением температуры объясняет теория активации. Почему нагревание вызывает столь значительное ускорение химических превращений? Для ответа на этот вопрос нужно вспомнить, в чем заключается сущность химической реакции.
Химическое превращение происходит тогда, когда возникают условия для перераспределения электронной плотности столкнувшихся частиц. Этот процесс требует затраты времени и энергии. Мгновенных процессов в природе вообще не существует.
Реакционно-способную систему можно охарактеризовать тремя последовательно совершающимися состояниями:
[начальное] → [переходное] → [конечное]
Для реакции взаимодействия газообразных веществ A2 и B2:
можно записать ее состояние
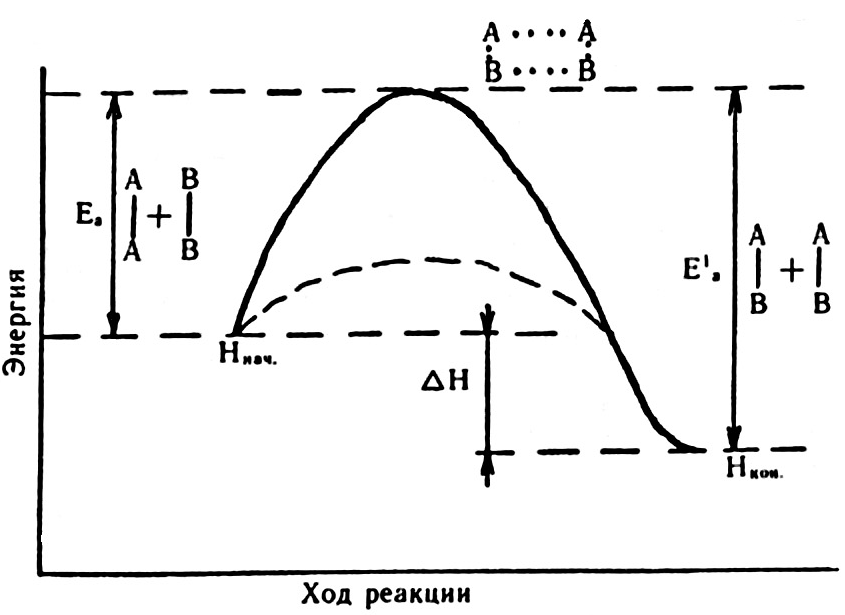
Рис. 22. Изменение энергии реагирующей системы
Энергия активации зависит от природы реагирующих веществ и служит характеристикой каждой реакции.
Энергетические изменения в реагирующей системе можно представить схемой, которая изображена на рис. 22.
Здесь ось абсцесс характеризует ход реакции: исходное состояние → переходное состояние → конечное состояние. По оси ординат отложена потенциальная энергия системы. Исходное состояние имеет энергию Hнач., конечное – Hкон. Разность энергий начального и конечного состояний системы равна тепловому эффекту реакции ∆H:
Энергия активированного комплекса выше энергии начального и конечного состояний системы. Таким образом, энергия активации – это своеобразный энергетический барьер, который отделяет исходные вещества от продуктов реакции.
Обратная реакция – превращение АВ в газообразные A2 и B2, естественно, также протекает через образование активированного комплекса A2B2. но величина энергии активации в этом случае иная, чем при синтезе АВ.
Как видно из рис. 22, затраченная на активацию молекул энергия затем, при образовании продуктов реакции, полностью или частично выделяется. Если при распаде активированного комплекса выделяется энергии больше, чем это необходимо для активирования молекул, то реакция экзотермическая, а в противном случае – эндотермическая.
Итак, скорость реакции непосредственно зависит от числа молекул, обладающих энергией, достаточной для образования активированного комплекса, а следовательно, способных к химическому превращению. Чем больше в системе активных молекул, тем скорость реакции больше. Один из путей увеличения числа активных молекул – нагревание.
6.5. Понятие о катализе и катализаторах. Катализом называется изменение скорости химических реакций в присутствии веществ – катализаторов. Катализаторы – это вещества, изменяющие скорость реакции за счет участия в промежуточном химическом взаимодействии с компонентами реакции, но восстанавливающие после каждого цикла промежуточного взаимодействия свой химический состав.
Различают положительный и отрицательный катализ. В случае положительного катализа скорость химической реакции при введении катализатора возрастает, например, получение серной кислоты или окисление аммиака в азотную кислоту с помощью платины. При отрицательном катализе, – наоборот, уменьшается, например, замедление взаимодействия раствора сульфита натрия с кислородом воздуха в присутствии этилового спирта. Отрицательный катализ часто называют ингибированием, а отрицательные катализаторы, снижающие скорость реакции, ингибиторами (механизм действия последних отличен от катализаторов).
Химические реакции, протекающие в присутствии катализаторов, называются каталитическими. На большинство химических реакций может быть оказано каталитическое воздействие. Число катализаторов велико. Их каталитическая активность весьма различна. Она определяется изменением скорости реакции, вызываемым катализатором.
Различают два вида катализа – гомогенный (однородный) и гетерогенный (неоднородный) катализ.
При гомогенном катализе реагирующие вещества и катализатор образуют однородную систему – газовую или жидкую. В этом случае между катализатором и реагирующими веществами отсутствует поверхность раздела. Примером может служить каталитическое окисление оксида серы (IV) оксидами азота в камерном способе получения серной кислоты (газовая фаза), а также действие разнообразных ферментов в биологических процессах. Для гомогенного катализа установлено, что скорость химической реакции пропорциональна концентрации катализатора.
При гетерогенном катализе реагирующие вещества и катализаторы образуют систему из разных фаз. В этом случае между катализатором и реагирующими веществами существует поверхность раздела. Обычно катализатор является твердым веществом, а реагирующие вещества – газами или жидкостями. Например, окисление аммиака (газообразная фаза) в присутствии платины (твердая фаза). Все реакции при гетерогенном катализе протекают на поверхности катализатора. Поэтому активность твердого катализатора будет зависеть и от свойств его поверхности (размера, химического состава, строения и состояния).
Действие положительных катализаторов сводится к уменьшению энергии активации реакции, другими словами, к снижению высоты энергетического барьера (см. рис. 22, пунктирная кривая).
В присутствии катализатора образуется активированный комплекс с более низким уровнем энергии, чем без него, а потому скорость реакции резко возрастает.
Механизм действия катализаторов обычно объясняют образованием промежуточных соединений с одним из реагирующих веществ. Так, если медленно протекающую реакцию A + B = AB вести в присутствии катализатора K, то катализатор вступает в химическое взаимодействие с одним из исходных веществ, образуя непрочное промежуточное соединение:
Реакция протекает быстро, так как энергия активации этого процесса мала. Затем промежуточное соединение АК взаимодействует с другим исходным веществом, выделяя катализатор К в свободном состоянии:
Энергия активации этого процесса также мала, а потому реакция протекает с достаточной скоростью. Если теперь оба процесса, протекающие одновременно, суммировать, то получим окончательное уравнение уже быстро протекающей реакции:
Поверхность катализатора неоднородна. На ней имеются так называемые активные центры, на которых, главным образом, и протекают каталитические реакции. Реагирующие вещества адсорбируются на этих центрах, в результате чего увеличивается концентрация их на поверхности катализатора. Это отчасти приводит к ускорению реакции. Но главной причиной возрастания скорости реакции является сильное повышение химической активности адсорбированных молекул. Под действием катализатора у адсорбированных молекул ослабляются связи между атомами и они делаются более реакционноспособными. В этом случае реакция ускоряется благодаря снижению энергии активации (в том числе за счет образования поверхностных промежуточных соединений).
Некоторые вещества снижают или полностью уничтожают активность твердого катализатора. Такие вещества называются каталитическими ядами.
В качестве примера можно привести соединения мышьяка, ртути, свинца, цианиды, к которым особенно чувствительны платиновые катализаторы.
Однако имеются и такие вещества, которые усиливают действие катализаторов данной реакции, хотя сами катализаторами не являются. Эти вещества называются промоторами (например, промотирование платиновых катализаторов добавками железами, алюминия и др.).
Следует особо отметить, что действие катализаторов избирательно, поэтому применяя разные катализаторы, можно получить из одного и того же вещества разные продукты. Для каждой реакции имеется свой наилучший катализатор.
Роль катализаторов в химическом производстве исключительно велика. (например, получение серной кислоты, синтез аммиака, получение из твердого угля жидкого топлива, переработка нефти и природного газа, получение искусственного каучука и т.д.). Большая роль принадлежит биологическим катализаторам – ферментам– особым веществам животного или растительного происхождения, являющихся белками. Они обладают каталитическим действием по отношению к некоторым биохимическим реакциям за счет понижения их очередной инактивации.
6.6. Химическое равновесие. Принцип Ле Шателье. Реакции, которые протекают в одном направлении и идут до конца, называются необратимыми. Их не так много. Большинство реакций являются обратимыми, т.е. они протекают в противоположных направлениях и не идут до конца. Например, реакция J2 + H2 2HJ при 350°С является типичной обратимой реакцией. В этом случае устанавливается подвижное химическое равновесие и скорости прямого процесса и обратного делаются равными.
Химическое равновесие – такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
Химическое равновесие называют динамическим равновесием. Этим подчеркивается, что при равновесии протекают и прямая, и обратная реакции, но их скорости одинаковы, вследствие чего изменений в системе не заметно.
Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными концентрациями. Обычно их обозначают при помощи квадратных скобок, например, [J2], [H2], [HJ] в отличие от неравновесных, обозначаемых СJ2, Cн2, СнJ
Количественной характеристикой химического равновесия служит величина, называемая константной химического равновесия. Изобразим обратимую реакцию в общем виде:
Согласно закону действующих масс, скорости прямой (V1) и обратной (V2) реакций выражаются уравнениями:
При равновесии скорости прямой и обратной реакций равны друг другу, откуда
Но k1 и k2 для данной реакции при одной и той же температуре являются величинами постоянными, а значит, и их отношение будет величиной постоянной. Обозначим его через К, получим
где: К – константа химического равновесия.
Она зависит от температуры и природы реагирующих веществ, но не зависит от их концентрации. Константа равновесия показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции, если концентрации каждого из реагирующих веществ равна 1 моль/л. В этом физический смысл К. Значения К находят путем расчета или на основании экспериментальных данных. Константа равновесия – важная характеристика реакции. По ее значению можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях.
На состояние химического равновесия оказывает влияние концентрация реагирующих веществ, температура, а для газообразных веществ – и давление.
При изменении одного из этих параметров равновесие нарушается, и концентрация всех реагирующих веществ будет изменяться до тех пор, пока не установится новое равновесие, но уже при иных значениях равновесных концентраций.
Подобный переход реакционной системы из одного состояния равновесия к другому называется смещением (или сдвигом) химического равновесия. Если при изменении условий увеличивается концентрация конечных веществ, то говорят о смещении равновесия вправо. Если же увеличивается концентрация исходных веществ, то равновесие смещается влево.
Направление смещения химического равновесия при изменениях концентрации реагирующих веществ, температуры и давления (в случае газовых реакций) определяется общим положением, известным под названием принципа подвижного равновесия или принципа Ле Шателье: если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие (изменяется концентрация, температура, давление), то оно благоприятствует протеканию одной из двух противоположных реакций, которая ослабляет воздействие. Поясним это правило на примере синтеза аммиака:
Если увеличить концентрации азота или водорода, то это будет благоприятствовать реакции, протекающей с уменьшением концентрации этих веществ, т.е. равновесие сместится вправо. Наоборот, при увеличении концентрации аммиака равновесие сместится влево.
Поскольку прямая реакция протекает с выделением тепла, то повышение температуры будет благоприятствовать реакции с поглощением тепла, т.е. равновесие будет смещаться влево. Наоборот, понижение температуры вызовет смещение равновесия вправо.
Чтобы решить вопрос, как влияет на смещение равновесия изменение давления, надо подсчитать число молей газообразных веществ в левой и правой частях уравнения. В приведенном примере в левой части уравнения содержится 4 моль (4 объема), а в правой – 2 моль (2 объема). Поскольку увеличение давления должно благоприятствовать процессу, ведущему к уменьшению объема, то в данном случае равновесие сместится вправо. Уменьшение давления сместит равновесие влево. Если же в уравнении обратимой реакции число молей в левой части равно числу молей в правой части, то изменение давления не вызывает смещения химического равновесия.
Следует отметить, что все катализаторы одинаково ускоряют как прямую, так и обратную реакции и поэтому на смещение равновесия влияние не оказывают, а только способствуют более быстрому его достижению.
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе
если объем газовой смеси уменьшится в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ: [SO2] = а,
[О2] =b, [SO3] == с. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объема равны
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3а, [О2] = Зb; [SO3] = Зс. При новых концентрациях скорости v’пр прямой и обратной реакций:
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной — только в девять раз. Равновесие системы сместилось в сторону образования SO3.
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70° С, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
Следовательно, скорость реакции vT2. при 70 0 С больше скорости реакции vT1 при 30° С в 16 раз.
Пример 3. Константа равновесия гомогенной системы
при 850 0 С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СO]исх = 3 моль/л, [H2O]иcx = 2 моль/л.
Решение. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
В условии задачи даны исходные концентрации, тогда как в выражение Кр входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [CO2]p = x моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и H2O расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ (моль/л):
Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ:
Таким образом, искомые равновесные концентрации: [СO2]р = 1,2 моль/л; [H2]p = 1,2 моль/л; [СO]р= 3-1,2 = 1,8 моль/л; [Н2O]р =2-1,2 =0,8 моль/л.
Пример 4. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — разложения РС15?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения РС15 эндотермическая (H > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру: б) так как в данной системе разложение РС15 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РС15, так и уменьшением концентрации РС13 или Сl2.