Угрожаемый по гиэ что значит
Угрожаемый по гиэ что значит
Асфиксия при родах характеризуется критическим снижением оксигенации плода в матке в процессе родов, что приводит к лактоацидозу и способствует развитию тяжёлого состояния новорождённого ребёнка, вызванного задержкой инициации дыхания. Она остаётся важной причиной повреждения головного мозга, приводящего к инвалидности или смерти, поэтому предотвращение асфиксии считают одной из ключевых целей современной акушерской помощи.
При фетальной КТГ могут выявляться изменения, однако этот метод исследования не подходит для определения тяжести асфиксии, если только она не глубокая. Нормальная КТГ даёт достоверный прогноз отсутствия асфиксических проблем у новорождённого. Анализ фетальной или пуповинной крови позволяет выявить метаболический ацидоз, однако с их помощью также не удаётся достоверно спрогнозировать исход для новорождённого, если у него нет тяжёлого ацидоза.
Низкие показатели по шкале Апгар на 1-й и 5-й минутах, отражающие задержку инициации дыхания и нарушение кровообращения при рождении, также слабо прогнозируют исход, однако если сохраняется низкое значение этого показателя (5 или меньше) в первые 10 мин после рождения, риск длительной обездвиженности или смертности составляет приблизительно 50%.
Термином «гипоксическая ишемическая энцефалопатия» описывают клинические проявления поражения головного мозга у младенцев, рождённых в срок, возникающие немедленно или в течение 48 ч после асфиксии, как антенатальной, так и постнатальной. Её подразделяют по степени тяжести.
• Лёгкая — младенец раздражительный, избыточно реагирует на стимуляцию, глаза его широко раскрыты, могут быть гипервентиляция, нарушенное кормление.
• Умеренная — у младенца отмечают значительные нарушения мышечного тонуса и движений, он не может принимать пищу, иногда возникают судороги.
• Тяжёлая — отсутствуют нормальные спонтанные движения или реакция на боль, тонус мышц конечностей варьирует от гипотонии до гипертонии, наблюдают продолжительные судороги, рефрактерные к терапии, отмечают мультиорганные нарушения.
Лечение гипоксической ишемической энцефалопатии у новорожденных
Квалифицированная реанимация и стабилизация факторов риска способствуют уменьшению поражения вследствие асфиксии. Детям с гипоксической ишемической энцефалопатией иногда требуются дополнительные лечебные мероприятия.
• Респираторная поддержка.
• Лечение клинических проявлений эпилептического припадка антиконвульсантами, продолжительная, интегрированная по амплитуде ЭЭГ (мониторирование функций головного мозга) всё чаще используется для подтверждения ранней энцефалопатии и в прогнозировании и интерпретации патологических движений.
• Ограничение жидкости в связи с транзиторным нарушением функций почек.
• Лечение гипотензии путём восполнения объёма и инотропной поддержки.
• Мониторирование и лечение гипогликемии и электролитного дисбаланса.
Рандомизированные клинические исследования показали, что умеренная гипотермия (охлаждение на 3-4 °С) может снизить повреждение мозга, если начата в первые 6 ч после рождения.
Прогноз гипоксической ишемической энцефалопатии у новорожденных
При лёгкой степени гипоксической ишемической энцефалопатии можно ожидать полного восстановления. У младенцев, перенёсших умеренную гипоксическую ишемическую энцефалопатию, но полностью восстановившихся по данным клинического обследования, которые нормально питаются в первые 7 дней жизни, долгосрочный прогноз благоприятный, однако если клинические изменения сохраняются спустя 10 дней, полное восстановление маловероятно.
При тяжёлой гипоксической ишемической энцефалопатии уровень смертности составляет 30-40%, а более 80% выживших младенцев имеют неврологические нарушения и нарушения развития, особенно церебральный паралич. Если при МРТ на 4-14-й день у младенцев, рождённых в срок, отмечают двусторонние нарушения в базальных ганглиях и таламусе, а также демиелинизацию в задней ножке внутренней капсулы, существует высокий риск развития церебрального паралича.
В связи с потенциальными медико-юридическими вопросами в отношении термина «асфиксия при рождении» было предложено, что младенцам с отсутствием дыхания при рождении или развитием судорог или других патологических неврологических проявлений обязательно проводить обследование в целях выявления возможной неонатальной энцефалопатии. Диагноз гипоксической ишемической энцефалопатии (ГИЭ) можно поставить только в случаях, если:
• есть признаки антенатальной гипоксии (например, предродовое кровотечение), или гипоксии в процессе родов (например, выпадение пуповины или значительное нарушение контуров КТГ), или гипоксии при родоразрешении (например, дистоция плеча);
• после рождения необходима реанимация;
• есть явные признаки энцефалопатии;
• есть признаки гипоксического повреждения других органов, таких как печень, почки или сердце;
• не установлены другие пре- или постнатальные причины;
• выявлены характерные изменения при нейровизуализации.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гипоксически-ишемическая энцефалопатия, ГИЭ
Повреждение головного мозга – гипоксия или асфиксия
Нарушения могут включать в себя эпилепсию, задержку развития, двигательные нарушения, психомоторную задержку и когнитивные нарушения. Как правило, тяжесть нарушений не может быть определена, пока ребенок не достигнет возраста трех-четырех лет.
Длительное время считалось, что асфиксия является основной причиной ДЦП, но два исследования показали, что только 9% случаев являются прямым результатом асфиксии. В оставшихся 91% случаев такие факторы, как преждевременные роды, осложнения во время родов или проблемы сразу же после рождения вызывают ДЦП. В некоторых случаях причина может не быть окончательно определена.
Когда возникает гипоксически-ишемическая энцефалопатия?
В 40 недель степень гипоксии повлияет на область поражения головного мозга; легкая гипоксия повлияет на парасагиттальной белое вещество, а тяжелая гипоксия влияет на скорлуу, таламус и парацентральное белое вещество. Область пораженного мозга будет иметь значительное влияние на симптомы, которые ребенок испытывает.
Каковы факторы риска и причины гипоксически-ишемической энцефалопатии?
Асфиксия является наиболее значимым фактором риска для ГИЭ. От степени и продолжительности кислородного голодания зависит, разовьется гипоксически-ишемическая энцефалопатия или нет, и насколько серьезными будут последствия. Факторы, могут привести к асфиксии:
Инсульт плода также увеличивает вероятность развития гипоксии-ишемической энцефалопатии. Факторы, которые могут привести к инсульта плода включают в себя:
Как поставить диагноз гипоксически-ишемической энцефалопатии?
При подозрении на гипоксически-ишемическую энцефалопатию проводятся методы нейровизуализации, чаще всего магнитно-резонансная томография.
Для того, чтобы выполнить эти исследования, врачи должны сначала заподозрить гипоксически-ишемическую энцефалопатию. Если роды были травматические, или если значительные факторы риска, такие как инсульт плода были известны во время беременности, гипоксически-ишемическая энцефалопатия может быть заподозрена при рождении. В противном случае, родители, врачи, воспитатели должны обратить внимание на видимые признаки, которые могут развиваться в течение длительного времени – задержку психо-моторного развития и задержку роста.
Некоторые признаки могут появиться вскоре после рождения. Дисфункция органов, особенно сердца, легких, почек, печени и крови будут указать возможность развития ГИЭ. Судороги в первые 24 часов жизни также может указывать на вероятность гипоксически-ишемической энцефалопатии.
Как лечится гипоксически-ишемическая энцефалопатия?
Лечение гипоксически-ишемической энцефалопатии сосредоточено на оказании помощи ребенку адаптироваться к нарушениям, которые возникают в результате травмы головного мозга. Методы реабилитации обычно используются для лечения церебрального паралича, вызванного гипоксической-ишемической энцефалопатией.
Асфиксия обычно вызывает стойкое повреждение, которое иногда продолжает прогрессировать даже после выхода из асфиксии. Чтобы предотвратить дальнейшее повреждение ребенка может быть медицинской контролировать, чтобы:
Как предотвратить гипоксически-ишемическую энцефалопатию?
Профилактические меры должны быть приняты во время беременности и во время родов включают в себя:
Четыре типа травмы или пороков развития головного мозга, которые вызывают ДЦП
Перивентрикулярная лейкомаляция
Повреждение белого вещества ткани мозга Перивентрикулярная лейкомаляция »
Гипоксически ишемическое поражение ЦНС
Лечение и уход
За пострадавшими должен быть особый уход, а за детьми, перенёсшими ГИЭ, он строится на контроле за:
РЕКОМЕНДУЕМ ПОСМОТРЕТЬ: Кислородное голодание мозга
Степени тяжести и характерные симптомы
Гипоксически-ишемическая энцефалопатия имеет 3 степени тяжести, для которых характерны свои проявления. По ним врачи часто дают предварительную характеристику повреждений мозговой деятельности и приблизительный прогноз.
Легкая степень
При такой степени у больного будет:
Средняя степень
Неврология при ней будет более выражена, т. к. нарушение насыщения мозга кислородом более длительное:
Тяжелая степень
Поражение в таких случаях более тяжелое, что проявляется в:
ПЭП — это разновидность гипоксически-ишемической энцефалопатии у детей раннего возраста. Ее диагностируют как сразу после рождения, так и на первом году жизни. Развивается ПЭП как внутриутробно, в процессе родовой деятельности, так и в первые 10 дней с момента рождения.
Она может быть трех степеней тяжести с характерной симптоматикой и протекать в острой форме — до месяца, в раннем восстановлении функций — до 4 месяцев, при позднем восстановлении — до 2 лет.
Диагностика
Перинатальный синдром ишемии на фоне гипоксии мозга начинают диагностировать, делая визуальный осмотр ребенка. Так же и со взрослыми. Несмотря на все достижения медицины, уникальный тест, позволяющий точно выявить ГИЭ, до сих пор не придуман. Все лабораторные методики направлены на выявление того, насколько сильно поврежден мозг и текущее состояние всего организма.
Какими будут исследования, зависит от симптомов, и как они развивались. Для расшифровки анализов есть специальные биомаркеры, которые дают полную картину о степени ГИЭ. Для исследования нужна кровь больного.
Нейровизуализацию проводят с помощью:
Дополнительного могут использовать:
При необходимости пострадавшего осматривает окулист, чтобы определить состояние зрительных нервов и глазного дна, а также на наличие болезней генетического типа в этой области.
Дальнейшее наблюдение
Из стационара выписывают только после прохождения полного курса физической терапии и комплексной оценки нервно-психического развития. Чаще всего после выписки пациенты не требуют специфического ухода, но регулярные осмотры в клинике обязательны, особенно для детей.
Если болезнь была тяжелой, то ребенок будет наблюдаться в специальном центре, где ему будет помогать врач по нервно-психическому развитию.
Лечение судорожности зависит от симптоматики центральной нервной системы и результатов исследований. Выписывают только с легким отклонением от нормы или вовсе в ее пределах. Фенобарбитал убирают постепенно, но обычно его пьют после выписки не менее 3 месяцев.
Происхождение ГИЭ
Находясь в утробе, плод «питается» тем, что ему поступает с материнской кровью. Одним из главных компонентов питания является кислород. Его недостаток отрицательно влияет на развитие центральной нервной системы будущего ребенка. А потребности в кислороде его формирующегося мозга даже выше, чем у взрослого человека. Если женщина во время беременности испытывает вредные влияния, плохо питается, болеет или ведет нездоровый образ жизни, это неминуемо отражается на ребенке. Он получает меньше кислорода.
Артериальная кровь с низким содержанием кислорода вызывает нарушения обмена в клетках мозга и гибель некоторых или целых групп нейронов. Головной мозг имеет повышенную чувствительность к колебаниям кровяного давления, особенно к его снижению. Обменные нарушения вызывают образование молочной кислоты и ацидоз. Далее процесс нарастает – формируется отек мозга с повышением внутричерепного давления и некрозом нейронов.
Перинатальное поражение центральной нервной системы может развиваться внутриутробно, во время родов и первые дни после рождения. Врачи считают временной диапазон от полных 22 недель беременности до 7 суток от рождения. Внутриутробные риски:
В родах факторами риска являются:
Сразу после рождения развитие гипоксически-ишемического поражения ЦНС у новорожденных возможно по причине низкого артериального давления, наличия ДВС синдрома (патология гемостаза, сопровождающаяся повышенным тромбообразованием в микроциркуляторных сосудах). Кроме того, ГИЭ может провоцироваться пороками сердца, проблемами с дыханием у новорожденного.
Угрожаемый по гиэ что значит
Гипоксически-ишемическая энцефалопатия (ГИЭ) встречается примерно у 1-6 из 1000 живорожденных и является самой важной проблемой неонатальной неврологии (Levene et al., 1985, Volpe, 2001, Ferriero, 2004). Гипоксически-ишемическая энцефалопатия (ГИЭ) относится к серьезным состояниям, при котором 15-20% пострадавших детей умирает в течение неонатального периода, а у 25% развиваются стойкие неврологические последствия (Volpe, 2008). Более двадцати лет назад было отмечено завышенное значение перинатальной гипоксии в этиологии задержки умственного развития и церебрального паралича (Freeman и Nelson, 1988, Вах и Nelson, 1993).
Badawi et al. (1998) обнаружили, что многие новорожденные подвергались антенатальным факторам риска, таким как лечение материнского бесплодия или заболеваний щитовидной железы, тогда как другие имели и анте-, и интранатальные факторы риска. Хотя не исключается возможность наличия пренатальных факторов риска, вероятно повышающих чувствительность ребенка к проблемам родового периода, в проспективном исследовании результатов MPT Cowan et al. (2003) было отмечено, что у большинства новорожденных (n=351) с неонатальной энцефалопатией повреждение мозга возникало в момент рождения или незадолго до этого.
Определение гипоксически-ишемической энцефалопатии (ГИЭ) сложное и роль асфиксии в родах трудно точно установить, так что и сам термин ставится под сомнение; вместо него предлагается неопределенное понятие «неонатальная энцефалопатия» (Nelson и Leviton, 1991, Leviton и Nelson, 1992, Badawi et al, 1998). Диагноз ГИЭ не должен устанавливаться без серьезной клинической основы и тщательного анализа альтернативных вариантов, потому что они могут играть роль в терапии и этиологии.
Патофизиология. Недостаточное поступление кислорода, вызывающее развитие гипоксической-ишемической энцефалопатии (ГИЭ), может возникнуть по двум механизмам: гипоксемия, т.е. ограниченный доступ кислорода в кровь; и ишемия, т.е. сниженная перфузия головного мозга. В большинстве случаев оба механизма связаны с асфиксией в виде гипоксии, сопровождающейся гиперкарбией (Altman et al., 1993). Обычно присутствующий при гипоксии ацидоз в значительной степени связан с повышенным образованием лактата. Преобразование глюкозы в молочную кислоту менее эффективно, чем окисление в цикле Кребса и митохондриальной системе транспорта электронов.
В результате окисления каждой молекулы глюкозы, переработанной в анаэробных условиях, образуется только две молекулы аденозина дифосфата (АДФ) по сравнению с 38 молекулами при аэробных условиях. Несмотря на значительное повышение скорости гликолиза и усиление мозгового кровотока из-за ацидоза и гиперкапнии (Laptook et al., 1988), потребности ткани мозга в кислороде не могут быть удовлетворены. Повышенная скорость гликолиза приводит к падению уровня глюкозы в мозге. Предупреждение этого состояния предварительным введением глюкозы повышает выработку АТФ и улучшает выживаемость (Vannucci и Yager, 1992). Однако избыточный уровень глюкозы в то же время приводит к повышенному образованию лактата, вредного для мозговой ткани взрослого, но, по-видимому, полезного для ЦНС новорожденного (Hattori и Wasterlain, 1990).
В итоге, в результате нехватки кислорода в клетках мозга снижается количество фосфокреатина и АТФ, конечных акцепторов электронов. Эти изменения были продемонстрированы у новорожденных с использованием фосфорной МРС (магнитно-резонансная спектроскопия) (Younkin et al., 1988, Laptook et al., 1989). Падение уровня высокоэнергетических соединений фосфата наблюдалось даже при стабилизации кардиопульмональной функции (Hope et al., 1984). В экспериментах на животных снижение уровня АТФ более чем на 30% происходило за 6 минут (Raichle, 1983). Также было отмечено накопление лактата, сохранявшееся в течение длительного периода времени (Groenendaal et al, 1994, Robertson et al., 1999).
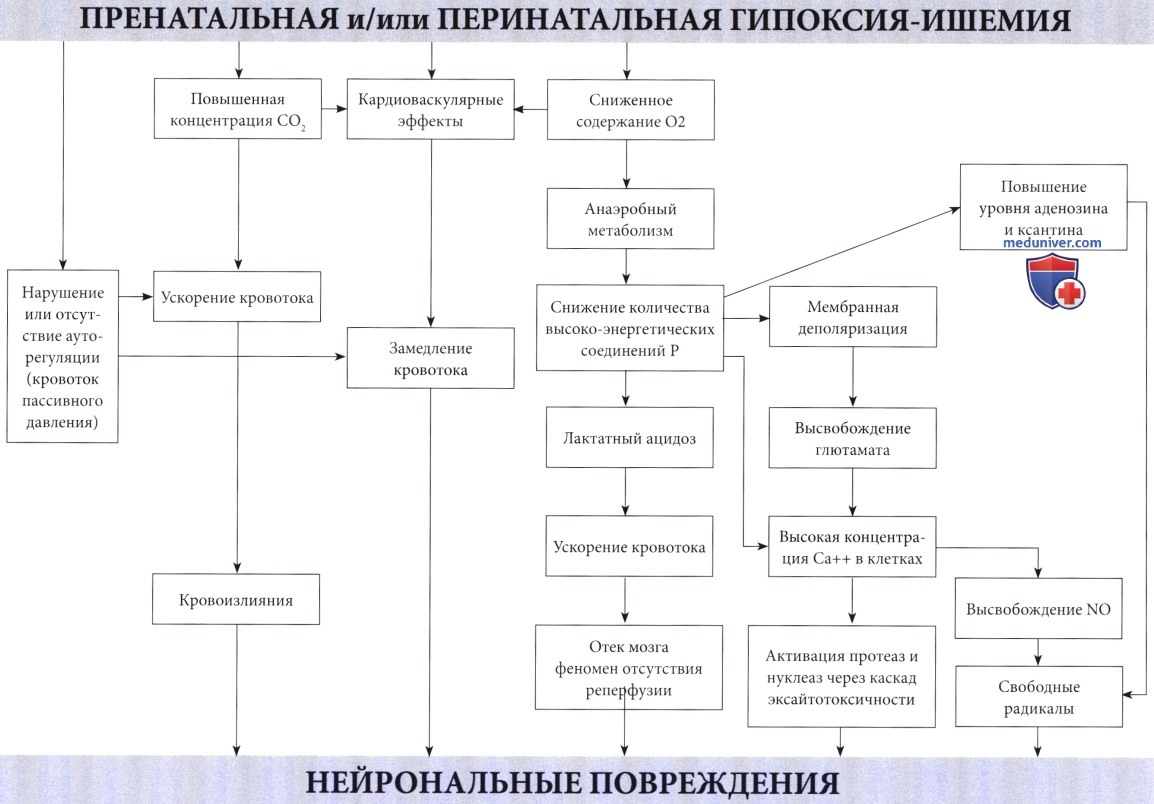
Нейрональные повреждения являются следствием различных комбинаций кровоизлияний и некрозов.
Последние связаны с каскадом событий, инициированных высвобождением глютамата, приводящим к массивному входу кальция в клетки.
Образование оксида азота (NO), вероятно, также является важным фактором.
В действительности, нарушению мозговой функции предшествует сбой в энергетическом метаболизме (см. Volpe, 2001). При угрозе перебоев организм отвечает угнетением нейрональной активности по неопределенному механизму, но при длительной гипоксии этого недостаточно.
Однако мозг новорожденного чрезвычайно устойчив к гипоксии. При экспериментах на плодах обезьян потребовалось снижение сатурации кислорода на 90% в течение не менее 25 минут, чтобы вызвать повреждение ткани мозга. В результате, любой, достаточно тяжелый для повреждения мозга эпизод асфиксии вызывает нарушения и других органов, особенно сердца, и при таких условиях ишемия постоянна.
Ишемия оказывает влияние, подобное асфиксии (Painter, 1989). Процесс гликолиза ускоряется, но поглощению глюкозы препятствует нарушение кровотока, соответственно запасы высокоэнергетических фосфатов истощаются, и накапливается лактат.
Влияние гиперлактатемии многопланово. Первоначально оно благотворно, поскольку повышает приток крови к мозгу, но затем становится вредным, так как хотя бы отчасти влияет на отек мозга, который в свою очередь может сдавить капиллярное русло и вызвать ишемию (Myers, 1972). В то же время он нарушает ауторегуляцию церебрального кровообращения, приводя к мозговому кровотоку пассивного давления (Lou, 1988), что делает мозг более чувствительным к изменениям системного давления крови. Сочетание отека мозга и системной недостаточности кровообращения, вероятно, играет существенную роль в происхождении гипоксического повреждения ЦНС. Гипоксия обычно повышает долю сердечного выброса, предназначенную для головного мозга.
По мере усиления степени гипоксии наблюдается уменьшение сердечного выброса с последующей неспособностью поддерживать артериальное давление на необходимом уровне. Но показатели частоты сердечных сокращений и артериального давления остаются неизменными до тех пор, пока артериальная сатурация не снизится более, чем на 65%, а затем также линейно снижаются. Это снижение может поддерживаться на протяжении часов без развития энцефалопатии, если содержание кислорода в артериальной крови не упадет более, чем на 85% (Fenichel, 1997).
Механизм отека мозга и гипоксического повреждения у плодов до конца неясен. Levene et al. (1989) выявили хорошую корреляцию между высокой скоростью мозгового кровотока—предположительно отражающей церебральную гиперемию, которая, в свою очередь, может отвечать за повышение внутричерепного давления — и неблагоприятным течением. Lupton et al. (1988) показали, что отек в большей степени является следствием, чем причиной, нейрональных некрозов, объясняя, таким образом, ограниченную эффективность противоотечного лечения новорожденных с ГИЭ (Levene et al., 1987). Не было замечено различий в степени внутричерепной гипертензии у детей с ГИЭ в группе выживших и умерших (Goitein et al, 1983).
Последние данные подтверждают основную роль апоптоза в развитии гипоксически-ишемического повреждения мозга новорожденных, возможно, даже большую, чем некроз после повреждения. Во время неонатального поражения мозга токсичность возбуждающих медиаторов, оксидативный стресс и воспаление способствуют ускоренной гибели клеток, главным образом, посредством апоптоза или некроза, что зависит от области поражения и тяжести повреждения. В настоящее время известно, что ГИЭ состоит из двух последовательных стадий, с окончательным повреждением с отсрочкой на несколько часов во время второй из них, определяемой как вторичная недостаточность энергии. Тем не менее, профилактика возможна, как только появляется терапевтическое окно.
Механизмы повреждения и некроза клеток при гипоксии и ишемии не просто итог энергетической недостаточности. Это вторичные пусковые факторы каскада разрушительных событий при достижении критического уровня дефицита энергии. Такие события происходят в течение нескольких часов. Избыточная мембранная деполяризация и высвобождение возбуждающих аминокислотных нейротрансмиттеров, в первую очередь глютамата (Lipton и Rosenberg, 1994), приводит к массивному входу кальция через NMDA и АМРА мембранные рецепторы (Morley et al., 1994) и к накоплению кальция в цитозоле. Кальций, в свою очередь, активирует различные липазы, протеазы и нуклеазы с последующим разрушением основных клеточных белков. Свободные радикалы прямо или косвенно вызваны повышенным уровнем кальция в цитозоле (McCord, 1985) и оксида азота (Dawson et al., 1992), играющего главную роль в их образовании.
Этот каскад возбуждающих медиаторов в конечном счете приводит к повреждению мембраны, разрушению цитоскелета и, наконец, к дезинтеграции клетки.
Теоретически существует возможность предотвращения многих процессов, поэтому проводились исследования с различными средствами, в том числе блокаторами кальциевых каналов (Miller, 1993, Palmer и Vanucci, 1993); антагонистами возбуждающих аминокислот (Hattori et al., 1989), особенно магнезией (Marret et al., 1995, Nelson и Grether, 1995); ингибиторами синтеза оксида азота (Dawson et al., 1992); акцепторами свободных радикалов (Palmer и Vannucci, 1993) и веществами, подавляющими образование свободных радикалов типа аллопуринола (Palmer et al., 1990, van Bel et al., 1998, Benders et al., 2006).
Редактор: Искандер Милевски. Дата публикации: 25.11.2018
Гипоксически-ишемическая энцефалопатия
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «03» октября 2019 года
Протокол №74
Гипоксически-ишемическая энцефалопатия – это острое повреждение головного мозга плода и новорожденного после перенесенной перинатальной асфиксии, вызванное дефицитом кислорода в крови (гипоксемия) и слабой перфузией (ишемия) достаточной силы и продолжительности, чтобы привести к функциональным и биохимическим изменениям (активация анаэробного гликолиза, развитие лактатацидоза) и тяжелым нарушениям энергетического обмена [1].
Перинатальная асфиксия – критическая кислородная недостаточность плода во время родов, приводящая к тяжелому метаболическому ацидозу, депрессии дыхания и нарушению адаптации кровообращения сразу после рождения [2].
Название протокола: Гипоксически-ишемическая энцефалопатия
Код(ы) МКБ-10:
| Код | Название |
| Р91.0 | Другие нарушения церебрального статуса у новорожденного |
| Р91.0 | Ишемия мозга |
Дата разработки/пересмотра протокола: 2014 год (пересмотр 2018 г.)
Сокращения, используемые в протоколе:
| аЭЭГ | – | Амплитудно-интегрированная электроэнцефалография |
| ГИЭ | – | гипоксически-ишемическая энцефалопатия |
| ИВЛ | – | искусственная вентиляция легких |
| УЗИ | – | ультразвуковое исследование |
| МРТ | – | магнитно-резонансная томография |
Пользователи протокола: врачи-неонатологи.
Категория пациентов: новорожденные дети.
Шкала уровня доказательности:
Соотношение между степенью убедительности доказательств и видом научных исследований
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследование случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное, или исследование случай-контроль, или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP | Наилучшая клиническая практика. |
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
| 1-ая степень (легкое поражение) | 2-ая степень умеренное поражение) | 3-я степень (тяжелое поражение) | |
| 1 | 2 | 3 | 4 |
| Уровень сознания | Повышенная раздражимость | Апатичность или заторможенность (снижена реакция на раздражитель) | Ступор, кома (отсутствует реакция на раздражитель) |
| Нейромышечный контроль | |||
| Мышечный тонус | Нормальный | Легкая гипотония | Вялый |
| Поза | Легкая дистальная флексия | Выраженная дистальная флексия в | Интермиттирующая децеребрация |
| Периостальные рефлексы | Повышены | Повышены | Снижены или отсутствуют |
| Сегментарный миоклонус | Присутствует | Присутствует | Отсутствует |
| Сложные рефлексы | Норма | Угнетение | Отсутствуют |
| Сосательный рефлекс | Слабый | Слабый или отсутствует | Отсутствует |
| Рефлекс Моро | Повышен с низким порогом | Ослаблен, неполный; высокий порог | Отсутствует |
| Окуловестибу-лярный рефлекс | Нормальный | Повышен | Ослаблен или отсутствует |
| Шейный тонический рефлекс | Легкий | Выраженный | Отсутствует |
| Вегетативные функции | Преобладает симпатическая | Преобладает парасимпатическая | Угнетение обеих систем |
| Зрачки | Мидриаз | Миоз | Непостоянный размер, часто асимметрия, недостаточная реакция на свет |
| Дыхание | Спонтанное | Спонтанное, иногда апноэ | Периодическое, апноэ |
| Частота сердечных сокращений | Тахикардия | Брадикардия | Варьирующая |
| Секреция бронхиальных желез | Скудная | Обильная | Варьирующая |
| Перистальтика кишечника | Нормальная или сниженная | Усилена, диарея | Варьирующая |
| Судороги | Нет | Частые, фокальные или мультифокальные | Редкие (за исключением децеребрации) |
| Результаты ЭЭГ | Норма (бодрствование) | Ранние: низкий вольтаж с непрерывными дельта- и тетра-волнами. Поздние: периодический | Ранние: периодический паттерн с изопотенциальными фазами. |
| ЭЭГ | паттерн (бодрствование); фокальные или многоочаговые судороги; «пик-волна» от 1,0 до 1,5 Гц | Поздние: тотальная изопотенциальность | |
| Продолжитель-ность | 2–14 дней | От нескольких часов до нескольких недель | |
| Исход | Около 100% ─ нормальный | В 80% случаев нормальный; патология, если симптомы персистируют более 5–7 дней | Около 50% умирают; у остальных – тяжелые последствия |
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии:
Для подтверждения тяжести перенесенной гипоксии в течение первых 30 минут после рождения у новорожденного проводится забор крови из пережатой артерии пуповины для определения ее газового состава (стабильность газового состава забранной крови сохраняется в пластиковом шприце в течение 30 минут!).
Критерии острой перинатальной асфиксии, которые могут быть причиной ГИЭ [4]:
Обязательные критерии (должны присутствовать все 4):
Помимо повреждения нервной системы, признаком тяжелой асфиксии является полиорганная недостаточность:
Тяжелое угнетение дыхательной и сердечной деятельности:
выражающаяся такими признаками, как олигурия и, в восстановительном периоде – полиурия, что приводит к значительному водно-электролитному дисбалансу.
Повреждения со стороны кишечника в первые несколько дней жизни могут не проявлять себя. Обычными являются вялая перистальтика кишечника и замедленное опорожнение желудка. В редких случаях развивается некротизирующий энтероколит.
Лабораторные исследования:
Цель всех лабораторных методов – оценить степень тяжести повреждения мозга и
контролировать функциональное состояние жизненно-важных систем.
Набор исследований зависит от развития симптомов. результаты дополнительных исследований должны интерпретироваться в комплексе с клиническим анамнезом и результатами объективного исследования (смотрите алгоритм дифференциальной диагностики).
Ранними изменениями являются общее снижение амплитуды фонового ритма с наличием различных степеней судорожной активности.
Особенно угрожающий признак – разрывное подавление паттерна (т.е изоэлектрическая ЭЭГ). Если этот образец ЭЭГ соответствует клинике – обычно он расценивается, как свидетельство необратимого повреждения, тождественного юридическому определению смерти мозга.
Дифференциальный диагноз
Дифференциальная диагностика неонатальных энцефалопатий:
Неонатальная энцефалопатия – это неспецифическая реакция ГМ на различные повреждения вследствие множества процессов. Диагноз ГИЭ выставляется только в тех случаях, когда точно установлено, что гипоксия и ишемия привели к клиническому состоянию новорожденного, что будет способствовать проведению специфических методов лечения и помощи в прогнозировании.
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза ГИЭ |
| 1 | 2 | 3 | 4 |
| Наследственные болезни обмена | Однотипная с ГИЭ симптоматика неврологических нарушений: •синдром угнетения, либо гипервозбуди-мости; •неонатальные судороги/кома | 1. Анализ семейного анамнеза: •близкородственный брак; •смерть предыдущих детей от: — сепсиса с неустановленным возбудите-лем; -синдром внезапной смерти; -неустановленная причина смерти. 2. Анализ особенностей внутриутробного развития плода: -ЗВУР; -наличие дисморфий; -гепатолиенальный синдром; -асцит плода; -неиммунная водянка плода. 3. Лабораторные исследования • в крови: аммиак, КОС, мочевина, триглицериды, спектр аминокислот и ацилкарнитинов; галактоза и активность фермента галактозо-1-фосфат-уридилтрансферазы. • в моче: кетоновые тела, рН, спектр органических кислот, сукцинил ацетон, запах и цвет. | Положительные специфические реакции на наследственные болезни обмена, специфический запах мочи и тела: • аммиак повышен, респираторный алкалоз, реакция на кетоновые тела отрицательная ‒ нарушение цикла мочевины, транзиторная гипераммо-ниемия; • аммиак повышен, рН в норме, кетоновые тела +, сладкий запах мочи (кленового сиропа, карамели) ― лейциноз; при запахе «вареной капусты» ‒ тирозинемия; • аммиак в норме или повышен, метаболический ацидоз, кетоновые тела +, запах «потных ног», «сыра» ‒ изовалериановая ацидемия; или запах • «кошачей мочи» ― 3-ОН- изовалериановая ацидурия; • высокий уровень фенилаланина, «мышиный» ― фенилкетонурия. Для уточнения диагноза НБО ‒ генетическое обследование. |
•С-реактивный белок;
•Бактериологическое исследование крови;
•Рентгенография органов грудной клетки;
Для ТБИ характерно появление через 8-12 и 24 часа после рождения лейкоцитоза/лейкопении, нейтрофилеза/нейтропении, повышение лейкоцитарного индекса ≥0,2, СОЭ ≥10 мм/час на 1- й неделе жизни и уровня С-реактивного белка ≥ 10 мг/л, положительный результат бактериологического исследования крови, на рентгенограмме при пневмонии характерны очаговые изменения
(БЭН)
Все перечисленные тесты не характерны для ГИЭ
Лечение (амбулатория)
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ
Карта наблюдения пациента, маршрутизация пациента (схемы, алгоритмы):
Немедикаментозное лечение:
Единственным методом немедикаментозного лечения, относительно широко используемым у детей, перенесших среднетяжелую и тяжелую асфиксию в родах, является контролируемая лечебная гипотермия. Суть методики заключается в создании гипотермического воздействия, позволяющего прервать вторую фазу гипоксически-ишемического повреждения и снизить количество погибших нервных клеток в результате вторичного энергетического дефицита/апоптоза 12.
Режимы охлаждения при гипотермии новорожденных.
| Cool Cap [9] | Системная гипотермия [10] | |
| Способ охлаждения | Голова и тело | Тело |
| Оборудование | Охлаждающая шапочка и источник лучистого тепла | Охлаждающее одеяло |
| Главная цель: температура | 33,0-34,0 0 С | 33,5 0 С |
| Главная цель: место | Прямая кишка | Пищевод |
| Контроль температуры на месте наложения | Сервоконтроль температуры кожи живота* | Сервоконтроль температуры пищевода |
| Возраст начала охлаждения | Менее 6 час | 5±1,1 час |
| Время достижения целевой температуры после начала охлаждения | 2 часа | ≈1,5 час** |
| Длительность охлаждения | 72 часа | 72 часа |
| Скорость согревания | 0,5 0 С/час | 0,5 0 С/час |
Перечень основных лекарственных средств (имеющих 100% вероятность применения)
Хирургическое вмешательство: нет.
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе: снижение летальности и тяжелой психоневрологической инвалидизации.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации в родовспомогательный стационар: для новорожденного нет.
Показания для экстренной госпитализации в родовспомогательный стационар для новорожденного: нет.
NB! Тип госпитализации в родовспомогательный стационар определяется состоянием беременной женщины (матери новорожденного с ГИЭ).
Информация
Источники и литература
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ВНЕДРЕНИЯ ПРОТОКОЛА
Список разработчиков протокола с указанием квалификационных данных:
Рецензенты:





