Уровень сероконверсии что это
Маркеры гепатита В (HBeAg, anti-HBcoreM, anti-HBe, Anti-HBcore)
Гепатит В – острое или хроническое заболевание печени, вызываемое вирусом гепатита В (HBV), протекающее в различных клинических вариантах: от бессимптомных форм до злокачественных (цирроз печени, гепатоцеллюлярная карцинома). На долю ГВ приходится около 15% всех регистрируемых в РФ острых гепатитов и не менее 50% хронических.
Схематично строение вирусной частицы гепатита В можно изобразить так:
Рис.1. Структура вируса гепатита В.
Белок внешней оболочки ВГВ является его поверхностным антигеном – HBsAg. HBsAg – это основной маркёр ГВ. При остром гепатите HBsAg может быть выявлен в крови обследуемых уже в инкубационный период в первые 4–6 недель от начала клинического периода. Присутствие HBsAg более 6 мес рассматривается как фактор перехода болезни в хроническую стадию.
Следует отметить, что только часть HBsAg, образующегося при размножении вируса, используется для построения новых вирусных частиц, основное же его количество поступает в кровь инфицированных лиц, где и определяется HBsAg- антиген.
Это четвертый маркер активной репликации вируса наряду с ДНК, HBs Ag и антиHBc –IgM.
Исчезновение HBeAg и быстрое нарастание титра анти-HBе у больного практически исключает угрозу хронизации ГВ. Отсутствие такой динамики и выявление монотонно низких концентраций анти-НВе, наоборот, может свидетельствовать о развитии хронического ГВ с невысокой активностью (HBeAg-негативный хронический ГВ).
анти-HBs определяют для оценки течения инфекционного процесса и благоприятности его исхода. Факт появления анти-HBs рассматривается как надежный критерий развития постинфекционного иммунитета, т.е. выздоровления после гепатита В. Хотя при хроническом гепатите В HBsAg и анти-HBs могут иногда обнаруживаются одновременно.
Период, в который отсутствуют и HBsAg, и анти-HBs, называется фазой серологического «окна». Сроки появления анти-HBs зависят от особенностей иммунологического статуса больного. Продолжительность фазы «окна» чаще составляет 3–4 мес. с колебаниями до года.
Анти-HBs могут сохраняться пожизненно. Анти-HBs обладают протективными (защитными) свойствами. Этот факт лежит в основе вакцинопрофилактики. В настоящее время в качестве вакцины против ГВ, в основном, применяют препараты рекомбинантного HBsAg. Эффективность иммунизации оценивают по концентрации антител к HBsAg у вакцинированных лиц. Согласно данным ВОЗ, общепринятым критерием успешной вакцинации считается концентрация антител, превышающая 10 мМЕ/мл.
При интегративной фазе развития (т.е. когда вирусные частицы не подвергаются дальнейшей репликации) геном HBV встраивается в геном гепатоцита. Основную роль играет фрагмент, несущий ген, кодирующий HBs антиген Поэтому при этой фазе идет преимущественное образование HBs Ag и антител к коровскому белку и анти- HBe Ag.
Рис. 2. Динамика серологических маркёров при остром гепатите В.
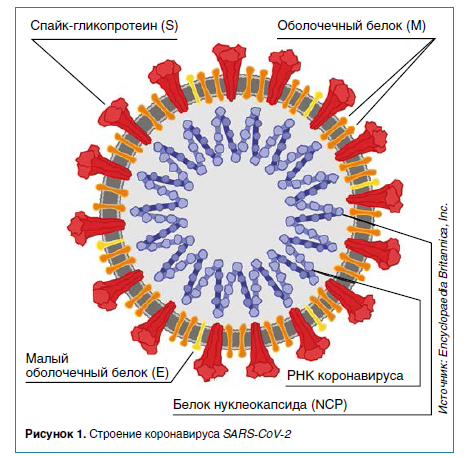
Иммунный ответ на коронавирус SARS-CoV‑2 у больных COVID‑19
Академик Российской академии наук, д.м. н., президент
ФБГУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
В статье представлен анализ результатов исследований иммунного ответа и памяти к SARS-CoV‑2, включая все ветви адаптивного иммунитета, иммуноглобулины, В-клетки памяти, CD8+- и CD4+-T-клетки у больных в динамике в течение 6–8 месяцев после начала заболевания.
Гуморальное звено
Факт первичного иммунного ответа слизистых на COVID‑19 необычен и требует объяснения. Обсуждаются две гипотезы.
Первая: вирусы контаминируют слизистые дыхательных путей и ЖКТ за 7–14 дней до появления системного ответа и клинических проявлений инфекции, поражая клетки микробиоты — используют их для репродукции вируса.
Вторая: кросс-реактивная продукция антител, предпосылкой которой являются Spike-реактивные CD4+-Т-клетки, обнаруженные у большинства пациентов с COVID‑19 и более чем у 34 % неинфицированных людей. Это подтверждает существование общих эпитопов эндемичных коронавирусов, вызывающих банальные ОРВИ и COVID‑19.
Важно, что изотипы иммуноглобулинов (либо IgG, либо IgA) конкурировали за нейтрализующую активность по отношению к SARS-CoV‑2 в зависимости от локализации. Сывороточные антитела IgG сильно коррелировали с величиной IgG-ответа и тяжестью заболевания. У пациентов, например, с IgA-назальным ответом определялась высокая активность нейтрализации вирусов. Инфекция у таких больных протекала бессимптомно.
Это, с одной стороны, предполагает возможность нейтрализации вируса с помощью IgA слизистых без системного ответа, что имеет отношение к исходам заболевания. А с другой стороны, из-за множества корреляций, наблюдаемых между типами антител и их активностью в разных анатомических участках, клиническая интерпретация гуморального ответа существенно затруднена.
Кроме того, эти данные имеют важное значение для нашего понимания защиты вакцинации, индуцирующей системный ответ на вакцинные гены или белки коронавируса по классическому пути и обеспечивающей иммунный ответ слизистых оболочек на 3–6‑й неделе после вакцинации. В идеале вакцина должна не только защитить реципиента от неизбежной болезни, но и предотвратить бессимптомное носительство, что закрыло бы проблему бессимптомных носителей в популяции.
Титры Spike IgА и RBD IgА сохранялись на стабильном уровне на протяжении всего периода наблюдения t1/2— 210 дней, но у отдельных пациентов уровень специфических IgА-антител достоверно снижался через 90 дней.
Нельзя дать однозначный ответ в отношении серонегативных случаев COVID‑19. По-видимому, кроме протективного эффекта иммунитета слизистых, ответ напрямую связан с уровнем вирусной нагрузки SARS-CoV‑2. С одной стороны, высокие вирусные нагрузки связаны с более ранним ответом антител, в то время как у пациентов с низкой вирусной нагрузкой не может быть сероконверсии. С другой стороны, кинетика иммунного ответа может быть показателем скорости элиминации вируса у больного.
Идентификация специфичных В-клеток памяти к Spike, RBD и NCP с использованием флюоресцентно окрашенных зондов на IgD– и (или) CD27+ c последующей дифференцировкой по изотипам поверхностных IgM, IgG или IgA показала следующее. Количество специфических В-клеток увеличивалось в течение 120 дней после начала заболевания с последующим выходом на плато, в то время как Spike-специфические В-клетки памяти у людей, не заболевших COVID‑19, практически не встречались. RBD-специфические В-клетки появлялись на 16‑й день, и их количество увеличивалось в течение последующих 4–5 месяцев. Интересно, что только 10–30 % Spike-специфических В-клеток памяти было специфично для домена RBD через 6 месяцев после выздоровления больных.
NCP-специфичные В-клетки памяти также стабильно увеличивались в те же сроки и определялись спустя 5–6 месяцев после заболевания. Представленность изотипов иммуноглобулинов Spike-специфических В-клеток имела следующую динамику. В ранней фазе (20–60 дней) после заболевания IgM+ и IgG+ на В-клетках были представлены одинаково. В период после 60 дней до 240‑х суток преобладали IgG+ Spike-специфические В-клетки. Частота IgА+ Spike-специфических клеток составляла примерно 5 %, и они равномерно распределялись в течение всего периода наблюдения в 8 месяцев. Корреляция между сывороточным IgA и IgA слизистых оболочек не проводилась.
Сходная картина динамики наблюдалась и в случае IgG+, IgM+ и IgА+ к эпитопам RBD и NCP коронавируса. В то же время долгосрочное присутствие циркулирующих В-клеток памяти, направленных как против основных SARS-CoV‑2‑нейтрализующих таргетов (Spike и RBD), так и против не нейтрализующего таргета (NCP), свидетельствует о клеточной памяти, сохраняющейся после естественного воздействия вируса. Это может быть использовано для планирования ревакцинации. Тот факт, что почти все RBD- специфические IgG+-В-клетки памяти экспрессировали CD27, свидетельствует о долгосрочной иммунной памяти.
Анализ полученных данных говорит о том, что снижение нейтрализующих и других антител к SARS-CoV‑2 после клинического выздоровления вовсе мунитета. Просто с развитием и сохра- нением памяти В-клеток, способных активизироваться при встрече с новыми штаммами коронавируса, уровень антител в сыворотке снижается, в то время как IgА-ответ слизистых сохраняется на постоянном уровне в течении всего периода наблюдения.
Клеточный ответ
Процент больных с обнаруживаемыми циркулирующими CD8+-Т-клетками памяти через месяц после возникновения симптомов составил 70 %. К 6–9 месяцам клетки обнаруживались у 50 % выздоровевших пациентов. Фенотипические маркеры показали, что большинство SARS-CoV‑2‑специфичных CD8+-Т-клеток представлены терминально дифференцированными клетками памяти.
Циркулирующие SARS-CoV‑2‑специфичные CD4+-Т-клетки памяти через месяц после начала заболевания обнаруживались у 93 % пациентов. Через 6–9 месяцев уровень этих клеток был стабильным, а сами они выявлялись у более чем у 90 % пациентов, перенесших COVID‑19. Причем это касалось как Spike-специфичных, так и мембраноспецифичных CD4+-Т-клеток памяти.
Интересно, что при сравнении параметров иммунного ответа у больных с тяжелым и легким течением инфекции гуморальные показатели были более высокими у тяжелых больных, в то время как CD8+-Т-клетки были стабильными, а CD4+ — более низкими в тяжелых случаях заболевания. Объяснений этому феномену нет, важно, что слабый ответ Т-клеток наблюдается в острой фазе заболевания. Кроме того, важна и методология исследования клеточного им-мунитета.
Нарушения клеточного ответа проиллюстрированы дефицитом интерферонов I и II типов у пациентов с тяжелыми и среднетяжелыми формами COVID‑19 по сравнению с легкими и бессимптомными случаями заболевания. Это может быть связано с подавлением воспаления интерлейкином‑12 (IL‑12) и развитием вторичного дефекта клеточного иммунитета.
Иммунное взаимодействие
Большой интерес представляет изучение взаимодействия гуморального и клеточного ответа на SARS-Cov‑2. В исследованиях RBD-IgG, Spike IgА, RBD-В-клеток памяти, CD8+- и CD4+-Т-клеток в динамике у одних и тех же пациентов установлено, что у большинства из них (64 %) положительные показатели отмечались через 1–2 месяц после начала заболевания. Через 5–8 месяцев число реконвалесцентов, позитивных на пять тестов, снизилось до 43 %. В то же время как минимум три из пяти тестов были положительными спустя 6–9 месяцев. Важно отметить, что IgG на Spike дает на порядок больше положительных ответов, чем на RBD-антиген. Попытки связать гуморально- клеточные взаимодействия не привели к успеху из-за неоднородности участников исследования и методик оценки иммунного ответа.
Неопределенный результат
В метаанализе 22 исследований (4969 пациентов) установлены неблагоприятные признаки тяжелых форм болезни и летальных исходов, такие как лимфопения и нейтрофилез. Поскольку CD4+-Т-клетки необходимы для сбалансированного и эффективного иммунного ответа, неудивительно, что низкий уровень лимфоцитов может отражать гипервоспалительные процессы и способствовать более тяжелому течению заболевания и повышенной смертности.
Нейтрофилы как неотъемлемая часть врожденной защиты контролируют баланс микробиоты и элиминацию продуктов клеточной деструкции за счет производства активных форм кислорода и высвобождения нейтрофильных внеклеточных ловушек в венозном кровотоке. Лимфопения (менее 500 клеток в 1 мкл) указывает на повышение риска тяжелой формы заболевания и смертельных исходов при COVID‑19 в 3 раза. Стойкий нейтрофилез со сдвигом влево свидетельствует об истощении костномозгового резерва, а при сдвиге вправо отражает нарушения выхода клеток в ткани. Этот легко контролируемый анализом крови параметр указывает на более чем семикратное увеличение для пациента риска заболеть тяжело и погибнуть от COVID‑19.
Попытки выявить закономерности иммунного ответа на SARS-CoV‑2 оказались пока безуспешными.
Во-первых, можно сделать вывод, что переболевшие коронавирусной инфекцией сохраняют иммунную память в последующие 6–9 месяцев. Дальнейшие динамические исследования покажут, в какие сроки наступает снижение иммунного ответа, требующее профилактической вакцинации и (или) ревакцинации.
Во-вторых, и это очень интересно, каждый изученный компонент иммунного ответа и иммунной памяти демонстрирует различную кинетику. Это связано с индивидуальным ответом на инфекцию, наличием преморбида и частого превращения моноинфекции в смешанные инфекции SARS-CoV‑2 с активизировавшейся микробиотой больного.
В-третьих, неоднородность ответа может быть центральным признаком, характеризующим иммунную память к SARSCoV‑2. Биологические специфические IgG имеют 21 день периода полураспада, уровень антител с течением времени отражает продукцию короткоживущих, а потом и долгоживущих плазматических клеток. С точки зрения исчезновения возбудителя в течение нескольких дней после появления клиники, процесс наработки антител должен быть снижен к 6 месяцам, но, если SARS-CoV‑2 Spike и RBD IgG сохраняются дольше 8 месяцев, это означает, что вирус персистирует в организме хозяина или его микробиоте. Нельзя исключать и связь с пролонгированным иммунным ответом естественной реиммунизации циркулирующими эпидемическими альфа-коронавирусами, поддерживающими иммунный ответ.
В-четвертых, выявление и анализ SARSCoV‑2‑специфических В-клеток памяти потенциально могут применяться в качестве маркера гуморального ответа при вакцинации. Сейчас исследования поствакцинального иммунного ответа проводятся с использованием иммунофлуоресцентного анализа с оценкой IgM- и IgG-антител в качестве маркеров эффективности вакцины (рис. 3). Методы ИФА-диагностики, к сожалению, не стандартизованы едиными белками S, RBD, NCP, качество которых зависит от очистки антигена. Поскольку количество В-клеток памяти стабильно с течением времени, они могут представлять собой более надежный маркер продолжительности гуморальных иммунных реакций, чем иммуноглобулины сыворотки крови.
Таким образом, из результатов исследований иммунного ответа у больных COVID‑19 невозможно сделать какие-либо выводы о защитном иммунитете при новой коронавирусной инфекции. Ведь изучение антител и клеток памяти при этом заболевании пока еще не завершено. А значит, обсуждаемые механизмы защитного иммунитета против SARS-CoV‑2 у людей окончательно не определены.
Источник: Газета «Педиатрия сегодня» №6, 2021
Иммуногенность новой гриппозной вакцины
Грипп и гриппоподобные заболевания занимают первое место по частоте и количеству случаев в мире. Эпидемия гриппа ежегодно приходит с наступлением осенне-зимнего сезона, и каждый раз иммунная система не готова к встрече с
Грипп и гриппоподобные заболевания занимают первое место по частоте и количеству случаев в мире. Эпидемия гриппа ежегодно приходит с наступлением осенне-зимнего сезона, и каждый раз иммунная система не готова к встрече с ним. Почему? Грипп является чемпионом среди вирусов по способности к генетической изменчивости, которая позволяет ему уходить от иммунного надзора. Вирус с изменившимися поверхностными белками уже не распознается специфическими противогриппозными антителами к штаммам-предшественникам.
Наиболее эффективным, безопасным и экономически оправданным средством профилактики гриппа является вакцинация. Чтобы вакцина защищала от гриппа, должно быть четкое соответствие вакцинных штаммов эпидемическим. В отличие от большинства других вакцинных препаратов, существует необходимость ежегодного обновления штаммового состава противогриппозных вакцин и, следовательно, необходимость ежегодной иммунизации. Проблема гриппа давно вышла за пределы одной страны. Центрами по гриппу ВОЗ, организованными по всему миру, проводится регулярный мониторинг и сбор информации по сезонным циркулирующим штаммам вируса гриппа и вспышкам заболеваемости. На основании анализа присланного материала эксперты делают прогнозы относительно разновидностей гриппа, которые будут циркулировать в следующем эпидсезоне, а также предлагают вирусы-кандидаты в вакцинные штаммы для производителей.
С учетом того, что дифференциальная диагностика гриппа от других ОРВИ затруднена, показатели иммуногенности вакцин принято оценивать по уровню специфических антител к гемагглютинину (ГА). Защитный эффект ГА-специфических антител неоднократно был продемонстрирован как у животных, так и у людей. Антитела нейтрализуют вирус гриппа, предотвращая его связывание с рецепторами, при этом уровень антител к гемагглютинину напрямую коррелирует с уровнем защищенности. При оценке потенциальной эффективности вакцины титр антител не менее чем 1:40 считают защитным. Антитела к другому изменчивому поверхностному белку вируса гриппа — нейраминидазе — не могут предотвратить инфекцию, однако играют важную роль в защите от тяжелых форм гриппа, препятствуя выходу вирусных частиц из инфицированных клеток и дальнейшему распространению вируса в организме. Гемагглютинин и нейраминидаза названы протективными белками, а вакцины, содержащие только эти очищенные белки, — субъединичными.
Современные достижения вирусологии, развитие технологий фармацевтической индустрии, интеграция исследователей разных стран в сфере контроля и борьбы с гриппом позволили вывести на новый уровень разработку и производство гриппозных вакцин. Вакцина Гриппол® Нео — результат международного сотрудничества двух компаний («Солвей Биолоджикалз Б. В.» и ФК «ПЕТРОВАКС»). Эта субъединичная вакцина содержит иммуноадъювант Полиоксидоний® и антигены (гемагглютинин и нейраминидазу) европейского качества, полученные из вируса, выращенного на культуре клеток. Рост вируса для вакцины осуществляется по современной технологии с использованием клеточной линии MDCK (Madine-Darbin Canine Kidney) в бессывороточной среде и является стандартизированным закрытым процессом, исключающим возможность контаминации любыми, в том числе неизвестными агентами. Применение культур клеток для наработки вирусного материала стало уже традиционным для целого ряда вакцинных препаратов. Но только благодаря разработкам специалистов компании «Солвей Биолоджикалз» технология стала доступной и для гриппозных вакцин. В 2001 году была зарегистрирована вакцина Инфлювак ТС (Нидерланды), в 2009 году в России — Гриппол ® Нео.
Снижение антигенной нагрузки в вакцинирующей дозе обеспечивает максимальный профиль безопасности препарата. Антигены с адъювантом образуют комплекс, который стимулирует гуморальное и клеточное звенья иммунитета. Это приводит к образованию специфических к протективным белкам антител, отвечающих за защиту от гриппа, и повышает общую резистентность организма к инфекции.
Клинические исследования безопасности и иммуногенности Гриппол ® Нео проводились с участием добровольцев в высокоспециализированных исследовательских центрах по изучению вакцинных препаратов и поствакцинальных реакций.
Материалы и методы
Вакцины
В клиническом испытании были использованы три инактивированные субъединичные вакцины, содержащие иммуноадъювант Полиоксидоний® и антигены (гемагглютинин и нейраминидазу) актуальных для эпидемического сезона 2008/2009 штаммов вируса гриппа: H1N1 A/Brisbane/59/2007; H3 N2 A/Uruguay/716/2007; B/Florida/4/2006. Два тестируемых препарата представляли собой две серии вакцины Гриппол® Нео производства ООО «ФК «ПЕТРОВАКС», содержащие по 5 либо по 10 мкг гемагглютинина каждого из трех штаммов и 500 мкг Полиоксидония®. В качестве препарата сравнения использовали коммерческую вакцину Гриппол® производства ФГУП «НПО «Микроген», содержащую по 5 мкг ГА штаммов вирусов гриппа типа А (H1N1 и H3N2), 11 мкг гемагглютинина вируса гриппа типа В, 500 мкг Полиоксидония®. Препараты, используемые в исследовании, были контролированы в ГИСК им. Л. А. Тарасевича на соответствие нормативной документации; испытуемые серии Гриппол® Нео и препарат сравнения зашифрованы специалистами ГИСКа, не принимающими участия в данном исследовании. Дешифровка была проведена после завершения клинического исследования и представления всех результатов в ГИСК.
Дизайн исследования
Исследования проведены в соответствии с утвержденными протоколами и согласно разрешению МЗ РФ на клинических базах ФГУ НИИ ДИ Росздрава и ГОУ ВПО СПбГМУ им. ак. И. П. Павлова в соответствии с требованиями Надлежащей клинической практики (GCP).
Дизайн исследования: рандомизированное, двойное слепое, контролируемое сравнительное в параллельных группах. Вакцинация добровольцев проведена после подписания информированного согласия.
Участники были отобраны в соответствии с критериями включения/исключения, определенными протоколом клинического испытания. Всего было вакцинировано 300 здоровых добровольцев в возрасте 18–55 лет (средний возраст — 24,5 ± 0,5 года). Перед прививкой все добровольцы были осмотрены врачом, было проведено измерение температуры тела, артериального давления, женщинам — тест на беременность.
Методом случайного выборочного распределения было сформировано три группы по 100 человек. Вакцинацию проводили однократно в дельтовидную мышцу в объеме 0,5 мл.
Постановка реакции и учет результатов
Парные сыворотки добровольцев, взятые до и через 21 день после вакцинации, исследовали с помощью стандартной методики в реакции торможения гемагглютинации (РТГА), как описано в МУ 3.3.2 1758–03. Постановка РТГА включала следующие этапы: подготовка сывороток, определение гемагглютинирующего титра в РГА и рабочей дозы вируса, постановка самой реакции. Для удаления неспецифических ингибиторов сыворотку обрабатывали RDE по методу, описанному в инструкции к препарату. В качестве рабочей дозы антигена использовалась доза 4АЕ, приготовленная из диагностикумов «Диагностикумы гриппозные для реакции торможения гемагглютинации сухие» (ФСП 42–0321–4042–03) трех штаммов, соответствующих вакцинным. Сыворотки титровали начиная с разведения 1:10. При учете результатов титр 1:1280 — равным 1:1280.
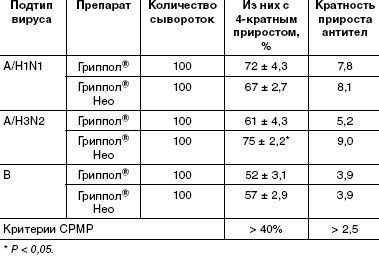
Иммуногенность оценивали в соответствии с требованиями Европейского комитета к противогриппозным вакцинам (СPMP/BWP/214/96), согласно которым должен выполняться по крайней мере один из трех критериев:
Статистика
Результаты исследований статистически обработаны с использованием t-критерия Стьюдента. Вариационный анализ полученных результатов проводили с применением пакета прикладных программ Statistica 6.0.
Результаты и обсуждение
Серологическое обследование с целью оценки иммунологической эффективности вакцинации проводили, сравнивая уровень антител в парных сыворотках, взятых до прививки и на 21-й день после вакцинации. Во всех экспериментальных группах в сыворотках привитых регистрировали статистически достоверное нарастание титров антител. По всем анализируемым критериям не наблюдалось статистически достоверной разницы в иммунном ответе на серии вакцины Гриппол® Нео с различными дозировками антигенов. В таблицах приведены данные, относящиеся к серии, содержащей по 5 мкг гемагглютинина каждого штамма.
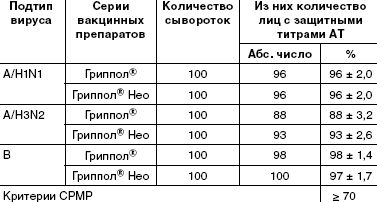
Подсчеты числа лиц с серопротекциями (защитными титрами антител (≥ 1:40)) показали, что в каждой группе уровень этих антител соответствует критерию CPMP (табл. 1).
Известно, что человеческая популяция неоднородна по наличию антител к различным штаммам и подтипам вируса гриппа вследствие гриппозных эпидемий и предыдущих вакцинаций. Среди вакцинированных добровольцев выявлены как серонегативные, так и серопозитивные участники (исходно имевшие защитный титр). Представлялось интересным оценить эффективность иммунизации в общей популяции людей (табл. 3).
Выводы и заключение
В настоящее время вакцина Гриппол ® Нео зарегистрирована (РУ № ЛСР-006029/09 от 23.07.2009 г.). Таким образом, семейство вакцин Гриппол ® пополнилось новым полноправным членом, а профилактическая медицина обрела новый инструмент для контроля такого заболевания, как грипп. Гриппол ® Нео стал первой в мире субъединичной адъювантной вакциной с клеточной технологией получения антигенов. При этом впервые вакцинация против гриппа разрешена людям с аллергией на белок куриного яйца. Исследования по расширению показаний к применению вакцины продолжаются.
Е. М. Войцеховская *
В. С. Вакин *, кандидат медицинских наук
А. А. Васильева *
Е. В. Кузнецова *, кандидат биологических наук
Н. И. Лонская **, кандидат медицинских наук
Г. А. Ельшина **, кандидат медицинских наук
М. А. Горбунов **, доктор медицинских наук
А. А. Соминина *, доктор медицинских наук
Ю. А. Зайцева ***
* ГУ НИИ гриппа РАМН, Санкт-Петербург
** ФГУН ГИСК им. Л. А. Тарасевича Роспотребнадзора, Москва
*** ООО ФК «ПЕТРОВАКС», Москва
Ключевые слова: вакцина, грипп, Гриппол ® Нео, клеточная культура