Электроотрицательность фосфора больше чем электроотрицательность
Электроотрицательность элементов по таблице Менделеева
Электроотрицательность — это характеристика атома, показывающая, насколько высока его способность притягивать к себе электроны. Когда химическая связь образована двумя разными элементами, электроны у одного из них всегда расположены более плотно, чем у другого. Тот атом, у которого электронная плотность выше, называется электроотрицательным, тот, у кого ниже — соответственно, электроположительным.
Как определить электроотрицательность
Существует несколько шкал, ориентируясь на которые, можно определить электроотрицательность того или иного элемента. Попробуем их перечислить:
Чтобы определить параметр «электроотрицательность» по таблице Менделеева, нужно всего лишь знать, что наиболее электроотрицательные свойства имеют те элементы, которые располагаются вверху таблицы и в правой ее части. То есть, чем выше и правее элемент находится в таблице Менделеева, тем выше у него электроотрицательность и наоборот, чем ниже и левее — тем выше у него электроположительность.
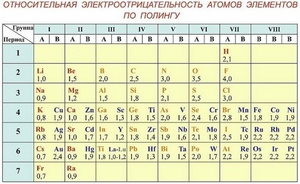
Шкала Полинга — наиболее часто используемая таблица электроотрицательности. Названа она в честь американского химика Лайнуса Полинга, который впервые ввел понятие электроотрицательности. Согласно шкале Поллинга, электроотрицательность всех имеющихся в природе элементов лежит в интервале от 0,7 (таковой она является у щелочного металла франция) до 4,0 (у газа-галогена фтора). В таблице приводятся относительные и неточные величины.
Шкала Малликена рассматривает электроотрицательность как величину энергии связи между валентными электронами. Приводятся максимально точные расчеты.
Расположение элементов в каждой из таблиц является идентичным, несмотря на то, что методы определения отличаются друг от друга, и величины тоже.
Самые высокие значения электроотрицательности
Фтор, один из галогенов — это элемент, обладающий наивысшей электроотрицательностью, а точнее — 3,98. Его химическая активность невероятно высока, настолько, что химики называют его не иначе как «все разгрызающий».
Следом за фтором идет кислород. Электроотрицательность кислорода немного пониже — 3,44, но тоже достаточно высока.
Следом за ними (спускаясь все ниже по правой части таблицы Менделеева) идут:
Большая часть неметаллов имеет электроотрицательность, колеблющуюся между значениями 2 и 3. У отличающихся наиболее высокой активностью металлов, от франция до бериллия, она колеблется от значения 0,7 до 1,57.
Как определить валентные электроны
Валентностью называют способность атома вступать во взаимодействие с другими атомами, образуя с ними определенные химические связи. Валентными электронами именуются электроны, непосредственно участвующие в образовании химической связи. Основными создателями, внесшими в теорию валентности наибольший вклад, являются русский ученый Бутлеров и немецкий ученый Кекуле. Электроны, которые принимают участие в образовании химической связи, называют валентными.
Атом, как мы все знаем из школьного курса, устроен таким образом, что довольно-таки напоминает по своему устройству Солнечную систему. В центре атома находится огромное ядро, чья масса чуть менее, чем полностью равняется массе всего атома, а вокруг него по орбиталям вращаются мелкие электроны, неодинаковые по своим внутренним характеристикам. Ядро атома окажется не таким уж и большим, если сравнить его размеры с длиной расстояния до орбиталей, по которым вращаются атомы. Чем дальше от ядра и чем ближе к внешней электронной оболочке находится электрон конкретно взятого атома, тем быстрее он вступает во взаимодействие с электронами других атомов.
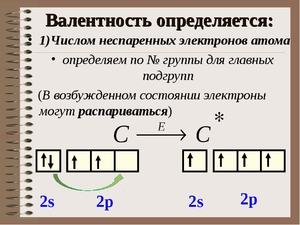
Итак, перед нами таблица Менделеева. Найти на ней нужно третий период. Последовательно перебираем элементы главных подгрупп в нем. Существует правило, согласно которому валентность элемента определяется по номеру его группы и равняется количеству электронов на внешней оболочке его атома.
Помимо главных, есть еще и побочные подгруппы. Когда дело касается их, учитываются еще и d-электроны на предыдущем подуровне. В таблице Менделеева все эти значения легко можно отыскать. Попробуем определить высшую валентность хрома. На внешнем уровне у хрома находится 1 электрон, на d-подуровне — 5. Следовательно, его высшая валентность равна 6. У марганца на внешнем уровне 2 электрона, на d-подуровне — 5. Значит, его высшая валентность — 7.
Все вышеописанное, за некоторыми исключениями, действительно для элементов всех других побочных подгрупп (помимо тех, в которые включены марганец и хром). Вот исключения:
Видео
Это видео поможет вам лучше усвоить такое понятие, как электроотрицательность.
Таблица электроотрицательности химических элементов

Всего получено оценок: 337.
Всего получено оценок: 337.
Выяснить активность простых веществ можно с помощью таблицы электроотрицательности химических элементов. Обозначается как χ. Подробнее о понятии активности читайте в нашей статье.
Что такое электроотрицательность
Свойство атома химического элемента притягивать к себе электроны других атомов называется электроотрицательностью. Впервые понятие ввёл Лайнус Полинг в первой половине ХХ века.
Все активные простые вещества можно разделить на две группы в соответствии с физическими и химическими свойствами:
Все металлы являются восстановителями. В реакциях они отдают электроны и обладают положительной степенью окисления. Неметаллы могут проявлять свойства восстановителей и окислителей в зависимости от значения электроотрицательности. Чем выше электроотрицательность, тем сильнее свойства окислителя.
Полинг составил шкалу электроотрицательности. В соответствии со шкалой Полинга наибольшей электроотрицательностью обладает фтор (4), наименьшей – франций (0,7). Это значит, что фтор является самым сильным окислителем и способен притягивать электроны большинства элементов. Напротив, франций, как и другие металлы, является восстановителем. Он стремится отдать, а не принять электроны.
Электроотрицательность является одним из главных факторов, определяющих тип и свойства образованной между атомами химической связи.
Как определить
Свойства элементов притягивать или отдавать электроны можно определить по ряду электроотрицательности химических элементов. В соответствии со шкалой элементы со значением более двух являются окислителями и проявляют свойства типичного неметалла.
Номер элемента
Элемент
Символ
Электроотрицательность
Вещества с электроотрицательностью два и меньше являются восстановителями и проявляют металлические свойства. Переходные металлы, обладающие переменной степенью окисления и относящиеся к побочным подгруппам таблицы Менделеева, имеют значения электроотрицательности в пределах 1,5-2. Ярко выраженными свойствами восстановителя обладают элементы с электроотрицательностью равной или меньше одного. Это типичные металлы.
В ряде электроотрицательности металлические и восстановительные свойства увеличиваются справа налево, а окислительные и неметаллические свойства – слева направо.

Помимо шкалы Полинга узнать, насколько выражены окислительные или восстановительные свойства элемента можно с помощью периодической таблицы Менделеева. Электроотрицательность увеличивается в периодах слева направо с увеличением порядкового номера. В группах значение электроотрицательности уменьшается сверху вниз.
Что мы узнали?
Электроотрицательность показывает способность элементов отдавать или принимать электроны. Эта характеристика помогает понять, насколько выражены свойства окислителя (неметалла) или восстановителя (металла) у конкретного элемента. Для удобства Полингом была разработана шкала электроотрицательности. Согласно шкале максимальными окислительными свойствами обладает фтор, минимальными – франций. В периодической таблице свойства металлов увеличиваются справа налево и сверху вниз.
Электроотрицательность
Эле́ктроотрица́тельность (χ) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары.
Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом. Он использовал понятие электроотрицательности для объяснения того факта, что энергия гетероатомной связи A—B (A, B — символы любых химических элементов) в общем случае больше среднего геометрического значения гомоатомных связей A—A и B—B.
В настоящее время для определения электроотрицательностей атомов существует много различных методов, результаты которых хорошо согласуются друг с другом, за исключением относительно небольших различий, и во всяком случае внутренне непротиворечивы.
Первая и широко известная шкала относительных атомных электроотрицательностей Полинга охватывает значения от 0,7 для атомов франция до 4,0 для атомов фтора. Фтор — наиболее электроотрицательный элемент, за ним следует кислород (3,5) и далее азот и хлор (3,0). Активные щелочные и щёлочноземельные металлы имеют наименьшие значения электроотрицательности, лежащие в интервале 0,7—1,2, а галогены — наибольшие значения, находящиеся в интервале 4,0—2,5. Электроотрицательность типичных неметаллов находится в середине общего интервала значений и, как правило, близка к 2 или немного больше 2. Электроотрицательность водорода принята равной 2,1. Для большинства переходных металлов значения электроотрицательности лежат в интервале 1,5—2,0. Близки к 2,0 значения электроотрицательностей тяжёлых элементов главных подгрупп. Существует также несколько других шкал электроотрицательности, в основу которых положены разные свойства веществ. Но относительное расположение элементов в них примерно одинаково.
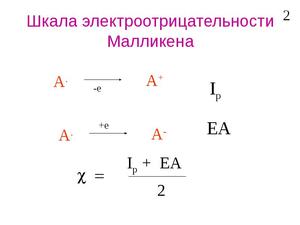
Теоретическое определение электроотрицательности было предложено американским физиком Р. Малликеном. Исходя из очевидного положения о том, что способность атома в молекуле притягивать к себе электронный заряд зависит от энергии ионизации атома и его сродства к электрону, Р. Малликен ввёл представление об электроотрицательности атома А как о средней величине энергии связи наружных электронов при ионизации валентных состояний (например, от А − до А + ) и на этой основе предложил очень простое соотношение для электроотрицательности атома:
где J1 A и εA — соответственно энергия ионизации атома и его сродство к электрону.
Помимо шкалы Малликена, описанной выше, существует более 20-ти различных других шкал электроотрицательности, среди которых шкала Л. Полинга (основана на энергии связи при образовании сложного вещества из простых), шкала Олреда-Рохова (основана на электростатической силе, действующей на внешний электрон) и др.
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности, от валентного состояния атома, формальной степени окисления, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других. В последнее время все чаще для характеристики электроотрицательности используют так называемую орбитальную электроотрицательность, зависящую от типа атомной орбитали, участвующей в образовании связи, и от её электронной заселённости, т. е. от того, занята атомная орбиталь неподелённой электронной парой, однократно заселена неспаренным электроном или является вакантной. Но, несмотря на известные трудности в интерпретации и определении электроотрицательности, она всегда остаётся необходимой для качественного описания и предсказания природы связей в молекулярной системе, включая энергию связи, распределение электронного заряда и степень ионности, силовую постоянную и т. д.
В период бурного развития квантовой химии как средства описания молекулярных образований (середина и вторая половина XX века) плодотворной оказался подход Л.Полинга, который в числе прочих исследований ввел собственную шкалу электроотрицательностей, в которой из «стандартных» элементов максимальную имеет фтор (

где 
Одним из наиболее развитых в настоящее время подходов является подход Сандерсона. В основу этого подхода легла идея выравнивания электроотрицательностей атомов при образовании химической связи между ними. В многочисленных исследованиях были найдены зависимости между электроотрицательностями Сандерсона и важнейшими физико-химическими свойствами неорганических соединений подавляющего большинства элементов периодической таблицы. [1] Очень плодотворной оказалась и модификация метода Сандерсона, основанная на перераспределении электроотрицательности между атомами молекулы для органических соединений. [2] [3] [4]